甲磺酸阿帕替尼联合多靶点抗原肽自体免疫细胞治疗骨与软组织肉瘤的临床实践(小样本报道)
乔 云 惠开元 任 岩 王 磊 宋大安 蒋晓东
(徐州医科大学附属连云港医院/连云港市第一人民医院肿瘤放疗科,连云港222002)
甲磺酸阿帕替尼联合多靶点抗原肽自体免疫细胞治疗骨与软组织肉瘤的临床实践(小样本报道)
乔 云 惠开元①任 岩 王 磊 宋大安 蒋晓东
(徐州医科大学附属连云港医院/连云港市第一人民医院肿瘤放疗科,连云港222002)
目的:评价抗血管生成靶向药物甲磺酸阿帕替尼联合多靶点抗原肽自体免疫细胞技术(Multiple antigens specific cell therapy,MASCTTM)治疗肉瘤的临床有效性和安全性。方法:收集6例经手术、放化疗治疗失败或拒绝手术、放化疗治疗的肉瘤患者,且治疗结束至少1个月以上。其中4例患者至少接受3周期MASCTTM治疗,并在第1天给予阿帕替尼500 mg,po,qd,口服至疾病进展,评价近期疗效和无进展生存时间(PFS)。其中2例单独使用甲磺酸阿帕替尼的患者为对照。检测患者的细胞免疫功能、外周血循环肿瘤细胞数(CTCs),并对患者进行生活质量测评,3周期MASCT TM治疗结束后1个月进行ELISPOT检测,治疗全程中记录患者的不良反应。结果:4例联合治疗患者均完成3周期治疗,其中1例患者治疗2周期后出现Ⅳ度手足综合征,改阿帕替尼为250 mg,po,qd后可耐受。治疗后1例患者为CR,3例为PR;4例患者的淋巴细胞免疫功能均有改善,CTCs数量明显减少,生活质量均较治疗前明显改善,未见有严重不良反应。ELISPOT检测提示患者对其中大部分的抗原肽有特异性响应(≥10/15种),4例患者PFS分别为7、6、9、4个月;2例单独使用阿帕替尼的患者1例SD,1例PD,PFS分别为1、2个月。结论:应用阿帕替尼联合MASCTTM技术对骨与软组织肉瘤患者安全、有效,具有良好的应用前景。
多靶点抗原肽自体免疫细胞治疗; 甲磺酸阿帕替尼;骨与软组织肉瘤
肉瘤是一组少见的具有不同临床和病理特征的间叶来源的肿瘤,可发生于全身各个部位,各年龄段均可发病。肉瘤整体上可分为两大类,软组织来源的肉瘤(如起源于纤维、脂肪、肌肉、神经、神经鞘、血管和淋巴管等结缔组织)和骨肉瘤[1],是一种原发性、高度恶性的肿瘤,早期可发生远处转移,危害极大[2]。肉瘤目前尚缺乏有效的治疗方法,其在体内易发生增殖、转移而导致患者死亡。
当前免疫治疗已成为继手术、放疗、化疗后的第4种治疗恶性肿瘤的方法。恒瑞源正生物科技有限公司提供的MASCTTM因具有靶向性、安全、高效、毒副作用小等优点,是临床研究的热点之一[3]。但是,临床研究发现,MASCTTM技术在治疗实体瘤过程中,许多患者治疗效果差或者无效。其原因可能是肿瘤微环境中存在免疫抑制细胞,抑制了CTL细胞在肿瘤组织的归巢以及肿瘤细胞表面高表达PD-L1等免疫负向调控因子介导的肿瘤免疫逃逸[4],是导致细胞免疫治疗效果有限的重要原因之一[5]。基于本研究团队在前期抗血管生成方面的研究,发现小分子抗血管生成药物甲磺酸阿帕替尼除了抗肿瘤血管生成外,还能够下调肿瘤细胞表面PD-L1表达、抑制调节性T细胞(regulatory T cell,Treg)的活性,增强免疫。因此,本研究设计了“甲磺酸阿帕替尼联合MASCTTM技术治疗晚期恶性实体肿瘤的单臂、开放、Ⅰ/Ⅱ期临床研究”,在入组治疗的20多例患者中,发现该方法对软组织肉瘤疗效明显,无重度和严重不良事件的发生,故对6例患者的治疗情况进行报道。
1 资料与方法
1.1 临床资料 2015年9月至2016年8月期间连云港市第1人民医院肿瘤科共收治了6例肉瘤患者,其中2例其他治疗失败后因经济等原因仅采用阿帕替尼单独治疗,其余4例采用本研究的方法,即甲磺酸阿帕替尼联合MASCTTM治疗,其一般临床资料见表1。本研究的纳入标准:经手术、放化疗治疗失败或拒绝手术、放化疗治疗的肉瘤患者,且末次治疗(手术、 化疗、 放疗)结束至少1个月以上。年龄≥18岁;组织学上证实为肉瘤(软组织肉瘤或骨肉瘤)。其他入组标准包括:生存期望值至少>3个月;正常或者近似正常的血液化验及肝肾功能。所有患者自愿接受甲磺酸阿帕替尼联合MASCTTM治疗,并签署了知情同意书。排除标准:有自身免疫疾病;使用免疫抑制剂治疗;不能控制的感染;严重过敏体质;孕期或哺乳期妇女;严重或不稳定的其他疾病患者均排除在外。
1.2 方法
1.2.1 治疗方案 所有患者治疗前均给予血常规、肝肾功能及合并症等进行检查,对相应的合并症进行针对性干预治疗。治疗期的第1天,对患者进行单细胞采集,第8天DC(Dendritic cells,DC)皮下注射,第28天进行效应性T细胞回输,28 d为一个周期,所有患者都做完3周期免疫治疗,同时患者在第1天即给予阿帕替尼(恒瑞,批准文号:国药准字:H20140103,规格:0.25 g×10片),口服500 mg,qd,餐后半小时服用,免疫治疗结束后继续服用阿帕替尼至疾病进展为止。
1.2.2 MASCTTM制备与回输 MASCTTM技术由本院肿瘤实验室规范制备,参加细胞培养及质量控制的技术人员均经过GMP培训和健康查体符合GMP上岗要求。细胞制备过程如下:①使用血细胞分离机采集患者外周血单个核细胞约2.0×109个进行分装冻存(注:采集细胞数目满足3个周期的自体免疫细胞治疗);②细胞制备第1天取约3.3×108个单个核细胞诱导培养树突状细胞,DC细胞负载15种抗原肽,抗原肽用量为1 μg/ml/条。③第8天,经细胞因子促成熟后的DC细胞,收取一半在患者淋巴结富集区10 cm范围内的腋窝或腹股沟皮下注射1 ml DC悬液,每次回输DC细胞数不少于1×107个;④第8天,复苏3.3×108个单个核细胞与另一半成熟DC共培养刺激产生抗原专一性的CTL;⑤第28天收集CTL制备成100 ml CTL悬液,用台盼蓝染色法检测细胞活力>95%,经由本院临床检验中心和本实验室同时进行细菌、真菌、支原体及细菌内毒素检测,检测结果均为阴性后,确保细胞培养和细胞回输的安全,混匀后送病房立即给患者回输,CTL数为(6~10)×109个。
表1 6例肉瘤患者的一般临床资料
Tab.1 General clinical data of six patients with sarcoma

CaseSexAge(years)PrimarysitePathologicdiagnosisMetastaticsitesPSTheearlytreatmentTherapeuticefficacy1Male29RightlowerlimbRhabdomyosarcomaBilaterallung90ChineseherbsPD2Male18RighthumerusOsteosarcomaNone90ChineseherbsPD3Male33LeftlowerlimbSynovialsarcomaLeftgroin90Surgery+radiotherapyPD4Female29RetroperitoneumChondrosarcomaSinglelung60Surgery+chemoradiotherapyPD5Male18PelvisEwing'ssarcomaBonemetastases90SixcyclesofchemotherapyPD6Female48PelviccavityLiposarcomaAbdominalandpelvicwidespreadmetastasis80ChineseherbsPD
1.2.3 细胞免疫功能评价 分别于治疗前1 d及3个周期治疗结束后1个月使用流式细胞仪测定患者的总T淋巴细胞(CD3+)、B细胞(CD3-CD19+)、自然杀伤(NK)细胞(CD3-CD16+CD56+)、辅助性T细胞(Th,CD3+CD4+)、抑制性T细胞(Ts,CD3+CD8+)的比例。
1.2.4 CTCs检测 分别于治疗前1 d及3个周期治疗结束后1个月进行CTCs检测,使用人外周血循环肿瘤细胞鉴别试剂盒(莱尔生物医药科技有限公司,货号:IHIRF53001)。结果判读:FISH阳性(信号≥3,40倍镜下信号不分层),CD45阴性,单个细胞,以CTC个数≥2个为阳性。
1.2.5 酶联免疫斑点法检测 使用ELISPOT检测试剂盒(U-CyTech Biosciences公司,货号:CT230-PR5)检测患者行MASCTTM3周期治疗后1个月对多肽的响应水平。结果判读:实验组与对照组都扣除背景(无关多肽抗原刺激孔的斑点数)后,实验组多肽刺激孔斑点数/对照组多肽刺激孔斑点数≥3倍,且实验组孔内斑点数/106脾细胞≥50个斑点即为阳性; 如对照组多肽刺激孔斑点数=0,则实验组孔内斑点数/106脾细胞≥50个斑点即为阳性。
1.2.6 疗效评估
1.2.6.1 观察指标 ①近期疗效评价 治疗满3个周期结束后1个月复查原发灶及转移灶肿块大小。根据实体瘤疗效评价标准RECIST 1.0(Response Evaluation Criteria in Solid Tumors 1.0)评价本研究的近期疗效:分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD);②无进展生存时间PFS:从患者签署知情同意书到疾病进展或死亡。
1.2.6.2 生存质量评价 患者在治疗前、每周期MASCTTM治疗后1个月进行生存质量评价,每位患者在治疗前均进行了调查问卷教育。本研究的健康和生活质量调查问卷采用EORTC QLQ-C30量表。问卷为自我报告形式,共30个项目,包括5个功能量表, 3个症状量表, 6个单项测量项目和一个整体生活质量量表(GQL)。问卷指标的评分采用分类评分法,总体健康状况/生活质量分7类:从1分到7分,其他指标的评分分为4类:从1分到4分。其中功能量表的得分越高,表示生活质量状况越好,症状量表得分越高,表示生活质量状况越差。
1.3 安全性评价 记录所有患者有无发热、全身皮肤潮红、瘙痒、皮疹及过敏反应、溶瘤综合征等免疫反应相关症状。同时观察患者治疗期间有无高血压、腹泻、蛋白尿、出血等阿帕替尼药物副反应,并根据其副反应轻重随时调整用药。
2 结果
2.1 近期疗效评价 4例患者均完成了3周期免疫治疗,并从第1天开始截止到随访日期均同时口服阿帕替尼,其中1例患者因口服阿帕替尼500 mg两周后,出现手足综合征(Ⅳ度)后改为250 mg口服。4例患者进行评价疗效,其中1例为CR、3例为PR,同期2例单独使用阿帕替尼的肉瘤患者1例SD,1例PD,见表2。附其中1例横纹肌肉瘤肺转移患者联合治疗前后下肢原发灶与肺转移灶对比图像和1例单独使用阿帕替尼治疗复发的盆腔脂肪肉瘤患者对比图,见图1、2。
2.2 无进展生存时间(PFS) 4例阿帕替尼联合MASCT治疗的肉瘤患者PFS分别为7、6、9、4个月,而同期2例单独使用阿帕替尼的肉瘤患者PFS分别为1、2个月。而文献报道帕唑帕尼治疗晚期软组织肉瘤患者的中位生存时间为4.6个月vs安慰剂对照组1.6个月。见图3。
2.3 生活质量评价 4例患者治疗后其功能量表的得分均较治疗前升高;相反地,其症状量表得分均较治疗前较低,说明患者生活质量经治疗后明显提高,特别是食欲、精神、睡眠、疼痛等均较治疗前有明显改善。2例单独使用阿帕替尼的患者生活质量无明显改善。
2.4 细胞免疫功能评价结果 检测4例联合治疗组的患者治疗前1 d与3周期结束后1月外周血T细胞亚群的变化结果,见图4。4例患者治疗后外周血中总T淋巴细胞、T辅助细胞、T抑制细胞、自然杀伤细胞、自然杀伤性T细胞百分率均有提高。
表2 阿帕替尼联合MASCT与阿帕替尼单药治疗近期疗效评价
Tab.2 Therapeutic Efficacy of six patients with sarcoma
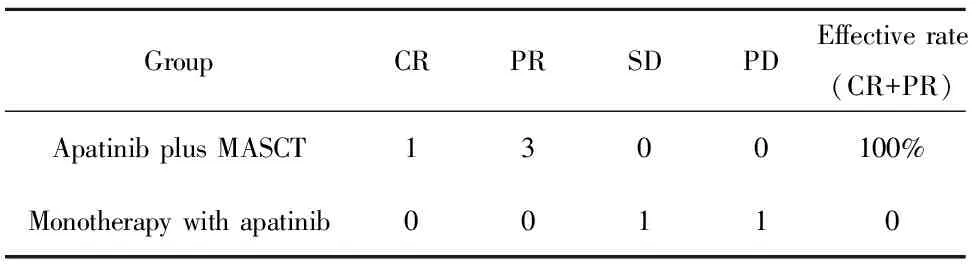
GroupCRPRSDPDEffectiverate(CR+PR)ApatinibplusMASCT1300100%Monotherapywithapatinib00110
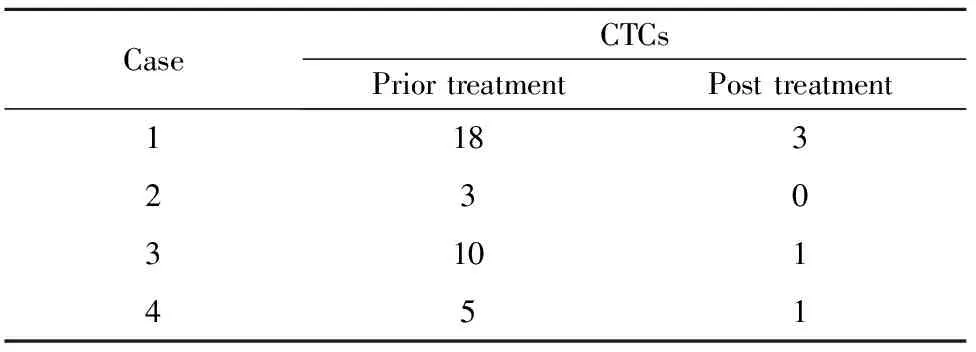
2.5 CTCs结果 4例联合治疗组患者治疗前后CTCs结果对比,显示治疗后CTCs数量均较治疗前减少,见表3。
2.6 ELISPOT结果 4例联合MASCT治疗的患者行ELISPOT法检测,结果提示大部分抗原肽均产生了强烈的免疫应答,提示本研究中的MASCTTM技术对肉瘤患者有良好的抗肿瘤作用。附1例抗原肽的响应结果,见图5。
2.7 安全性评价结果 4例行MASCTTM治疗的患者无发热、全身皮肤潮红、瘙痒、皮疹、溶瘤综合征及其他免疫反应相关的不良事件。1例口服阿帕替尼500 mg 两周后出现Ⅳ度手足综合征,阿帕替尼减量为250 mg后可耐受,余患者未见高血压、腹泻、蛋白尿、出血等并发症。血常规、肝肾功能、电解质、血糖未见明显异常。2例单独使用阿帕替尼的患者1例出现Ⅱ度高血压,对症治疗后缓解。
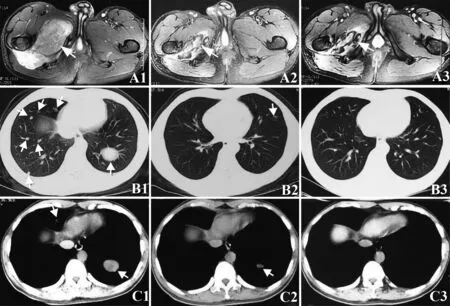
图1 横纹肌肉瘤肺转移患者治疗前后下肢原发灶与肺转移灶对比图像Fig.1 Comparative images of recurrent pelvic liposarc-oma in lower extremity and lung metastases of a patient with rhabdomyosarcoma before and after treatmentNote: A.Representative images of primary lesion MRI.Primary lesions were significantly reduced from 13 cm× 8 cm to 5 cm× 3 cm.Arrows indicate necrotic tissue and liquefaction in the primary lesion;B.Representative CT images of metastatic lesions in patient′s lung (pulmonary window).Extensive and multiple metastatic lesions (see arrows) in bilateral pulmonary CT images completely disappeared after 3-cycle immunotherapy; C.Representative CT images of metastatic lesions in patient′s lung (mediastinal window).The 5 cm× 5 cm metastatic lesion in the lung (left lower lobe) disappeared completely after 3-cycle immunotherapy (see arrow).1,2,and 3 represent the bilateral pulmonary CT images of the patient before,1-,and 4-months after 3-cycle immunotherapy,respectively.
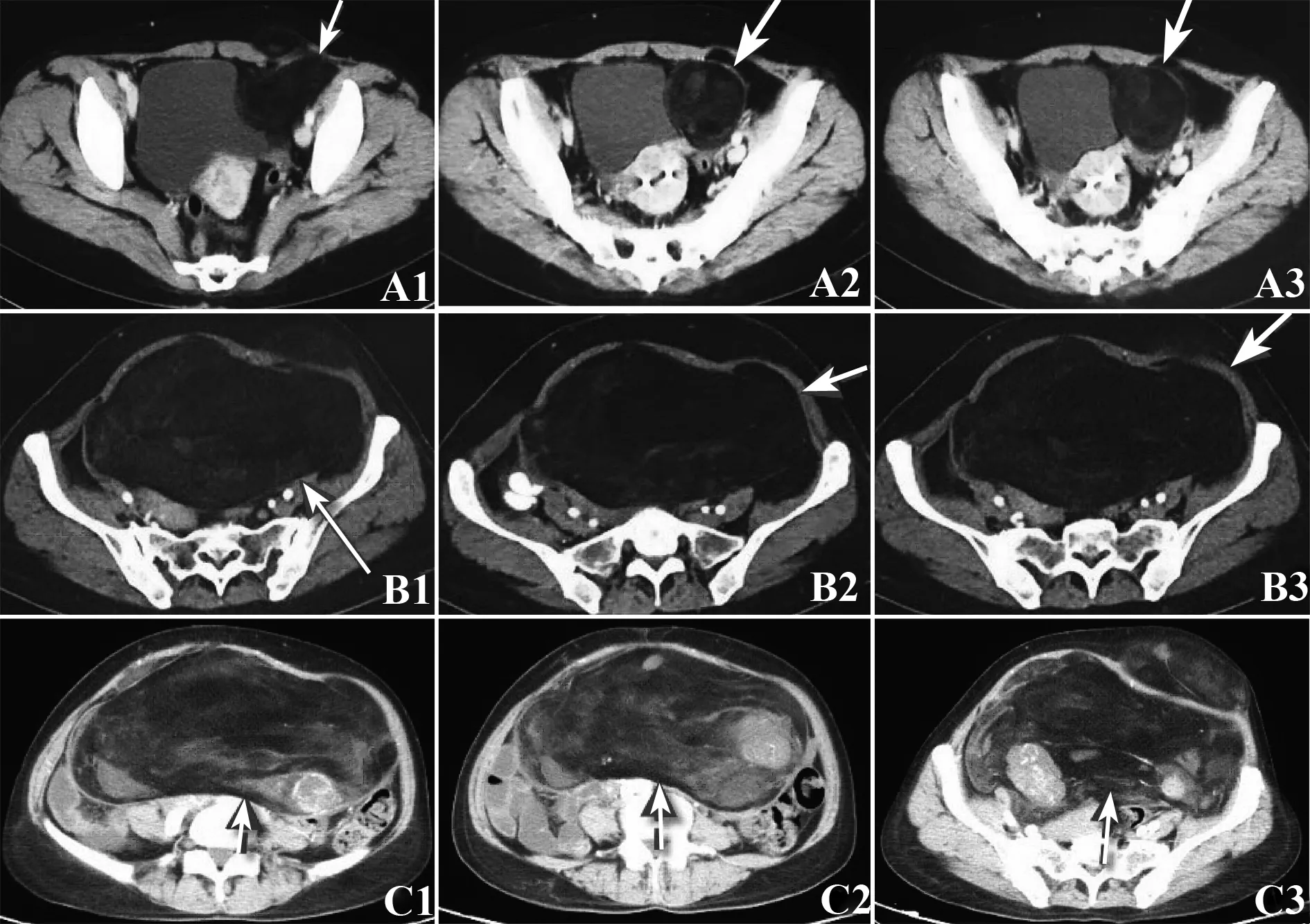
图2 单独使用阿帕替尼治疗复发的腹膜后脂肪肉瘤患者治疗前后对比图像Fig.2 Comparative images of recurrent retroperitoneal liposarcoma in a patient before and after apatinib monotherapyNote: A.A1-A3 represent CT images of pelvic liposarcoma (see arrow) before apatinib monotherapy;B.B1-B3 represent CT images of postoperative recurrent liposarcoma and significant lesion progression (see arrow);C.C1-C3 represent steady lesion progression (see arrow) in follow-up CT images 3 months after apatinib monotherapy.

图3 阿帕替尼联合MASCT治疗或单独使用阿帕替尼的PFSFig.3 Comparison of survival and PFS between apatinib and MASCT and apatinib monotherapy-treated sarcoma patientsNote: A.Comparison of PSF among four sarcoma patients after apatinib and MASCT and two sarcoma patients after the apatinib monotherapy;B.Comparison of median PSF of advanced sarcoma patients in pazopanib-treated and placebo groups from a previous publication.Compared with placebo group,pazopanib improved PFS of patients with advanced soft tissue sarcoma by 3 months.
表3 4例患者治疗前后CTCs结果(个/7.5ml)
Tab.3 CTCs of four patients underwent combination therapy with apatinib and MASCT(positive signal cells/7.5ml)
CaseCTCsPriortreatmentPosttreatment11832303101451

图4 4例患者治疗前后细胞免疫功能评价(%)Fig.4 Evaluation of cell immune functions for four patients underwent combination therapy with apatinib and MASCT(%)Note: 1.Case 1 prior treatment;1′.Case 1 post treatment;2.Case 2 prior treatment;2′.Case 2 post treatment;3.Case 3 prior treatment;3′.Case 3 post treatment;4.Case 4 prior treatment;4′.Case 4 post treatment.

图5 ELISPOT法检测病例1患者体内各种抗原肽的响应情况Fig.5 ELISPOT assay to evaluate different antigenic peptide responses in a sarcoma patientNote: A.Different antigenic peptide responses measured by ELISPOT assay in a sarcoma patient after 3-cycle combination therapy of apatinib and MASCT.A1 represents blank control; A2 represents unrelated negative control; A3 represents patient's response to A4-A18 represent the corresponding responses to individual antigenic peptides,including hTERT,p53,Survivin,NY-ESO-1,CEA,CCND1,CDCA1,MET,RGS5,MMP7,EGFR1+2,GUCY1A3,Muc-1,CA9,and Her2;B.Statistical analysis of triplicate ELISPOT assay for each antigenic patient response after treatment.
3 讨论
目前,血管内皮生长因子(Vascular endothelial growth factor,VEGF)被认为是最具潜力的抗血管生成靶点。本研究团队在前期研究中发现:肿瘤细胞中VEGFR2 可通过MAPK及PI3K/AKT 两条信号通路导致其下游VEGF 表达上调,而过表达的VEGF一方面分泌到肿瘤微环境,作用于血管内皮细胞表面的VEGFR2,刺激新生血管生成,另一方面通过自分泌用于肿瘤细胞表面的VEGFR2,通过正反馈环路导致肿瘤细胞产生更加大量的VEGF,导致肿瘤新生血管的不断生成[6]。因此VEGFR2 为肿瘤血管生成的关键分子之一。阿帕替尼是一种新型口服小分子抗血管生成制剂,可高度选择性地结合并抑制VEGFR2,从而抑制肿瘤血管生成,改善免疫状态、抑制肿瘤生长[7](图2)。近年来,肿瘤免疫治疗越来越受到重视,目前已被广泛用于胃癌、肝癌、肾癌、非小细胞肺癌和卵巢癌等实体瘤的辅助和解救治疗中[8]。其中,肉瘤不但罕见,而且其预后较差,复发率高,全身治疗疗效非常不理想。因此,本研究采用甲磺酸阿帕替尼联合MASCTTM技术治疗肉瘤患者取得了良好的临床疗效,4例患者中3例为PR,1例为CR,可显著提高患者的生活质量,且未观察到不良反应。
抗肿瘤血管生成治疗相关的获益机制很复杂,除了抑制肿瘤新生血管外,免疫状态的改善也是获益的关键因素之一[9]。多项研究证实抗肿瘤血管生成治疗可以改变肿瘤微环境中各种免疫抑制性细胞的构成[10],特别是Treg细胞的比例和功能。MASCTTM多靶点抗原肽自体免疫细胞技术集主动免疫与被动免疫治疗于一体,可调节和增强机体的免疫功能,杀伤肿瘤细胞。本研究中的4例肉瘤患者,原发肿瘤病灶和转移灶较治疗前均有一定的退缩,其中1例评价为CR,3例评价为PR,有效率100%,同期2例单独使用阿帕替尼的患者1例SD,1例PD,联合组和单独组的中位PFS为6.5 vs 1个月,说明本研究方案有一定的临床疗效。在一项Ⅱ期临床研究中,达卡巴嗪单药治疗既往治疗失败的晚期软组织肉瘤患者总体缓解率(Overall response rate,ORR)仅为15.5%,而吉西他滨联合达卡巴嗪方案为26.3%[11]。目前对于肉瘤的靶向治疗中,帕唑帕尼(Pazopanib)于2012年4月26日被美国食品与药品管理局(Food and Drug Administration,FDA)批准用于治疗既往蒽环类为基础方案治疗失败的复发转移性软组织肉瘤(脂肪肉瘤除外)。在Ⅲ期PALETTE研究中帕唑帕尼与安慰剂对照,帕唑帕尼治疗晚期软组织肉瘤仅使PFS提高了3个月(4.6 vs 1.6),总缓解率仅为6%,总生存并无改善[12]。
本研究采用EORTC QLQ-C30量表对阿帕替尼联合MASCTTM治疗的肉瘤患者进行生活质量测评。结果提示患者失眠、疼痛、肢体活动受限等症状评分下降,而躯体功能和总健康评分明显升高,提示此治疗方案对于改善肉瘤患者生活治疗具有重要意义,目前尚无有关文献报道。并且4例患者治疗期间无血常规异常(白细胞减少、血小板减少)、器官功能损伤(肝肾功能损伤)和不良反应(恶心、呕吐、发热、神经毒性反应)等,说明本研究方案安全,可应用于临床治疗。
循环肿瘤细胞(Circulating tumor cells,CTCs)是指自发或因诊疗操作由实体瘤或转移灶释放进入外周血循环的肿瘤细胞,是恶性肿瘤患者出现术后复发和远处转移的重要原因。大量研究显示,CTCs的检测有助于早期发现肿瘤的微转移、监测术后复发、评估疗效及预后,以及选择合适的个体化治疗[13]。本研究中的4例患者在治疗前与治疗后1个月进行的CTCs检测中发现,4例患者在治疗前均有一定数量的CTCs。Sastre等[14]使用CellSearch系统检测94例大肠癌患者的外周血CTCs,将CTCs≥2个/7.5 ml外周血定义为阳性。借用此标准,4例患者治疗前的阳性率为100%,而治疗后的阳性率仅为25%。此结果在一定程度上说明阿帕替尼联合MASCTTM技术治疗肉瘤患者有一定的临床疗效。
有研究表明,恶性肿瘤患者由于细胞免疫功能受到较大的损害,机体内辅助性T细胞(CD4+)减少,而抑制性T细胞(CD8+)增多,且随病情的进一步恶化,CD4+/CD8+比值逐渐减少甚至倒置[15]。本研究结果显示,本方案治疗后患者体内参与免疫调节、免疫监视和杀伤靶细胞的CD3+、CD4+、CD56+细胞水平均较治疗前有升高,提示阿帕替尼联合MASCTTM治疗明显提高肉瘤患者的抗肿瘤免疫功能。
ELISPOT是从单细胞水平检测分泌抗体细胞(ASC) 或分泌细胞因子(CK) 细胞的一项细胞免疫学检测技术。在许多研究中,该技术已被用于免疫动物外周血淋巴细胞中抗原特异的细胞毒性T细胞(CTL)的数量检测。本研究中患者在3周期治疗后1月进行了对抗原肽的响应情况检测,结果提示其对大部分抗原肽均有响应,应答率较高,这进一步从侧面说明本方案中的MASCTTM技术所添加的抗原肽对肉瘤患者大部分产生了肿瘤特异性免疫应答,从而发挥抗肿瘤作用。
本研究课题采用甲磺酸阿帕替尼联合MASCTTM技术治疗肉瘤患者目前在国内外尚无报道。结果显示,免疫治疗加抗VEGFR2治疗对于骨与软组织肉瘤患者安全、有效,其中对于远处转移、局部复发患者也有一定的疗效,可有效提高免疫功能细胞活性,改善患者的生活质量。目前本课题组正在开展Ⅰ/Ⅱ期床试验,进一步探索阿帕替尼联合MASCTTM对晚期恶性实体瘤患者的对安全性及临床治疗疗效。
[1] Stiller CA,Trama A,Brewster DH,etal.Descriptive epidemiology of Kaposi sarcomas in Europe:Report from the RARECARE project[J].Cancer Epidemiol,2014,38(6):670-678.
[2] Bonvalot S,Levy A,Terrier P,etal.Primary extremity soft tissue sarcomas:does local control impact survival?[J].Ann Surg Oncol,2016.[Epub ahead of print]
[3] Damm K,Volk J,Horn A,etal.Patient preferences in allergy immunotherapy (AIT) in Germany -a discrete-choice-experiment[J].Health Econ Rev,2015,6(1):32.
[4] Martín-Gayo E,Sierra-Filardi E,Corbí Angel L,etal.Plasmacytoid dendritic cells resident in human thymus drive natural Treg cell development[J].Blood,2010,115(26):5366-5375.
[5] Chen J,Jiang CC,Jin L,etal. Regulation of PD-L1:a novel role of pro-survival signalling in cancer[J].Annals Oncol,2016,27(3):409-416.
[6] Liu L,Qiao Y,Hu C,etal.Endostatin exerts radiosensitizing effect in non-small cell lung cancer cells by inhibiting VEGFR2 expression[J].Clin Translational Oncol,2016,18 (1):18-26.
[7] Roviello G,Ravelli A,Polom K,etal.Apatinib:A novel receptor tyrosine kinase inhibitor for the treatment of gastric cancer[J].Cancer Lett,2016,372(2):187-191.
[8] Chu H,Du F,Jiang L,etal.The Efficacy of CIK-based immunotherapies for advanced solid tumors[J].Technol Cancer Res Treat,2016.[Epub ahead of print]
[9] Wilke H,Muro K,Van Cutsem E,etal.Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW):a double-blind,randomised phase 3 trial[J].Lancet Oncol,2014,15(11):1224-1235.
[10] Motz GT,Coukos G.The parallel lives of angiogenesis and immunosuppression:cancer and other tales[J].Nat Rev Immunol,2011,11(10):702-711.
[11] García-Del-Muro X,López-Pousa A,Maurel J,etal.Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma:a spanish group for research on sarcomas study[J].J Clin Oncol,2011,29(18):2528-2533.
[12] Van der Graaf WT,Blay JY,Chawla SP,etal.Pazopanib for metastatic soft-tissue sarcoma (PALETTE):a randomised,double-blind,placebo-controlled phase 3 trial[J].Lancet,2012,379(9829):1879-1886.
[13] Paterlini-Brechot P,Benali NL.Circulating tumor cells (CTC) detection:clinical impact and future directions[J].Cancer Lett,2007,253:180-204.
[14] Sastre J,Maestro ML,Puente J,etal.Circulating tumor cells in colorectal cancer:correlation with clinical and pathological variables[J].Ann Oncol,2008,19:935-938.
[15] Oleinika K,Nibbs RJ,Graham GJ,etal.Suppression,subversion and escape:the role of regulatory T cells in cancer progression[J].Clin Exp Immunol,2013,171(1):36-45.
[收稿2016-08-25 修回2016-09-25]
(编辑 许四平)
Clinical research on apatinib mesylate combined with multiple antigens specific cell therapy in treatment of osteosarcoma and soft tissue sarcoma(small sample report)
QIAOYun,HUIKai-Yuan,RENYan,WANGLei,SONGDa-An,JIANGXiao-Dong.
DepartmentofRadiationOncology,theAffiliatedLianyungangHospitalofXuzhouMedicalUniversity/theFirstPeople′sHospitalofLianyungang,Lianyungang222002,China
Objective: To evaluate the effect and safety of molecular targeted therapy of apatinib mesylate combined with multiple antigen stimulatiing cellular therapy in treatment of osteosarcoma and soft tissue sarcoma.Methods: Six patients with sarcoma were collected by the failure of surgery,radiation and chemotherapy treatment or refusal surgery,radiation and chemotherapy,and at least one month from the last treatment of surgery,radiation and chemotherapy.All of the patients at least received three cycle MASCTTM.From Day 1,everyone were given Apatinib 500 mg,po,qd ,until the disease progression.To measure the patient′s quality of life depending on EORTC QLQ-C30,meanwhile,detecting the cellular immunity function and circulating tumor cells(CTCs) of patients before treatment and one month after 3 cycle MASCTTM.At last,monitoring the cellular immune responses by the Enzyme-linked immuno spot (ELISPOT) assay.Results: All of the four patients completed the treatment of 3 cycle MASCTTM.Only one patient reduced apatinib from 500 mg to 250 mg because of palmar-plantar erythrodyses-thesia.The response rates of the four patients received MASCTTMand apatinib mesylate after treatment were 1 for complete response (CR),3 for partial response (PR).The life quality and cellular immunity function were improved in all of the patients.ELISPOT assay suggested that the majority of antigen peptides could induce specific cytotoxic T lymphocytes(CTLs) response.The Progression-Free-Survival (PFS)of four patients received MASCTTMand apatinib mesylate was 7,6,9 and 4 months ,while the response rates of the two patients received apatinib mesylate were 1 for (Stable disease)SD,one for (Progression disease)PD.And PFS of the two patients were one month and two months.Conclusion: Combination of MASCTTMand apatinib mesylate is safe,effective and were good prospects for application.
Multiple antigens specific cell therapy;Apatinib mesylate;Osteosarcoma and shoft tissue sarcoma
10.3969/j.issn.1000-484X.2017.01.024
乔 云(1986年-),女,硕士,医师,主要从事肿瘤免疫治疗与免疫逃逸机制研究,E-mail:qiaojoanna@163.com。
及指导教师:蒋晓东(1970年-)男,博士,教授,博士生导师,主要从事抗肿瘤血管生成治疗与免疫逃逸的机制研究。
R738.6
A
1000-484X(2017)01-0114-06
①并列第一作者。
——评《卵巢恶性肿瘤诊疗手册》