噻可拉林协同顺铂促进宫颈癌c4-1及Hela细胞凋亡机制的研究
董红玲 周 萍 杨文静
(江汉大学附属医院妇产科,武汉430015)
噻可拉林协同顺铂促进宫颈癌c4-1及Hela细胞凋亡机制的研究
董红玲 周 萍①杨文静
(江汉大学附属医院妇产科,武汉430015)
目的:探讨噻可拉林协同顺铂促进宫颈癌c4-1、Hela细胞凋亡的机制。方法:用不同浓度噻可拉林和顺铂单独或联合作用于体外培养的c4-1、Hela细胞,MTT法检测c4-1、Hela细胞生长抑制率,Hoechst 33342 和AO-EB染色法检测细胞凋亡,Western blot检测细胞Bax、Bcl2、p53、p21蛋白的表达,流式细胞术检测细胞增殖周期。结果:c4-1及Hela细胞经不同浓度的噻可拉林和顺铂单独或联合作用后,细胞的体外增殖活力被明显抑制,呈剂量依赖关系,且在联合使用噻可拉林(10 nmol/L):顺铂(4 μmol/L)用量时抑制效果最明显(P<0.05);AO-EB染色法显示,噻可拉林和顺铂联合使用,细胞凋亡更明显。Western blot则显示,Bax、p53、p21表达明显上调,而Bcl2的表达则明显下调。结论:噻可拉林能协同顺铂上调Bax、p53、p21的表达和下调Bcl2的表达,抑制宫颈癌c4-1、Hela细胞增殖同时促进细胞凋亡。
噻可拉林;顺铂;宫颈癌;凋亡
子宫颈癌是世界上最常见的恶性肿瘤之一,它占所有癌症发病率的13%[1],人乳头状瘤病毒(Human papilloma virus,HPV)感染是子宫颈癌发生的主要因素,该疾病常好发于育龄妇女,中老年妇女因生殖系统易感HPV,也是发病人群之一[2]。最近,有两个预防HPV的疫苗(Gardasil和Cervarix)上市,但是对于已经感染HPV或患宫颈癌患者而言,该疫苗无任何作用[3]。因此,仍然需要寻找新的治疗策略。目前宫颈癌的常规治疗方法是放疗、化疗和手术治疗。顺铂无论是单独使用或与托泊替康组合使用的首选药物。然而,顺铂治疗时产生的副作用如骨髓抑制症、粒细胞减少、血小板减少、肾毒性和神经毒性贫血会对患者产生严重危害[4]。鉴于以上血液系统毒性反应和后天耐药,在整个化疗过程中必须对使用顺铂使用剂量进行严格的限制[5]。因此提高低剂量顺铂的化疗效果是目前临床治疗有效的治疗手段之一[6,7]。噻可拉林是一种硫代缩酚酸肽双嵌入剂,研究表明,其对很多肿瘤细胞均有一定的细胞毒性,包括乳腺癌细胞、肺癌细胞、结肠癌细胞、肾癌细胞以及黑色素瘤细胞。它能够诱导肿瘤细胞周期在G1期停滞[7-9]。本研究将探讨噻可拉林协同顺铂对宫颈癌c4-1、Hela细胞凋亡的影响,并初步研究其机制。
1 材料与方法
1.1 试剂与设备 主要试剂包括RPMI1640培养、基胎牛血清(FBS)购自美国Gibco公司,胰蛋白酶、MTT、DMSO、青霉素、链霉素购自美国Sigma公司,Bax、Bcl2、p53、p21、β-actin抗体购自Santa cruz,ECL试剂购自Thermo fisher,细胞裂解液、PMSF(蛋白酶抑制剂)、BCA试剂盒购自上海碧云天生物技术研究所,SDS-PAGE试剂购自Bio-Rad,噻可拉林购自马尔药品公司,AO-EB染色试剂盒购自北京索莱宝科技有限公司。主要设备包括CO2培养箱,超净工作台, 荧光显微镜,Bio-Rad垂直电泳仪,Bio-Rad Western blot化学发光成像系统。人宫颈癌c4-1、Hela细胞株购自中国典型培养物保藏中心(CCTCC)。
1.2 方法
1.2.1 细胞培养 人宫颈癌c4-1、Hela细胞株培养于含有10%FBS、150 U/ml青霉素、150 U/ml链霉素的RPMI1640培养基中,5%的CO2培养箱中37℃常规培养,0.25%胰蛋白消化传代后按实验需要接种于6孔板中。
1.2.2 MTT比色法分析不同浓度噻可拉林和顺铂单独使用或联合使用对c4-1、Hela细胞增殖活性的影响 取对数生长期的c4-1、Hela细胞,调整细胞浓度为1×106ml-1,接种至96孔板,每孔100 μl,分为对照组,顺铂单独使用(终浓度为0.75、1、2、3、4 μmol/L )组,噻可拉林单独使用(终浓度为0、2、4、8、10 nmol/L)组,顺铂和噻可拉林联合使用组共4组,每组每个浓度设4个复孔。继续培养48 h,终止培养前4 h向每孔中加入40 μl MTT,使MTT的终浓度为1 mg/ml,4 h后结束培养,弃掉上清,向每孔中加入150 μl DMSO,置低速摇床上10 min,酶联检测仪测定每孔吸光度OD值(λ=492 nm)。计算细胞增殖活性:增殖活性(%)=实验组OD/对照组OD×100%。
1.2.3 流式细胞术检测细胞增殖周期 取对数期的c4-1、Hela细胞,收集细胞后 1 200 r/min离心10 min,PBS洗1次去除FBS,用无血清的RPMI1640培养基重悬细胞,然后接种至培养瓶中培养24 h后,终止培养,收集细胞,以16%的RPMI1640重悬细胞,调整细胞密度为106ml-1,将细胞接种于6孔培养板,每孔2 ml细胞,实验组细胞加入最佳浓度的顺铂和噻可拉林(4 μmol/L和10 nmol/L),对照组细胞加入等量的无血清培养基。参照文献[10]的方法,流式细胞仪分析细胞周期,资料经Modfit软件进行分析。
1.2.4 Hoechst 33342和AO-EB染色检测细胞凋亡 取对数期的c4-1、Hela细胞,消化后接种于已经放入清洗灭菌盖玻片的6孔板中,接种量为5×104孔-1,待细胞贴壁后,向其中加入对c4-1、Hela细胞增殖影响最佳浓度的顺铂和噻可拉林,继续培养,每24 h换液一次,换液时再次加入顺铂和噻可拉林,48 h以Hoechst 33342和AO-EB染色试剂盒进行染色,方法参照文献[11]进行。染色后,荧光显微镜下观察细胞凋亡情况。
1.2.5 Western blot检测Bax、Bcl2、p53、p21、β-actin蛋白表达量 取对数期的c4-1、Hela细胞,经顺铂和噻可拉林处理后收集细胞,加入细胞裂解液及PMSF,充分裂解后4℃离心机12 000 r/min离心5 min,取上清,BCA法蛋白定量后,加入5×loading buffer,沸水煮10 min后置冰上,然后进行SDS-PAGE,电泳结束后转膜、洗膜(5 min×3次)、5%BSA封闭,封闭结束后洗膜(5 min×3次),孵育一抗,4℃冰箱过夜,然后再次洗膜(5 min×3次),孵育二抗,37℃低速摇床1 h,结束后洗膜(5 min×3次),ECL法曝光。
1.3 统计学分析 所有数据均采用SPSS20.0软件进行分析,计量资料采用单因素方差分析,P<0.05为具有显著的统计学意义。
2 结果
2.1 不同浓度噻可拉林和顺铂单独使用或联合使用对c4-1、Hela细胞增殖活性的影响 结果显示,随着噻可拉林和顺铂浓度的增加,噻可拉林和顺铂单独使用或联合使用细胞增殖活性与对照组比明显下降(P<0.05),而当噻可拉林和顺铂浓度分别小于等于2 nmol/L和1 μmol/L时,联合使用组与单独使用组比较,细胞增殖活性未有明显变化(P>0.05);当噻可拉林和顺铂浓度分别10 nmol/L和4 μmol/L时联合使用,其较单独使用时细胞增殖活性下降更明显(P<0.05),见图1。
2.2 噻可拉林协同顺铂对c4-1、Hela细胞周期的影响 噻可拉林协同顺铂作用c4-1、Hela细胞后,能够诱导细胞出现G0/G1期停滞(见表1),结果显示,加入8 h后开始起作用,48 h最显著,与单独使用组相比,差异具有显著的统计学意义(P<0.05)。


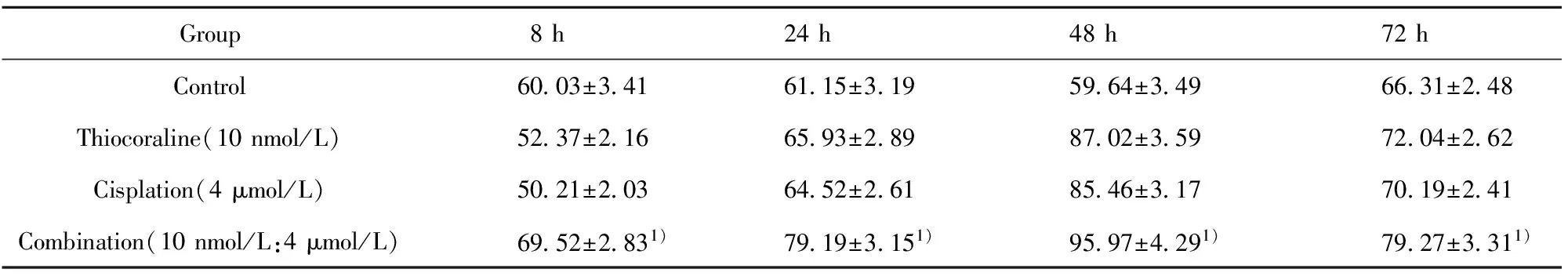
Group8h24h48h72hControl6003±3416115±3195964±3496631±248Thiocoraline(10nmol/L)5237±2166593±2898702±3597204±262Cisplation(4μmol/L)5021±2036452±2618546±3177019±241Combination(10nmol/L:4μmol/L)6952±2831)7919±3151)9597±4291)7927±3311)
Note:Compared with the control group,thiocoraline and cisplatin group,1)P<0.05.

图1 不同浓度噻可拉林和顺铂单独使用或联合使用对c4-1、Hela细胞增殖活性的影响Fig.1 Influence on cell proliferation activity of different concentration of thiocoraline and cisplatin alone or in combination on c4-1 and Hela cellNote:*.P<0.05.

图2 噻可拉林协同顺铂对c4-1、Hela细胞凋亡的影响Fig.2 Effect of thiocoraline combination with cisplatin on apoptosis of c4-1 and Hela cell

图3 噻可拉林协同顺铂对c4-1、Hela细胞Bax、p53、p21、Bcl2表达的影响Fig.3 Effect of thiocoraline combination with cisplatin on the expression of Bax,p53,p21,Bcl2 of c4-1 and Hela cellNote: 1.Control;2.Thiocoraline(100 nmol/L);3.Cisplation(4 μmol/L);4.Combination(10 nmol/L: μmol/L).
2.3 噻可拉林协同顺铂对c4-1、Hela细胞凋亡的影响 Hoechst 33342和AO-EB染色显示,噻可拉林协同顺铂(终浓度为10 nmol/L和4 μmol/L)能够明显的诱导c4-1、Hela细胞凋亡(见图2),AO-EB染色显示联合使用组较单独使用组可见更多的细胞核呈现固缩状橘红色荧光(见图2)。
2.4 Western blot检测结果 噻可拉林和顺铂均能够明显上调Bax、p53、p21的表达,噻可拉林则能下调Bcl2的表达,而顺铂单独使用则不影响Bcl2的表达。协同使用时(终浓度为10 nmol/L和4 μmol/L) Bax、p53、p21表达较单独使用上调更明显,而Bcl2则较噻可拉林单独使用无明显变化(见图3)。
3 讨论
宫颈癌是妇科最常见的恶性肿瘤之一,它威胁着全球女性的健康,其中80%的病例发生在发展中国家[12]。且随着人们的两性生活观念的转变,该疾病发病呈现逐年上升和年轻化趋势。中老年妇女由于其生理机能的退化和机体免疫力的下降,对HPV呈现易感性,因此中老年妇女和育龄妇女仍是高发人群[13]。我国每年新发病例10万以上,是导致女性死亡的第二大恶性肿瘤[14]。目前宫颈癌的主要治疗手段是手术结合术后化疗,而化疗对患者机体正常功能又具有极大的损伤,因此如何降低化疗对患者的副作用成为宫颈癌术后化疗未来治疗方案中非常重要的一个环节。顺铂是宫颈癌化疗中最常用的药物,特别是转移性的宫颈癌,而顺铂治疗的毒性反应和获得性耐药是临床宫颈癌化疗面临的重要问题[15]。如何在低剂量的顺铂下更有效的杀死肿瘤细胞,抑制肿瘤生长及转移,成为使用顺铂治疗转移性宫颈癌的策略之一,某些天然的有毒或无毒的具有抗癌特性的化合物将是解决这一问题的有效途径。
研究表明,噻可拉林是一种来自海洋放线菌Micromonospora marina的具有抗瘤潜能的天然疏水性化合物,它能够对细胞的周期进行干扰,其主要作用方式是抑制DNA合成酶的活性,对细胞周期进行调控,影响细胞的增殖[9]。最近的研究表明,噻可拉林能够抑制甲状腺髓样癌TT细胞的增殖。本研究观察到,噻可拉林单独使用能够明显抑制宫颈癌c4-1、Hela细胞的增殖,同时能够诱导细胞出现凋亡,当其协同顺铂使用时,能够明显提高顺铂促进c4-1、Hela细胞凋亡的作用。细胞凋亡被认为是一种细胞主动参与的“自杀”机制,化疗药物被认为是在这一过程中对细胞内的某些靶点进行作用,从而诱导细胞出现“自杀”现象。本研究观察到的现象表明,噻可拉林可能是协同顺铂作用于c4-1、Hela细胞后,上调了p53的表达,而上调的p53则能够导致其下游的p21蛋白表达增加的,同时上调的p53还能够直接对促凋亡分子Bax的表达进行调控。这表明,噻可拉林协同顺铂的这种诱导表达模式导致细胞p53功能的恢复,从而上调p21和Bax,诱导细胞出现凋亡。此外,本研究还观察到,单独使用噻可拉林和与顺铂联合使用时Bcl-2表达下调效应是一样的,这表明,噻可拉林还能通过作用于凋亡的线粒体通路Bcl-2家族对细胞凋亡进行调控。而噻可拉林是通过何种途径调控Bcl-2表达、以及协同顺铂调控p53及其下游调控细胞凋亡基因表达仍需要进一步的研究。
综上所述,尽管噻可拉林是一种疏水性化合物,其在体内半衰期非常短,同时体内还存在p450及其同工酶对其进行降解,但鉴于其在体外能够通过下调Bcl-2和协同低浓度顺铂恢复p53功能促进宫颈癌c4-1、Hela的凋亡,这为宫颈癌化疗降低顺铂使用浓度提供了联合用药的基础。因此,开发能够转变噻可拉林疏水性和降低其在体内降解的途径,将会为临床降低宫颈癌化疗时使用顺铂的毒性反应和化疗耐药提供新的策略。
[1] Wild CP.International agency for research on cancer[J].Encyclopedia Toxicology,2014,22(12):1067-1069.
[2] Agawu A,Buttenheim AM,Taylor L,etal.Sociodemographic differences in human papillomavirus vaccine initiation by adolescent males[J].J Adolesc Health,2015,57(5):506-514.
[3] Schiller JT,Castellsagué X,Villa LL,etal.An update of prophylactic human papillomavirus L1 virus-like particle vaccine clinical trial results[J].Vaccine,2008,19 (26) :53-61.
[4] Bailleux C,Falk AT,Chand-Fouche ME,etal.Concomitant cervical and transperineal parametrial high-dose-rate brachytherapy boost for locally advanced cervical cancer [J].J Contemp Brachyther,2016,8(1):23-31.
[5] Yu H,Gou S,Wang Z,etal.Toward overcoming cisplatin resistance via sterically hindered platinum(II) complexes[J].Eur J Med Chem,2016,27(114):141-152.
[6] He F,Wang Q,Zheng XL,etal.Wogonin potentiates cisplatin-induced cancer cell apoptosis through accumulation of intracellular reactive oxygen species[J].Oncol Rep,2012,28 (2) :601-605.
[7] Wang XT,Govind SP,Shyama PS,etal.Phenethyl isothiocyanate sensitizes human cervical cancer cells to apoptosis induced by cisplatin[J].Mol Nutr Food Res,2011,55 (10) :1572-1581.
[8] Erba E,Bergamaschi D,Ronzoni S,etal.Mode of action of thiocoraline,a natural marine compound with anti-tumour activity[J].Br J Cancer,1999,80(7):971-980.
[9] Romero F,Espliego F,Pérez Baz J,etal.Thiocoraline,a new depsipeptide with antitumor activity produced by a marine micromonospora.I.Taxonomy,fermentation,isolation,and biological activities[J].J Antibiot,1997,50(9):738-741.
[10] Xu T,Pang Q,Zhou D,etal.Proteomic investigation into betulinic acid-induced apoptosis of human cervical cancer HeLa cells[J].PLoS One.2014,22,9(8):e105768.
[11] 张大勇,项晓霞,陈 律,等.不同年龄大鼠血清对骨髓间充质干细胞衰老影响的实验研究[J].中国细胞生物学学报,2011,33(10):1109-1115.
[12] Dasari S,Wudayagiri R,Valluru L.Cervical cancer: Biomarkers for diagnosis and treatment[J].Clin Chim Acta,2015,20(445):7-11.
[13] 王 静,许可葵,史百高,等.4374例宫颈癌患者预后及其影响因素分析[J].中国肿瘤,2014,23(4):281-288.
[14] 张 斌,周爱芬,陈 忠,等.武汉市20余万农村妇女宫颈癌和乳腺癌筛查情况分析[J].中国妇幼保健,2013,28(9):1398-1402.
[15] Cai L,Wang Z,Liu D.Interference with endogenous EZH2 reverses the chemotherapy drug resistance in cervical cancer cells partly by up-regulating Dicer expression[J].Tumour Biol,2016,37(5):6359-6369.
[收稿2016-03-25 修回2016-05-05]
(编辑 许四平)
Mechanism of thiocoraline combination with cisplatin on promoting apoptosis of cervical cancer cell line c4-1 and Hela
DONGHong-Ling,ZHOUPing,YANGWen-Jing.
ObstetricsandGynecology,AffiliatedHospitalofJianghanUniversity,Wuhan430015,China
Objective:To investigate the apoptosis by thiocoraline in combination with cisplatin on cervical cell line c4-1 and Hela and its mechanism.Methods: Different concentrations of thiocoraline and cisplatin alone or in combination used for cultured c4-1 and Hela cells.The inhibition of cell proliferation was detected by MTT assay,and the apoptosis was detected by Hoechst 33342 and AO-EB staining.The expressions of the protein Bax,Bcl2,p53,p21 were detected by Western blot.The cell cycle of c4-1 and Hela cells were detected by Flow cytometry.Results: The cell proliferation activity of c4-1 and HeLa cells were inhibited obviously by different concentrations of thiocoraline and cisplatin alone or in combination.The inhibition effect was in a dose-dependent manner.Meanwhile,when the concentrations of thiocoraline and cisplatin were 10 nmol/L and 4 μmol/L,respectivity the inhibitory effect was most significant (P<0.05);Hoechst 33342 and AO-EB staining showed that the cell apoptosis effect was more obvious on thiocoraline in combination with cisplatin.The Western blot showed that the expressions of the protein Bax,p53,p21 were significantly up-regulated,and the Bcl2 was significantly down-regulated.Conclusion: Thiocoraline combination with cisplatin could up-regulate the expression of the protein Bax,p53,p21 and down-regulation the expression of Bcl2 to inhibition the proliferation and promotion apoptosis of cervical cell line c4-1 and Hela.
Thiocoraline;Cisplatin;Cervical carcinoma;Apoptosis
10.3969/j.issn.1000-484X.2017.01.020
董红玲(1980年-),女,主治医师,主要从事妇科炎症、宫颈癌及卵巢肿瘤,妊娠合并内科疾病的诊断及治疗等方面的研究,E-mail:donghongling2344@163.com。
及指导教师:周 萍(1980年-),女,主治医师,主要从事子宫内膜异位症、妇科肿瘤等方面的研究。
R711
A
1000-484X(2017)01-0099-04
①武汉市妇女儿童医疗保健中心妇产科,武汉430015。