响应面试验优化两步酶法合成母乳脂替代品工艺及脂肪酸组成分析
熊志琴,潘丽军*,姜绍通,沈 鸿,操丽丽
响应面试验优化两步酶法合成母乳脂替代品工艺及脂肪酸组成分析
熊志琴,潘丽军*,姜绍通,沈 鸿,操丽丽
(合肥工业大学食品科学与工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
采用两步酶法合成母乳脂替代品。以油茶籽油和棕榈酸为原料,在有机相体系中利用脂肪酶Novozym 435催化合成Sn-2位富含棕榈酸的甘油三酯,通过单因素试验和响应面设计,获得了最佳合成条件为反应溶剂正己烷、溶剂用量10 mL/g、底物(棕榈酸-油茶籽油)质量比1.1∶1、脂肪酶用量(以底物质量计)10.1%、反应时间16.5 h、反应温度50 ℃,Sn-2位棕榈酸含量达到66.08%;以第一步酸解反应得到的甘油三酯和鱼油为底物,经Sn-1,3专一性脂肪酶Lipozyme TL IM催化酯交换制备母乳脂替代品。制品检测结果表明,其不仅棕榈酸的含量和分布与母乳脂相似,而且具有较高含量的二十碳五烯酸、二十二碳六烯酸等多不饱和脂肪酸,亦可作为婴儿配方奶粉的脂肪来源。
母乳脂替代品;油茶籽油;脂肪酶;鱼油;多不饱和脂肪酸
母乳是天然的生物胶体体系,含有脂肪、蛋白质、糖类、矿物质和其他生理活性物质,是新生婴儿首选食品[1-2]。母乳脂中98%为甘油三酯(tiacylglycerols,TAGs),主要脂肪酸有棕榈酸、硬脂酸、油酸、亚油酸和长链多不饱和脂肪酸二十二碳六烯酸(docosahexenoic acid,DHA)、花生四烯酸(arachidonic acid,ARA)、二十碳五烯酸(eicosapentenoic acid,EPA)等[3-4],其中70%左右棕榈酸位于甘油骨架Sn-2位上,而油酸和亚油酸等不饱和酸则优先分布在Sn-1,3位上[5]。大量研究表明[6-7],棕榈酸只有富集在甘油酯Sn-2位上才有助于提高婴儿对脂肪和钙质的吸收率,降低便秘、肠阻的可能性。近年来由于受工作压力、个人因素等影响,常常出现母乳不足、母乳营养缺乏等情况,配方奶粉便成为供给婴儿健康成长与发育的理想辅助食品[8]。然而,配方奶粉中的油脂大多由天然植物油直接调配而成,不仅Sn-2位棕榈酸含量与母乳脂相差较大[9],而且缺少促进婴儿大脑发育的EPA、DHA、ARA等长链多不饱和脂肪酸。因此,开发一种脂肪酸组成和分布与母乳脂相似的结构脂质是改善婴儿营养与健康的必然趋势。
母乳脂作为母乳的主要营养物质之一,既提供给婴儿所需50%左右的能量,又能促进婴儿体内必需脂肪酸和脂溶性维生素的消化吸收[10]。目前,Zou Xiaoqiang等[11]采用猪油(Sn-2位富含棕榈酸)和预先调配好的混合植物油经Sn-1,3专一性脂肪酶催化合成母乳脂替代品;Nielsen等[12]以猪油和大豆油脂肪酸为原料制备出母乳脂替代品,但是由于宗教信仰、风俗习惯等因素,一些国家排斥使用猪油,因此其市场潜力远小于植物油。用植物油制备母乳脂替代品的研究主要有:Esteban等[13]以富含棕榈酸的棕榈硬脂和油酸为底物合成1,3-二油酸-2-棕榈酸型母乳脂替代品;Turan等[14]将棕榈酸富集在富含VE的榛子油Sn-2位上,制备出具有一定氧化稳定性的母乳脂替代品;Teichert等[15]将三棕榈酸甘油酯和富含十八碳四烯酸(stearidonic acid,SDA)的大豆油进行酶促酯交换,从而合成含有SDA的母乳脂替代品。
油茶籽油富含β-谷甾醇、生育酚等生理活性物质,不饱和脂肪酸含量高达90%左右[16],且Sn-2位棕榈酸相对含量较一般植物油高。鱼油富含EPA、DHA、ARA等长链多不饱和脂肪酸,具有增强记忆、促进婴儿大脑发育和改善神经传导等功能[17],是目前婴儿配方奶粉首选的补充剂,但鱼油的脂肪酸含量和分布与母乳脂相差较大,需对其进行改性与修饰。然而目前国内外有关油茶籽油和鱼油改性制备母乳脂替代品的研究报道尚较少。本研究以油茶籽油为原料,棕榈酸为酰基供体,在有机相体系中利用脂肪酶Novozym 435催化合成Sn-2位富含棕榈酸的甘油三酯,通过单因素试验和响应面试验探究最佳合成条件;采用酸解反应得到的甘油三酯和鱼油为底物,经Sn-1,3专一性脂肪酶Lipozyme TL IM催化酯交换制备出一种母乳脂替代品;对其主要脂肪酸组成进行检测与分析,为母乳脂替代品的生产提供参考依据。
1 材料与方法
1.1 材料与试剂
油茶籽油、鱼油 市售;Novozym 435酶、Lipozyme TL IM酶 美国诺维信公司;猪胰脂肪酶、胆酸钠 北京索莱宝科技有限公司;棕榈酸、氢氧化钾、氯化钙、盐酸、正己烷、无水乙醇、甲醇(均为分析纯) 国药集团化学试剂有限公司;正己烷(色谱纯)天津市光复精细化工研究所;硅胶板 安徽良臣硅源材料有限公司。
1.2 仪器与设备
SKY-110WX型恒温水浴摇床 江苏金坛市金城国胜实验仪器厂;Hei-VAP型旋转蒸发仪 德国Heizbad公司;GC7890A气相色谱仪 美国安捷伦科技公司;GCMS-QP2010气相色谱-质谱仪 日本岛津制作所;AR1140/C型电子天平 奥豪斯仪器(上海)有限公司。
1.3 方法
1.3.1 Sn-2位富含棕榈酸甘油三酯的合成
称取1.0 g油茶籽油和适量棕榈酸于25 mL具塞锥形瓶中,加入一定量的反应溶剂和脂肪酶Novozym 435,塞紧瓶塞,密封,于转速165 r/min的恒温水浴摇床中反应。
1.3.2 单因素试验
按照1.3.1节方法,分别考察反应溶剂种类(正己烷、环己烷、叔丁醇、丙酮、叔戊醇)、溶剂用量(4、6、8、10、12、14 mL/g)、反应时间(4、8、12、16、20、24 h)、底物(棕榈酸-油茶籽油)质量比(0.5∶1、1∶1、1.5∶1、2∶1、2.5∶1)、反应温度(40、45、50、55、60、65 ℃)、脂肪酶用量(按底物质量计)(4%、6%、8%、10%、12%、14%)因素对甘油三酯棕榈酸含量与分布的影响,试验重复3 次,采用SPSS 17.0软件处理数据、显著性分析,结果用±s表示。
1.3.3 响应面试验优化
根据单因素试验结果进行方差分析,选取影响较显著的因素及其较好的水平区间进行Box-Behnken响应面试验设计,确定酸解反应最优合成条件,每组试验重复3 次,结果用±s表示。试验设计因素及水平选择如表1所示。
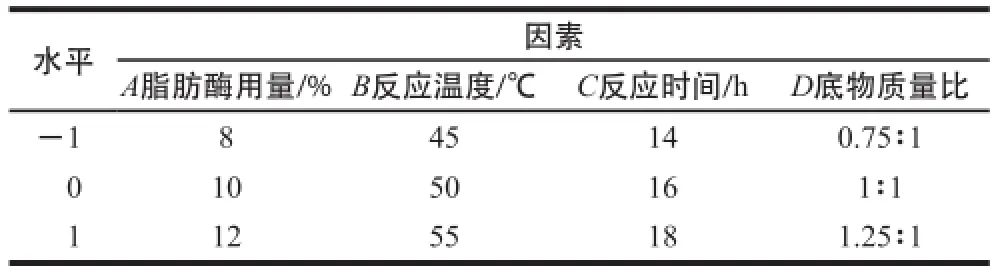
表1 响应面试验设计因素与水平Table1 Factors and their levels used in the response surface design
1.3.4 有机溶剂结晶法提纯甘油三酯
1.3.4.1 甘油三酯的分离纯化
根据孙登文等[18]的方法并作适当修改。将反应液经过滤除酶、真空旋转蒸发除溶剂后,加入适量无水乙醇,在57~60 ℃条件下搅拌进行溶解,然后在25~30 ℃条件下边冷却边搅拌至目标产物结晶析出,抽滤后再加入适量的体积比为2∶2∶1的混合溶剂(甲醇-乙醇-水)进行重结晶,真空干燥即得纯品。
1.3.4.2 甘油三酯纯度的测定
参考寿佳菲[19]的气相色谱-质谱方法稍做修改。具体操作条件如下:
色谱柱:DB-17HT毛细管柱(30 m×0.25 mm,0.25 μm);载气为高纯氦气,流速1.5 mL/min;分流比20∶1,进样量1 μL;溶剂延迟2 min;进样口温度350 ℃,接口温度340 ℃,柱温100 ℃,升温程序为:以30 ℃/min升至 250 ℃,再以10 ℃/min升至340 ℃,保持20 min。离子源为电子电离源;离子源温度250 ℃,电子能量70 eV;电子倍增器电压1.2 kV;质量扫描范围40~1 000 u。
按峰面积归一法计算甘油三酯的纯度,如式(1)所示:
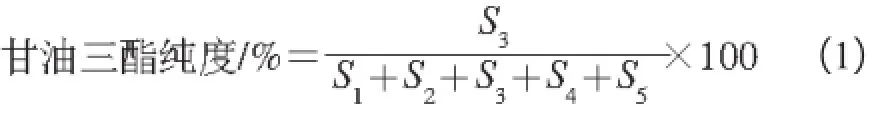
式中:S1为单甘酯对应的峰面积;S2为甘油二酯对应的峰面积;S3为甘油三酯对应的峰面积;S4为游离脂肪酸对应的峰面积;S5为其他物质对应的峰面积。
1.3.4.3 甘油三酯回收率的计算
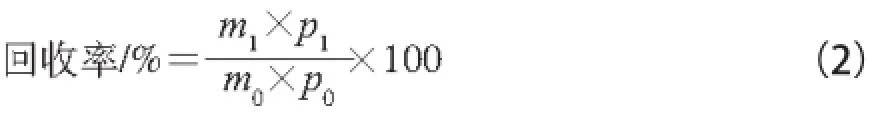
式中:m1为纯化后的样品质量/g;p1为纯化后的样品纯度/%;m0为纯化前的样品质量/g;p0为纯化前的样品纯度/%。
1.3.5 母乳脂替代品的制备
称取酸解反应得到的甘油三酯和鱼油各1 g于25 mL具塞锥形瓶中,加入160 mg脂肪酶Lipozyme TL IM(按底物质量计,8%)和8 mL正己烷(按底物质量计,4 mL/g),通氮气保护防止氧化,于转速165 r/min、温度50 ℃恒温水浴摇床反应4 h,反应结束后继续通氮气冷却至室温。
1.3.6 脂肪酸组成测定
1.3.6.1 总脂肪酸组成测定
参照潘丽军等[20]的方法略作修改,将分离纯化后的产物经薄层层析分离后,刮下甘油三酯条带溶于3 mL的色谱纯正己烷中,加入500 μL KOH-甲醇溶液(1 mol/L),剧烈摇晃1 min后,加入3 mL蒸馏水静置分层,取上清液用无水硫酸钠干燥后进行气相色谱分析。
1.3.6.2 Sn-2位脂肪酸组成测定
采用Nagachinta等[21]的方法进行检测。取一定量的油脂,用胰脂酶将其水解成2-单甘酯,经薄层层析分离后,刮下单甘酯条带并溶于正己烷中,按照1.3.6.1节方法进行甲酯化,气相色谱分析其脂肪酸组成。
1.3.6.3 脂肪酸甲酯的气相色谱分析条件
色谱柱:DB-WAX毛细管柱(30 m×0.25 mm,0.25 μm);检测器:火焰离子化检测仪;进样口温度230 ℃;升温程序:100 ℃保持1 min,以20 ℃/min升至200 ℃,保持1 min后,以3 ℃/min升至230 ℃,保留12 min;氮气流速0.8 mL/min;进样量1 μL;分流比10∶1。
按峰面积归一法计算油脂中不同脂肪酸的含量,如式(3)所示:

2 结果与分析
2.1 单因素试验结果
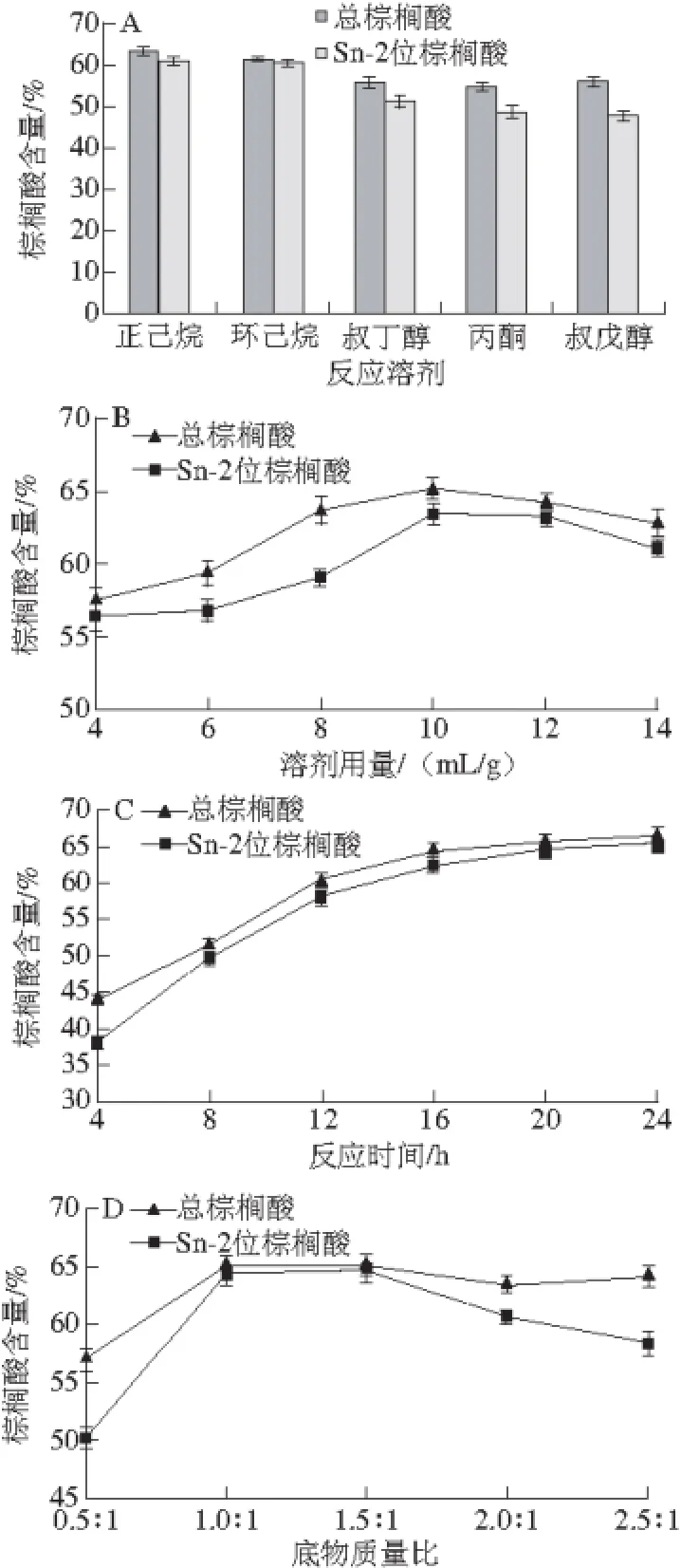
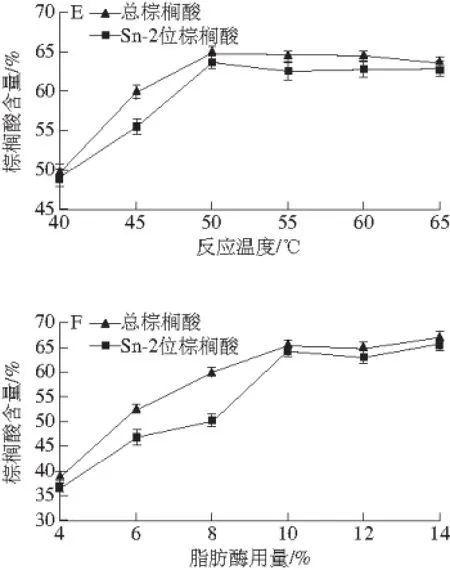
图1 反应溶剂(A)、溶剂用量(B)、反应时间(C)、底物质量比(D)、反应温度(E)、脂肪酶用量(F)对棕榈酸含量与分布的影响Fig. 1 Effects of solvent type and dosage (B), reaction time (C), palmitic acid/camellia seed oil ratio (D), reaction temperature (E), enzyme dosage (F) on the content and distribution of palmitic acid
由图1A可知,以极性较小的正己烷、环己烷为反应溶剂时,合成的甘油三酯总棕榈酸、Sn-2位棕榈酸含量均相近,且高于极性较大的叔丁醇、丙酮和叔戊醇,考虑到较低沸点的正己烷在真空旋转蒸发时相对容易去除,故选择正己烷为反应溶剂。图1B显示,较适宜的溶剂用量为10 mL/g。在图1C中,总棕榈酸与Sn-2位棕榈酸含量在0~16 h内迅速增长(P<0.05),而在16~24 h过程中两者均增长缓慢并趋于平衡,考虑到较长反应时间会造成部分脂肪酶失活,多种副产物产生[22-23],故选择反应时间16 h。图1D表明,底物质量比在1∶1~1.5∶1范围内时,总棕榈酸与Sn-2位棕榈酸含量趋于平衡,且分别达到最高,继续增加质量比,总棕榈酸含量变化差异不显著(P>0.05),Sn-2位棕榈酸含量显著下降(P<0.05),原因可能是过量的棕榈酸夺走了脂肪酶表面必需水,包裹脂肪酶,增加空间位阻,进而影响脂肪酶催化效率[24],为了降低生产成本,选择较适底物质量比1∶1。由图1E可知,反应温度50 ℃时,两指标值均达到最高,温度继续升高呈下降趋势,故反应温度50 ℃是较适宜的。在图1F中,当脂肪酶用量在4%~10%范围内时,两指标值呈显著增加(P<0.05),继续增加酶量,两者皆处于平缓波动状态,变化差异不显著(P>0.05)。综合考虑选择较适脂肪酶用量为10%。
2.2 响应面试验结果
2.2.1 响应面试验设计与结果
响应面试验方案与结果见表2。
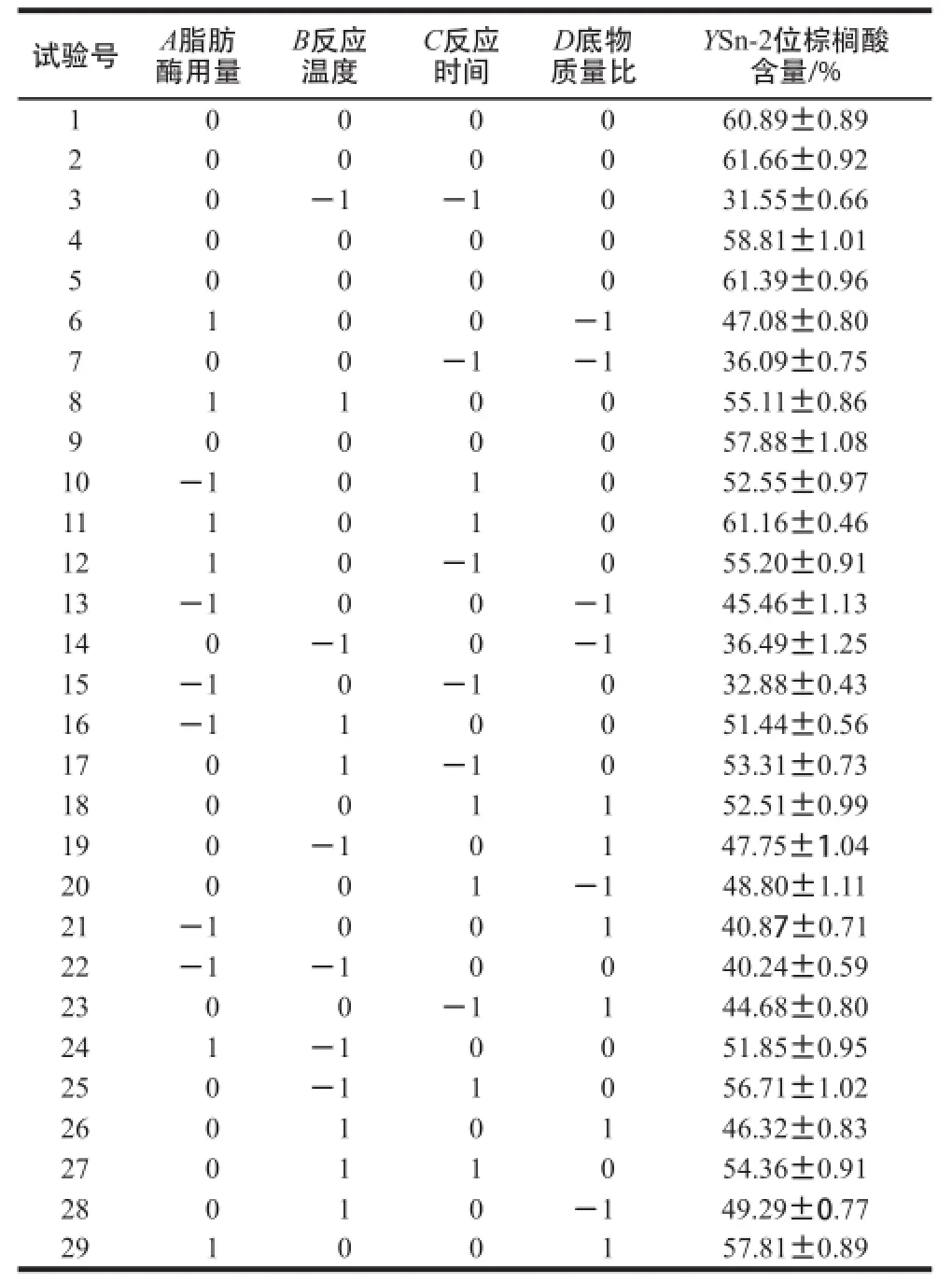
表2 响应面试验设计与结果Table2 Experimental design and results for response surface analysis
2.2.2 回归模型的有效性分析与方差分析
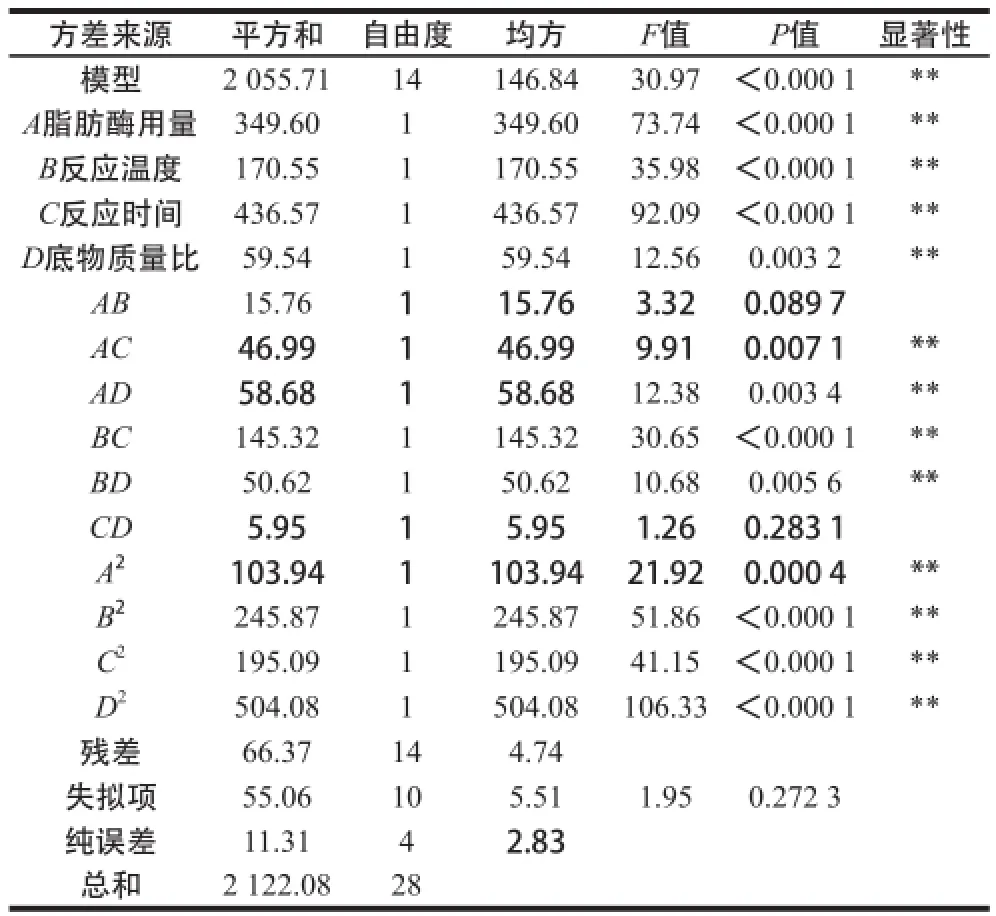
表3 回归模型的方差分析Table3 Analysis of variance of the fitted quadratic regression equation
由表3可知,二次回归模型的P<0.000 1,说明此回归模型极显著;失拟项P=0.272 3>0.05,说明该模型可以接受;决定系数R2为0.968 7,说明回归方程能较好地反映响应值与各因素之间变化关系[25];校正决定系数R2Adj为0.937 4,表明此回归模型可以解释93.74%的试验数据的变异性。A、B、C、D、AC、AD、BC、BD、A2、B2、C2、D2对响应值的影响极显著(P<0.01)。
通过Design-Expert 8.0.6获得的回归方程模型为:Y/%=63.13+5.40A+3.77B+6.03C+2.23D-1.98AB-3.43AC+3.83AD-6.03BC-3.56BD-4.00A2-6.16B2-5.48C2-8.82D2。根据此回归方程,确定合成Sn-2位富含棕榈酸甘油三酯的最优工艺条件为:反应温度50.40 ℃、底物质量比1.08∶1、脂肪酶用量10.08%、反应时间16.42 h。此条件下,合成的甘油三酯Sn-2位上棕榈酸含量达到65.79%。
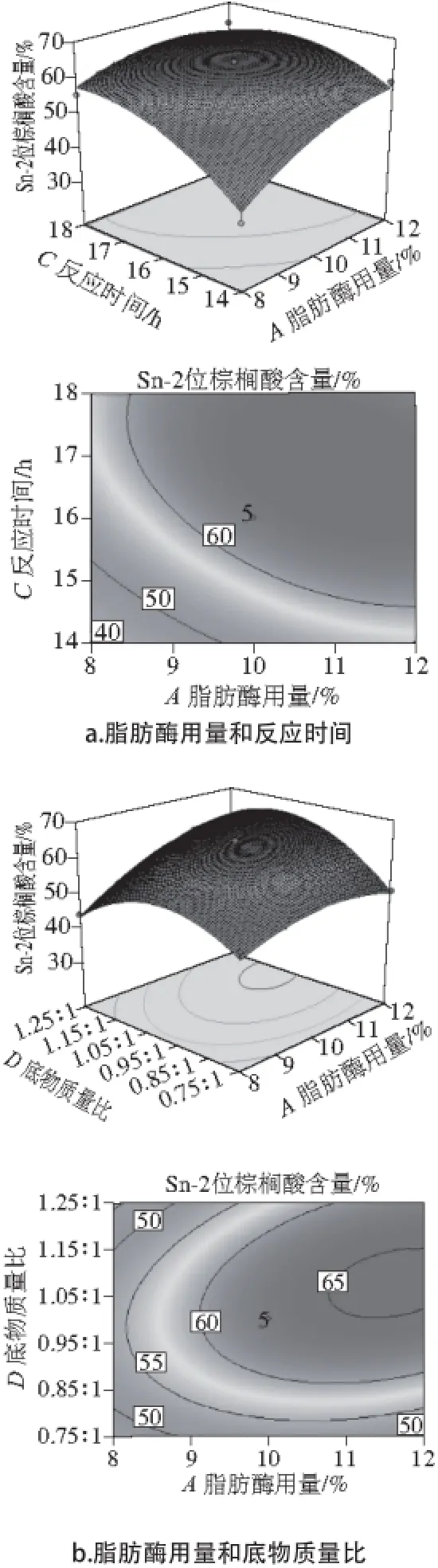
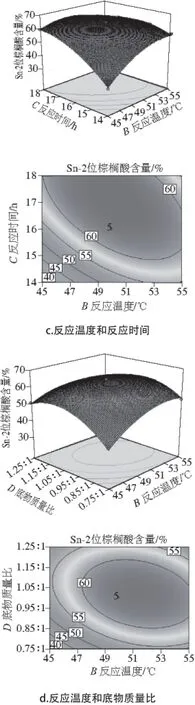
图2 各因素交互作用对Sn-2棕榈酸含量影响的响应面和等高线Fig. 2 Response surface and contour plots showing the effects of four variables on the content of palmitic acid at Sn-2 position
响应面设计中,两因素交互作用响应面和等高线如图2所示。可以看出,AC、AD、BC、BD的交互作用对甘油三酯Sn-2位棕榈酸含量影响的主次顺序为:BC>AD>BD>AC。
2.2.3 验证实验
根据响应面法获得的最佳合成条件,进行3 次平行验证实验,圆整后最终确定的条件为反应温度50 ℃、底物质量比1.1∶1、脂肪酶用量10.1%、反应时间16.5 h,此条件下甘油三酯Sn-2上棕榈酸含量平均值为66.08%。该值落在响应值Y的95%预测区间[62.50%,69.08%],所建回归模型具有较好的拟合性。
2.3 有机溶剂结晶法提纯甘油三酯
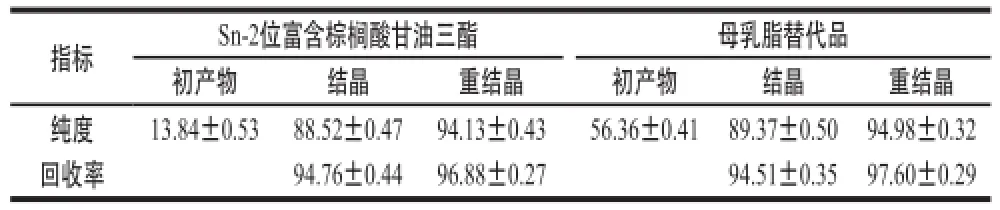
表4 Sn-2位富含棕榈酸甘油三酯及母乳脂替代品的纯度和回收率Table4 Purity and recovery of TAGs rich in PA at Sn-2 position and human milk fat substitutes %
由表4可知,经有机溶剂重结晶后,两步酶法合成的母乳脂替代品纯度达到94.98%,总回收率(结晶回收率×重结晶回收率)为92.24%。
2.4 产物主要脂肪酸组成检测与分析
采用1.3.6.3节条件,分别对油茶籽油、鱼油、反应产物Sn-2位富含棕榈酸甘油三酯和母乳脂替代品进行主要脂肪酸含量检测,结果见表5~7。
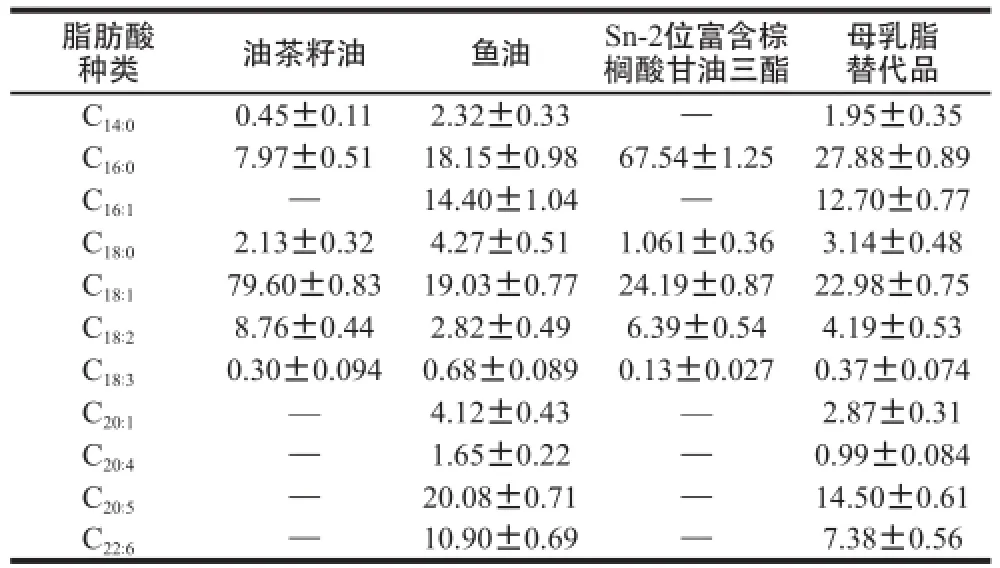
表5 总脂肪酸的含量Table5 Total fatty acid contents of camellia seed oil, fish oil, TAGs rich in PA at Sn-2 position and human milk fat substitutes %
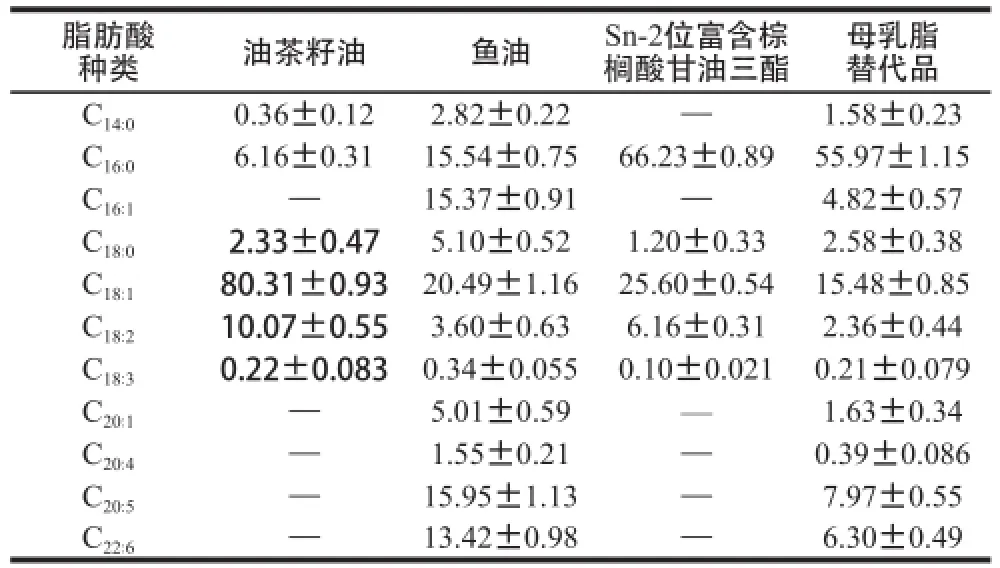
表6 Sn-2位脂肪酸的含量Table6 Sn-2 fatty acid contents of camellia seed oil, fish oil, TAGs rich in PA at Sn-2 position and human milk fat substitutes %
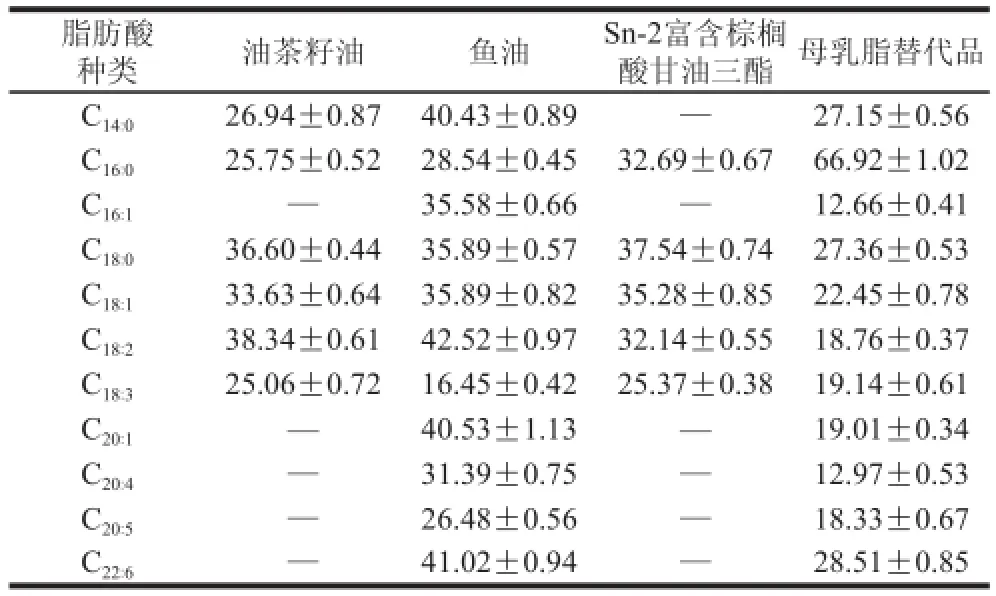
表7 Sn-2位脂肪酸的相对含量Table7 The relative contents of Sn-2 fatty acids in camellia seed oil, fish oil, TAGs rich in PA at Sn-2 position and human milk fat substitutes %
由表5~7可知,两步酶法合成的母乳脂替代品,Sn-2位棕榈酸的相对含量达到66.92%,与母乳脂[26]极相似,明显高于蒋与燕[27]和Yüksel[28]等直接采用棕榈硬脂为原料合成的母乳脂替代品(Sn-2位棕榈酸相对含量分别为50.61%和46.20%);多不饱和脂肪酸EPA、DHA、ARA总含量分别为14.50%、7.38%、0.99%;硬脂酸、油酸、亚油酸等脂肪酸的含量与分布基本处在母乳脂标准范围[26]之内。
3 结 论
以甘油三酯Sn-2位棕榈酸含量为指标,确定酸解反应的最佳反应溶剂为正己烷,较适宜溶剂用量为10 mL/g;利用响应面优化试验获得最优工艺条件为反应温度50 ℃、底物质量比1.1∶1、脂肪酶用量10.1%(以底物质量计)、反应时间16.5 h,此条件下,测得甘油三酯Sn-2位棕榈酸含量为66.08%。
两步酶法合成的母乳脂替代品,经有机溶剂重结晶分离提纯后,纯度达到94.98%,总回收率为92.24%;主要脂肪酸含量和分布基本处于母乳脂标准范围之内,总棕榈酸与Sn-2位棕榈酸含量分别达到27.88%、55.97%,棕榈酸分布在Sn-2位的相对含量为66.92%,与母乳脂极相似。
制品中具有较高含量的不饱和脂肪酸,单不饱和脂肪酸总含量为38.55%,以油酸、棕榈油酸、花生烯酸为主;多不饱和脂肪酸总含量为27.43%,以EPA、DHA和亚油酸为主,其中EPA、DHA含量分别为14.50%、7.38%,表明该母乳脂替代品是一种营养品质较高的油脂,能够增强婴儿记忆力、促进婴儿智力发育。
[1] ZOU X Q, HUANG J H, JIN Q Z, et al. Model for human milk fat substitute evaluation based on triacylglycerol composition prof le[J]. Journal of Agricultural and Food Chemistry, 2013, 61(1): 167-175. DOI:10.1021/jf304094p.
[2] 杜芳芳, 李建平, 郑晓辉, 等. 母乳及婴幼儿配方奶粉中脂肪酸的组成及分布特点[J]. 食品科学, 2015, 36(11): 245-250. DOI:10.7506/ spkxl002-663m201511046.
[3] PINA-RODRIGUEZ A M, AKOH C C. Synthesis and characterization of a structured lipid from amaranth oil as a partial fat substitute in mil k-based infant formula[J]. Journal of Agricultural and Food Chemistry, 2009, 57(15): 6748-6756. DOI:10.1021/jf901048x.
[4] MENESES F, TORRES A G, TRUGO N M. Essential and long-chain polyunsaturated fatty acid status and fatty acid composition of breast milk of lactating adolescents[J]. British Journal of Nutrition, 2008, 100(5): 1029-1037. DOI:10.1017/S0007114508945177.
[5] ZOU L, AKOH C C. Characterisation and optimisation of physical and oxidative stability of structured lipid-based infant formula emulsion: effects of emulsif ers and biopolymer thickeners[J]. Food Chemistry, 2013, 141(3): 2486-2494. DOI:10.1016/j.foodchem.2013.05.029.
[6] SONG Q, LIU Y D, LI X M, et al. Effect of positional distribution of palmitic acid in triglycerides on the absorption of the nutrition in rats[J]. Science and Technology of Food Industry, 2012, 33(16): 349-354. DOI:10.13386/j.issn1002-0306.2012.16.010.
[7] INNIS S M, DYER R, NELSON C M. Evidence that palmitic acid is absorbed as Sn-2 monoacylglycerol from human milk by breast-fed infants[J]. Lipids, 1994, 29(8): 541-545. DOI:10.1007/BF02536625.
[8] 钟金锋, 覃小丽, 王永华. 人乳脂替代品的酶法合成及其评价的研究进展[J]. 食品工业科技, 2014, 35(16): 377-384. DOI:10.13386/ j.issn1002-0306.2014.16.074.
[9] LÓPEZ-LÓPEZ A, LÓPEZ-SABATER M C, CAMPOY-FOLGOSO C, et al. Fatty acid and Sn-2 fatty acid composition in human milk from Granada (Spain) and in infant formulas[J]. European Journal of Clinical Nutrition, 2002, 56(12): 1242-1254. DOI:10.1038/ sj.ejcn.1601470.
[10] WANG Y H, MAI Q Y, QIN X L, et al. Establishment of an evaluation model for human milk fat substitutes[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1): 642-649. DOI:10.1021/jf903048p.
[11] ZOU X Q, HUANG J H, JIN Q Z, et al. Preparation of human milk fat substitutes from lard by lipase-catalyzed interesterif cation based on triacylglycerol profiles[J]. Journal of the American Oil Chemists Society, 2014, 91(12): 1987-1998. DOI:10.1007/s11746-014-2533-z.
[12] NIELSEN N S, YANG T K, XU X B, et al. Production and oxidative stability o f a human milk fat substitute produced from lard by enzyme technology in a pilot packed-bed reactor[J]. Food Chemistry, 2006, 94(1): 53-60. DOI:10.1016/j.foodchem.2004.10.049.
[13] ESTEBAN L, JIMÉNEZ M J, HITA E, et al. Production of structured triacylglycerols rich in palmitic acid at Sn-2 position and oleic acid at sn-1,3 positions as human milk fat substitutes by enzymatic acidolysis[J]. Biochemical Engineering Journal, 2011, 54(1): 62-69. DOI:10.1016/j.bej.2011.01. 009.
[14] TURAN D, YEŞILÇUBUK N Ş, AKOH C C. Enrichment of Sn-2 position of hazelnut oil with palmitic acid: optimization by response surface methodology[J]. LWT-Food Science and Technology, 2013, 50(2): 766-772. DOI:10.1016/j.lwt.2012.07.009.
[15] TEICHERT S A. Stearidonic acid soybean oil enriched with palmitic acid at the Sn-2 position by enzymatic interesterification for use as human milk fat analogues[J]. Journal of Agricultural and Food Chemistry, 2011, 59(10): 5692-5701. DOI:10.1021/jf200336t.
[16] XIE J, LIU T S, YU Y X, et al. Rapid detection a nd quantif cation by GC-MS of camellia seed oil adulterated with soybean oil[J]. Journal of Oil and Fat Industries, 2013, 90(5): 641-646. DOI:10.1007/s11746-013-2209-0.
[17] CAO S L, GUAN Z F, CAI Y P, et al. The analysis and research of comp onents of fatty acid in deep-sea f sh oil and seal oil[J]. Journal of Chinese Mass Spectrometry Society, 1999, 20(1): 70-75.
[18] 孙登文, 湛日景. 用溶剂结晶法分离单脂肪酸甘油酯的工艺: 92100594.6[P]. (1993-08-04).
[19] 寿佳菲. 中长链脂肪酸甘油三酯的酶法制备与分离纯化研究[D]. 合肥: 合肥工业大学, 2012: 22-24.
[20] 潘丽军, 寿佳菲, 符克皇, 等. MLM型结构脂的酶法合成及其理化性质分析[J]. 食品科学, 2012, 33(12): 18-23.
[21] NAGACHINTA S, AKOH C C. Production and characterization of DHA and GLA-enriched structured lipid from palm olein for infant formula use[J]. Journal of the American Oil Chemists Society, 2013, 90(8): 1141-1149. DOI:10.1007/s11746-013-2255-7.
[22] DENG L, XU X B, HARALDSSON G G, et al. Enzymatic production of alkyl esters through alcoholysis: a critical evaluation of lipases and alcohols[J]. Journal of Oil and Fat Industries, 2005, 82(5): 341-347. DOI:10.1007/s11746-005-1076-3.
[23] HITA E, ROBLES A, CAMACHO B, et al. Production of structured triacylglycerols (STAG) rich in docosahexaenoic acid (DHA) in position 2 by acidolysis of tuna oil catalyzed by lipases[J]. Process Biochemistry, 2007, 42(3): 415-422. DOI:10.1016/ j.procbio.2006.09.023.
[24] MUÑÍO M D M, ROBLES A, ESTEBAN L, et al. Synthesis of structured lipids by two enzymatic steps: ethanolysis of f sh oils and esterif cation of 2-monoacylglycerols[J]. Process Biochemistry, 2009, 44(7): 723-730. DOI:10.1016/j.procbio.2009.03.002.
[25] 曹刘霞. 非水相酶催化合成L-抗坏血酸油酸酯、结构表征及性质研究[D]. 郑州: 河南工业大学, 2011: 25-29.
[26] QIN X L, YANG B, WANG Y H. Study on composition of fa tty acid and distribution of Sn-2 fatty acid in colostrum human milk[J]. Science and Technology of Food Industry, 2010, 31(5): 81-83. DOI:10.13386/ j.issn1002-0306.2010.05.070.
[27] 蒋与燕. 酶法催化生产母乳脂肪替代物的研究[D]. 广州: 华南理工大学, 2013: 26-41.
[28] Y☒KSEL A, YEŞIL☒UBUK N Ş. Enzymatic production of human milk fat analogues containing stearidonic acid and optimization of reactions by response surface methodology[J]. LWT-Food Science and Technology, 2012, 46(1): 210-216. DOI:10.1016/j.lwt.2011.10.004.
Optimization of Two-Step Lipase-Catalyzed Synthesis of Human Milk Fat Substitutes by Response Surface Methodology and Fatty Acid Composition Analysis
XIONG Zhiqin, PAN Lijun*, JIANG Shaotong, SHEN Hong, CAO Lili
(Key Laboratory for Agriculture Products Processing of Anhui Province, School of Food Science and Engineering, Hefei University of Technology, Hefei 230009, China)
Human milk fat substitutes (HMFS) were prepared by a two-step enzymatic procedure. Firstly, triacylglycerols (TAGs) rich in palmitic acid (PA) at Sn-2 position were synthesized by Novozym 435 lipase-catalyzed acidolysis of camellia seed oil with palmitic acid in organic system. The optimal alcoholysis conditions were determined using one-factor-ata-time experiments and response surface methodology as follows: n-hexane as reaction solvent at a dosage of 10 mL/g; palmitic acid/camellia seed oil mass ratio, 1.1:1; lipase dosage (on the basis of substrate mass), 10.1%; reaction time, 16.5 h; and temperature, 50 ℃. Under these conditions, TAGs with 66.08% PA at Sn-2 position were obtained. Then HMFS were synthesized by transesterif cation of these TAGs with f sh oil catalyzed by the Sn-1,3 specif c lipase Lipozyme TL IM. The f nal product was tested, and the results showed that the content and distribution of palmitic acid in the HMFS were similar to those of human milk fat. Besides, it had high levels of eicosapentaenoic acid (EPA), and docosahexenoic acid (DHA). Therefore, the HMFS could be used as a fat source for infant formula.
human milk fat substitutes; camellia seed oil; lipase; f sh oil; polyunsaturated fatty acids
10.7506/spkx1002-6630-201702039
TQ645
A
1002-6630(2017)02-0248-07
熊志琴, 潘丽军, 姜绍通, 等. 响应面试验优化两步酶法合成母乳脂替代品工艺及脂肪酸组成分析[J]. 食品科学, 2017, 38(2): 248-254. DOI:10.7506/spkx1002-6630-201702039. http://www.spkx.net.cn
XIONG Zhiqin, PAN Lijun, JIANG Shaotong, et al. Optimization of two-step lipase-catalyzed synthesis of human milk fat substitutes by response surface methodology and fatty acid composition analysis[J]. Food Science, 2017, 38(2): 248-254. (in Chinese with English abstract)
10.7506/spkx1002-6630-201702039. http://www.spkx.net.cn
2016-06-28
“十二五”国家科技支撑计划项目(2011BAD02B04)
熊志琴(1989—),女,硕士研究生,研究方向为食品资源综合利用。E-mail:xiongzhiqin929@163.com
*通信作者:潘丽军(1955—),女,教授,硕士,研究方向为农产品资源综合利用。E-mail:pljhfut@tom.com

