养肝解毒丸微生物限度检查法的验证实验
刘广文+苑艳飞
[摘要]目的建立适合养肝解毒丸微生物限度检查的方法,保证方法的科学性和检查结果的准确、可靠。方法按照《中国药典》2015年版四部规定的微生物限度检查法对微生物限度和控制菌进行检查,以5种试验菌的回收率对检验方法的有效性进行验证和确认。结果在3次独立的平行试验中,需氧菌总数、霉菌和酵母菌总数验证中各试验菌每次试验的比值在0.5~2的范围内;试验组可以检出控制菌大肠埃希菌和乙型副伤寒沙门菌。结论需氧菌总数、霉菌和酵母菌总数检查采用薄膜过滤法,控制菌检查可采用常规法。
[关键词]养肝解毒丸;微生物限度检查;方法学验证
微生物试验的结果易受试验条件的影响,特别是制剂中含有较强的抑菌成分时,只采用常规方法进行微生物限度检查,其结果不能真实反映其污染的微生物状况Ⅲ。口服制剂中微生物污染状况的控制是药品质量控制的重要指标。中药口服制剂尤其易受到微生物的污染,因此中国药典2015年版四部通则中规定微生物限度是中药丸剂的必检项目。
近年来,关于中成药微生物限度检查的方法学验证试验的报道表明,通过方法学验证试验可以消除药物的抑菌作用,使检验结果更具有效性。养肝解毒丸是由山药、龙胆草、败酱草、夏枯草、灵芝、牡丹皮、山茱萸等十二味中药组方组成的复方制剂。其主要功能是滋肾,解毒。现根据《中国药典》2015年版四部微生物限度检查法规定,必须对其检查方法进行验证,笔者通过对养肝解毒丸进行需氧菌总数、霉菌和酵母菌总数及相关控制菌的测定建立了适合的微生物限度检查方法并对方法进行验证,确保了检测方法的可行性。
1试验材料
1.1仪器
GNP-9270BS-Ⅲ型隔水式恒温培养箱,上海新苗医疗器械制造有限公司;SPX-150B-Z型生化培养箱,上海博讯实业有限公司;101A-1型数显电热鼓风干燥箱,深圳市亿博兰电子有限公司;MLS-3780型高压蒸汽灭菌器,日本三洋。
1.2试药
养肝解毒丸(泰安市中医医院,批号:151201,151202,151203)。
1.3培养基
胰酪大豆胨琼脂培养基(广东环凯微生物科技有限公司,批号:3104593);胰酪大豆胨液体培养基(广东环凯微生物科技有限公司,批号:3104633);沙氏葡萄糖琼脂培养基(广东环凯微生物科技有限公司,批号:3104369);沙氏葡萄糖液体培养基(广东环凯微生物科技有限公司,批号:3103279);肠道菌增菌液体培养基培养基;(广东环凯微生物科技有限公司,批号:3104601);紫红胆盐葡萄糖琼脂培养基(广东环凯微生物科技有限公司,批号:3104591);麦康凯液体培养基(广东环凯微生物科技有限公司,批号:3104449);麦康凯琼脂培养基(广东环凯微生物科技有限公司,批号:3104517);RV沙门菌增菌液体培养基(广东环凯微生物科技有限公司,批号:3104566);木糖赖氨酸脱氧胆酸盐琼脂培养基(广东环凯微生物科技有限公司,批号:3104616)。
1.4稀释剂、冲洗剂
氯化钠一蛋白胨缓冲液(北京陆桥技术有限责任公司,批号:140424)、0.9%无菌氯化钠溶液。
1.5菌种
实验所用的菌株传代次数不得超过5代(从菌种保藏中心获得的冷冻干燥菌种为第0代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。
以下菌株均购自山东省食品药品检验研究院(符合药典标准规定)。
金黄色葡萄球菌[CMCC(B)26 003第4代];铜绿假单胞菌[CMCC(B)10 104第4代]枯草芽孢杆菌[CMCC(B)63 501第4代];大肠埃希菌[CMCC(B)44102第4代];乙型副伤寒沙门菌[CMCC(B)50 094第4代];白色念珠菌[CMCC(F)98 001第4代];黑曲霉[CMCC(F)98 003第4代]。
2验证方法与结果
2.1菌液的制备方法
取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、大肠埃希菌和沙门菌的新鲜培养物至10mL胰酪大豆胨液体培养基中,将上述各培养基均置于隔水式恒温培养箱(30~35℃)中培养18~24h。分别取各培养物1mL,加0.9%无菌氯化钠溶液9mL,10倍递增稀释制成每毫升含菌数为小于100cfu的菌悬液。
取白色念珠菌的新鲜培养物至10mL沙氏葡萄糖液体培养基中,置生化培养箱(20~25℃)培养2~3d,取培养物1mL,加0.9%无菌氯化钠溶液9mL,10倍递增稀释制成每毫升含菌数小于100cfu的菌悬液。
取黑曲霉的新鲜培养物至沙氏葡萄糖琼脂斜面培养基中,置生化培养箱(20~25℃)培养5~7d,使大量的孢子形成。用5mL含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液将孢子洗脱。然后,过滤孢子悬液至无菌试管内,取该孢子液1mL,加含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液9mL,10倍递增稀释制成每毫升含孢子数为小于100cfu的孢子液。
2.2供试液的制备方法
每批样品从两个最小包装里取供试品10g,加pH 7.0无菌氯化钠一蛋白胨缓冲液至100mL,混匀,作为1:10供试液。
2.3培养基适用性检查
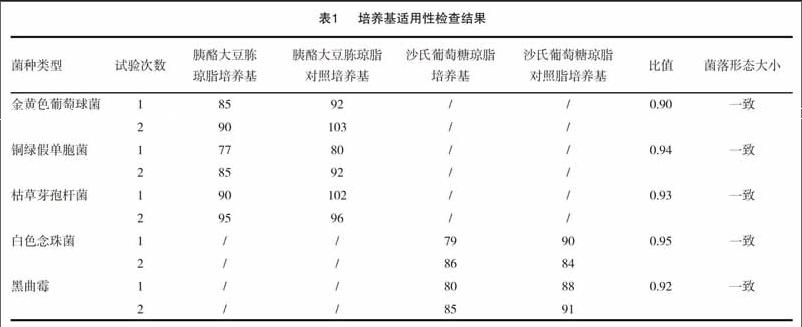
取金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌的菌液各不大于100cfu,分别注入无菌平皿中,立即倾注胰酪大豆胨琼脂培养基,每株试验菌平行制备2个平皿,混匀,凝固,置30~35℃培养18~24h,计数;取白色念珠菌、黑曲霉的菌液各不大于100cfu,分别注入无菌平皿中,立即倾注沙氏葡萄糖琼脂培养基,每株试验菌平行制备2个平皿,棍匀,凝固,置20~25℃培养5~7d,计数。同时,用相应的对照培养基替代被检培养基进行上述试验。见表1。
2.4验证方法:薄膜过滤法
试验组:取上述1:10的供试液10mL过滤,用pH 7.0的氯化钠一蛋白胨缓冲液300mL分3次冲洗滤膜,在最后一次冲洗液中加入上述稀释的5种菌的菌悬液1mL(小于100cfu),过滤,取出滤膜,贴于相应的培养基中,胰酪大豆胨琼脂培养基置30~35℃培养3~5d,沙氏葡萄糖琼脂培养基置20~25℃培养5~7d,测定试验菌数。
供试品对照组:取上述1:10的供试液10mL过滤,用pH 7.0的氯化钠一蛋白胨缓冲液300mL分3次冲洗滤膜,取出滤膜,贴于相应的培养基中,胰酪大豆胨琼脂培养基置30~35℃培养3~5d,沙氏葡萄糖琼脂培养基置20~25℃培养5~7d,测定试验菌数。
菌液对照组:将pH 7.0氯化钠一蛋白胨缓冲液100mL置于过滤器中,加入不大于100cfu的试验菌液,过滤后取出滤膜贴于相应的培养基中,胰酪大豆胨琼脂培养基置30~35℃培养3~5d,沙氏葡萄糖琼脂培养基置20~25℃培养5~7d,测定试验菌数。
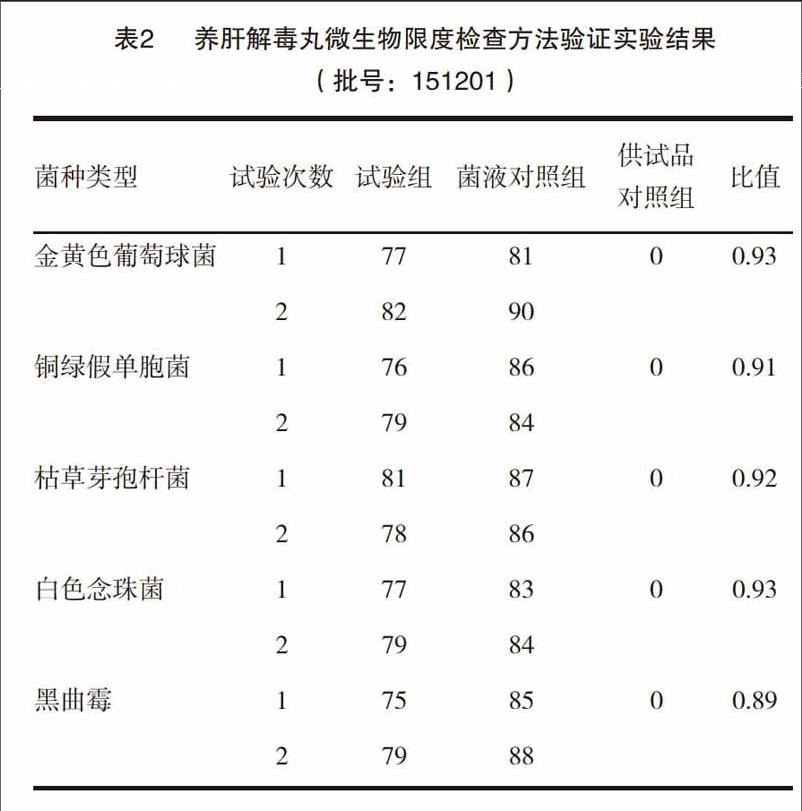
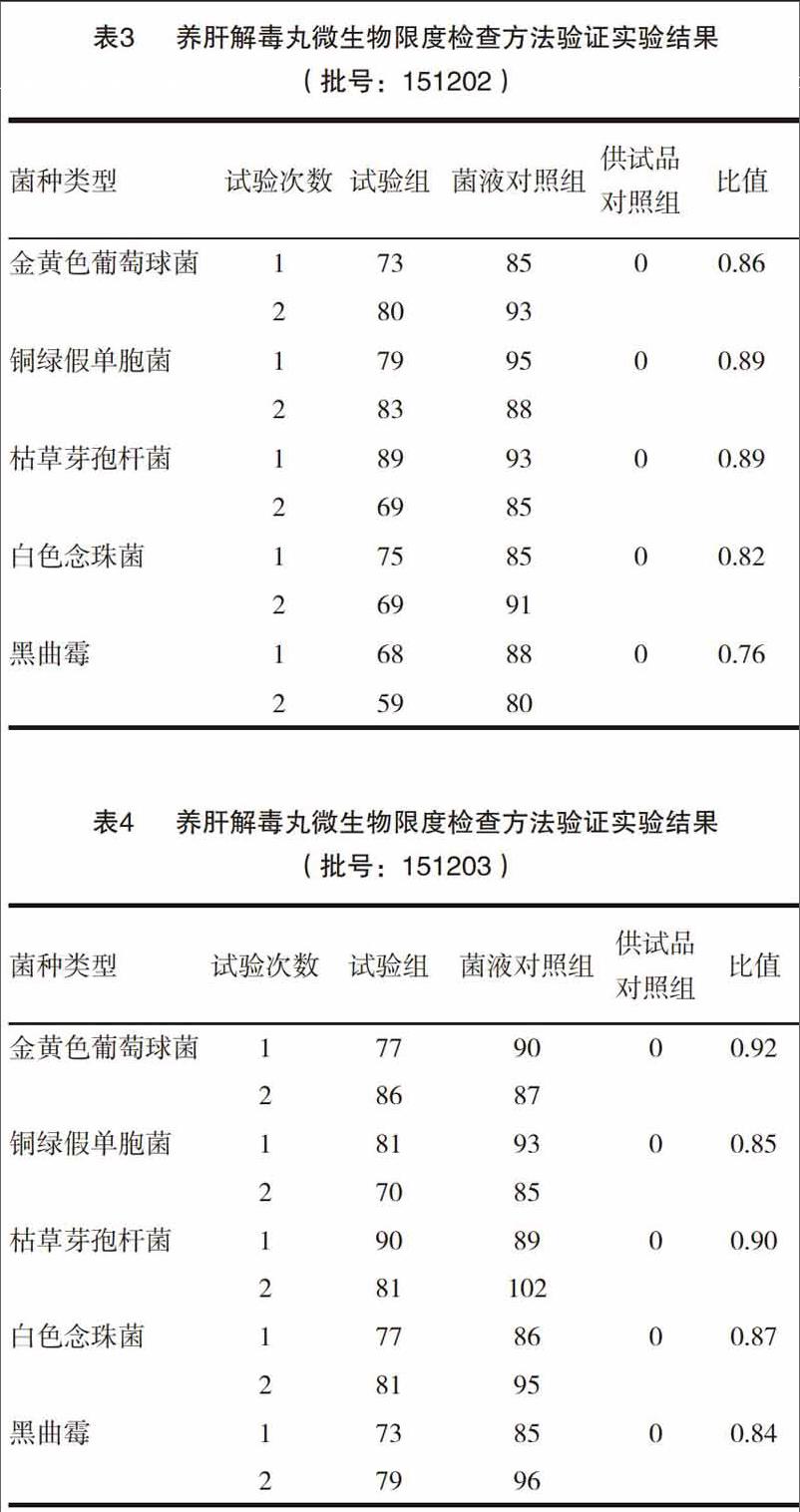
验证结果:依照下列公式,计算五种菌的回收率,结果见表2~4。
试验组菌比值=(试验组平均菌落数一供试品对照组的平均菌落数)/菌液对照组的平均菌落数。
由表2~4可见,采用薄膜过滤法对养肝解毒丸进行需氧菌总数、霉菌和酵母菌总数比值的测定,五种菌的比值均在0.5~2的范围内,符合《中国药典》2015年版四部微生物限度检查验证要求,故薄膜过滤法可用于养肝解毒丸的需氧菌总数、霉菌和酵母菌总数的检查。
2.5控制菌(耐胆盐革兰阴性菌、大肠埃希菌和沙门菌)检查方法的验证
耐胆盐革兰阴性菌:取1:10的供试液100mL,混匀,在20~25℃培养2h。取供试液3份,每份10mL,加入100mL肠道菌增菌液体培养基,其中一份加入1mL大肠埃希菌作为阳性对照,一份加入1mL金黄色葡萄球菌液作为阴性菌对照,一份不加菌作为供试品检查,均培养24~48h后,划线接种于紫红胆盐葡萄糖琼脂培养基平板上,依法培养,观察菌落形态。
大肠埃希菌:取1:10的供试液3份,每份10mL,加入100mL麦康凯液体培养基,其中一份加入1mL大肠埃希菌作为阳性对照,一份加入1mL金黄色葡萄球菌液作为阴性菌对照,一份不加菌作为供试品检查,均培养24~48h后,划线接种于麦康凯琼脂培养基平板上,依法培养,观察菌落形态。
沙门菌:取10g供试品接种至100mL胰酪大豆胨液体培养基中,混匀,30~35℃培养18~24h。取上述培养物3份,每份0.1mL,加入10mL RV沙门菌增菌液体培养基,其中一份加入1mL乙型副伤寒沙门菌作为阳性对照,一份加人1mL金黄色葡萄球菌液作为阴性菌对照,一份不加菌作为供试品检查,均培养24~48h后,划线接种于木糖赖氨酸脱氧胆酸盐琼脂培养基平板上,依法培养,观察菌落形态。
验证结果:见表5。
由表5可见,采用常规法,控制菌能正常检出,阴性对照未检出,符合《中国药典》2015年版四部微生物限度检查控制菌检查验证要求,所以常规法可用于养肝解毒丸的控制菌检查。
通过以上验证实验证明,养肝解毒丸的微生物限度检查方法,需氧菌总数、霉菌和酵母菌总数检查可采用薄膜过滤法,采用常规法控制菌也能正常检出,由此确定验证方法成立,本实验室建立的该项目的检查方法符合规定。
3讨论
按照2015年版《中国药典》四部的要求,在进行药品微生物限度检查时,只有在该检验条件下的样品浓度不足以抑制污染微生物的生长时,才能使供试品中的微生物得到真实反映,从而保证检验结果的科学性和准确性。有很多文献就具有抑菌成分的中成药的需氧菌总数、霉菌和酵母菌总数的检验方法进行了探索和研究。中药制剂是含有多种成分的复合制剂,其中任何成分具有抑菌作用均可影响微生物限度检查的准确性,因此必须对药品的微生物限度检查方法进行严格的验证,才能保证检查方法的完整性和可靠性。
3.1实验室的检验环境对试验方法的影响
2015年版《中国药典》对微生物限度检查的环境提出了明确的要求:应在不低于D级背景下的B级单向流空气区域内进行,B级区域的空气供给应通过终端高效空气过滤器(HEPA)。应严格按照相关国家标准进行定期的环境监测,并制定清洁、消毒和卫生的标准操作规范,防止检验过程中环境造成检品的假阳性。
3.2预处理
在进行薄膜过滤时须先将供试液采用适宜的方法进行预处理,然后再移至带有冲洗液的滤罐中充分混匀后再进行减压抽滤,否则由于供试液杂质太多造成滤罐堵塞引起滤罐爆裂,可能造成人员伤害。在过滤完后必须进行二次冲洗,以保证抑菌成分的彻底清除。可将取出的滤膜正面向上贴于培养基上,经多次试验证明,这样培养出的菌落大并且清晰,特别是在菌落数较多时,菌落会向周围的培养基扩散,不至于菌落都堆积在一起,不利于菌落计数。
3.3菌落计数误差对验证方法的影响
当细菌生长小而密集时,极易发生计数误差。故菌落计数时应仔细观察,必要时借助放大镜或低倍显微镜,以排除药渣和小气泡干扰计数;如难区别,可适当延长培养时间。
3.4药品微生物检验用的试验菌
试验菌应来自认可的国内或国外菌种保藏机构的标准菌株,或使用与标准菌株所有相关特性等效的可以溯源的商业派生菌株。工作菌株的传代次数应严格控制,不得超过5代(从菌种保藏机构获得的标准菌株为第0代),以防止过度的传代增加菌种变异的风险。制备后的菌液若在室温下放置,应在2h内使用;若保存在2~8℃,可在24h内使用。
养肝解毒丸在检查需氧菌总数、霉菌和酵母菌总数时,其组分中有抑菌成分,故需通过薄膜过滤法将抑菌成分清除,方能达到检验目的,因此实验证明本研究建立的方法适用于养肝解毒丸的微生物限度检查。另外当药物的生产方法变更、制剂组分改变、检查法修订或检验条件发生改变时检查方法也应该进行重新验证。

