碘-硫氰酸盐体系浸取废旧线路板中的金
谢良军,冷桂平,李颖欣,朱雅芳,李银旋,梁昌金
(韩山师范学院材料科学与工程学院,广东潮州 521041)
电子产业的迅猛发展,在给人们带来科技享受的同时,也带来了诸多的环境隐患[1].电子垃圾中含有铜、铁、锌、锡等贱金属以及金、银、铂、钯等贵金属.大量电子垃圾堆积既占用土地,又是对其中资源的浪费,而堆放或填埋,其中所含的重金属浸出会对环境造成潜在危害[2-3].对电子垃圾中的有用资源进行再回收利用,不仅可以减少电子垃圾对环境造成的危害,还可以缓解资源短缺带来的压力,既减少环境污染,又为社会创造一定的财富,符合当下绿色环保的发展主题.
目前,从电子垃圾中回收金属资源的方法主要有物理法(机械处理及火法)、化学法(湿法)及生物法[4].其中又以湿法中的氰化法最为成熟,一直沿用了上百年[5].但是氰化法存在对人体危害大、环境污染严重等问题[6].在如今环保主题的发展要求下,急需寻找一种绿色、无毒、浸金效率高的新方法来代替氰化法.对金的浸出有一定效果的硫氰酸盐法、硫脲法、硫代硫酸盐法、卤化法、氨法及微生物法等成为人们研究的重点[7].这些方法对环境的污染程度远远小于氰化法.其中又以硫氰酸盐法研究的最为广泛,鉴于其对人体危害小,化学性质稳定,浸金效率高且浸出速率可与氰化法比拟的优点,越来越收到科研人员的重视[8-9].
硫氰酸盐是一种络合剂,只要氧化剂的氧化还原电位在0.47 V以上,硫氰酸盐就可以与金络合[10],其主要产物为Au(SCN)2-和Au(SCN)4-.常用的氧化剂有软锰矿(MnO2)和Fe3+,也有用溴、过氧化氢及碱性加压氧化[11-15].但是(SCN)2及(SCN)3-极易水解,影响了浸金效率,因此人们在尝试使用一种新的氧化剂,这些氧化剂除了能够将SCN-氧化成(SCN)2及(SCN)3-之外,还能与硫氰酸盐结合形成新的、稳定的络合体系,如硫脲[16]、和氨水[17]等.
该实验以碘单质为氧化剂,以硫氰酸铵为浸出剂浸出废旧印刷线路板中的金.由于碘单质的氧化电位为0.5345 V,满足在适当条件下将Au氧化成Au(SCN)2-所需的氧化剂的氧化还原电位[10],故理论上是可行的.碘单质固体作为无污染氧化剂,具有绿色环保,操作简单、安全的特点,符合当下绿色生产的要求.
1 浸金原理
在以Fe3+做氧化剂的浸出体系中,酸性是必要条件,但是对设备的要求比较高.为此,实验以中性条件作为起始点,加入氧化剂碘之前,用氨水将pH调至中性,由于电子垃圾中含有大量的铜,因此,氨水的加入会使金发生如下反应[18]:

由于氨水主要参与了中和反应,所以反应(1)的速率和强度不高.用氨水调至pH=6.5左右后,加入单质碘.正常情况下,单质碘在水中的溶解很慢,有SCN-存在,极易发生与I2和I-相类似的反应,加速I2的溶解[19-20]:
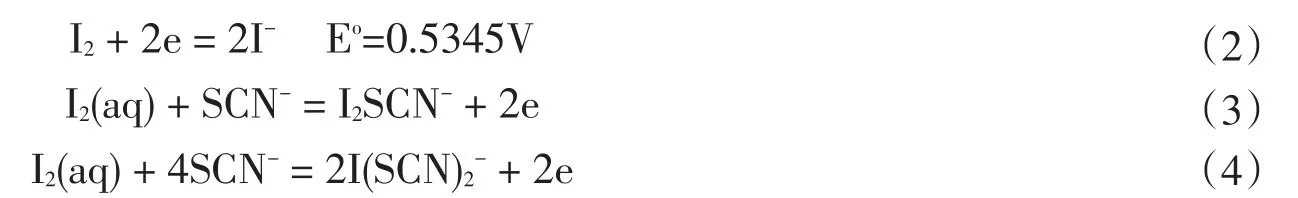
如果是酸性环境,还可以发生接下来的反应:

研究表明[19],I2SCN-和I(SCN)2-是比(SCN)2及(SCN)3-更稳定的络合剂,其与金的络合速率可以与同浓度下的硫脲及单纯I-的速率媲美,更重要的是,碘-硫氰酸盐浸出体系可以减少碘的挥发.
过量的碘可以发生自身的浸取反应[21]:

2 实验过程
2.1 试剂与仪器
试剂:硫氰酸铵、固体碘单质、氨水、硫酸、硝酸、盐酸、高氯酸、氢氟酸,以上试剂均为分析纯,金的标准溶液(1 000 μg/mL)
仪器:TAS-986型原子吸收分光光度计,回旋式水浴恒温振荡器,电热板,密封式制样粉碎机,循环水抽滤机(SHZ-III),pH计(PHS-25C),低温冷却水循环泵(DLSB-10型)
2.2 实验方法
2.2.1 废旧线路板的预处理
用钳子拔掉废旧线路板上的小器件后掰成约1 cm2的小块,然后用密封式制样粉碎机制成粉末,再过筛200目.筛分后的粉末,先用1∶4的稀硝酸浸泡24 h,去除其中部分有机物及贱金属,后在抽滤机上用去离子水反复冲洗、过滤,烘干备用.取0.500 g烘干后的粉末放入聚四氟乙烯坩埚中,用混合酸进行高温消解,后用原子吸收分光光度计对消解液中的主要金属元素进行测定,测得预处理后粉末中的金含量为w1=0.083 2 mg/g.
2.2.2 金的浸出实验
取步骤2.2.1中预处理后的粉末0.500 g放置于250 mL锥形瓶中,加入20 mL一定浓度的硫氰酸铵溶液,并调节pH至约为中性,然后加入一定质量的碘单质,将锥形瓶放入水浴恒温振荡器中,设置振荡速度为300 r/min,在设定温度下振荡反应一段时间.待反应完成后,吸取部分反应液进行离心分离,后对上清液利用原子吸收分光光度计进行金含量的测定,记为w2,利用以下公式计算浸金率x:

以上数值都是在多次平行实验下取平均值.
3 结果与讨论
实验先从中性环境开始,选取硫氰酸铵浓度、碘单质加入量、反应温度、反应时间等四个因素组合进行正交实验,以确定各个因素对金的浸出率的影响大小.其中硫氰酸铵浓度对金的浸出率影响最大,反应时间影响最小,通过试验得到各个因素的最佳组合为:硫氰酸铵浓度为60 g/L,碘单质用量为0.25 g,反应温度为25℃,反应时间为1 h.最后,通过控制变量法选取了对金的浸出率有影响的6个因素进行单因素实验研究分析.
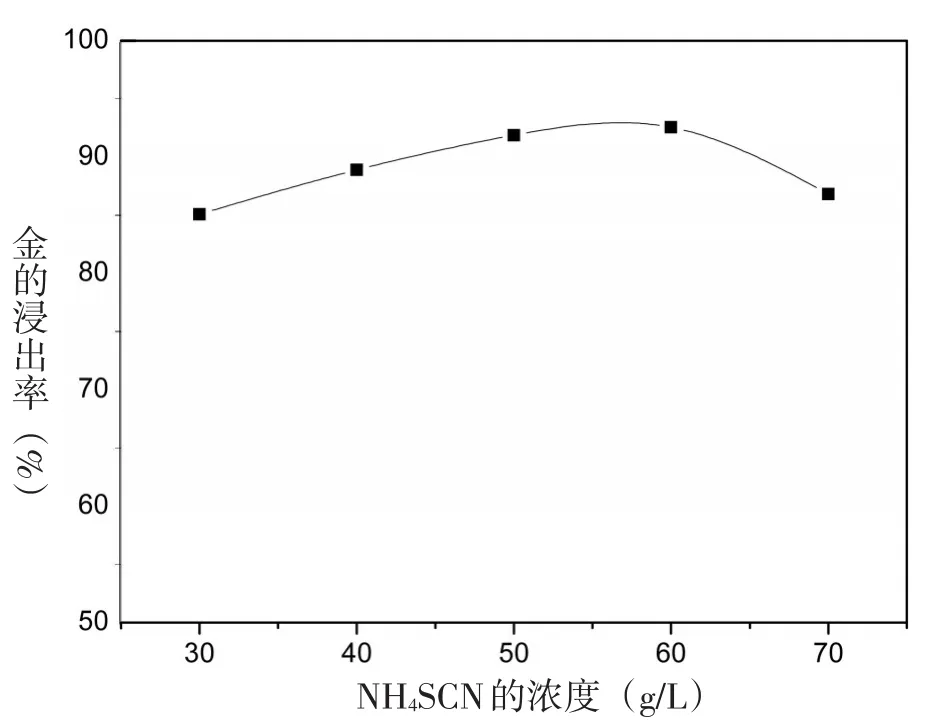
图1 硫氰酸铵浓度对浸金率的影响
3.1 硫氰酸铵浓度对浸金率的影响
实验条件:预处理后的粉末0.500 g,20 mL一定浓度的硫氰酸铵溶液,0.25 g碘单质,pH≈6.5,浸取温度25℃,时间1 h,硫氰酸铵的浓度分别为30 g/L、40 g/L、50 g/L、60 g/L、70 g/L,不同浓度的硫氰酸铵对应的浸出率如图1所示.
由图1可知,金的浸出率随硫氰酸铵浓度的增加而增加.但是硫氰酸铵浓度在60 g/L之后,金的浸出率呈下降趋势,这是因为金的硫氰酸盐络合物的稳定性与浸出剂浓度成反比[8].随着SCN-增加,I2SCN-和I(SCN)2-发生水解,生成I-、硫酸盐及硫氰酸盐的其他氧化产品[20].
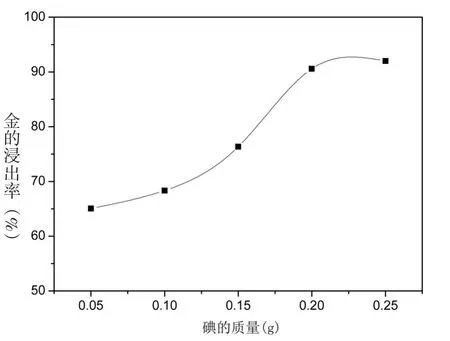
图2 碘的用量对浸金率的影响
3.2 碘的用量对浸金率的影响
实验条件:预处理后的粉末0.500 g,20 mL浓度为60 g/L的硫氰酸铵溶液,加入不同质量的碘固体,pH≈6.5,浸取温度25℃,时间1 h,其中碘的加入量为 0.05 g、0.10 g、0.15 g、0.20 g、0.25 g,其对浸金率的影响如图2所示.
由图2可知,金的浸出率随着碘用量的增加而增加,可见,碘的加入对浸金率有促进作用,且浓度越高,金的浸出率也越大.起初,碘的量很少,受其他金属的干扰,金的浸出率上升的速度比较缓慢,当碘的用量达到0.1 g时,金的浸出率开始快速上升,可能高浓度的碘也参与了浸金反应,碘的用量增加到0.25 g时,金的浸出率达到96%,随着金的浸出殆尽,增加碘的用量,浸金率却趋于平缓势.
3.3 温度对浸金率的影响
实验条件:预处理后的粉末0.500 g,20 mL浓度为60 g/L的硫氰酸铵溶液,0.25 g碘单质,pH≈6.5,时间1 h,分别取浸取温度为10℃、20℃、30℃、40℃、50℃,其对浸金率的影响如图3所示.
由图3可知,金的浸出率随温度的升高而逐渐下降,但是变化不大.这主要是由于随着温度的升高,I2SCN-和I(SCN)2-的分解所致.这同时也反映出了I2SCN-和I(SCN)2-的稳定性比较高,由于挥发所致的碘的损失比较少.为节约成本,可以选取25℃进行试验.

图3 温度对金浸出率的影响
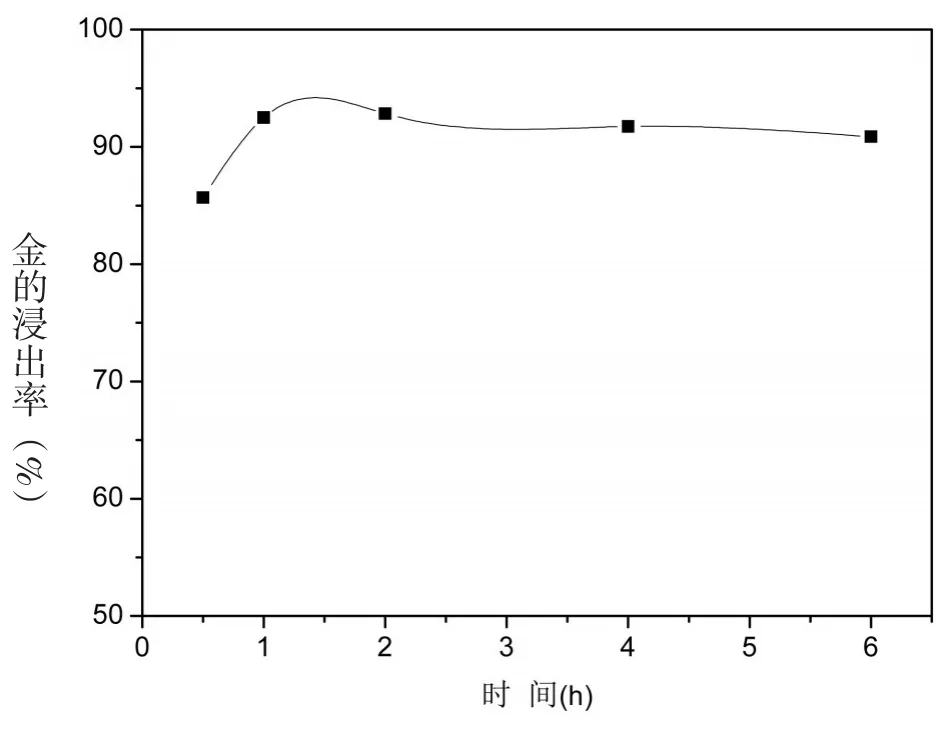
图4 反应时间对金浸出率的影响
3.4 时间对浸金率的影响
实验条件:预处理后的粉末0.500 g,20 mL浓度为60 g/L的硫氰酸铵溶液,0.25 g碘单质,pH≈6.5,浸取温度为25℃,改变反应时间0.5 h、1 h、2 h、4 h、6 h,其对浸金率的影响如图4所示.
由图4可知,反应进行到1 h时,金的浸取率达到92%,之后的时间里,金的浸取率变化不大.可见,碘-硫氰酸盐体系的浸金速率比较快,考虑到时间和成本问题,反应时间宜控制在1 h.
3.5 固液比对浸金率的影响
实验条件:20 mL浓度为60 g/L的硫氰酸铵溶液,0.25 g碘单质,pH≈6.5,浸取温度25℃,反应时间1 h,改变浸取反应固液比1∶5,1∶10,1∶20,1∶30,1∶40,其对浸金率的影响如图5所示.
从图5可以看出,当固液比为1∶40时,粉末与溶液能充分接触,浸金率有最大值,达到92%.
3.6 pH值对浸金率的影响
在金属浸出实验中,pH是一个很大的影响因素,大量试验表明,硫氰酸盐浸金最适宜的pH为1~3,此时硫氰酸盐更稳定,不易分解[8].但是,近中性环境下,硫氰酸盐也有效果不错的浸出率[14].Davis等[22]的研究表明,碘与金的络合可以具有一个很广泛的pH,pH<9.5的情况下AuI2-都能稳定存在.为研究pH对碘-硫氰酸盐浸金体系的影响,特做了pH的单因素实验.
反应条件:预处理后的粉末0.500 g,20 mL浓度为60 g/L的硫氰酸铵溶液,0.25 g碘单质,浸取温度25℃,时间1h,改变pH值分别为1、2、3、5、7,对应金浸出率变化如图6所示.
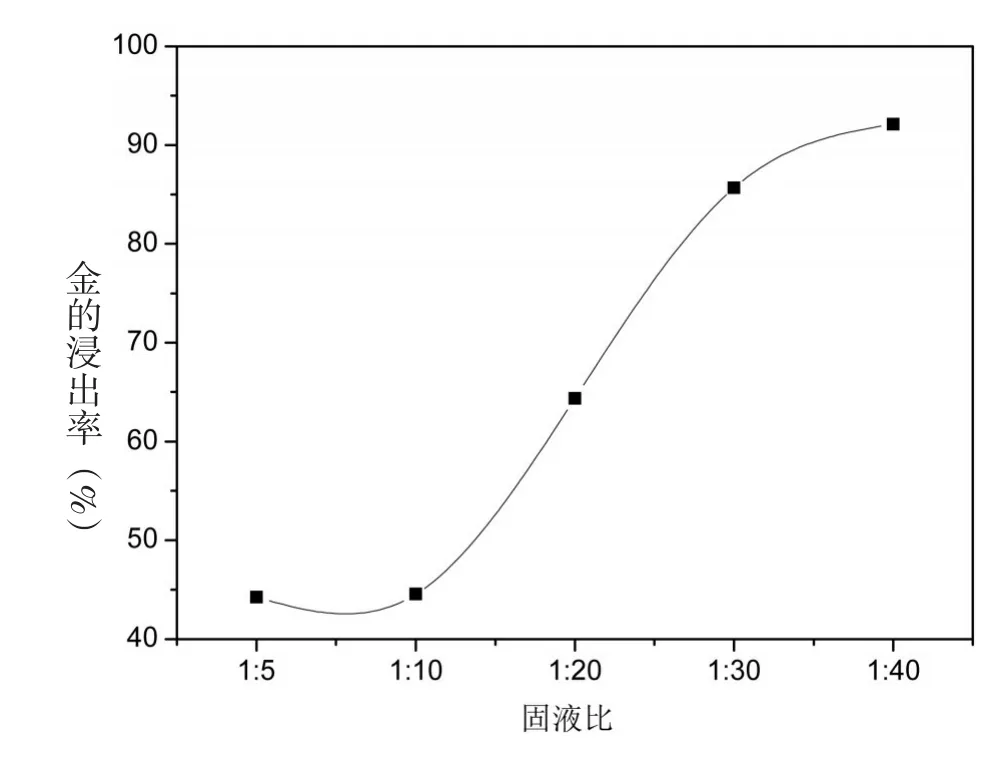
图5 固液比对浸金率的影响

图6 pH值对浸金率的影响
从图6可知,浸金率随pH的增加呈降低趋势,pH<3时,浸金率可高达95%,这是因为在酸性条件下,随着H+浓度的增加,碘的氧化能力也不断提高,促使下列反应向正方向进行,同时增加硫氰酸盐的稳定性[20]:
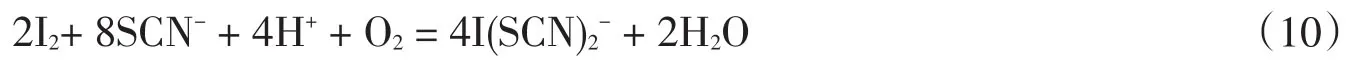
在pH=3~7范围内,金的浸出率变化不大,为减少酸性对设备的腐蚀,降低反应成本,可以考虑在pH接近中性条件下进行浸出实验,所以选择中性进行实验,在条件允许的情况下,尽量降低pH,以提高浸出率.
4 结 论
(1)近中性条件下,碘-硫氰酸盐组成的浸金体系,浸出废旧线路板中的金是可行的.且碘与SCN-能形成比(SCN)2-及(SCN)3-更为稳定的I2SCN-和I(SCN)2-,不易水解,还可以减少碘的挥发损失.此浸金过程操作简单,对设备要求低而且又可以解决设备腐蚀问题,还可以减少化学污染,实现了贵金属资源金的回收,符合当下强调保护环境的化学生产主题,实现了环保和生产的双赢.
(2)在25℃、近中性条件下,硫氰酸铵的浓度为60 g/L,固液比为1∶40,碘的浓度为12 g/L,震荡速率为300 r/min,反应时间为1 h时,金的浸出率可达到92.2%.其中硫氰酸铵浓度、碘的用量、固液比等因素对浸金效率影响比较大;浸出时间1 h时,浸金率就可趋于稳定;而反应温度对浸金率的影响较小.pH<3时,浸出率比较高,pH=3~7范围内,金的浸出率变化不大,为减少酸性对设备的腐蚀,降低反应成本,可以考虑在pH接近中性条件下进行浸出实验,在条件允许的情况下,也可以降低pH,以提高浸出率.
(3)根据药品成本及金的浸出率可粗略计算,1吨电子垃圾粉末大约可盈利1 000元以上,实际操作可能会低于这个理论值,但不难发现碘-硫氰酸铵浸金体系在工业上应用推广的实用性,这给环保公司和冶金厂等机构,提供了参考价值.
[1]阮培华.电子信息产品步入强制环保时代[J].高科技与产业化,2007,5:66-69.
[2]马国军,钟颢,苏伟厚.废旧电脑资源化初探[J].再生资源与循环经济,2009,2(1):34-37.
[3]梁昌金.浅析电子垃圾现状及其资源化利用[J].广东化工,2015,42(14):110-111.
[4]梁昌金.电子垃圾中金的生物浸取技术研究进展[J].韩山师范学院学报,2015,36(3):96-102.
[5]Syed S.Recovery of gold from secondary sources-A review[J].Hydrometallurgy,2012,115-116:30-51.
[6]刘秉涛.硫氰酸盐法从高铜硫化金矿中浸取金银的研究[J].华北水利水电学院学报,1994(4):53-57.
[7]Jeffrey M I,Breuer P L,Choo W L.A kinetic study that compares the leaching of gold in the cyanide,thiosulfate,and chlo⁃ride systems[J].Metallurgical and Materials Transactions,2001,32:979-986.
[8]吴浩,黄万抚,邱峰,等.硫氰酸盐浸金研究进展[J].贵金属,2016,37(8):72-78.
[9]庞锡涛,薛山.硫氰酸盐提金影响硫氰酸盐稳定性的因素[J].黄金,1995,16(8):22-25.
[10]王治科,陈东辉,陈亮.硫氰酸盐浸金体系选择氧化剂的热力学判据[J].有色金属,2006,58(4):26-28.
[11]冀少华,安莲英,唐明林.硫氰酸盐法从工业废渣中浸取金银的实验研究[J].矿产综合利用,2009(1):43-44.
[12]王治科,张含,叶存玲.硫氰酸盐-铁(Ⅲ)体系从废电路板中选择性浸出金银[J].有色金属:冶炼部分,2013(11):32-35.
[13]王清江,宗魏.溴-硫氰酸盐体系浸取硫化矿中的金[J].华东师范大学学报:自然科学版,1996(3):72-76.
[14]梁昌金,马传净.中性环境中硫氰酸盐浸取废旧电路板中的金[J].贵金属,2015,36(4):1-6.
[15]胡燕清,杨声海,陈永明.某毒砂金矿硫氰酸盐氨性体系加压氧化提金探索试验[J].有色金属:冶炼部分,2012(9):34-37.
[16]杨喜云,刘政坤,郭孔彬,等.硫脲-硫氰酸钠浸出难处理金矿及浸出剂的稳定性[J].中国有色金属学报:2014,24(8):2164-2170.
[17]胡燕清.氨性硫氰酸铵从难处理硫化金矿氧压浸金研究[D].长沙:中南大学,2012.
[18]Vukcevic S. The mechanism of gold extraction and copper precipitation from low grade ores in cyanide ammonia systems[J].Minerals Engineering,1997,10(3):309-326.
[19]Barbosa-Filho O,Monhemius A J. Iodide-thiocyanate leaching system for gold[M]. Netherlands:Springer,1994:425-440.
[20]Long C,Skoog D A.A Thiocyanate Complex of Iodine(I)[J].Inorganic Chemistry,1966,5(2):206-210.
[21]李桂春,吴寿慈.碘法浸金的研究[J].矿质工程,2003,23(6):54-55.
[22]Davis A,Tran T,Young D.Solution chemistry of iodide leaching of gold[J].Hydrometallurgy,1993,32:143-159.

