《国家基本药物目录》中化学药与中成药不良反应项的对比分析
庞震苗+严志敏+陈远见


【摘 要】 目的:调查分析药品说明书中不良反应项的现状,为完善我国药品说明书提供建议和参考。方法:采用文献检索法,收集2012年《国家基本药物目录》下500份药品说明书,将其分为化学药和中成药;在我国药品说明书和标签管理规定的基础上,结合美国相关指导原则,对目录下中成药与化学药说明书中不良反应项内容的完整性与科学性作出评价。结果:中成药的不良反应项标注率和内容完整度远低于化学药;在药品说明书不良反应项中术语的使用也存在不规范现象。结论:基药说明书中不良反应项内容,特别是中成药的相关内容仍需进一步完善。
【关键词】 《国家基本药物目录》;化学药;中成药;不良反应项;评价
【中图分类号】R95 【文献标志码】 A【文章编号】1007-8517(2016)24-0090-03
Abstract:Objective To investigate and analyze the adverse reactions descriptions in pharmaceutical instructions of essential drugs in order to propose suggestions and basis for improving pharmaceutical instructions in China. Methods A total of 500 pharmaceutical instructions were collected by literature mining and categorized as chemical drugs and Chinese patent drugs. The extent of integrity and scientific authenticity of adverse reaction descriptions in pharmaceutical instructions of both chemical drugs and Chinese patent drugs was evaluated. Administrative regulations on pharmaceuticalinstructionsand labels in China were employed as the majorcriterion while related guidelines proposed by FDA in US were adjuvant reference in the evaluation. Results Among all 500 subjects, specification rate and completeness of adverse reaction descriptions in instructions of Chinese patent drugs are far lesssatisfactory than chemical drugs. Moreover, ineligible terminological use was observed in some of the instructions. Conclusion Improvement is required for the descriptions of adverse reactions in pharmaceutical instructions of essential drugs especially those of Chinese patent drugs.
Keywords:Essential Drugs; Adverse Reactions; Evaluation;Analysis
2012版《国家基本药物目录》(以下简称《目录》),包含了化学药品和生物制品317种、中成药203种,共计520种,较2009年版增加了213种,目录中的化学药品和生物制品数量与世界卫生组织现行推荐的基本药物数量相近,并坚持中西药并重。随着我国经济的高速发展,《目录》下的中成药和化学药药品说明书中不良反应项的规范标注和统一问题正日益凸显,特别是中成药部分在上市前并未进行临床试验,反映在“药品说明书”上,就是“不良反应”项缺乏科学、严谨、公正、客观的指标和表述[1]。本文就基药目录下药品的不良反应项,对化学药和中成药展开对比评价分析,以期促进基本药物药品说明书的科学化、规范化,提高广大群众对不良反应的正确认识,及临床用药的安全性。
1 资料与方法
1.1 研究对象 以国家食品药品监督管理局公布的药品说明书为数据源,以《目录》为范围,收集500份基药目录下的药品说明书,以药品说明书中的不良反应项作为本文的研究对象。
1.2 方法 借鉴美国食品药品监督管理局颁布的“人用处方药和生物制剂说明书的不良反应部分指导原则”[2],同时参照我国国家食品药品监督管理局颁布的《药品说明书和标签管理规定》[3](局令第24号)(2006),对基药目录下药品说明书中不良反应项内容的完整性与科学性进行统计、整理、分析、评价,数据采用Excel表进行频数分析。
2 结果
2.1 化学药与中成药药品说明书中不良反应的标注情况 500种药品说明书中,化学药299份,中成药为201份,其不良反应有实质性内容的为标注阳性,标注率为65.20%,其中化学药的标注率为97.66%,中成药药品说明书不良反应标注率仅为16.92%。具体见表1。
2.2 化学药与中成药药品说明书中不良反应标注内容完整性的概况 明确的不良反应术语描述是科学、客观描述不良反应的基本要求。但调查的基药中,299份化学药品的不良反应存在不同程度的表述含糊不清,如注射用盐酸左氧氟沙星的“一般均能耐受”、甲硝唑片的“一般不影响治疗”、氨甲苯酸注射液的“瞳部不适”……相对于化学药品来说,中成药药品说明书的规范性更加缺乏。
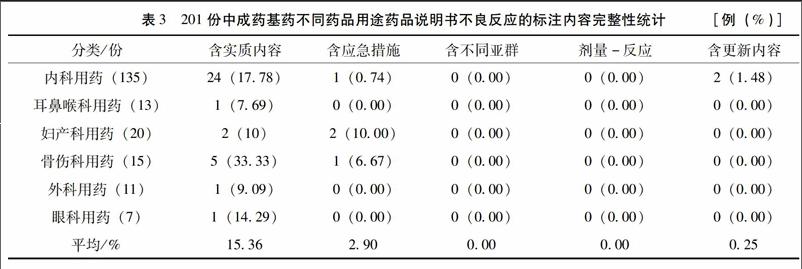
完整的不良反应应该包含实质性内容、应急措施、不同亚群的反应、不同剂量的反应和部分更新的内容。不良反应的更新内容是指生产企业通过收集药品上市后不良反应监测报告或文献报告等,对不良反应进行补充更新的内容。本研究中,化学药中有描述的占8.58%,中成药只有0.25%,不良反应项下的更新内容严重不足。具体见表2、表3。
3 讨论与建议
研究结果显示,中成药说明书不良反应项表述情况令人堪忧,大部分中成药以“不良反应尚不明确”作为标注内容,比例高达78.11%,还有4.98%的中成药不良反应项直接缺失。
笔者认为造成这种现象的原因有三:一是中成药本身所具备的循证医学证据严重缺乏,基础研究中原始资料质量不高,2010年《药品生产质量管理规定》[4](GMP)中明确规定:“药品生产企业在药品上市前应进行三期临床试验研究”,调查结果表明,目前大部分中成药在上市前并未进行规范的临床试验;其次,我国药品不良反应报告制度不完善,西药药品的不良反应更容易得到临床反馈,进而更能反映在药品说明书的不良反应项中,但中成药药品由于临床应用中很难发现和收集其不良反应症状,中成药的安全性问题难以得到重视,缺乏持久的常规性的药品不良反应的跟踪监测;第三,中成药生产厂家在跟踪上市后不良反应,及时更新完善药品说明书不良反应的主动性和积极性严重不足。这些因素共同导致了中成药药品不良反应项内容欠缺规范的结局。
结合以上问题,笔者建议:①鼓励药企积极投入到药物的基础研究中,特别是基本药物目录中的中成药的基础研究,努力提高原始研究资料质量;②药品说明书应详细叙述药品引起的不良反应,指导医务人员、药品使用者一旦发生于药物相关的不良反应时,应当采取相应的应急措施,以缓解药品不良反应、降低药物不良反应导致的死亡率;③相关部门应积极采用行政手段,规范基药生产厂家对药品上市后不良反应信息的更新,对不重视药品不良反应更新的生产企业给予必要的处罚,促进基药药品说明书的不断完善,为临床药提供更多可参考的依据。国家食品药品监督管理局应对基药的药品说明书进行规范管理,提高基药临床用药的安全性和权威性[5]。
国家基本药物制度的建立促进了我国卫生事业的飞速发展,在保障群众用药安全、维护人民健康、减轻“看病难”、“看病贵”问题上做出了突出贡献。笔者建议,应在国家层面积极完善药品说明书规范化制度,持续提升中成药药品说明书的规范性。
参考文献
[1]王鸿蕴,王煊,朱文涛.中成药说明书与美国药品说明书对比研究 [J].中国药物评价,2013,30(2):73-76.
[2]FDA.Guidance for industry adverse reactions section of labeling for human prescription drug and biological products-content and forma.[2006-01-18].http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm075057.pdf.
[3]国家食品药品监督管理局.药品说明书和标签管理规定[J]. 医药导报, 2006, 8(8):155-156.
[4]中华人民共和国卫生部.药品生产质量管理规范(2010年修订)(卫生部令第79号)[J]. 中华人民共和国国务院公报, 2011,(20):34-63.
[5]贾娜,张珂良,魏晶,等.中药说明书存在的问题及建议[J].中国执业药师,2011,8(2):43-45.
(编辑:程鹏飞)

