蜈蚣草燃烧过程中As迁移转化规律
李小乐,段伦博,雷梅,赵长遂
(1东南大学能源与环境学院能源热转换及其过程测控教育部重点实验室,江苏 南京 210096;2中国科学院地理科学与资源研究所环境修复中心,北京 100101)
蜈蚣草燃烧过程中As迁移转化规律
李小乐1,段伦博1,雷梅2,赵长遂1
(1东南大学能源与环境学院能源热转换及其过程测控教育部重点实验室,江苏 南京 210096;2中国科学院地理科学与资源研究所环境修复中心,北京 100101)
蜈蚣草是砷(As)的高富集植物,为研究蜈蚣草燃烧过程中As的迁移规律及形态演变,在管式炉中对蜈蚣草进行了燃烧实验,实验发现:蜈蚣草中As挥发率随温度的升高先增加后减小,在500℃达到最高。500℃之前挥发率升高是由于低温区无机As的挥发;温度高于500℃时挥发率下降,是由于As的快速氧化使挥发的As3+减少以及灰中元素对As的固定作用。蜈蚣草燃烧后底灰中的水溶As主要是As5+,其含量随着温度的升高先降低再增加,800℃到达峰值,占原样品As含量的81%。在400~500℃之间,水溶As5+含量下降主要是由于As的挥发率增加;在500~700℃之间,As的固定主要为灰的物理吸附;当温度到800℃,As的固定主要为化学吸附。水溶As5+的比例在900℃时有所下降,可能是因为温度过高使生物质灰烧结,As5+无法充分溶解,使测量到的As5+含量减少。综合考虑As的回收再利用工艺,推荐800℃为蜈蚣草的最佳燃烧温度。
蜈蚣草;燃烧;As;可溶As;形态
引 言
国家“十二五”规划以来,土壤的污染问题受到全社会的广泛关注,2014年环境保护部与国土资源部联合发布的《全国土壤污染状况调查公告》[1],对面积为6300000 km2的国土进行调查后发现全国环境状况总体不容乐观,土壤总的污染超标率为 16.1%,其中轻微、轻度、中度和重度污染点位比例分别为11.2%、2.3%、1.5%和1.1%,无机污染物超标点位数占全部超标点位的82.8%。2015年国土资源部中国地质调查局发布的《中国耕地地球化学调查报告》[2]指出,全国耕地重金属中-重度污染或超标的点位比例占2.5%,覆盖面积3488万亩(1亩= 666.7 m2),轻微-轻度污染或超标的点位比例占 5.7%,覆盖面积 7899万亩。土壤污染直接关系到社会发展与国民身体健康,因此,为切实加强土壤污染防治,逐步改善土壤环境质量,2016年5月,中央政府颁布了《土壤污染防治行动计划》[3],为下一阶段改善土壤环境做出了明确的部署。
砷(As)是土壤重金属污染的主要污染物之一。因其剧毒性,As污染已经成为一个全球性的问题[4-5]。一些学者研究发现,As及其化合物会导致皮肤癌、肺癌、肾癌等一系列癌症[6-7]。通过对人体在无机As中的暴露率和癌症发病率进行对比研究,国际癌症机构(IARC)将As及其化合物划分为一类致癌物质,美国环境保护局(USEPA)同时把As划分为A类致癌物。As污染主要来自于大气沉降、污水灌溉、农药和化肥、采矿和冶金等方面[8]。报告显示国内土壤As污染的超标点位率为2.7%[1],严重威胁着国民的身体健康。
传统的土壤重金属污染修复方法主要包括物理修复技术和化学修复技术两方面,植物修复土壤重金属污染技术是近年来才发展起来,与传统修复技术相比,这种新兴技术被很多学者认为更具高效性与环保性[9-19]。
蜈蚣草是一种 As元素的高富集植物,自从Chen等[12]首先发现蜈蚣草对 As的高富集性以及Ma等[13]首次对蜈蚣草这一特性进行报告后,很多学者都对其进行了研究,并取得了一定的成果。Chen等[14-15]在中国建立蜈蚣草培育基地,并成功修复了As污染的土壤,Zhao等[16]对美国、英国和法国的几种蜈蚣草进行了研究并发现它们对 As的高富集性,Wang等[17]对中国南部的11种凤尾蕨类植物进行实验,发现 As的高富集特性是凤尾蕨类植物的基本特征,无论生长环境中 As含量的高低,它都能表现出对As的高富集能力,同时发现了As含量高于0.2%的蜈蚣草。Lombi等[18]和Tu等[19]研究发现凤尾蕨植物中As的含量最多为5000~10000 mg·kg−1。
国内蜈蚣草修复土壤 As污染技术主要应用在广东、广西、云南以及湖南等As污染严重的地区[20]。国内第一个蜈蚣草修复实验基地在湖南郴州建立,其中发现了干重达 2.34%的蜈蚣草。在实验过程中,每年每公顷实验土壤都会产生5 t富As的蜈蚣草[14,21]。因此,如何妥善地处理在修复过程中所产生的大量富 As蜈蚣草是一个关键的问题,同时处理工艺的经济性和环保性对植物修复技术的发展具有重要的意义。之前有些学者用化学溶液直接提取蜈蚣草中的As,并验证有一定的效果[22-25],但大量的溶液提取会造成环境的二次污染。Sas-Nowosielska等[26]认为焚烧修复后的产物有更好经济性与可行性。Xie等[27]研究发现,在蜈蚣草的焚烧过程中,62.5%的As在温度到达400℃之前已经挥发。潘雅妹等[28]用CaO固定蜈蚣草燃烧底灰中的As,再用碱浸法(NaOH-Na2CO3)浸提,最后用硫酸铜作沉淀剂成功制备了砷酸铜。Yan等[29]用马弗炉进行蜈蚣草燃烧实验,发现 As的挥发温度主要在 400℃以下,然而其他学者在煤燃烧和防腐材料的燃烧过程中却发现 As的挥发温度主要是在1000℃以上的高温区[30-32]。
到目前为止,虽然很多学者对蜈蚣草中As的提取进行了研究,但研究集中于蜈蚣草中As的直接提取,而对蜈蚣草热处理过程中As的迁移规律和形态变化研究不深,同时一些学者对As挥发特性的研究结论并不一致。因此,进一步研究蜈蚣草热处理过程中As的迁移规律对减少As的排放至关重要。本文中利用管式炉装置,研究在不同的温度下蜈蚣草燃烧过程中As的迁移规律以及形态的演变特性,为蜈蚣草热处理的产业化提供一定的理论依据。
1 实验方法
1.1 样品准备
实验所用的蜈蚣草取自广西环江县,取蜈蚣草的地上部分,在70℃的恒温箱中烘干,再用粉碎机粉碎,最后过0.18 mm筛获取实验样品。样品工业分析和元素分析见表1,通过 ICP-MS测得主要痕量元素的含量,见表 2,其中 As的含量为318.39 mg·kg−1,而生长环境中As的浓度为25.40 mg·kg−1。

表1 蜈蚣草工业分析及元素分析Table 1 Ultimate analysis and proximate analysis of P. vittata
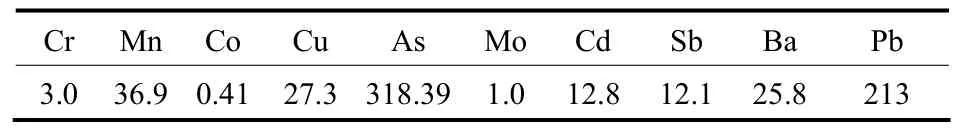
表2 蜈蚣草中主要痕量元素的含量Table 2 Concentrations of trace elements in P. vittata/mg·kg−1
1.2 燃烧实验
为了研究不同温度对蜈蚣草燃烧过程中 As迁移及形态的影响规律,在管式炉中进行了一系列实验,管式炉的系统图如图1。用电子天平(精度为0.001 g)称取 4 g样品平铺于瓷舟中,以 400 ml·min−1的速率进气吹扫炉膛,5 min后开始升温,当温度到达工况设定温度后,再将瓷舟推入石英管的恒温区,保持恒温30 min以保证样品充分燃烧,然后停止加热,等炉膛冷却至室温后取出样品,整个过程一直保持进气状态,管式炉出口到吸收瓶中间的管道及滤膜用电加热带加热恒温 110℃,防止As的低温冷凝。实验从3个位置收集待测样品,在瓷舟中取出底灰,在玻璃纤维膜上取出飞灰,但飞灰中As含量经测试不足总量的1%,所以在本研究中被忽略。再根据EPA-method 29[33],采用冰浴法并用5%HNO3和10%H2O2混合溶液收集反应挥发的气相 As。实验燃烧温度为 400~900℃,气氛是空气。
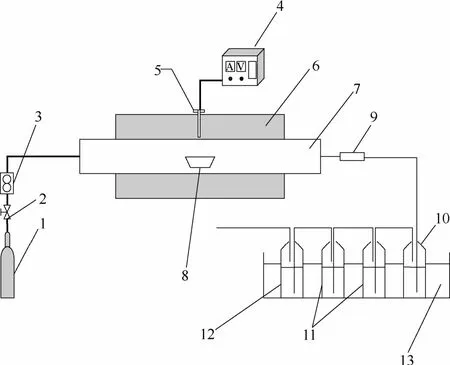
图1 管式炉系统图Fig.1 Schematic diagram of tube furnace
1.3 As含量测试
底灰和蜈蚣草样品用HNO3和HClO4的混合溶液进行消解[分析纯,体积比为4:1(HNO3:HClO4)],然后用浓度为7%的HCl溶液提取,定容至适当体积后,用电感耦合等离子体质谱仪(ICP-MS,安捷伦7900型)测定As浓度,通过11组空白实验测出仪器对As的检测限为0.09 μg·L−1,每个样品测3次取平均值。
为了研究燃烧过程中 As的迁移特性,对不同温度下燃烧底灰中As含量进行计算并得出挥发率,As挥发率[%(质量)]的计算如式(1)[34]。
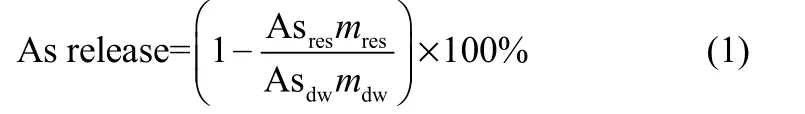
式中,Asres为底灰中As的浓度,g·kg−1;mres为底灰质量,g;Asdw为蜈蚣草中As的浓度,g·kg−1;mdw为蜈蚣草总质量,g。
1.4 As形态分析
As化合物的剧毒性主要取决于As的形态,通常 As3+比 As5+的毒性更强,因此研究燃烧底灰中As的形态有重要的意义。称取0.010 g样品于10 ml浓度为0.1%的HNO3溶液,使样品中的As充分释放,且能溶于浓度为0.1%HNO3溶液的As称为水溶 As。然后在常温水浴中超声浸提 2 h使水溶性As充分溶出,再将溶液以7000 r·min−1离心10 min,获取上清液,通过高速液相色谱仪(HPLC,日本岛津LC20-AB)和ICP-MS对As3+和As5+的含量进行测定。形态分析所用的色谱为岛津 L20-AB。HPLC-ICP-MS流动相配制:5 mmol·L−1磷酸氢二铵+10 mmol·L−1硝酸铵,调节pH=7.0,流速为1.0 ml·min−1,定量环 200 μl。色谱柱为汉米尔顿prp-x100,阴离子色谱柱 250 mm。液相色谱仪和ICPMS连接管为Peek材料。测定As3+和As5+的强度曲线,使用外标法(计算曲线峰面积,与标准峰对比)进行色谱定量计算,获得不同形态 As的含量。标准溶液是由 200 ml砷酸根溶液标准物质(GBW08667)与 200 ml亚砷酸根溶液标准物质(GBW08666)混合而成,As3+和 As5+的标准波峰图如图2所示。
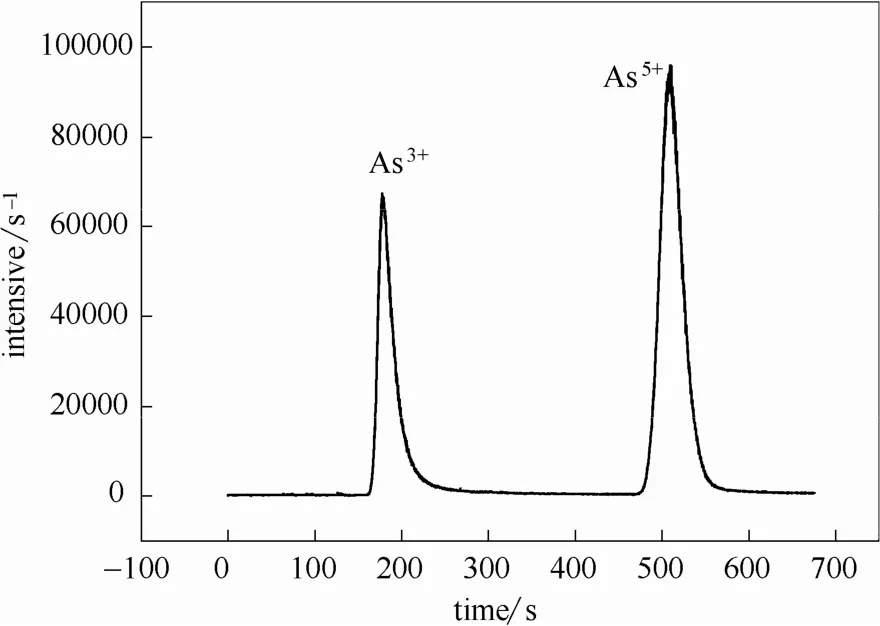
图2 As3+和As5+的标准波峰图Fig.2 Standard peaks of As3+and As5+
2 实验结果与分析
2.1 蜈蚣草燃烧过程中As的挥发
蜈蚣草燃烧过程中,随着温度的升高,底灰的质量分数越来越小,如图3所示。在500℃时,样品燃烧的质量损失率达到83%。在500~900℃的升温过程中,样品的底灰质量损失率为 6%左右,说明样品的分解主要在 500℃之前,这是因为占生物质质量分数较高的纤维素与半纤维素主要分解温度在500℃之前[35-36]。
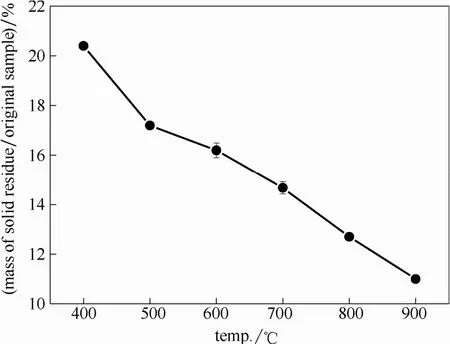
图3 燃烧过程中底灰的质量Fig.3 Mass of solid residue during combustion
图4所示为样品在不同温度燃烧过程中As的回收率。从图中可以看出当温度低于600℃时,As的回收率在80%左右,而温度高于600℃时,回收率升高到约为90%,这是因为当温度较低时,挥发到气相中的 As会发生冷凝吸附在出口温度较低的石英管出口处和连接管壁上。很多学者对煤燃烧过程中As的回收率进行了研究,李小乐等[37]在5 kW循环流化床上研究煤燃烧过程中痕量元素的迁移规律时发现As的回收率高于150%,Reed等[38]表明在气化炉中痕量元素的回收率在 100%±30%都属于正常的误差范围。这些回收率的误差可能是由于在测试时取样不均、痕量元素浓度太低、测量误差与实验误差等因素造成的[39]。因此,本实验中 As的回收率在80%~90%之间是合理的。
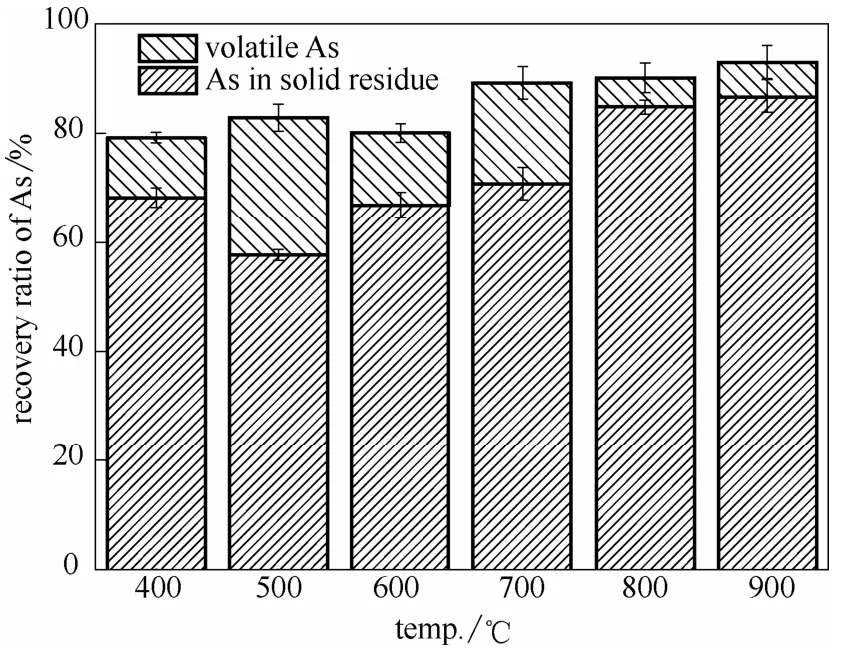
图4 As的回收率Fig.4 Recovery of As (volatile As was collected from solution)
图5所示为样品在不同温度燃烧过程中As的挥发率随温度的变化趋势,从图中可以看出,As的挥发率随温度的升高先增加后减小,在 500℃达到最高。这与一些学者的结果相反,Cuypers等[40]发现在防腐木材(CCA treated wood)的热解过程中,当温度高于390℃,As的挥发率随温度的升高有明显的增加,Vassileva等[41]在马弗炉里对As含量较低的地面植物(草、番茄叶、蔬菜、米粉、橘叶以及白菜)进行灰化实验时没有发现As的挥发现象,结果说明热处理过程中As的挥发性可能与As的含量及形态密切相关。图 5中还可看出,约 43%的As在500℃时挥发,Yan等[29]在蜈蚣草的焚烧实验中发现 As的挥发率随温度的升高而增加,在 800℃时达到总量的24%,但其中62.5%是在低于400℃时挥发的。这说明 As的挥发主要在低温区。蜈蚣草中As主要以无机的As5+和As3+形式赋存于一些化合物中,例如FeAsO4, AlAsO4和Ca3(AsO4)2[42],以及一些有机物,例如一甲基胂酸(MMA)和二甲基胂酸(DMA)[43]。这些无机As的挥发性随着温度的升高而增加,主要以氧化物的形式挥发[44]。甲基胂酸在加热时易生成As2O5,As2O5在327℃时会分解成As2O3[44-47],且As2O3的沸点为457.2℃[48],并在135℃时就开始挥发[49],所以As2O3是As的低温挥发的主要形式。表3所示为蜈蚣草样品在不同温度下燃烧底灰的含碳量,表中可以看出当温度在400~500℃时,底灰的含碳量超过20%,说明蜈蚣草样品尚未达到完全燃烧所需温度,因此在低温条件下蜈蚣草样品先热解后燃烧的过程,有利于 As的挥发。
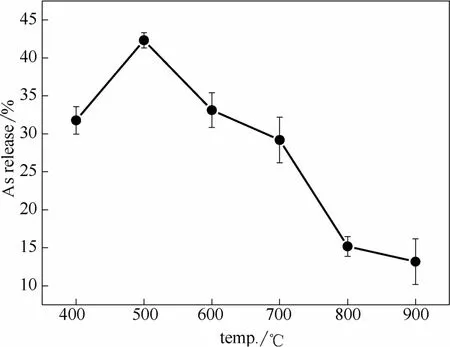
图5 蜈蚣草燃烧过程中As的挥发率Fig.5 As release during combustion of P. vittata

表3 不同温度底灰的含碳量Table 3 Carbon content of bottom ash at different temperatures
当温度高于500℃时,As的挥发率随温度的升高逐渐减小,到900℃时As的挥发率只有13%。这与一些学者的研究结论并不一致,Yan等[29]和潘雅妹等[28]对蜈蚣草进行燃烧实验均发现,As的挥发率随温度的升高而增加。这可能是由于升温速率不同而造成的差异,Yan等的升温速率为25℃·min−1,会造成部分 As在到达预定工况温度之前就已经挥发,而本研究中采取快速升温,样品升温速率在100℃·s−1以上,使蜈蚣草整体能迅速到达燃烧温度,表3中可以看出当温度高于600℃时底灰的含碳量低于15%,且随着温度的升高迅速下降。在高温下样品中挥发分和焦炭几乎同时实现燃烧状态,As也同时被氧化,因此高温下As来不及以As3+的形态挥发,所以高温下 As的挥发率随温度的升高而下降。同时蜈蚣草样品成分的不同也会有一定的影响,蜈蚣草样品中存在一些元素在高温时能将 As固定在底灰中而不挥发。对 700℃燃烧后的底灰进行XRF分析,结果见表4。从表中可以发现CaO的质量分数约为 20.5%,MgO的质量分数约为6.36%,还存在少量Fe、Al等元素,这些元素的氧化物不仅可以对挥发的As有一定的物理吸附作用,还能与As反应生成热稳定性强的化合物
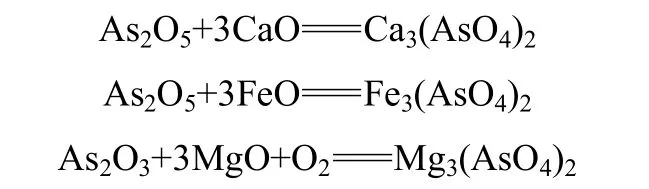
Chen等[50]发现在 300~500℃时,CaO对 As的固定主要通过物理吸附的方式,当温度达到600~800℃时,CaO对As的固定主要通过化学反应,固定效果也会得到增强。张军营等[51]模拟固定床燃烧实验,发现815℃下,CaO对煤中As挥发性的抑制率平均为15.31%,同时在循环流化床实验中也发现CaO有良好的固As效果。
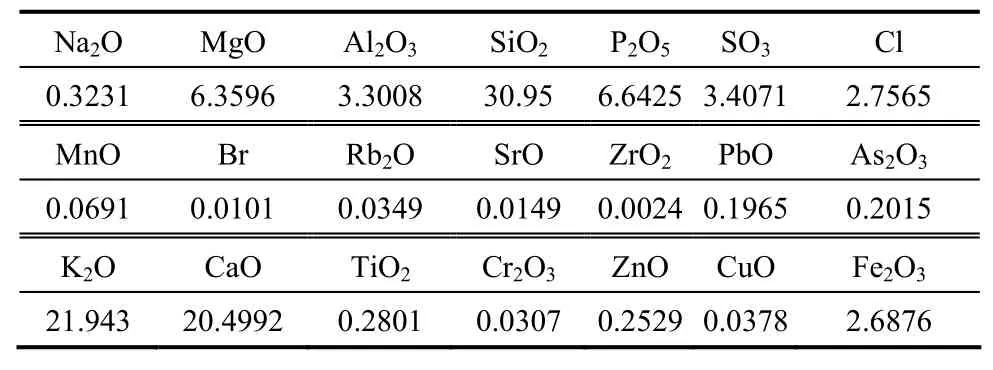
表4 700℃底灰的XRF分析Table 4 XRF analysis of solid residue at 700℃/%(mass)
同时,由于样品底灰中Al、Ca、K、Si等元素的含量较高,使生物质灰的烧结温度降低[51],从而易发生烧结现象,将 As封闭在灰颗粒内部,不易挥发。
因此,样品中固 As元素的含量对蜈蚣草燃烧过程中As的迁移有重要的影响。
2.2 As的形态转化
为了更深入地研究蜈蚣草燃烧过程中 As形态的转化规律,用HPLC-ICP-MS测定了底灰中水溶As的形态及其含量。发现底灰中 As主要形态呈As5+,这与Yan等[29]发现蜈蚣草在400℃以上燃烧后底灰中主要为As5+有相同的结果。图6所示为蜈蚣草在不同温度燃烧后底灰中水溶As5+占样品中总As量的比例。从图中可以看出,温度在 400~700℃时,底灰中水溶 As5+的含量占样品总 As量的5%~25%,且随着温度的升高比例逐渐降低。在400~500℃之间,水溶 As5+含量下降主要是由于As的挥发率增加,底灰中As含量减少。在500~700℃之间,As的挥发率下降的同时,水溶As5+也在减少,这说明在这一阶段 As的固定主要是依靠底灰中一些化合物的物理吸附,As的形态并没有太大的变化且水溶性较差。当温度到 800℃,底灰中的水溶As5+的含量达到峰值,占总As量的80%以上,说明当温度高于700℃后样品中的固As元素主要通过化学氧化的作用对 As进行固定,且效果比物理吸附的效果好很多,这与Chen等[50]的结果类似。水溶As5+的比例在900℃时有所下降,可能是因为温度过高使生物质灰烧结[52],导致在形态分析过程中As5+无法充分溶解到溶液中,从而使仪器检测到的As5+含量减少。
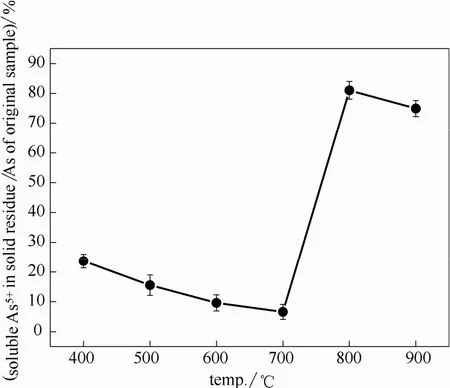
图6 底灰中水溶As5+占样品中总As量的比例Fig.6 Soluble As5+in solid residue/As of original sample
图7所示为底灰中不同形态As的比例,从图中可以看出当温度低于700℃时,底灰中的As主要是不可溶的As,而当温度高于800℃时,底灰中的水溶As5+为主要的As形态。所以,蜈蚣草的燃烧过程中,由于800℃时底灰中As的高含量与高水溶性有利于As的回收及提取,800℃是后续生物质灰渣As回收再利用的最佳工艺温度。
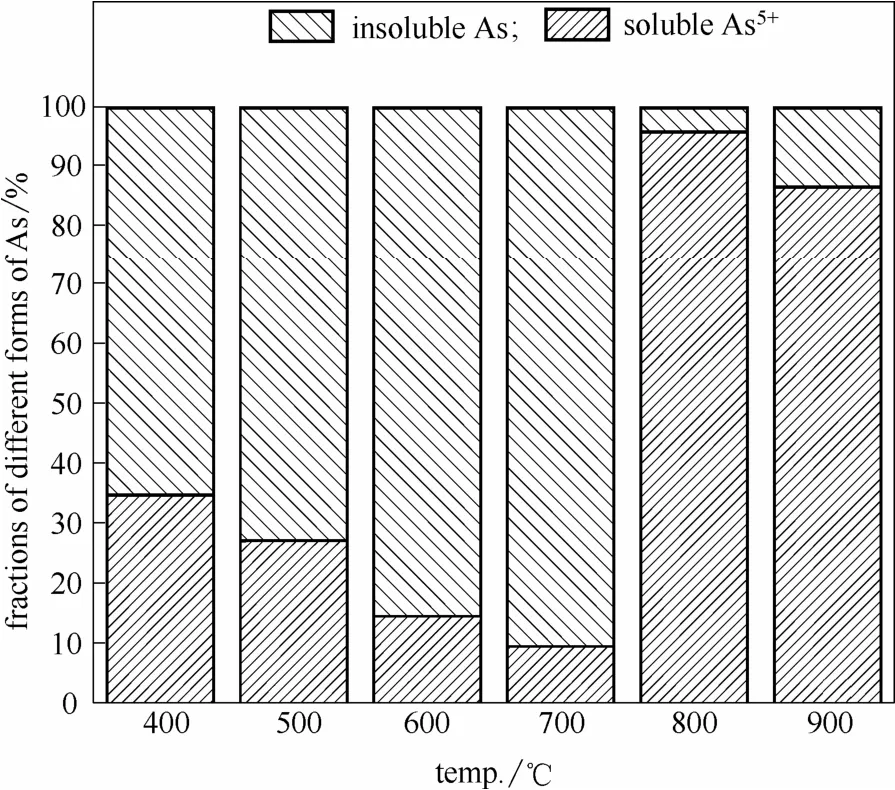
图7 底灰中不同形态As的比例Fig.7 Fractions of different forms of As in solid residue
3 结 论
(1)蜈蚣草燃烧过程中As的挥发率随温度的升高先增加后减小,在 500℃达到最高,占总含量的 43%。500℃之前挥发率升高是由于低温区无机As的挥发,当温度高于500℃,挥发率下降是因为蜈蚣草中 As的氧化使挥发性降低以及存在一些元素对As有固定作用。
(2)蜈蚣草燃烧后底灰中的水溶 As主要是As5+,其含量随着温度的升高先降低再增加,800℃时最高为总含量的81%。在400~500℃之间,水溶As5+含量下降主要是由于As的挥发率增加;而在 500~700℃之间,As的固定主要是依靠底灰中一些化合物的物理吸附,但 As的形态没有变化且水溶性较差。当温度到800℃,样品中的固As元素主要通过化学氧化的作用对 As进行固定,且效果比物理吸附的效果更好。水溶As5+的比例在900℃时有所下降,可能是因为温度过高使生物质灰烧结,导致在形态分析过程中 As5+无法充分溶解到溶液中,从而使仪器检测到的As5+含量减少。
(3)由于蜈蚣草在800℃燃烧后底灰As的高含量与高水溶性,该温度是后续生物灰渣 As回收再利用工艺的最佳温度。
[1]环境保护部和国土资源部. 全国土壤污染状况调查公告[EB/OL]. [2014-4-17]. http: //www.mlr.gov.cn/xwdt/jrxw/201404/ P020140417573876167417.pdf. Ministries of Land and Resources and Environmental Protection of China. The survey of the soil pollution in China[EB/OL]. [2014-4-17]. http: //www.mlr.gov.cn/xwdt/jrxw/201404/P020140417573876167417. pdf.
[2]国土资源部中国地质调查局. 中国耕地地球化学调查报告[EB/OL]. [2015-6]. http: //www.cgs.gov.cn/UploadFiles/ 2015_06/26/ %E4%B8%AD%E5%9B%BD%E8%80%95%E5%9C%B0%E5%9C %B0%E7%90%83%E5%8C%96%E5%AD%A6%E8%B0%83%E6 %9F%A5%E6%8A%A5%E5%91%8A%EF%BC%882015%E5%B9 %B4%EF%BC%89.pdf.China Geological Survey. The geochemical survey of arable land in China [EB/OL]. [2015-6]. http: //www.cgs.gov.cn/UploadFiles/ 2015_06/26/%E4%B8%AD%E5%9B%BD%E8%80%95%E5%9C% B0%E5%9C%B0%E7%90%83%E5%8C%96%E5%AD%A6%E8% B0%83%E6%9F%A5%E6%8A%A5%E5%91%8A%EF%BC%8820 15%E5%B9%B4%EF%BC%89.pdf.
[3]环境保护部和国土资源部. 土壤污染防治行动计划 [EB/OL]. [2016-5-31]. http: //www.gov.cn/zhengce/content/2016-05/31/ content_ 5078377.htm. Ministries of Land and Resources and Environmental Protection of China. The soil pollution control action plan [EB/OL]. [2016-5-31]. http: //www.gov.cn/zhengce/content/2016-05/31/content_5078377. htm.
[4]ACHARYYA S K, CHAKRABORTY P, LAHIRI S, et al. Arsenic poisoning in the Ganges delta[J]. Nature, 1999, 401(6753): 545.
[5]KARIM M M. Arsenic in groundwater and health problems in Bangladesh[J]. Water Research, 2000, 34(1): 304-310.
[6]NAUJOKAS M F, ANDERSON B, AHSAN H, et al. The broad scope of health effects from chronic arsenic exposure: update on a worldwide public health problem[J]. Environmental Health Perspectives (Online), 2013, 121(3): 295.
[7]YOSHIDA T, YAMAUCHI H, SUN G F. Chronic health effects in people exposed to arsenic via the drinking water: dose-response relationships in review[J]. Toxicology and Applied Pharmacology, 2004, 198(3): 243-252.
[8]尹彦勋, 张玉芬, 王坤. 浅论植物修复技术对土壤重金属污染的清除[J]. 天津科技, 2007, 34(1): 43-44. YIN Y X, ZHANG Y F, WANG K. Discussion of the soil heavy metal pollution cleaning by phytoremediation[J]. Tianjin Science& Technology, 2007, 34(1): 43-44.
[9]MITCH M L. Phytoextraction of toxic metals: a review of biological mechanism[J]. Journal of Environmental Quality, 2002, 31(1): 109-120.
[10]GUPTA A K, VERMA S K, KHAN K, et al. Phytoremediation using aromatic plants: a sustainable approach for remediation of heavy metals polluted sites[J]. Environmental Science & Technology, 2013, 47(18): 10115-10116.
[11]ALI H, KHAN E, SAJAD M A. Phytoremediation of heavy metals—concepts and applications[J]. Chemosphere, 2013, 91(7): 869-881.
[12]CHEN T B, WEI C Y. Arsenic hyperaccumulation in some plant species in South China[C]//Proceedings of the International Conference of Soil Remediation, 2000: 194-195.
[13]MA L Q, KOMAR K M, TU C, et al. A fern that hyperaccumulates arsenic[J]. Nature, 2001, 409(6820): 579.
[14]CHEN T, WEI C, HUANG Z, et al. Arsenic hyperaccumulator Pteris vittata L. and its arsenic accumulation[J]. Chinese Science Bulletin, 2002, 47(11): 902-905.
[15]CHEN T B, LIAO X Y, HUANG Z C, et al. Phytoremediation of arsenic-contaminated soil in China[M]// WILLEY N. Phytoremediation: Methods and Reviews. Humana Press, 2007: 393-404.
[16]ZHAO F J, DUNHAM S J, MCGRATH S P. Arsenic hyperaccumulation by different fern species[J]. New Phytologist, 2002, 156(1): 27-31.
[17]WANG H B, WONG M H, LAN C Y, et al. Uptake and accumulation of arsenic by 11 Pteris taxa from southern China[J]. Environmental Pollution, 2007, 145(1): 225-233.
[18]LOMBI E, ZHAO F J, FUHRMANN M, et al. Arsenic distribution and speciation in the fronds of the hyperaccumulator Pteris vittata[J]. New Phytologist, 2002, 156(2): 195-203.
[19]TU C, MA L Q. Effects of arsenic concentrations and forms on arsenic uptake by the hyperaccumulator ladder brake[J]. Journal of Environmental Quality, 2002, 31(2): 641-647.
[20]陈同斌, 张斌才, 黄泽春, 等. 超富集植物蜈蚣草在中国的地理分布及其生境特征[J]. 地理研究, 2005, 24(6): 825-833. CHEN T B, ZHANG B C, HUANG C Z, et al. The geographic distribution and habitat characteristics of P. vittata, a hyperaccumulator, in China[J]. Geographical Research, 2005, 24(6): 825-833.
[21]LIAO X Y, CHEN T B, XIE H, et al. Effect of application of P fertilizer on efficiency of As removal from As-contaminated soil using phytoremediation: field study[J]. Acta Scientiae Circumstantiae, 2004, 24(3): 455-462.
[22]马杰, 韩勇和, 周小勇.等.不同浸提方法对土壤及蜈蚣草中 As形态浸提效果[J].现代仪器, 2012,18(2): 16-19. MA J, HAN Y H, ZHOU X Y, et al. Effect of different extraction methods on arsenic speciation extraction in soil and Pteris vittata L[J]. Modern Instruments, 2012, 18(2): 16-19.
[23]RUIZ-CHANCHO M J, LÓPEZ-SÁNCHEZ J F, SCHMEISSER E, et al. Arsenic speciation in plants growing in arsenic-contaminated sites[J]. Chemosphere, 2008, 71(8): 1522-1530.
[24]ZHANG W, CAI Y, TU C, et al. Arsenic speciation and distribution in an arsenic hyperaccumulating plant[J]. Science of the Total Environment, 2002, 300(1): 167-177.
[25]肖维林. 砷超富集植物蜈蚣草产后处置及其资源化研究[D]. 南昌:南昌大学, 2007. XIAO W L. Post remediation treatment of arsenic hyperaccumulator plant Pteris vittata L. and the resourceful utilization[D]. Nanchang: Nanchang Univercity, 2007.
[26]SAS-NOWOSIELSKA A, KUCHARSKI R, MAŁKOWSKI E, et al. Phytoextraction crop disposal—an unsolved problem[J]. Environmental Pollution, 2004, 128(3): 373-379.
[27]XIE Q E, YAN X L, LIAO X Y, et al. The arsenic hyperaccumulator fern Pteris vittata L[J]. Environmental Science & Technology, 2009, 43(22): 8488-8495.
[28]潘雅妹, 廖辉伟, 周远, 等. 生态修复植物蜈蚣草中As的回收[J].化工环保, 2013, 33(1): 63-66. PAN Y M, LIAO H Y, ZHOU Y, et al. Recovery of arsenic from hyperaccumulator Pteris vittata L[J]. Environmental Protection of Chemical Industry, 2013, 33(1): 63-66.
[29]YAN X L, CHEN T B, LIAO X Y, et al. Arsenic transformation and volatilization during incineration of the hyperaccumulator Pteris vittata L[J]. Environmental Science & Technology, 2008, 42(5): 1479-1484.
[30]MCMAHON C K, BUSH P B, WOOLSON E A. How much arsenic is released when CCA wood is burned[J]. Forest Products Journal, 1986, 36(11/12): 45-50.
[31]MILLER B B, DUGWELL D R, KANDIYOTI R. Partitioning of trace elements during the combustion of coal and biomass in a suspension-firing reactor[J]. Fuel, 2002, 81(2): 159-171.
[32]FURIMSKY E. Characterization of trace element emissions from coal combustion by equilibrium calculations[J]. Fuel ProcessingTechnology, 2000, 63(1): 29-44.
[33]United States Environmental Protection Agency. Determination of metals emissions from stationary sources: EPA method 29[S]. Washington, DC, 1996.
[34]KISSINGER H E. Reaction kinetics in differential thermal analysis[J]. Analytical Chemistry, 1957, 29(11): 1702-1706.
[35]王树荣, 谭洪, 骆仲泱, 等. 木聚糖快速热解试验研究[J]. 浙江大学学报(工学版), 2006, 40(3): 419-423. WANG S R, TAN H, LUO Z Y, et al. Experimental research on rapid pyrolysis of xylan[J]. Journal of Zhejiang University(Engineering Science), 2006, 40(3): 419-423.
[36]RAVEENDRAN K, GANESH A, KHILAR K C. Pyrolysis characteristics of biomass and biomass components[J]. Fuel, 1996, 75(8): 987-998.
[37]李小乐, 孙海程, 段伦博, 等. 不同添加剂/吸附剂对循环流化床燃烧痕量元素迁移的影响规律[J]. 燃烧科学与技术, 2016, 22(1): 45-49. LI X L, SUN H C, DUAN L B, et al. Influence of different additives/adsorbents on migration of trace elements in circulating fluidized bed combustion[J]. Journal of Combustion Science and Technology, 2016, 22(1): 45-49.
[38]REED G P, DUGWELL D R, KANDIYOTI R. Control of trace elements in gasification: distribution to the output streams of a pilot scale gasifier[J]. Energy & Fuels, 2001, 15(4): 794-800.
[39]RATAFIA-BROWN J A. Overview of trace element partitioning in flames and furnaces of utility coal-fired boilers[J]. Fuel Processing Technology, 1994, 39(1/2/3): 139-157.
[40]CUYPERS F, HELSEN L. Pyrolysis of chromated copper arsenate (CCA) treated wood waste at elevated pressure: influence of particle size, heating rate, residence time, temperature and pressure[J]. Journal of Analytical and Applied Pyrolysis, 2011, 92(1): 111-122.
[41]VASSILEVA E, DOČEKALOVÁ H, BAETEN H, et al. Revisitation of mineralization modes for arsenic and selenium determinations in environmental samples[J]. Talanta, 2001, 54(1): 187-196.
[42]CHESWORTH S, YANG G, CHANG D P Y, et al. The fate of arsenic in a laminar diffusion flame[J]. Combustion and Flame, 1994, 98(3): 259-266.
[43]潘志明, 邓天龙. 砷污染土壤的蜈蚣草修复研究进展[J]. 土壤, 2007, 39(3): 341-346. PAN Z M, DENG T L. The research progress of remediation of As contaminated soil by P. vittata[J]. Soils, 2007, 39(3): 341-346.
[44]HELSEN L, VAN DEN BULCK E, VAN BAEL M K, et al. Arsenic release during pyrolysis of CCA treated wood waste: current state of knowledge[J]. Journal of Analytical and Applied Pyrolysis, 2003, 68(3): 613-633.
[45]CHESWORTH S, YANG G, CHANG D P Y, et al. The fate of arsenic in a laminar diffusion flame[J]. Combustion and Flame, 1994, 98(3): 259-266.
[46]BARIN I, SAUERT F, SCHULTZE-RHONHOF E, et al. Thermochemical Data of Pure Substance[M]. Weinheim: VCH, 1989.
[47]WU C Y, BISWAS P. An equilibrium analysis to determine the speciation of metals in an incinerator[J]. Combustion and Flame, 1993, 93(1): 31-40.
[48]WEAST R C. Handbook of chemistry and physics[J]. The American Journal of the Medical Sciences, 1969, 257(6): 423.
[49]HATA T, BRONSVELD P M, VYSTAVEL T, et al. Electron microscopic study on pyrolysis of CCA (chromium, copper and arsenic oxide)-treated wood[J]. Journal of Analytical and Applied Pyrolysis, 2003, 68(3): 635-643.
[50]CHEN D, HU H, XU Z, et al. Findings of proper temperatures for arsenic capture by CaO in the simulated flue gas with and without SO2[J]. Chemical Engineering Journal, 2015, 267: 201-206.
[51]张军营, 任德贻, 钟秦, 等. CaO对煤中砷挥发性的抑制作用[J].燃料化学学报, 2000, 28(3): 198-200. ZHANG J Y, REN D Y, ZHONG Q, et al. Inhibition effect of CaO on the arsenic volatility of coal[J]. Journal of Fuel Chemistry and Technology, 2000, 28(3): 198-200.
[52]赖喜锐, 周肇秋, 刘华财,等. 生物质灰烧结熔融规律实验研究[J].农业机械学报, 2016, 47(3): 158-166. LAI X R, ZHOU Z Q, LIU H C, et al. Experiment study of biomass ash sintering and melting[J]. Transactions of the Chinese Society of Agricultural Machinery, 2016, 47(3): 158-166.
Arsenic transformation behavior during combustion of P. vittata
LI Xiaole1, DUAN Lunbo1, LEI Mei2, ZHAO Changsui1
(1Key Laboratory of Energy Thermal Conversion and Control, Ministry of Education, School of Energy and Environment, Southeast University, Nanjing 210096, Jiangsu, China;2Center for Environmental Remediation, Institute of Geographic Sciences and Natural Resources Research, Chinese Academy of Sciences (CAS), Beijing 100101, China)
P. vittata is one of the hyperaccumulators of arsenic(As), the combustion experiments were conducted in a horizontal tube furnace to investigate the transformation behavior of As during the combustion of P. vittata. Results show that the release of As in P.vittata increased first then decreased, reaching the highest at 500℃. With increasing temperature from 400℃ to 500℃, the higher release rate is due to the volatility of the inorganic As at lower temperature. With further increase the temperature from 500℃ to 900℃, As release decreased which may be attributed to the fast oxidation of As and the formation of some inorganic compounds. Moreover, the soluble As in the solid residue mainly presents as As5+, and the content varies largely with the temperature with a peak value of 81% of total As at 800℃. The content of soluble As5+decreases before 500℃ due to the volatility of the inorganic As. The physical adsorption of some compounds plays an important role for the As fixation at the temperature from 500℃ to 700℃, while the As fixation is mainly conducted by the chemical oxidation at 800℃. The content of soluble As5+decreases a little, possibly because of the sintering of the ash. Considering the As recycling process, 800℃ is recommended as theoptimum combustion temperature for the P. vittata.
P. vittata; combution; As; soluble As; speciation
DUAN Lunbo, associate professor, duanlunbo@seu. edu.cn
X 712
:A
:0438—1157(2017)01—0281—08
10.11949/j.issn.0438-1157.20161173
2016-08-22收到初稿,2016-10-24收到修改稿。
联系人:段伦博。
:李小乐(1992—),男,硕士研究生。
国家自然科学基金项目(51206023)。
Received date: 2016-08-22.
Foundation item: supported by the National Natural Science Foundation of China(51206023).

