粘质沙雷氏菌产灵菌红素的碳源分析、菌种诱变及动力学
荣广健,张佑红,陈艳,谌颉,黄萌,周锋
(1武汉工程大学化学与环境工程学院,湖北 武汉 430073;2武汉工程大学化工与制药学院,绿色化工过程教育部重点实验室,湖北 武汉 430073)
粘质沙雷氏菌产灵菌红素的碳源分析、菌种诱变及动力学
荣广健1,张佑红2,陈艳2,谌颉2,黄萌2,周锋2
(1武汉工程大学化学与环境工程学院,湖北 武汉 430073;2武汉工程大学化工与制药学院,绿色化工过程教育部重点实验室,湖北 武汉 430073)
使用流式细胞仪研究了不同碳源对粘质沙雷氏菌ZSG新陈代谢的影响,发现不同碳源导致ZSG的DNA含量、细胞内部颗粒密度、表面粗糙度和细胞大小在发酵过程中呈现有差异的变化。对ZSG进行复合诱变筛得一株稳定突变菌株ZSG7,在250 ml摇瓶和5 L发酵罐中进行发酵,其灵菌红素(PG)产量比出发菌株分别提高了62.5%和269%。对ZSG7进行发酵培养基优化后PG产量比优化前提高了100%。对ZSG7发酵进行溶氧分段控制模式调控后PG产量比DO调控前提高了30.9%。对ZSG7发酵进行恒定pH调控后比pH调控前提高了35.9%。对ZSG7发酵进行补料组分优化后比补料前提高了47.6%。基于Logistic方程和Luedeking-Piret方程建立了恒定pH7分批发酵和补料分批发酵的菌体生长模型和PG合成模型。拟合模型参数后,模型可以合理地描述恒定pH7分批发酵和补料分批发酵的过程。
流式细胞仪;碳源;灵菌红素;动力学模型;诱变;优化;发酵
引 言
PG是一大类具有甲氧基吡咯环骨架结构的天然色素[1]。PG对多种癌细胞具有抑制作用[2-4],还具有免疫抑制[5]、抗细菌[6]、抗真菌[7-8]、抗疟疾[9]、除藻[10]、染色[11]等多种功能。PG对酸碱性敏感,在碱性条件下不稳定容易分解,在酸性条件下可较长时间保存[12]。PG是一种可以被粘质沙雷氏菌等多个种属的微生物合成出来的次级代谢产物[13-15]。发酵过程中菌体生长和产物合成过程具有一定的规律性,构建发酵动力学模型可对菌体生长和产物合成过程进行深入研究[16]。目前流式细胞仪在微生物检测领域应用广泛[17],但对PG发酵检测分析的研究还比较少,同时关于PG发酵最佳pH的研究主要是初始pH,发酵中恒定pH的研究也比较少。本文首先使用流式细胞仪对粘质沙雷氏菌利用不同碳源时的生长代谢情况进行分析,然后通过菌种诱变、培养基优化和在5 L发酵罐中培养工艺优化来提高PG产量,最后进行发酵动力学模拟,为以后PG工业化奠定基础。
1 材料与方法
1.1 菌株
粘质沙雷氏菌株,由本实验室自糖化车间酸性土壤中筛选获得并保藏于中国典型培养物保藏中心(CCTCC NO: M 209195),菌株编号ZSG[18]。
1.2 实验仪器
主要仪器:赛多利斯生物反应器,BIOSTAT A plus,购于广州宝信捷生物应用设备有限公司;振荡培养箱,SPX-250B-D,上海博讯实业有限公司医疗设备厂;超净工作台,AIR TECH,苏净集团安泰公司;高速离心机,TG18M,台式多管低速离心机,TDZ5-WS,长沙平凡仪器仪表有限公司;紫外可见分光光度计,UV-1800,苏州岛津仪器有限公司;流式细胞仪,FACS Calibur,美国BD公司。
1.3 材料与溶液配制
琼脂粉(强度>1300 g·cm−2),牛肉浸膏,蛋白胨,酵母粉,鱼粉蛋白胨,胰蛋白胨均为生化试剂BR。
蔗糖,甘油,油酸,可溶性淀粉,尿素,硝酸铵,无水氯化钙,无水氯化镁,氯化钾,十二水合磷酸氢二钾,氢氧化钠,浓盐酸,硫酸钠,二甲亚砜(DMSO),十二烷基磺酸钠(SDS),吐温-80均为分析纯。
固体培养基:牛肉膏0.5%,蛋白胨1%,琼脂粉2%,NaCl 0.5%。
种子培养基:蔗糖0.5%,蛋白胨1.5%,NaCl 0.5%,MgCl20.25%,吐温-80 1.0%。
发酵培养基:在种子培养基的基础上调整。
PBS缓冲液:0.27 g KH2PO4,1.42 g Na2HPO4,8 g NaCl,0.2 g KCl,加去离子水约800 ml,充分搅拌溶解后加入浓盐酸调节pH至7.2,定容至1 L,高温高压灭菌后室温保存。
1.4 培养方法
保藏菌种经活化后接入装有种子培养基的 250 ml锥形瓶中,装液量为50 ml,将锥形瓶置于恒温振荡培养箱中29℃、160 r·min−1条件下培养24 h,按 10%的接种量接入发酵培养基中,29℃、160 r·min−1下培养。
1.5 菌体干重和PG浓度测量方法
本实验采用陈艳等[19]测量菌体干重和PG浓度的方法进行测量。
1.6 DNA含量分布检测
取发酵液0.5 ml于5 ml流式管中,2000 r·min−1离心5 min,弃上清。用PBS缓冲液清洗菌体,离心弃PBS,重复两遍。沉淀中缓慢加入1 ml 70%的冰乙醇,对细胞进行破膜与固定,样品保藏于−20℃冰箱中冻存过夜。分析时,离心弃上清,PBS溶液清洗两遍。加入125 μl的试剂A(Trypsin buffer),20~25℃下反应10 min,降解细胞组织碎片,再加入 100 ml试剂 B(Trypsin inhibitor and Rnase buffer),20~25℃下反应 10 min,降解细胞中的RNA,最后再加入125 μl的试剂C(PI染料)进行DNA染色,2~8℃避光条件下孵育10 min后即可上 FCM 检测。流式检测图谱采用 Cell Quest和Modifit软件分析。
1.7 菌种诱变与筛选
先将处于对数生长期后期的粘质沙雷氏菌用体积分数1.0%的硫酸二乙酯处理20 min(终止反应为加入 25%的硫代硫酸钠溶液),然后用紫外线照射20 s,最后稀释涂平板,在恒温29℃下培养48 h,挑取单菌落进行摇瓶发酵实验,筛选PG产量最高且稳定的突变菌株。
1.8 突变菌株发酵培养基优化
采用单因素实验和 L9(34)正交实验对发酵培养基进行优化。
1.9 突变菌株溶氧分段控制模式调控
培养条件:5 L发酵罐中装液量为3 L,培养温度29℃,不调pH,发酵周期为66 h。实验设置4组DO分段控制模式(如图5):(A)发酵全程均为转速200 r·min−1,通气比1 vvm,作为对照;(B)第0~12 h转速200 r·min−1,通气比1 vvm,第12~24 h DO为10%,将DO偶联转速,系统自动将DO恒定,第24 h以后控制DO为30%;(C)第0~12 h DO为10%,第12~24 h DO为30%,第24 h以后DO为60%;(D)第0~12 h DO为30%,第12~24 h DO为60%,第24 h以后DO为90%。在发酵过程中,适当调节通气量,保证转速处于200~500 r·min−1之间。
1.10 突变菌株恒定pH发酵调控
使用突变菌株在5 L发酵罐中进行发酵实验,装液量3 L,接种量10%,29℃,发酵周期66 h,DO为前面最优条件。发酵设置5组变量:不调pH(作为对照),恒定pH5,恒定pH6,恒定pH7,恒定pH8。pH使用pH探头实时监控,由发酵系统软件通过发酵系统主机的蠕动泵使用1 mol·L−1盐酸溶液和 1 mol·L−1氢氧化钠溶液自动调节发酵液pH,从而实现恒定pH。
1.11 突变菌株补料调控
在最佳恒定pH下进行补料培养,设置3种补料组分:(a)0.5%油酸、0.5%蛋白胨和0.5%吐温-80;(b)1%蛋白胨和0.5%吐温-80;(c)1%油酸和0.5%吐温-80。流加方式为使用发酵系统自带的蠕动泵蠕动流加。
1.12 发酵过程动力学数据处理
在发酵过程中定时取样,测定样品的菌体干重、PG含量,采用Origin 8.0软件对发酵动力学模型参数进行求解。
2 结果与分析
2.1 使用流式细胞仪分析不同碳源对细菌的生长代谢调控的影响
本实验设置了4组实验,比较不同物质作碳源时 ZSG的生长代谢情况。发酵培养基配方:碳源0.5%,蛋白胨1.5%,NaCl 0.5%,MgCl20.25%,吐温-80 1.0%,4组碳源分别为蔗糖、葡萄糖、牛肉膏、甘油。图1是ZSG利用不同碳源时的菌体生长和PG合成曲线。使用流式细胞仪对粘质沙雷氏菌利用不同碳源时的生长代谢进行检测分析,其细胞荧光(FL2-A)信号以及侧向散射光(SSC)信号、前向散射光(FSC)信号分布如图2(a)、(b)、(c)所示。FL2-A信号反映了细胞中DNA相对含量,信号强度越大,说明DNA含量越高。SSC信号反映了颗粒性质和细胞精细结构。细菌表面有细胞壁,表面比较光滑而粗糙度较小,当细菌长有纤毛时,细菌表面粗糙度显著变大。细菌内部颗粒和表面纤毛共同影响着SSC信号,推测表面纤毛起的作用比细菌内部颗粒大。FSC信号表示相对细胞大小。
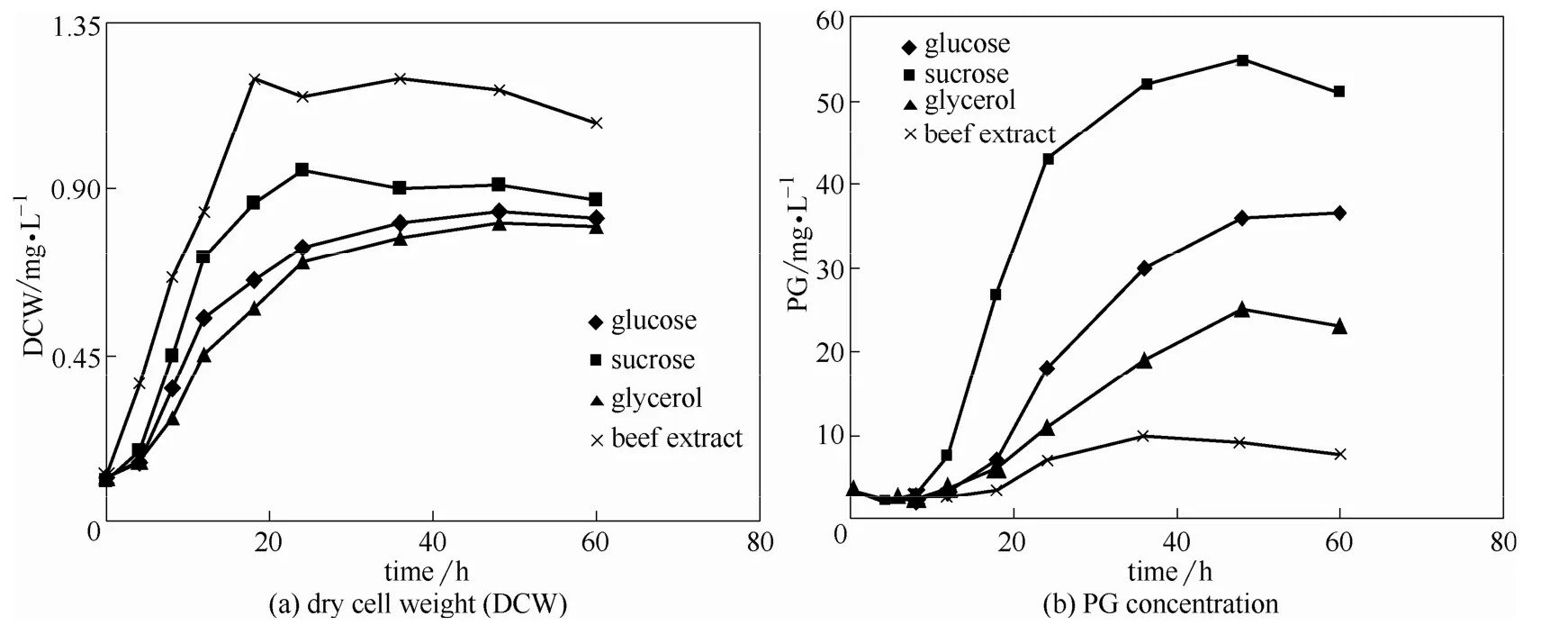
图1 碳源对菌体干重和PG产量影响Fig.1 Effect of carbon source on DCW and PG production
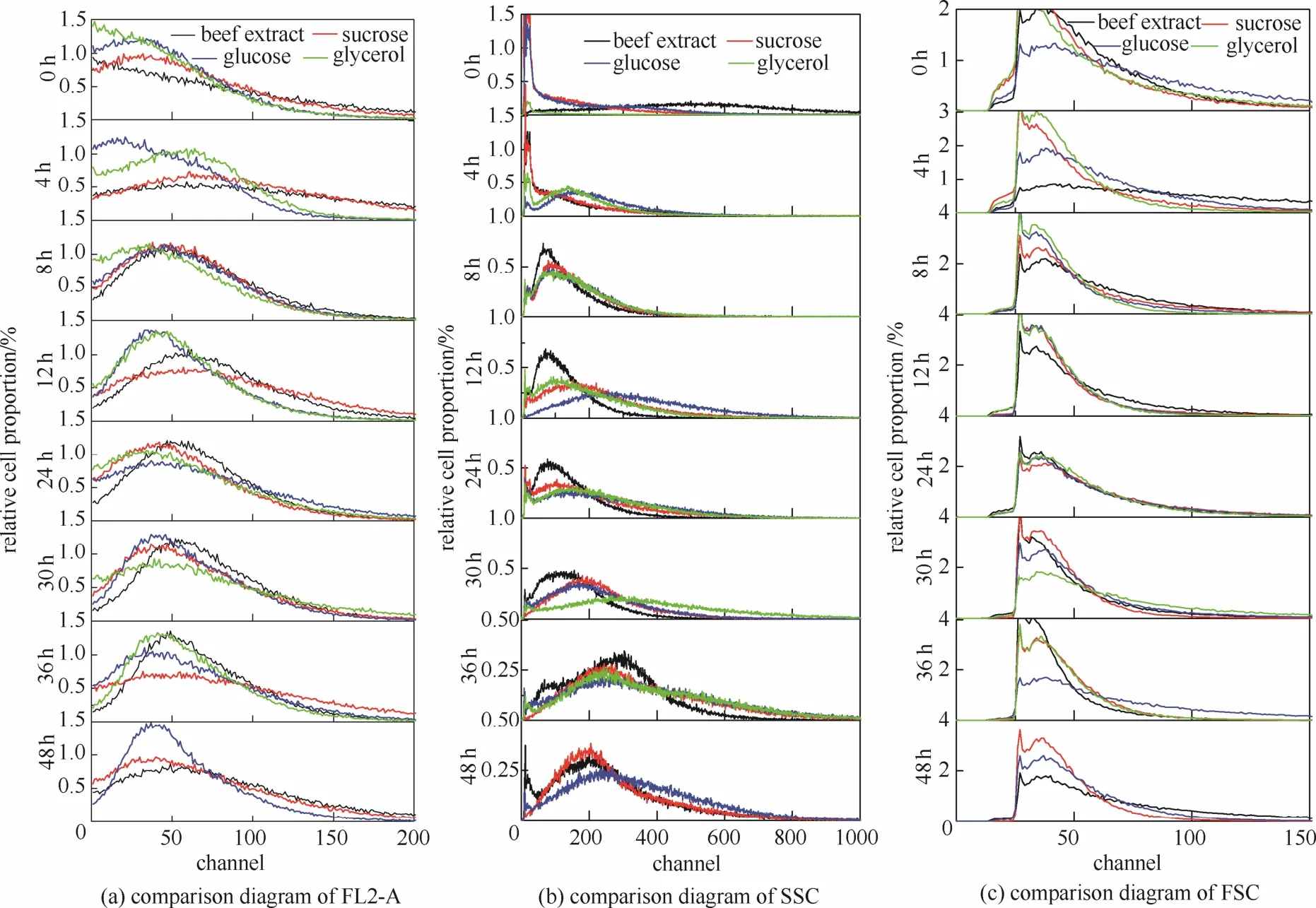
图2 流式细胞仪检测结果Fig.2 Test results of flow cytometry
第0 h时,发酵开始,菌种被加入发酵罐,开始适应新环境,4组均处于迟滞期;FL2-A信号大多位于0~100道,极少量为100~200道,细胞中DNA含量比较低;绝大部分SSC信号处于0~50道,细胞颗粒还很少,纤毛还没有长出;不同碳源下细胞大小有所不同,但大部分FSC信号处于25~50道之间。
第4 h时,蔗糖组、葡萄糖组、甘油组均进入对数生长期;蔗糖组和牛肉膏组FL2-A信号图形都比较扁平,FL2-A信号迅速增长,表明DNA积累很快,甘油组FL2-A信号有少许增强,表明细胞中DNA含量不是很高,DNA复制不是很快,葡萄糖组几乎没有变化,可能是由于葡萄糖浓度过大反馈抑制了细胞中DNA合成;蔗糖组和牛肉膏组SSC信号几乎未变化,说明此时细胞内部颗粒密度比较低,纤毛还没有长出,葡萄糖组和甘油组中处于0~50道上的 SSC信号细胞比例明显缩小,有一部分SSC信号移动到50~300道上,可能是由于细胞分裂和DNA复制比较慢,细胞中滞留一些颗粒;牛肉膏组细胞大小发生明显变化,FSC信号图变得扁平,波峰几乎消失,大部分细胞DNA含量高而细胞还未分裂,故而细胞体积偏大。
第8 h时,4组均进入对数生长期;蔗糖组和牛肉膏组FL2-A信号开始降低,细胞中DNA含量明显减少,大部分细胞是刚分裂出来的,葡萄糖组FL2-A信号则是从低道数向高道数移动,说明细胞中DNA含量缓慢增加,甘油组FL2-A信号图形向低道数小范围移动,表明DNA含量小范围下降;蔗糖组、葡萄糖组和甘油组SSC信号增加,细胞内部颗粒增加,纤毛开始长出,牛肉膏组SSC信号虽然向高道数移动,但是高道数SSC信号较少,推测纤毛还没长出;牛肉膏组FSC信号逐渐集中到25~50道之间,但是变化较小,表明细胞体积逐渐回复到原来大小。
第12 h时,蔗糖组PG开始合成,而葡萄糖组、牛肉膏组和甘油组只有微量合成;蔗糖组FL2-A信号增强,DNA相对含量增加,葡萄糖组和甘油组FL2-A信号降低,表明细胞完成分裂,细胞中DNA含量比较低,牛肉膏组FL2-A信号变化不大;蔗糖组SSC信号从第12~36 h缓慢增强,这期间细胞从对数生长期后期进入到稳定期,随着细胞数目的增多,细胞分裂减慢至逐渐停止,个体为生存逐渐积累颗粒物质,增加纤毛来加强细菌群体交流;甘油组SSC信号变化在第12~36 h与蔗糖组相似,只是甘油组SSC信号要稍强,这期间甘油组仍然处于对数生长期,且甘油组中细胞分裂比较缓慢;葡萄糖组SSC信号从第12~30 h缓慢降低,说明随着细胞分裂细胞内部颗粒和表面纤毛有些许减少。
第24 h时,蔗糖组和牛肉膏组已进入稳定期,葡萄糖组和甘油组仍处于对数生长期,4组都在合成 PG,但蔗糖组产量最大,葡萄糖组其次,甘油组再次,牛肉膏组最小;蔗糖组大部分FL2-A信号处于低道数上,这是因为大部分细胞为刚刚分裂出来的细胞,新细胞中DNA含量比较低,牛肉膏组FL2-A信号图形几乎没有变化,葡萄糖组FL2-A信号从第24~30 h重复了从第8~12 h的荧光动向,表明这期间细胞又经历了一次细胞分裂,但是时间相对延长,甘油组FL2-A信号增强,DNA含量细微增加;牛肉膏组FSC信号基本没有变化。
第30 h时,葡萄糖组和甘油组仍处于对数生长期,4组合成PG的速度下降,但产量次序不变;蔗糖组FL2-A信号降低,DNA含量细微减少,甘油组FL2-A信号仍在增加;牛肉膏组SSC信号开始增强,细胞内部颗粒开始积累,纤毛开始生长。
第 36 h时,葡萄糖组和甘油组开始进入稳定期,蔗糖组和甘油组仍在慢速合成 PG,葡萄糖组和牛肉膏组停止合成 PG,但产量仍次序不变;蔗糖组出现一些较高FL2-A信号,可能是蔗糖组细胞适应稳定期后二次生长,葡萄糖组FL2-A信号进一步降低,甘油组FL2-A信号则向25~75道集中,DNA含量范围缩小,细胞趋于保持现有状态;葡萄糖组和牛肉膏组SSC信号进一步增强,说明细胞内部颗粒积累不少,纤毛长出很多。
第48 h时,蔗糖组和甘油组已停止合成PG;牛肉膏组出现一些较强的FL2-A信号,可能是细胞在稳定期后进行二次生长,蔗糖组高道数FL2-A信号减少,说明二次生长减缓,葡萄糖组FL2-A信号向25~75道集中,DNA含量范围缩小,细胞趋于保持现有状态;4组SSC信号明显降低,细胞内部颗粒和表面纤毛减少。
综上所述,菌体干重大小依次为牛肉膏组>蔗糖组>甘油组>葡萄糖组,PG产量大小依次为蔗糖组>葡萄糖组>甘油组>牛肉膏组,使用流式细胞仪对细菌个体分析发现粘质沙雷氏菌利用不同碳源时其DNA含量、细胞颗粒密度、表面粗糙度和细胞大小呈现不同变化。牛肉膏组细胞中DNA含量变化比较快,细胞颗粒密度增加和纤毛生长比较迟缓,对数生长期时细胞体积偏大,细胞生长繁殖很快,推测由于牛肉膏中包含碳氮源、无机盐、生长因子等,营养丰富,牛肉膏组细胞繁殖过快,抑制了与生长繁殖无关的次级代谢如纤毛合成和PG合成,结果菌体干重最大,PG产量极低。PG合成是在对数生长期后期启动的,牛肉膏组PG产量太少可能与PG前体的合成在对数生长期后期被抑制有关。葡萄糖组菌体干重最小,PG产量也不高,可能是由于葡萄糖是比较容易利用的碳源,其分解产物阻遏细菌利用其他碳源,进而细胞生长繁殖比较慢,同时PG合成缓慢,产量不高。甘油组菌体干重和PG产量均排第三,分析发现甘油组细胞中DNA含量、细胞颗粒密度、表面粗糙度和细胞大小等变化缓慢,细胞生长繁殖也较慢,PG产量最终比较低。蔗糖组菌体干重仅次于牛肉膏组,但PG产量最高,通过流式细胞仪分析,可以发现蔗糖组细胞中DNA含量、细胞颗粒密度、表面粗糙度和细胞大小等变化比较协调,蔗糖是二糖,没有葡萄糖代谢阻遏效应,又没有牛肉膏那么多营养成分,细胞利用蔗糖效率高,生长繁殖比较快,但没有出现细胞生长大于分裂现象,也没有抑制次级代谢产物的合成,所以PG产量很高。在这4种碳源中,未诱变的野生型粘质沙雷氏菌 ZSG使用蔗糖作碳源时菌体量和PG产量都比较高,说明蔗糖是这 4种碳源中最合适的。但是野生型粘质沙雷氏菌ZSG的PG产量还是太低,因此后续实验将对ZSG进行菌种诱变,从根本上提高PG产量。
2.2 菌株诱变及筛选
经菌种诱变筛得一株 PG摇瓶产量达到 0.104 g·L−1的菌株 ZSG7,比出发菌株的 0.064 g·L−1提高了62.5%,其菌体干重0.93 g·L−1比原始菌株的0.73 g·L−1提高了27.4%。经过10代发酵培养其PG产量基本不变,说明遗传稳定性良好,如表1。在5 L发酵罐中按相同条件(29℃,200 r·min−1,2 vvm)进行培养比较,诱变后ZSG7的最大菌体干重为0.84 g·L−1,与原始菌株的0.92 g·L−1相近,如图3(a),其PG最高产量为0.1723 g·L−1,比原始菌株的0.0467 g·L−1提高了269%,诱变后PG产量提高很大,如图3(b)。
2.3 发酵培养基优化
单因素实验结果如图4所示。突变株ZSG7使用油酸作为碳源和KCl作为无机盐,其菌体干重和PG产量明显高于用蔗糖作为碳源和MgCl2作为无机盐时,即菌株最佳碳源和最佳无机盐发生改变。由单因素实验确定最佳碳源是油酸,最佳氮源是蛋白胨,最佳无机盐是 KCl,最佳表面活性剂是吐温-80。
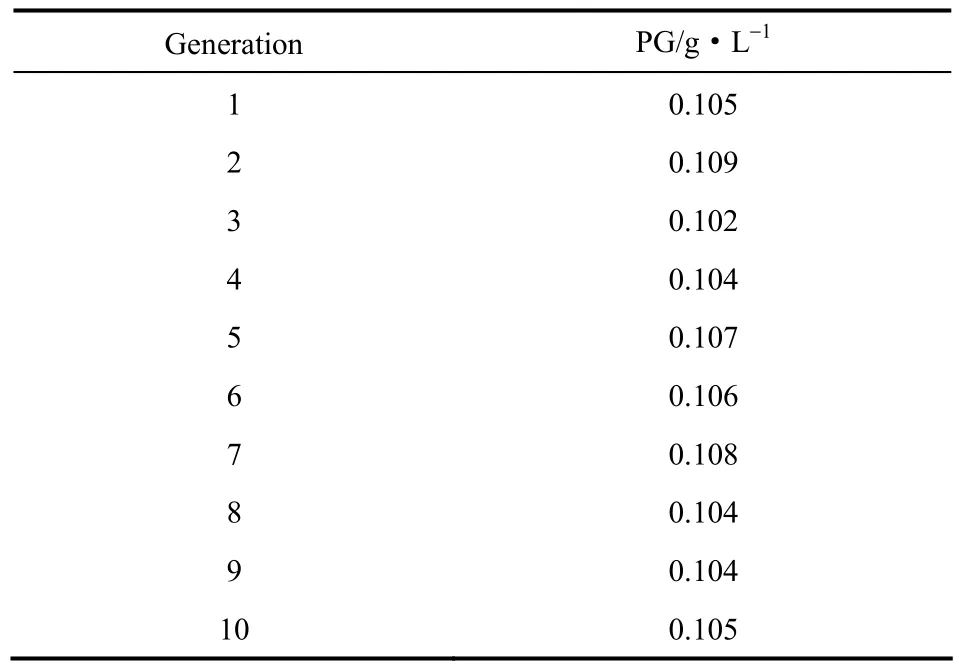
表1 突变株传代稳定性实验Table 1 Mutant strain ZSG7 generation stability
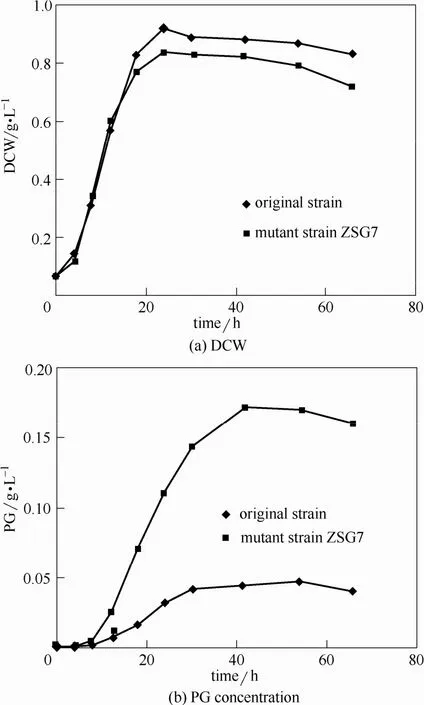
图3 原始菌株和突变菌株ZSG7在5 L反应器中发酵结果比较Fig.3 Comparison of fermentation results in 5 L reactor between original strain and mutant strain ZSG7

图4 单因素实验优化结果Fig.4 Optimization results of single factor experiments
以菌体干重和PG产量为指标,采用L9(34)正交实验对油酸、蛋白胨、KCl和吐温-80进行优化,实验结果与分析如表2、表3和表4。

表2 培养基优化的培养基成分和水平Table 2 Medium components and levels of medium optimization
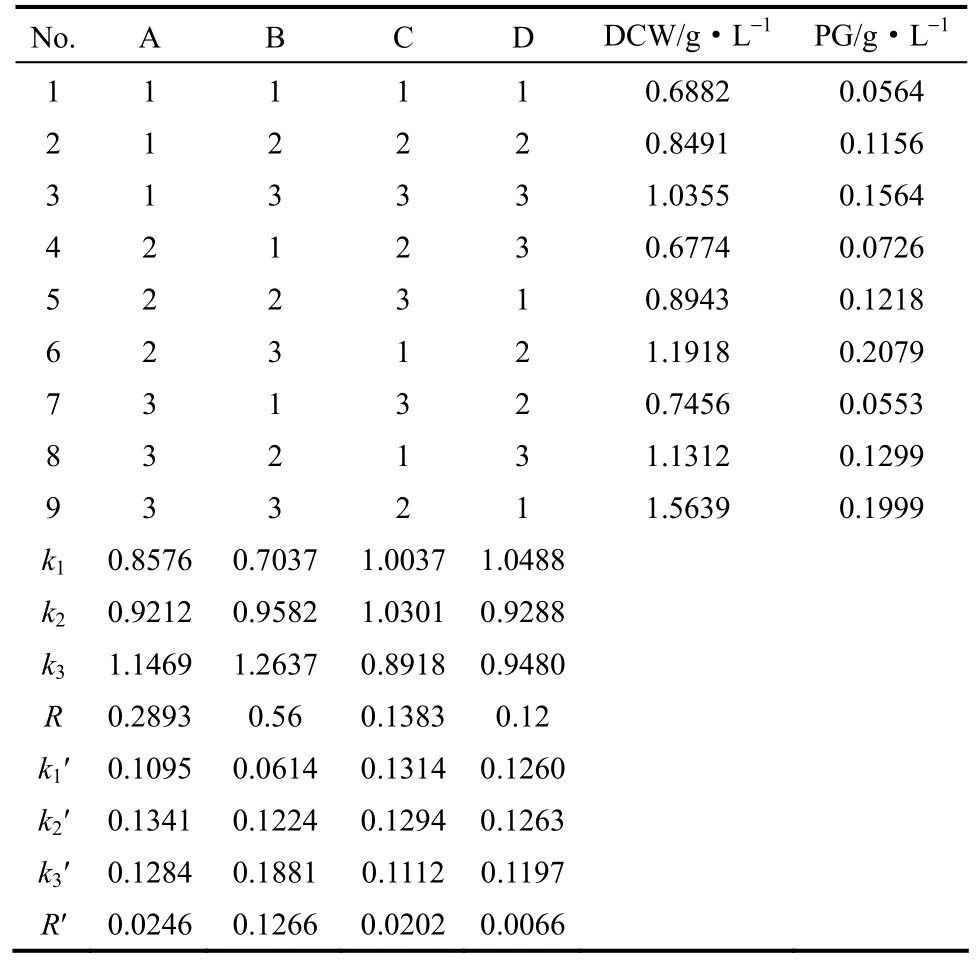
表3 优化培养基L9(34)正交实验结果Table 3 Orthogonal results of optimization medium

表4 方差分析Table 4 ANOVA
由表3可知:由极差R可得,各因子对菌体生长的影响为B(蛋白胨) >A(油酸)>C (KCl) >D (吐温-80),以菌体干重为指标时,A3B3C2D1为最佳培养基配方,菌体干重达到 1.5639 g·L−1;由极差 R′可得,各因子对PG产量的影响为B (蛋白胨) > A(蔗糖)>C (KCl) >D(吐温-80) ,以PG产量为指标时,最优培养基配方为 A2B3C1D2,PG产量最高为0.2079 g·L−1。
由表4可知,FB>3.110>FA>FC>FD,表示B因素影响显著,而A因素、C因素、D因素都不具有显著影响。综合考虑极差分析和方差分析,并且经过重复实验,得出Serratia marcescens ZSG7产PG培养基最优配方为:油酸1.0%,蛋白胨1.5%,无水氯化钾0.25%,吐温-80 1.0%,NaCl 0.5%。在250 ml摇瓶中进行发酵,培养基优化后ZSG7菌体干重(1.19 g·L−1)比优化前(0.93 g·L−1)提高了28%,而PG产量(0.2079 g·L−1)则比优化前(0.104 g·L−1)提高了100%。
2.4 溶氧分段控制模式对PG产量的影响
图5是4组模式的溶氧变化。DO实验结果如图6和表5所示,菌体干重为D组>C组>B组>A组(对照组),PG产量为C组>B组>A组(对照组)>D组。粘质沙雷氏菌合成PG是一个耗氧的过程,但并不是DO越大PG产量越高,其中D组每段控制模式的DO均大于C组的,但是PG产量却远远低于C组,C组PG产量比对照组提高了30.9%。显然C组控制模式(第0~12 h DO为10%,第12~24 h DO为30%,第24 h以后DO为60%)为粘质沙雷氏菌发酵产PG的最佳分段DO控制模式。
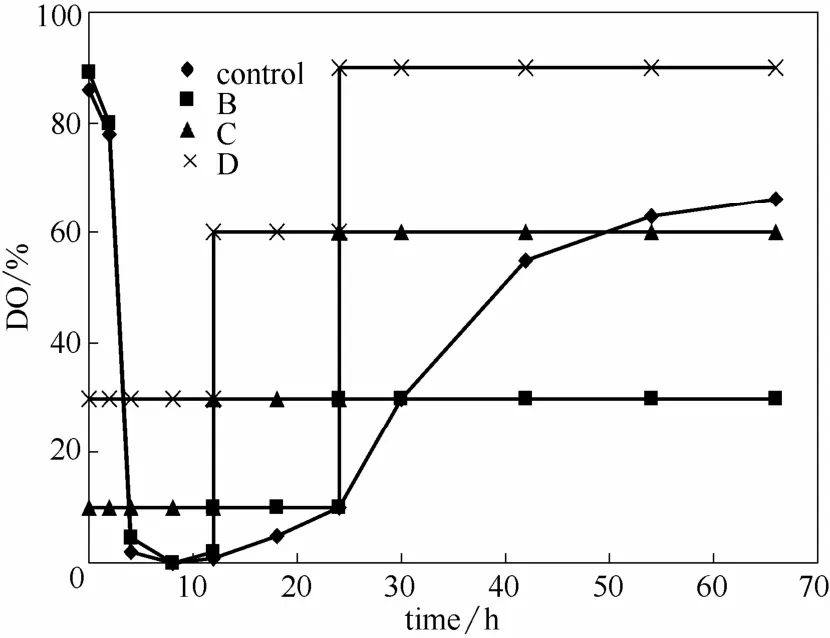
图5 溶氧调控变化Fig.5 Variation of controlling DO
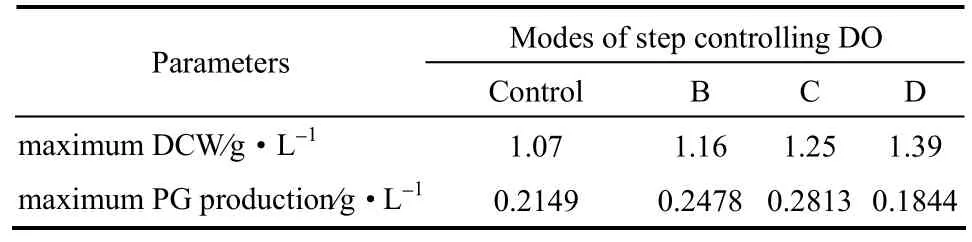
表5 溶氧分段控制下的发酵结果比较Table 5 Comparison of fermentation results by step controlling DO
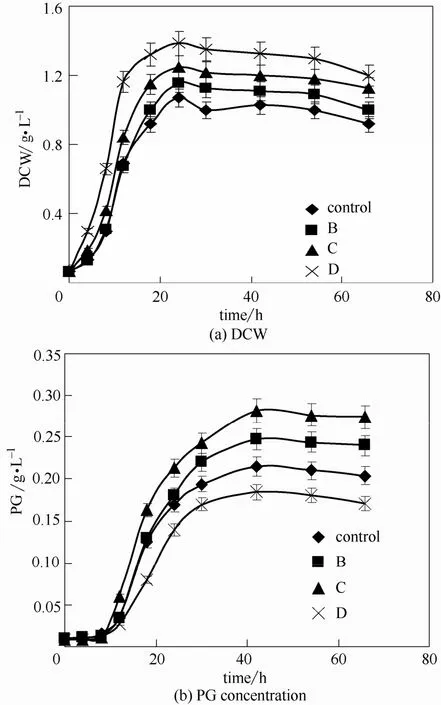
图6 溶氧对发酵过程的影响Fig.6 Effect of DO on fermentation
2.5 恒定pH对PG产量的影响
由图7可知,当不调pH时,发酵液pH会随着菌体繁殖发生变化:在0~4 h,pH基本保持在初始值4.9左右;在4~30 h,发酵液pH快速上升;第11 h时,pH为6;第23 h时,pH为7;第30 h时,pH为7.5,此时pH快速上升结束,以后pH上升极为缓慢,发酵结束时pH才到8.1。这表明该菌生长繁殖和生产PG是一个pH变大的过程。
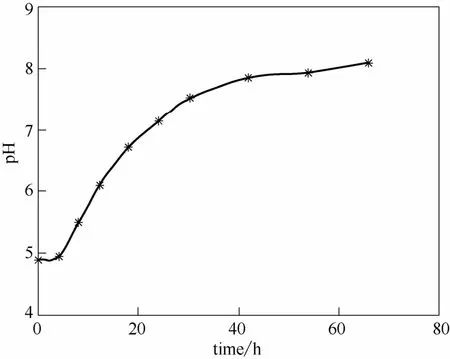
图7 粘质沙雷氏菌ZSG7发酵过程中pH曲线Fig.7 Curve of pH in fermentation process of Serratia marcescens ZSG7
设恒定pH5、6、7、8和不调pH(对照组)时的菌体生长速度分别为V5、V6、V7、V8和Vf。由图8(a)可知,当菌体大量繁殖时,V7>V6>V5>V8。不调pH时,在0~4 h,pH基本保持在4.9左右,在4~23 h,pH从4.9快速上升到7,这段时间菌体大量繁殖改变了发酵液pH,同时pH变化也给菌体生长速度带来了影响。由图8(a)和表6可知,恒定pH6和7时的最大菌体干重非常接近,明显高于恒定pH5时与不调pH时,恒定pH8时V8最小,最大菌体干重也是最小,这表明在恒定pH8时细菌生长繁殖受到了影响。综合考虑最大菌体干重和菌体生长速度,菌体生长繁殖的最适恒定pH是pH7。

图8 恒定pH对发酵过程的影响Fig.8 Effect of pH on fermentation
设恒定pH5、6、7、8和不调pH时的PG生产速度分别为ʋ5、ʋ6、ʋ7、ʋ8和ʋf,PG最大产量分别为M5、M6、M7、M8和Mf。由图8(b)可知,在第12~24 h时为ʋ7>ʋ6>ʋ5>ʋ8,而在第24~42 h时为ʋ7>ʋ6>ʋ8>ʋ5,其中恒定pH5发酵在第24 h以后就不再产 PG。最终 PG产量大小依次为M7>M6>M8>M5,如表6。ʋ5与M5低于恒定pH6和7条件下的,这说明由于发酵液(恒定pH5)酸性太高,有关PG合成的基因和酶受到了抑制,结果PG生产能力受到严重影响,产量大大降低。而 ʋ8与M8同样很低,这说明由于在恒定pH8时细菌活性比较弱,同时PG在恒定pH8条件下不稳定,容易分解,大量PG在刚刚生产出来时就被恒定碱性环境所分解了。M6比Mf高出11.1%。而不调pH时的PG产量在发酵第12~34 h是高于pH6条件下的,这是因为不调pH时的发酵液pH在第11~23 h从pH6逐渐上升到pH7,粘质沙雷氏菌活性升高,产PG的速度加快,但是随着发酵液pH在第23 h后超过7并继续上升,由于PG在碱性条件下容易分解以及粘质沙雷氏菌活性因发酵环境碱性增强而下降,导致从第23 h开始PG生产速度不断下降,结果PG最高仅为0.2813 g·L−1。当pH为7时,PG产生速度最快,产量最高,达到0.3822 g·L−1,比不调pH高出35.9%。因此,PG生产的最适恒定pH是pH7。
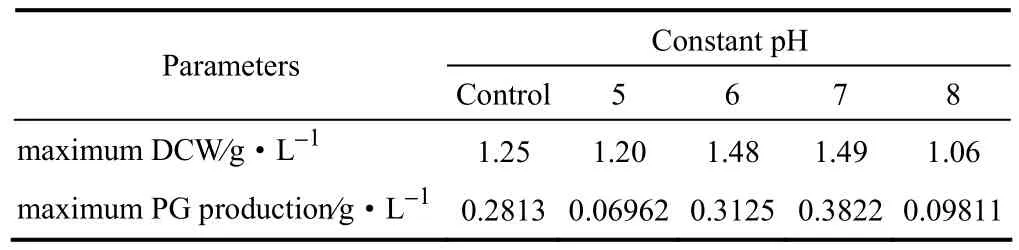
表6 恒定pH下的发酵结果比较Table 6 Comparison of fermentation results in constant pH
2.6 补料调控对PG产量的影响
在发酵第42 h时PG合成基本停止,因此补料起始点定为第42 h,持续12 h。补料发酵和分批发酵均是在pH恒定在7时进行。如图9所示,3种补料组分与不补料时相比,菌体干重和PG产量都得到了提升。
由表7可知,不同补料组分下菌体干重和PG产量不同。与不补料的对照组相比,组分a、b、c的菌体干重分别提高了46.7%、29.4%和23.6%,而其PG产量分别提高了47.6%、33.6%和21.2%。补料组分a可以得到最高的菌体干重和PG产量,因此,采用补料组分a,在第42 h时补料,补充0.5%油酸、0.5%蛋白胨和 0.5%吐温-80。如图 9所示,当发酵78 h后PG含量下降,说明PG的分解大于生产,应该中止发酵,因此发酵周期定为78 h。
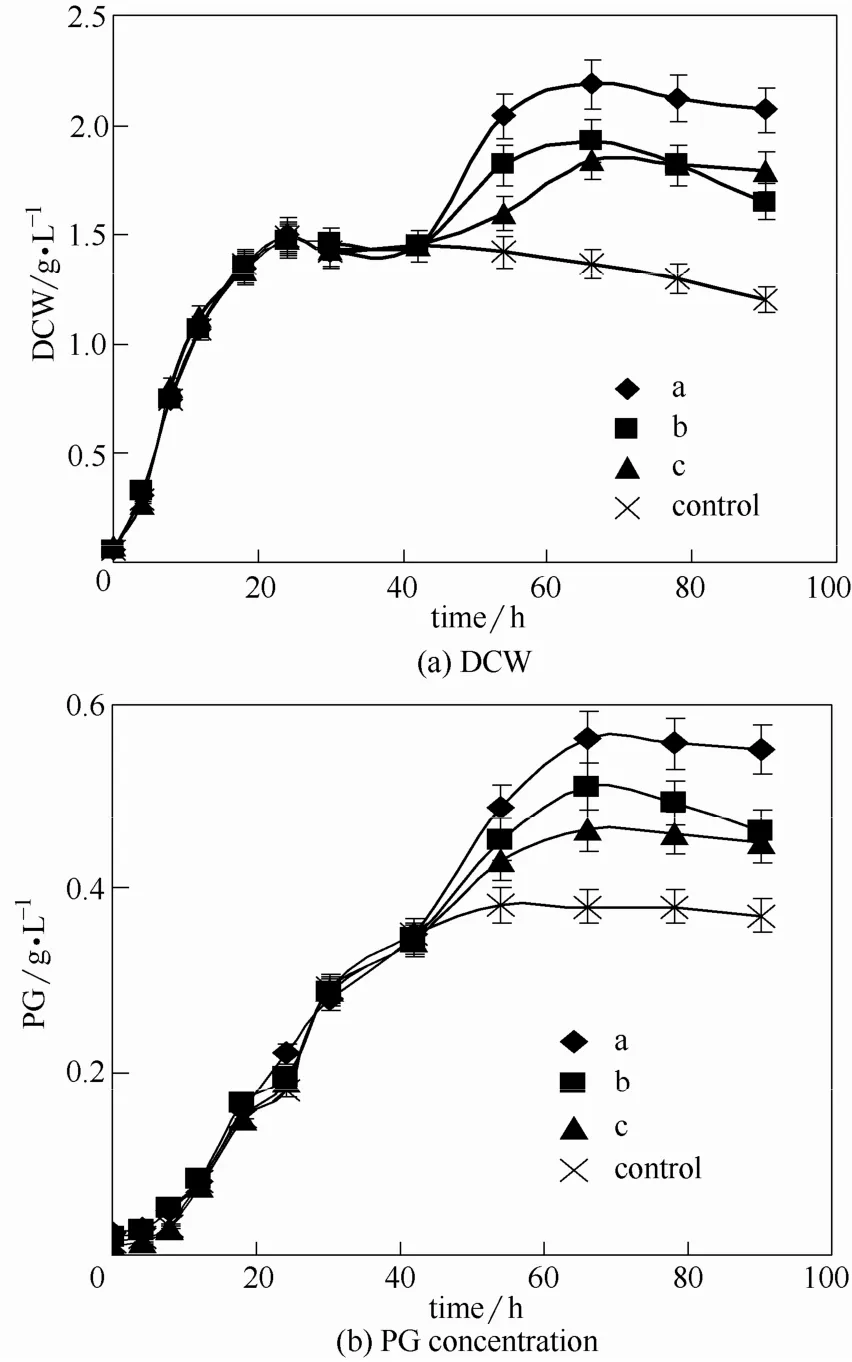
图9 不同补料组分对发酵过程的影响Fig.9 Effect of different fed-batch components on fermentation
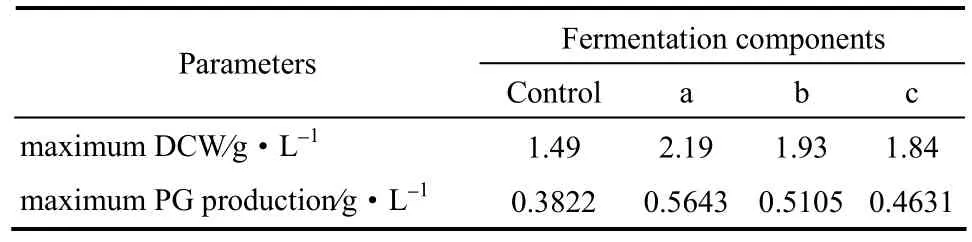
表7 补料控制下产PG的发酵过程参数比较Table 7 Comparison of parameters with PG production under fed-batch control
2.7 发酵动力学模型及模拟
2.7.1 菌体生长动力学模型及模拟 菌体生长动力学模型常用Monod及Logistic方程进行构建[20]。由图8和图9可以看出,菌体生长是一条S形曲线,本文采用Logistic方程模拟菌体生长动力学模型
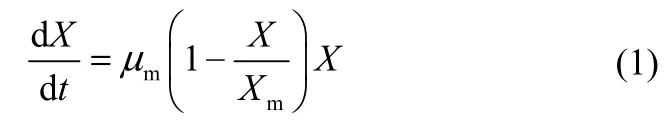
其中,μm为最大比生长速率,Xm为最大菌体干重。以t=0,X=X0(X0为初始菌体干重)为条件,将Logistic方程式(1)进行积分,可得
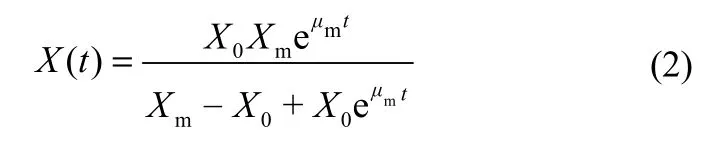
对于补料发酵,当菌体生长进入稳定期后开始补料,可以设定补料前稳定期菌体干重为Xm1,则有

将图8(a)中恒定pH7下的分批发酵的菌体干重数据代入式(2),非线性拟合可得Logistic方程参数,即X0=0.05 g·L−1,Xm=1.418 g·L−1,μm=0.415 h−1,R2=0.9916,说明两者拟合效果非常好,如图10(a)。其菌体干重X随时间t变化的函数为
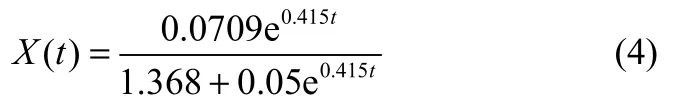
如图 9(a),补料分批发酵的菌体生长曲线为双S形,需要分段进行参数拟合,第1段S形曲线用式(2)进行拟合,参数为X0=0.05 g·L−1,Xm=1.426 g·L−1,μm=0.403 h−1,R2=0.9831,第2段S形曲线用式(3)进行拟合,参数为 Xm1=1.426 g·L−1,X0=1.57×10−10g·L−1,Xm=0.701 g·L−1,μm=0.448 h−1,R2=0.9815,说明拟合效果非常好,如图10(b)。其菌体干重X随时间t变化的函数为

2.7.2 产物动力学模型及模拟 PG合成起始于对数生长期后期,与菌体生长有部分偶联,可以使用Luedeking-Piret方程[21]对其进行拟合

当a≠0、b=0时为生长偶联型;a=0、b≠0时为非生长偶联型;a≠0、b≠0时为部分生长偶联型。将式(1)和式(2)代入式(7)后积分可得


图10 菌体生长动力学的模拟Fig.10 Simulation of cell growth kinetics
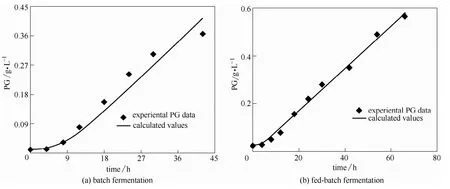
图11 PG生产动力学的模拟Fig.11 Simulation of PG production kinetics
将图8(b)中恒定pH7下的分批发酵的PG数据和 X0、Xm、μm代入式(8),非线性拟合可得Luedeking-Piret方程参数为a=0.05,b=0.00832,这证明PG合成是部分生长偶联型,R2=0.9577,说明拟合效果非常好,如图11(a)。其PG浓度随时间t变化的函数为

补料分批发酵全程的 X0=0.05 g·L−1,Xm=Xm1+0.707 g·L−1=2.127 g·L−1,μm=0.448 h−1,与图9(b)中补料发酵PG数据一起代入式(8)进行非线性拟合,得a=0.4,b=0.00419,这也证明PG合成是部分生长偶联型,R2=0.9934,说明拟合效果非常好,如图11(b)。其PG浓度随时间t变化的函数为

3 结 论
使用流式细胞仪研究了不同碳源对粘质沙雷氏菌生长代谢的影响,发现粘质沙雷氏菌利用不同碳源时其DNA含量、细胞颗粒密度、表面粗糙度和细胞大小呈现有差异的变化。未诱变的野生菌ZSG以蔗糖为碳源时PG产量最高,菌体干重比较高,DNA含量、细胞颗粒密度、表面粗糙度和细胞大小等变化比较协调,没有葡萄糖代谢阻遏效应,没有出现细胞生长大于分裂现象,也没有抑制次级代谢产物的合成。
将野生菌ZSG进行诱变,得到一株稳定突变菌株ZSG7,在250 ml摇瓶和5 L发酵罐中发酵PG产量分别为0.104 g·L−1和0.1723 g·L−1,与出发菌株相比分别提高了62.5%和269%。突变菌株的最优发酵培养基是油酸 1.0%,蛋白胨 1.5%,KCl 0.25%,吐温-80 1.0%,NaCl 0.5%。培养基优化后PG摇瓶产量比优化前提高了100%。ZSG7发酵中最佳溶氧分段控制模式是第0~12 h DO为10%,第12~24 h DO为30%,第24 h以后DO为60%,其PG产量是0.2813 g·L−1,比DO调控前提高了30.9%。ZSG7发酵中最佳恒定pH是pH7,其PG产量是0.3822 g·L−1,比pH调控前提高了35.9%。在ZSG7发酵中补料0.5%油酸、0.5%蛋白胨和0.5%吐温-80后PG达到0.5643 g·L−1,比补料前提高了47.6%。
使用Logistic方程和Luedeking-Piret方程分别对在恒定pH7下的分批发酵和补料发酵的菌体生长和PG合成进行了动力学分析,用Origin 8.0软件拟合出了动力学模型参数,较好地表现了菌株 ZSG7恒定pH7分批发酵和补料分批发酵的动力学特征。
符 号 说 明
a,b——与菌体生长相关的产物合成常数
M5,M6, M7,M8,Mf——恒定pH5、6、7、8和不调pH时的PG最大产量,g·L−1
t——发酵时间, h
V5,V6,V7, V8,Vf——恒定pH5、6、7、8和不调pH时的菌体生长速度,g·L−1·h−1
ʋ5,ʋ6,ʋ7, ʋ8,ʋf——恒定pH5、6、7、8和不调pH时的PG生产速度,g·L−1·h−1
X——菌体干重, g·L−1
Xm——最大菌体干重, g·L−1
Xm1——补料前稳定期的最大菌体干重,g·L−1
X0——起始菌体干重, g·L−1
μm——最大比生长速率, h−1
下角标
m——最大
0——发酵起始
[1]MONTANER B, PREZ-TOMS R. The prodigiosins: a new family of anticancer drugs[J]. Current Cancer Drug Targets, 2003, 3(1): 57-65.
[2]ARAUJO A J, MARINHO F J, SOUSA T S, et al. Evidences for the involvement of HER on prodigiosin anticancer effects[J]. Planta Medica, 2012, 78(11): 78-92.
[3]KAVITHA R, AISWARIYA S, RATNAVALI M G. Anticancer activity of red pigment from Serratia marcescens in human cervix carcinoma[J]. International Journal of PharmTech Research, 2010, 2(1): 784.
[4]CHAWRAI S R, WILLIAMSON N R, MAHENDIRAN T, et al. Characterisation of Pig C and Hap C, the prodigiosin synthetases from Serratia sp. and Hahella chejuensis with potential for biocatalytic production of anticancer agents[J]. Chemical Science, 2012, 3:447-454.
[5]ALESSIO D R, BARGIOTTI A, CARLINI O, et al. Synthesis and immunosuppressive activity of novel prodigiosin derivatives[J]. Journal of Medicinal Chemistry, 2000, 43: 2557-2565.
[6]王玉洁, 孙诗清, 朱长俊, 等. 天然红色素灵菌红素的抗菌性能及应用[J]. 天然产物研究与开发, 2012, 24: 1626-1629, 1654. WANG Y J, SUN S Q, ZHU C J, et al. Antibacterial property and application of natural red pigment prodigiosin[J]. Natural Product Research and Development, 2012, 24: 1626-1629, 1654.
[7]NAKASHIMA T, KATO Y, YAMAGUCHI K. Evaluation of the anti-trichophyton activity of a prodigiosin analogue produced byγ-proteobacterium, using stratum corneum epidermis of the Yucatan micropig[J]. Journal of Infection and Chemotherapy, 2005, 11(3):123-128.
[8]ISAKA M, JATURAPAT A, KRAMYU J, et al. Potent in vitro antimalarial activity of metacycloprodigiosin isolated from Streptomyces spectabilis BCC 4785[J]. Antimicrobial Agents and Chemotherapy, 2002, 46(4): 1112-1113.
[9]GERBER N N. Prodigiosin-like pigments[J]. Critical Reviews in Microbiology, 1975, 3: 469-485.
[10]JEONG H, YIM J H, LEE C, et al. Genomic blueprint of Hahella chejuensis, a marine microbe producing an algicidal agent[J]. Nucleic Acids Research, 2005, 33(22): 7066-7073.
[11]ANA K, TATJANA I T, MILOS P, et al. Crude bacterial extracts of two new Streptomyces sp. isolates as bio-colorants for textile dyeing[J]. World Journal of Microbiology & Biotechnology, 2014, 30(8): 2231-2240.
[12]刘同军, 杨海龙, 唐华. 灵菌红素的研究进展[J]. 食品与药品, 2007, 9(8): 47-51. LIU T J, YANG H L, TANG H. Progress on prodigiosin[J]. Food and Drug, 2007, 9(8): 47-51.
[13]EL-BONDKLY A M, EL-GENDY M M, BASSYOUNI R H. Overproduction and biological activity of prodigiosin-like pigments from recombinant fusant of endophytic marine Streptomyces species [J]. Antonie Van Leeuwenhoek, 2012, 102(4): 719-734.
[14] GUTIÉRREZ-ROMÁN M I, HOLGUIN-MELÉNDEZ F, BELLO-MENDORA R, et al. Production of prodigiosin and chitinases by tropical Serratia marcescens strains with potential to control plant pathogens[J]. World Journal of Microbiology and Biotechnology, 2012, 28(1): 145-153.
[15] SAKATA T, YOSHIKAWA T, NISHITARUMIZU S. Algicidal activity and identification of an algicidal substance produced by marine Pseudomonas sp. C55a-2[J]. Fisheries Science, 2011, 77(3): 397-402.
[16]CUI Y H, TONG Q Y, WU S J. Kinetic model of pullulan batch fermentation[J]. Journal of Food Science and Biotechnology, 2009, 28(3): 361-365.
[17]张峻峰, 刘道亮, 赵占民, 等. 流式细胞术在微生物快速检测领域的研究进展[J]. 食品工程, 2010, (3): 19-22. ZHANG J F, LIU D L, ZHAO Z M, et al. Research development on flow cytometry in the rapid detection of microorganisms[J]. Food Engineering, 2010, (3): 19-22.
[18]朱雄伟, 翟莉莉, 张楠, 等. 产灵菌红素菌株的分离鉴定[J]. 湖北大学学报(自然科学版), 2012, 34(4): 384-386,393. ZHU X W, ZHAI L L, ZHANG N, et al. Separation and identification of prodigiosin-producing strain[J]. Journal of Hubei University (Natural Science), 2012, 34(4): 384-386,393.
[19]陈艳, 谌颉, 张佑红, 等. 灵菌红素分批发酵过程的溶氧和补料调控[J]. 化学与生物工程, 2015, (8): 56-59. CHEN Y, CHEN J, ZHANG Y H, et al. Regulation of DO and feeding in process of prodigiosin batch fermentation[J]. Chemistry & Bioengineering, 2015, (8): 56-59.
[20]戚以政, 汪叔雄. 生化反应动力学与反应器[M]. 北京: 化学工业出版社, 2007: 40. QI Y Z, WANG S X. The Biochemical Reaction Kinetics and Reactor[M]. Beijing: Chemical Industry Press, 2007: 40.
[21]LUEDEKING R, PIRET E L. A kinetic study of the lactic acid fermentation: batch process at controlled pH[J]. J. Biochem. Microbiol. Technol. Eng., 1959, 1(4): 393.
Carbon source analysis, mutagenesis and kinetics of Serratia marcescens producing prodigiosin
RONG Guangjian1, ZHANG Youhong2, CHEN Yan2, CHEN Jie2, HUANG Meng2, ZHOU Feng2
(1School of Chemistry Environmental Engineering, Wuhan Institute of Technology, Wuhan 430073, Hubei, China;2School of Chemical Engineering and Pharmacy, Wuhan Institute of Technology, Key Laboratory for Green Chemical Process of Ministry of Education, Wuhan 430073, Hubei, China)
The DNA contents, the internal grain densities, the surface roughness and the cell sizes of Serratia marcescens ZSG cells were detected to have different changes by the flow cytometry when ZSG cells were cultivated in the medium with the different carbon sources. Through mutagenizing compoundly ZSG cells, a stable mutant strain ZSG7 was gained, of which the prodigiosin (PG) production in the 250 ml conical flask and in 5 L fermentor were increased by 62.5% and 269% compared with the the original strain yields, respectively. PG production of fermentation with the optimal culture medium in the 250 ml conical flask was increased by 100% compared with the unoptimized. After dissolved oxygen (DO) was optimized by step controlling, the PG production was increased by 30.9% compared with the DO-unoptimized. After constant pH was optimized, the PG production was increased by 35.9% compared with the pH-unoptimized. After the fed-batch components were optimized, the PG production was increased by 47.6% compared with the batch fermentation with constant pH7. The kinetic models about bacteria growth and PG formation of the batch fermentation with constant pH7 and the fed-batch fermentation were built based on the Logistic equation and Luedeking-Piret equation. With the fittingmodel parameters, the models could provide reasonable description for the processes of the batch fermentation with constant pH7 and the fed-batch fermentation.
flow cytometry; carbon source; prodigiosin; kinetic modeling; mutagenesis; optimization; fermentation
Prof. ZHANG Youhong, youhong@aliyun.com
Q 815;TQ 920.6
:A
:0438—1157(2017)01—0244—12
10.11949/j.issn.0438-1157.20160505
2016-04-19收到初稿,2016-10-10收到修改稿。
联系人:张佑红。
:荣广健(1989—),男,硕士研究生。
湖北省科技厅省重点自然科学基金(2013CFA101)。
Received date: 2016-04-19.
Foundation item: supported by Hubei Key Natural Science Foundation, China (2013CFA101).

