基于甘草配伍黄芩同时泡沫分离甘草酸和黄芩苷
丁琳琳,王延吉,吴兆亮,邓菲,李瑞,刘伟
(河北工业大学化工学院,天津 300130)
基于甘草配伍黄芩同时泡沫分离甘草酸和黄芩苷
丁琳琳,王延吉,吴兆亮,邓菲,李瑞,刘伟
(河北工业大学化工学院,天津 300130)
为了同时分离甘草中有表面活性的甘草酸和黄芩中无表面活性的黄芩苷,开发了甘草配伍黄芩泡沫分离工艺。通过荧光光谱、紫外吸收光谱和红外吸收光谱分析表明,甘草酸与黄芩苷存在相互作用,并且甘草黄芩配伍强化了甘草酸和黄芩苷的提取。以甘草酸和黄芩苷的富集比和回收率为评价指标,当温度为40℃、气体体积流量为100 ml·min−1、甘草酸初始浓度为0.2 g·L−1、甘草黄芩质量比为3:1时,获得甘草酸的富集比和回收率分别为11.0和73.5%,黄芩苷的富集比和回收率分别为5.8和38.5%。通过甘草与黄芩配伍,利用泡沫分离获得黄芩中的黄芩苷。同时,与单独泡沫分离甘草中甘草酸相比,甘草酸的富集比提高了194.9%,回收率提高了23.3%。因此,甘草配伍黄芩能有效泡沫分离甘草酸和黄芩苷。
泡沫;分离;浸取;甘草酸;黄芩苷
引 言
泡沫分离是近年来备受关注的一种分离技术[1]。根据表面吸附原理,以气泡作为载体,泡沫分离在富集水溶液中低浓度表面活性物质方面呈现出明显优势[2-4]。由于其温和的操作条件有利于保持天然产物的生物活性,泡沫分离已被用于制药工程领域来获取中草药中的有效成分[5-6]。已有研究表明泡沫分离能够从单味药中将具有表面活性的有效成分高效浓缩,如人参皂苷[7]。焦萌[8]则以十二烷基磺酸钠作为捕获剂实现了银杏黄酮的泡沫分离。但基于中药配伍理论实现单味药中无表面活性有效成分的泡沫分离尚未见报道。
配伍理论在临床中的应用十分广泛,它是通过有选择性地将两味及以上药物配伍合用以达到临床用药目的[9]。配伍药物间发生的相互作用导致药物主要有效成分物理或化学的变化是配伍药物发挥临床作用的主要原因[10]。药物配伍导致的主要有效成分性质的变化将进一步影响到药物共煎液性质的变化,这为同时泡沫分离配伍药物中的主要有效成分提供了可能。甘草和黄芩在中药制剂中常作为配伍药物出现[11-12]。黄芩(Scutellaria baicalensis Georgi)的有效成分黄芩苷(baicalin)具有利尿、抗炎、抗菌消炎等药理作用[13-14],但无表面活性。而甘草(Glycyrrhiza uralensis)的 主 要 成 分 甘 草 酸(glycyrrhizic acid)是一种五环三萜类天然表面活性物质[15-17]。基于甘草与黄芩的配伍实现甘草酸和黄芩苷的泡沫分离可以避免外加捕获剂造成的二次污染。而且甘草和黄芩作为常用配伍药物,其泡沫分离产物同时含有两味药的主要有效成分,即甘草酸和黄芩苷,这将对其复方制剂的制备奠定基础。
本文基于中药配伍理论,在通过荧光光谱、紫外吸收光谱和红外吸收光谱分析发现甘草酸与黄芩苷之间存在相互作用的基础上,研究甘草黄芩共煎对甘草酸和黄芩苷提取的影响,并研究温度、气体体积流量、甘草酸初始浓度和甘草黄芩质量比对泡沫分离效果的影响,最后确定两种有效成分的泡沫分离工艺。本研究对于拓宽泡沫分离在制药工程领域的应用范围具有重要意义。
1 材料与方法
1.1 实验试剂
甘草和黄芩均购于北京同仁堂天津药店。甘草酸标准品和黄芩苷标准品均购于上海晶纯生化科技有限公司。本文所用其他实验试剂均购于天津康科德科技有限公司。
1.2 实验装置
实验装置如图1所示。全塔高850 mm,入口处内径36 mm,椭球部分出现在400~750 mm 处,中心处内径72 mm,由玻璃制成。塔底部安装有多孔聚乙烯膜气体分布器,孔径0.425 mm。压缩空气由鼓泡口引入,通过气体分布器分散成气泡。随着泡沫的上升,泡沫间隙的液体会由于泡沫排液重新回流至主体液中,泡沫自塔顶流出,收集于消泡器中。分离塔外部紧紧缠绕硅胶管,硅胶管与501型超级恒温器相连接以控制塔内温度。温度监测的温度计附在柱上。所有的泡沫分离实验是在批处理模式下进行。

图1 实验装置示意图Fig. 1 Schematic diagram of experimental process
1.3 实验仪器
GB11A型高效液相色谱仪,安捷伦科技有限公司;JYW-200B型自动界面张力仪,承德试验机责任有限公司;DFA100型泡沫分析仪,德国克吕士公司;LAMBDA 25型紫外分光光度计,美国铂金埃尔默仪器公司;Hitach F-4500型荧光分光光度计,日本日立公司;TNSOR 27型傅里叶红外光谱仪,德国布鲁克公司。
1.4 甘草酸和黄芩苷的含量测定
用甲醇分别配制浓度为0.63 g·L−1的黄芩苷标准品溶液,0.82 g·L−1的甘草酸标准品溶液,及甘草酸和黄芩苷浓度分别为0.60 g·L−1和0.79 g·L−1的混合标准品溶液。色谱条件:色谱柱为DiamonsilTMC18柱 (250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸溶液,梯度洗脱,0~10 min (10:90),10~15 min (28:72),15~40 min (30:70),40~50 min (40:60),50~60 min (50:50);检测波长为250 nm;流速为1.0 ml·min−1。
将甘草酸标准品、黄芩苷标准品、甘草单煎液和黄芩单煎液在上述检测条件下得到的谱图进行对比,结果表明甘草黄芩配伍并不影响对合煎液中甘草酸和黄芩苷浓度的测定。
1.5 荧光光谱的测定
荧光光谱测定在荧光分光光度计上进行,配有R3788光电倍增器、150 W氙灯、1 cm石英比色皿、恒温水浴装置和偏振器。激发和发射单色器通带宽度为 10.0 nm,扫描速度为 240 nm·min−1,仪器灵敏度设定为低。扫描波长在200~600 nm范围内,激发波长为325 nm。在比色管中分别加入一定量的黄芩苷标准品和甘草酸标准品,制备成含黄芩苷浓度为3.8 mg·L−1和甘草酸浓度为4.6 mg·L−1的混合水溶液,将比色管振荡并置于水浴中保持一定时间,迅速转移至石英池中进行荧光谱图的扫描。
1.6 紫外吸收光谱的测定
分别精密称取甘草酸标准品和黄芩苷标准品适量,用蒸馏水加温使其溶解,配制成甘草酸浓度为31.1 g·L−1和黄芩苷浓度为11.6 g·L−1的标准品溶液及浓度相同的混合标准品溶液。利用紫外光谱仪在200~410 nm波长范围扫描检测甘草酸和黄芩苷标准品溶液及甘草酸黄芩苷混合标准品溶液的紫外吸收光谱。
1.7 红外吸收光谱的测定
甘草酸标准品、黄芩苷标准品、甘草酸标准品与黄芩苷标准品的物理混合物 (甘草酸标准品与黄芩苷标准品按摩尔比1:1混合,研磨即得)及甘草酸标准品-黄芩苷标准品结合物 (采用 1.5节制备方法得到两者的混合溶液,冻干即得)的红外光谱测定分别采用KBr压片法在傅里叶红外光谱仪上进行,分辨率256,步长4 cm−1,扫描范围为4000~400 cm−1。
1.8 甘草黄芩共煎液表面张力和泡沫半衰期的测量
移取50 ml 甘草黄芩共煎液于样品槽中,在甘草酸浓度0.3 g·L−1和温度40℃的条件下,通过自动界面张力仪分别测定不同甘草黄芩质量比所得共煎液的表面张力。
本实验以泡沫半衰期表征泡沫的稳定性。在上述实验条件和气体体积流量100 ml·min−1条件下,移取50 ml上述甘草黄芩共煎液于样品槽中,调节鼓气时间为15 s,通过泡沫分析仪测定其泡沫半衰期。
1.9 泡沫分离效果的评价指标
泡沫分离效率由富集比(E)和回收率(R)两个参数进行评价,其定义如下

式中,V0和Vf分别表示原液和消泡液的体积,ml;C0和Cf分别表示原液和消泡液中甘草酸(或黄芩苷)的含量,g·L−1;E为甘草酸(或黄芩苷)的富集比;R为甘草酸(或黄芩苷)的回收率,%。
2 结果和讨论
2.1 甘草酸和黄芩苷的相互作用
2.1.1 荧光光谱分析 由图2可以看到,当激发黄芩苷时,在200~600 nm波长范围内出现两个荧光发射峰,峰位位于325 nm和475 nm处。随着甘草酸的加入,黄芩苷475 nm附近的荧光强度发生部分猝灭。甘草酸与部分黄芩苷发生了相互作用,生成了无荧光或弱荧光特性的结合物,致使黄芩苷结构中的荧光发色团发生变化,从而导致黄芩苷的发射峰强度随之改变。
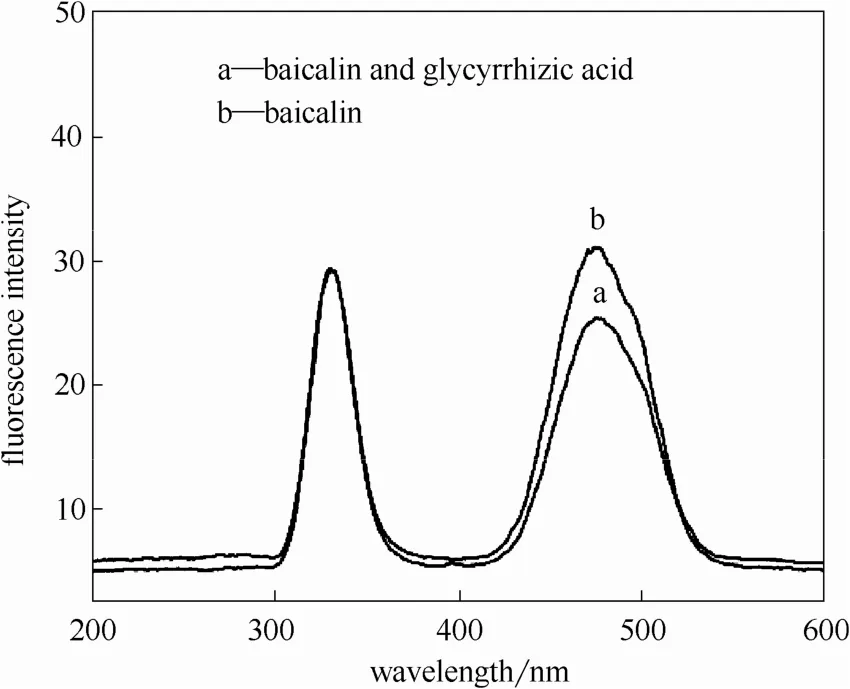
图2 甘草酸和黄芩苷的荧光光谱Fig. 2 Fluorescence emission spectra of glycyrrhizic acid and baicalin
2.1.2 紫外光谱分析 由图3可知,甘草酸标准品在256 nm处有最大吸收峰,黄芩苷标准品在276 nm和317 nm处有吸收峰,而两者混合溶液发生了蓝移,在268 nm和317 nm处有吸收峰,且吸收强度明显降低。甘草酸和黄芩苷溶液混合后,两者发生了相互作用,导致生色团的环境发生变化,从而导致其紫外吸收峰位置的移动和强度的改变。

图3 甘草酸、黄芩苷及其混合物的紫外吸收光谱Fig. 3 UV absorption spectra of glycyrrhizic acid, baicalin and mixture
2.1.3 红外光谱分析 由图4可知,甘草酸与黄芩苷物理混合物的红外谱图是甘草酸和黄芩苷主要吸收峰的叠加。而在甘草酸-黄芩苷结合物谱图中,主要由黄芩苷酚羟基产生的3492 cm−1和3398 cm−1处的特征吸收峰分别移动至 3488 cm−1和 3380 cm−1[18],特征吸收峰强度也明显减弱,主要由甘草酸糖苷羧基产生的1405 cm−1处的特征吸收峰强度有所增强[19]。这是由于黄芩苷C5、C6处的O—H键长更长[图 5(a)],具有更高的活性[18],更容易与甘草酸中的羟基[图 5(b)]形成氢键。因此,甘草酸与黄芩苷形成的结合物可以在泡沫分离过程中共吸附在气-液界面上,随气泡排出分离塔,进而实现两者的同时分离。

图4 甘草酸(a)、黄芩苷(b)、物理混合物(c)及甘草酸-黄芩苷结合物(d)的红外光谱图Fig. 4 FTIR spectra of glycyrrhizic acid (a), baicalin (b), physical mixtures (c) and complex (d)

图5 黄芩苷(a)和甘草酸(b)的化学结构式Fig. 5 Chemical structural formula of baicalin (a) and glycyrrhizic acid (b)
2.2 甘草黄芩合煎对甘草酸和黄芩苷提取的影响
分别称取甘草和黄芩各5 g,各加水200 ml,煎煮2 h,分别得甘草单煎液和黄芩单煎液。另取甘草和黄芩各5 g,加水200 ml,煎煮2 h,得甘草黄芩合煎液。在单煎和合煎过程中分别每20 min取一次样,测定甘草酸和黄芩苷的浓度,研究甘草黄芩合煎对甘草酸和黄芩苷提取的影响,结果如图6所示。

图6 甘草黄芩合煎对甘草酸和黄芩苷提取浓度的影响Fig. 6 Effects of combined decoction of Glycyrrhiza and Scutellaria on concentrations of glycyrrhizic acid and baicalin
由图6可知,甘草黄芩合煎提取液中甘草酸的浓度较甘草单煎提高了7.31%,而黄芩苷的浓度较黄芩单煎提高了74.2%。这是由于甘草与黄芩配伍后,提取液中甘草酸与黄芩苷发生相互作用,提取液的释放平衡向着有利于甘草酸和黄芩苷释放的方向进行。此外,甘草酸作为一种天然的表面活性物质还具有增溶作用[20],最终导致合煎液中黄芩苷浓度的提高较甘草酸更为显著。
2.3 温度对泡沫分离效果的影响
温度是影响泡沫分离效果的重要因素[21]。在气体体积流量100 ml·min−1、甘草黄芩质量比3:1、甘草酸的初始浓度 0.3 g·L−1条件下,研究温度(30~50℃)对泡沫分离效果的影响,结果如图 7所示。

图7 温度对甘草酸和黄芩苷富集比和回收率的影响Fig. 7 Effects of temperature on E and R of glycyrrhizic acid and baicalin
由图7可知,随着温度的升高,甘草酸和黄芩苷的富集比均呈现上升趋势,而回收率则呈下降趋势。随着温度由30℃升高到50℃,黄芩苷的回收率从47.1%减小到35.4%,下降了24.7%,甘草酸的回收率从87.9%减小到67.5%,下降了23.2%;而黄芩苷的富集比从2.1增加到9.7,提高了371.2%,甘草酸的富集比从3.7增加到18.4,提高了397.3%。当温度较低时,泡沫相气泡间隙液黏度高且流动性差,造成排液阻力大,使得泡沫持液量增加,从而获得高的回收率,但富集比低。随着温度的升高,分子热运动加剧,为对抗分子间的吸引力提供了能量,导致溶液黏度降低,改善了间隙液的流动性[22],从而有利于泡沫排液和气泡聚并[23],使得持液量减小,富集比增加[24]。此外,激烈的分子热运动削弱了分子间的相互作用[25],使得甘草酸与黄芩苷之间的结合作用减弱,通过结合作用吸附在气液界面上的黄芩苷的量减少,从而导致黄芩苷富集比随温度的增加幅度较甘草酸小。并且泡沫排液的强化和泡沫持液量的减少,使得消泡液体积减少,从而导致两者的回收率均随温度的升高而降低[26]。综合考虑温度对甘草酸、黄芩苷的富集比和回收率的影响,40℃为适宜的操作温度。
2.4 气体体积流量对泡沫分离效果的影响
气体体积流量会显著影响泡沫分离过程中的界面吸附和泡沫排液[27-28]。研究不同气体体积流量(50~250 ml·min−1)对泡沫分离效果的影响,在温度40℃、甘草黄芩质量比3:1、甘草酸的初始浓度0.3 g·L−1条件下进行,结果如图8所示。
由图8可知,随着气体体积流量的升高,甘草酸和黄芩苷的富集比均呈下降趋势,而回收率呈上升趋势。当气体体积流量由50 ml·min−1升高到250 ml·min−1时,黄芩苷的回收率从 32.0%增加到61.1%,提高了91.2%,甘草酸的回收率从65.7%增加到93.1%,提高了 41.8%;而黄芩苷的富集比从8.0减小到1.7,下降了78.3%,甘草酸的富集比从16.4 减小到 2.6,下降了 84.1%。当气体体积流量较低时,塔内泡沫上升速度慢,气泡在泡沫相中停留的时间变长[29],泡沫排液得到强化,塔顶处泡沫持液量小,富集比高[30]。随着气体体积流量的增加,气泡在泡沫相中的停留时间变短,间隙液在重力作用下向下的排液速度也变慢,导致泡沫的持液量增加[31],但是增大的气体体积流量会产生更多的气泡,消泡液的体积也随之增加,因此富集比降低,而回收率增加。综合考虑气体体积流量对甘草酸、黄芩苷的富集比和回收率的影响,选择 100 ml·min−1为适宜的气体体积流量。
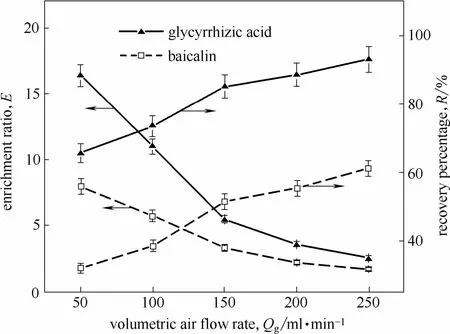
图8 气体体积流量对甘草酸和黄芩苷富集比和回收率的影响Fig. 8 Effects of volumetric air flow rate on E and R of glycyrrhizic acid and baicalin
2.5 甘草黄芩质量比对泡沫分离效果的影响
在温度40℃、气体体积流量100 ml·min−1、甘草酸的初始浓度0.3 g·L−1条件下,研究不同甘草黄芩质量比(6:1、3:1、1:1、1:3和1:6)对泡沫分离效果的影响,如图9所示。
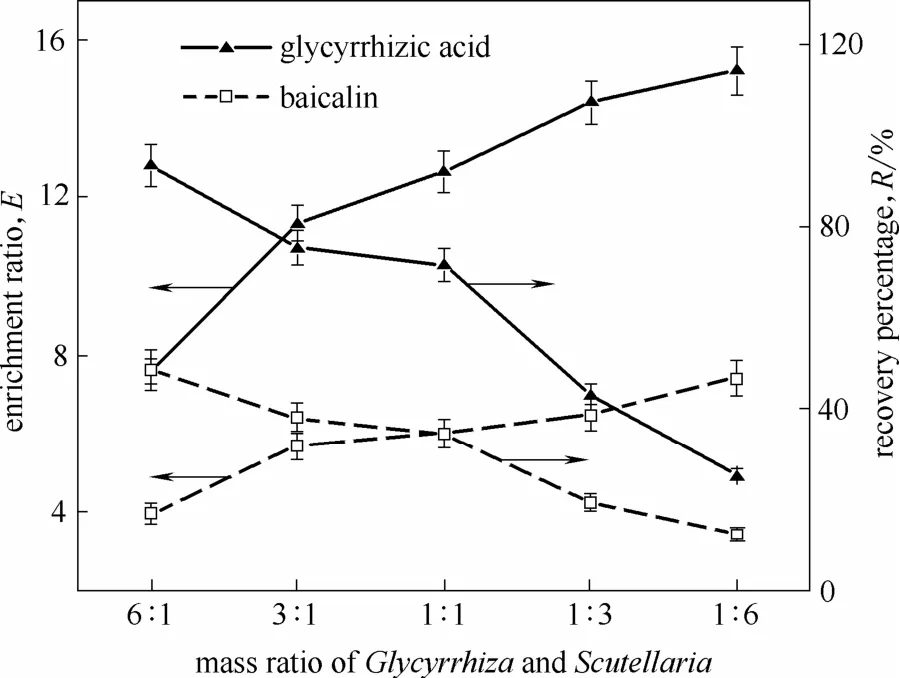
图9 甘草黄芩质量比对甘草酸和黄芩苷富集比和回收率的影响Fig. 9 Effects of mass ratio of Glycyrrhiza and Scutellaria on E and R of glycyrrhizic acid and baicalin
由图9可知,随着由草黄芩质量比的降低,甘草酸和黄芩苷的富集比均呈上升趋势,而回收率呈下降趋势。当甘草黄芩质量比由 6:1变化到1:6 时,黄芩苷的回收率从48.6% 降低到12.3%,下降了 74.7%,甘草酸的回收率从 93.4%增加到25.3%,提高了 72.9%;而黄芩苷的富集比从 3.9增加到7.4,提高了87.6%,甘草酸的富集比从7.6增加到15.2,提高了100%。在甘草酸初始浓度固定的情况下,甘草黄芩质量比降低,原料液中黄芩苷的浓度随之增加。甘草酸与黄芩苷结合,甘草酸的表面活性基团被络合或掩蔽,影响了具有表面活性的甘草酸的亲水性及泡沫性能,使得原料液的表面张力降低,泡沫稳定性也降低(图10),从而加剧了气泡的聚并,泡沫持液量减少,富集比升高,回收率降低。综合考虑甘草黄芩质量的配比对甘草酸、黄芩苷的富集比和回收率的影响,甘草黄芩质量的适宜配比为 3:1,并且这一配比在临床药物应用配伍范围内[32],可以为其复方制剂的制备提供依据。
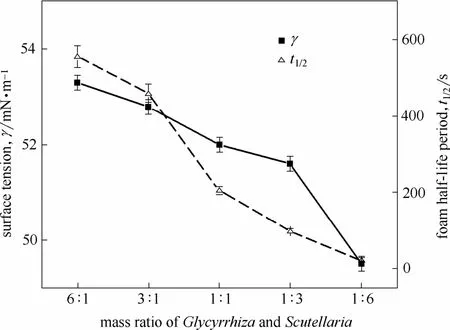
图10 甘草黄芩质量比对表面张力和半衰期的影响Fig. 10 Effects of mass ratio of Glycyrrhiza and Scutellaria on γ and t1/2
2.6 甘草酸初始浓度对泡沫分离效果的影响
原料液浓度是影响泡沫分离性能的重要参数[33]。在温度40℃、气体体积流量100 ml·min−1、甘草黄芩质量比3:1条件下,研究不同甘草酸初始浓度(0.1~0.5 g·L−1)对泡沫分离效果的影响,结果如图11所示。
由图11可知,随着甘草酸初始浓度的升高,甘草酸和黄芩苷的富集比均呈下降趋势,而回收率呈上升趋势。当甘草酸初始浓度由0.1 g·L−1升高到0.5 g·L−1时,黄芩苷的回收率从 25.3% 增加到49.7%,升高了96.4%,甘草酸的回收率从55.8%增加到89.4%,升高了60.2%;而黄芩苷的富集比从6.9减小到4.1,降低了40.6%,甘草酸的富集比从15.2减小到7.4,降低了51.3%。在固定甘草黄芩质量比的情况下,甘草酸初始浓度的增加,意味着提取液中甘草酸的相对浓度变大,未能与黄芩苷形成结合物的游离甘草酸增多,吸附在气液界面上的甘草酸浓度随之增加,泡沫稳定性增加[4],从而不利于泡沫相排液,泡沫持液量随之增加,从而导致回收率升高,富集比降低[34]。综合考虑甘草酸初始浓度对甘草酸、黄芩苷的富集比和回收率的影响,甘草酸的初始适宜浓度为 0.2 g·L−1。

图11 甘草酸初始浓度对甘草酸和黄芩苷富集比和回收率的影响Fig. 11 Effects of initial concentration of glycyrrhizic acid on E and R of glycyrrhizic acid and baicalin
3 结 论
(1)基于甘草酸和黄芩苷之间存在的相互作用,以有表面活性的甘草酸为捕获剂,实现了甘草配伍黄芩泡沫分离有表面活性的甘草酸和无表面活性的黄芩苷。
(2)相较甘草、黄芩各自单煎,甘草配伍黄芩将甘草酸和黄芩苷在浸提液中的浓度分别提高了7.31%和74.2%。
(3)在甘草酸初始浓度 0.2 g·L−1,甘草黄芩质量比3:1,温度40℃,气体体积流量100 ml·mim−1条件下,甘草酸的富集比和回收率分别为 11.0和73.5%,黄芩苷的富集比和回收率分别为 5.8和38.5%。而在相同实验条件下,单独泡沫分离黄芩无法获得黄芩苷,单独泡沫分离甘草中甘草酸的富集比和回收率分别为3.73和59.6%。由此可见,甘草配伍黄芩能有效泡沫分离甘草酸和黄芩苷,拓宽了泡沫分离在分离中药有效成分中的应用。
[1]LINKE D, ZORM H, GERKEN B, et al. Laccase isolation by foam fractionation-new prospects of an old process[J]. Enzyme and Microbial Technology, 2007, 40(2): 273-277.
[2]BOONYASUWAT S, CHAVADEJ S, MALAKUL P, et al. Anionic and cationic surfactant recovery from water using a multistage foam fractionator[J]. Chemical Engineering Journal, 2003, 93(3): 241-252.
[3]SARACHAT T, PORNSUNTHORNTAWEE O, CHAVADEJ S, et al. Purification and concentration of a rhamnolipid biosurfactant produced by Pseudomonas aeruginosa SP4 using foam fractionation[J]. Bioresource Technology, 2010, 101(1): 324-330.
[4]HU N, LI R, WU Z L, et al. Intensification of the separation of CuO nanoparticles from their highly diluted suspension using a form flotation column with S type internal[J]. Journal of Nanoparticle Research, 2015, 17(10): 1-11.
[5]XIAO Z Y, LI X R, SHAO W Y, et al. Purification and concentration of the total saikosaponins extracted from Radix Bupleuri using foam fractionation[J]. Separation Science and Technology, 2014, 49(3): 469-475.
[6]LIU W, ZHANG H X, WU Z L, et al. Recovery of isoflavone aglycones from soy whey wastewater using foam fractionation and acidic hydrolysis[J]. Journal of Agricultural and Food Chemistry, 2013, 61(30): 7366-7372.
[7]MA J G, XIU Z L, ZHANG D J, et al. Concentration and separation of glycyrrhizic acid by foam separation[J]. Journal of Chemical and Biotechnology, 2002, 77(6): 720-724.
[8]焦萌. 表面活性剂协助泡沫分离富集银杏黄酮及纯化的工艺研究[D]. 天津: 河北工业大学, 2015. JIAO M. Study on enrichment and purification of Ginkgo flavonoids by surfactant-assisted foam fractionation[D]. Tianjin: Hebei University of Technology, 2015.
[9]郭浩, 黎巍威, 王小莹, 等. 方剂配伍减毒的现代研究进展[J]. 中国中药杂志, 2012, 37(1): 120-123. GUO H, LI W W, WANG X Y, et al. Advance of research on toxic attenuation by compatability of traditional Chinese medicine presciptions[J]. China Journal of Chinese Meterria Media, 2012, 37(1): 120-123.
[10]陈广, 陆付耳, 李伶俐, 等. 肉桂与黄连不同配伍比例对交泰丸中小檗碱含量的影响[J]. 医药导报, 2013, 32(3): 353-355. CHEN G, LU F E, LI L L, et al. Effects of Cinnamon and Coptis in different compatibility proportion on content of berberine in Jiaotai Bolus[J]. Herald of Medicine, 2013, 32(3): 353-355.
[11]戴开金, 罗佳波, 吴昭晖, 等. 配伍对葛根芩连汤中甘草酸含量的影响[J]. 中草药, 2003, 34(12): 1084-1087. DAI K J, LUO J B, WU Z H, et al. Influence of compatibility on glycyrrhizinic acid in Gegen Qinlian Decoction[J]. Chinese Traditional and Herbal Drugs, 2003, 34(12): 1084-1087.
[12]庞婷, 麦蓝尹, 陈勇, 等. 中药药对配伍的化学成分变化研究进展[J]. 中药材, 2015, 38(11): 2429-2434. PANG T, MAI L Y, CHEN Y, et al. Research progress on chemical compasition changes of traditional Chinese medicine[J]. Chinese Traditional and Herbal Drugs, 2015, 38(11): 2429-2434.
[13]施高翔, 邵菁, 汪天明, 等. 黄芩及其有效成分抗菌作用新进展[J]. 中国中药杂志, 2014, 39(19): 3713-3718. SHI G X, SHAO J, WANG T M, et al. New advance in studies onantimicrobal activity of Scutellaria baicalensis and its effective ingredients[J]. China Journal of Chinese Meterria Media, 2014, 39(19): 3713-3718.
[14]CHANG W H, CHEN C H, LU F J. Different effects of baicalein, baicalin and wogonin on mitochondrial function, glutathione content and cell cycle progression in human hepatoma cell lines[J]. Planta Medica, 2002, 68(2): 128-132.
[15]MA J G, XIU Z L, ZHANG D J, et al. Concentration and separation of glycyrrhizic acid by foam separation [J]. Journal of Chemical Technology and Biotechnology, 2002, 77(6): 720-724.
[16]兰洁, 杨明, 韩丽, 等. 泡沫分离法与常规方法制备甘草酸粗品的比较[J]. 华西药学杂志, 2007, 22(1): 25-27. LAN J, YANG M, HAN L, et al. Comparison between foam fractionation and conventional processing crafts for glycyrrhizic acid inclusion compound [J]. West China Journal of Pharmaceutical Sciences, 2002, 22(1): 25-27.
[17]苏艳桃, 韩丽, 马鸿雁, 等. 间歇式泡沫分离提取甘草中甘草酸的工艺研究[J]. 中草药, 2007, 38(3): 365-368. SU Y T, HAN L, MA H Y, et al. Separation of glycyrrhizic acid by intermittence foam fractionation[J]. Chinese Traditional and Herbal Drugs, 2007, 38(3): 365-368.
[18]刘小宁. 黄芩中黄酮类化合物清除自由基机理的密度泛函理论计算[D]. 新乡: 河南师范大学, 2012. LIU X N. Density functional theory calculation on Scutellaria baicalensis Georgi's flavonoids eliminating free radicals[D]. Xinxiang: Henan Normal University, 2012.
[19]邓江. 含小檗碱的中药与甘草煎煮过程中的化学变化——小檗碱与甘草酸的沉淀反应机理研究[D]. 长沙: 湖南中医药大学, 2007. DENG J. The chemical changes in the decoction process of Traditional Chinese Medicine containing berberine and liquorice—study on the precipitation reaction mechanism of berberine and glycyrrhizic acid[D]. Changsha: Hunan University of Chinese Medicine, 2007.
[20]孟翔宇, 皮子凤, 宋凤瑞, 等. 麻黄-甘草药对配伍前后主要药效成分及抗炎活性的变化[J]. 应用化学, 2009, 26(7): 801-806. MENG X Y, PI Z F, SONG F R, et al. Changes in the effective compounds and the antiinflammatory activity before and after the decoction of Ephedra and Liquorite[J]. Chinese Journal of Applied Chemistry, 2009, 26(7): 801-806.
[21]张艳霞, 吴兆亮, 武增江, 等. 温度对高浓度SDS水溶液泡沫稳定性及分离的影响[J]. 高校化学工程学报, 2012, 26(3): 536-540. ZHANG Y X, WU Z L, WU Z J, et al. Effects of temperature on foam stability and separation efficiencies of foam formed by high concentration SDS aqueous solution during foam separation[J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(3): 536-540.
[22]任文辉, 林智群, 彭道林. 液体表面张力系数与温度和浓度的关系[J]. 湖南农业大学学报, 2004, 30(1): 77-79. REN W H, LIN Z Q, PENG D L. On the relationship between the liquid surface tension and the temperature and the concentration[J]. Journal of Hunan Agricultural Univercity (Natural Science), 2004, 30(1): 77-79.
[23]BEHKISH A, LEMOINE R. Gas holdup and bubble size behavior in a large-scale slurry bubble column reactor operating with an organic liquid under elevated pressures and temperatures[J]. Chemicl Engineering Journal, 2007, 128(2/3): 69-84.
[24]URAIZEE F, NARSIMHAN G. Effect of coalescence on the performance of continuous foam fractionation column[J]. Separation Science and Technology, 1992, 27(7): 937-953.
[25]LIU W, WU Z L, WANG Y J, et al. Rhamnolipid assisted recovery of lycopene from the tomato-based processing wastewater using foam fractionation[J]. Journal of Food Engineering, 2015, 164: 63-69.
[26]LIU W, WU Z L, WANG Y J, et al. Isolation of soy whey proteins from isoflavones in the concentrated solution using foam fractionation[J]. Separation Science and Technology, 2015, 149: 31-37.
[27]BOONYASUWAT S, CHAVADEJ S, MALAKUL P, et al. Surfactant recovery from water using a multistage foam fractionator(Ⅰ): Effects of air flow rate, foam height, feed flow rate and number of stages[J]. Separation Science and Technology, 2005, 40(9): 1835-1853.
[28]周生鹏, 唐奕, 廖学品, 等. 胶原多肽基表面活性剂对染料废水的泡沫分离性能[J]. 化工学报, 2015, 66(11): 4493-4500. ZHOU S P, TANG Y, LIAO X P, et al. Foam separation behaviors of collagen-peptide based surfactant for treatment of fye wastewater[J]. CIESC Journal, 2015, 66(11): 4493-4500.
[29]CROFCHECK C, GILLETTE K. Evaluation of foam fractionation column scale-up for recovering bovine serum albumin[J]. Transactions of the ASABE, 2003, 46(6): 1759-1764.
[30]HOSSAIN M, FENTON G. Concentration of proteins from single component solution using a semibatch foam process [J]. Separation Science and Technology, 1998, 33(16): 26-23.
[31]PILON L, RVISKANTA R. Minimun superficial air flow rate for onset of foaming[J]. Chemical Engineering and Processing: Process Intensification, 2004, 43(2): 149-160.
[32]郭理想. 张仲景运用黄芩的规律研究[D]. 北京: 北京中医药大学, 2012. GUO L X. Study on the law of application of Scutellaria by Zhang Zhongjing[D]. Beijing: Beijing University of Chinese Medicine, 2012.
[33]寇倩云, 吴兆亮, 胡楠. 牛血清白蛋白和溶菌酶混合溶液的泡沫性能与其浓度的关系[J]. 化工学报, 2015, 66(10): 4107-4114. KOU Q Y, WU Z L, HU N. Relationship between foam properties and protein concentration in aqueous solution of bovine serum albumin and lysozyme[J]. CIESC Journal, 2015, 66(10): 4107-4114.
[34]YANG Q W, WU Z L, ZHAO Y L, et al. Enhancing foam drainage using foam fractionation column with spiral internal for separation of sodium dodecyl sulfate[J]. Journal of Hazardous Materials, 2011, 192(3): 1900-1904.
Simultaneous separation of glycyrrhizic acid and baicalin by mixing Glycyrrhiza with Scutellaria using foam fractionation
DING Linlin, WANG Yanji, WU Zhaoliang, DENG Fei, LI Rui, LIU Wei
(School of Chemical Engineering, Hebei University of Technology, Tianjin 300130, China)
For simultaneous separating glycyrrhizic acid with surface activity from Glycyrrhiza and baicalin without surface activity from Scutellaria simultaneously, a novel technology for foam fractionation of the leaching liquor of Glycyrrhiza and Scutellaria was developed. The fluorescence emission spectra, UV absorption spectra and FTIR spectra showed that there was complexing action between glycyrrhizic acid and baicalin. The compatibility of Glycyrrhiza and Scutellaria enhanced the extraction of glycyrrhizic acid and baicalin, accomplished the separation of baicalin by foam fractionation, and improved the foam fractionation performances of glycyrrhizic acid. Using enrichment ratio and recovery percentage as the evaluation indexes, the effects of temperature, volumetric air flow rate, the initial concentration of glycyrrhizic acid and the mass ratio of Glycyrrhiza and Scutellaria on the foam fractionation performances were investigated. The results showed that the enrichment ratio and the recovery percentage of glycyrrhizic acid reached 11.0 and 73.5% with the enrichment ratio and the recovery percentage of baicalin reached 5.8 and 38.5%, respectively, under the conditions of temperature 40℃, volumetric air flow rate 100 ml·min−1, the initial concentration of glycyrrhizic acid 0.2 g·L−1and the mass ratio of Glycyrrhiza and Scutellaria 3:1. In this work, baicalin was separated by foam fractionation for the first time. Compared to the technology of foam fractionation of the leaching liquor from Glycyrrhiza, thenovel one increased the enrichment ratio and the recovery percentage by 194.9% and 23.3%, respectively. Therefore, the addition of Scutellaria effectively improved the foam fractionation performances of glycyrrhizic acid and baicalin.
foam; separation; leaching; glycyrrhizic acid; baicalin
Prof. WANG Yanji, yjwang@hebut.edu.cn; Prof. WU Zhaoliang, zhaoliangwu_hebut@163.com
TQ 028.8; R 284.2
:A
:0438—1157(2017)01—0170—08
10.11949/j.issn.0438-1157.20160920
2016-07-04收到初稿,2016-09-28收到修改稿。
联系人:王延吉,吴兆亮。
:丁琳琳(1983—),女,博士研究生。
国家自然科学基金项目(21346008);河北省重点基础研究项目(16964002D)。
Received date: 2016-07-04.
Foundation item: supported by the National Natural Science Foundation of China (21346008) and the Key Basic Research Project of Hebei Province (16964002D).

