桔梗皂苷D防御口腔黏膜上皮细胞感染白色念珠菌的作用
朱立芬, 王 冰
(重庆市中医院口腔科,重庆 400010)
桔梗皂苷D防御口腔黏膜上皮细胞感染白色念珠菌的作用
朱立芬, 王 冰△
(重庆市中医院口腔科,重庆 400010)
目的: 探讨桔梗皂苷D对白色念珠菌黏附口腔黏膜上皮细胞的影响。方法: MTT法检测不同桔梗皂苷D对口腔上皮KB细胞存活率的影响;将白色念珠菌、KB细胞以及不同浓度的桔梗皂苷D共同培养,革兰染色检测白色念珠菌黏附数,台盼蓝排斥实验检测念珠菌活力和菌丝转换率;ELISA法检测上清液中IL-18与人β-防御素2 (HBD-2)的蛋白含量;实时荧光定量PCR和Western blot法分别检测KB细胞中HBD-2 mRNA与蛋白表达的变化。结果: 桔梗皂苷D对KB细胞存活率无影响;随着桔梗皂苷D浓度的增加,白色念珠菌的黏附数、菌活力和菌丝转换率逐渐下降,上清液中IL-18与HBD-2的蛋白含量以及KB细胞中HBD-2 mRNA表达与蛋白水平逐渐降低。结论: 桔梗皂苷D具有抑菌作用,并参与了口腔黏膜上皮细胞防御白色念珠菌感染的免疫反应。
桔梗皂苷D; 口腔上皮细胞; 白色念珠菌
口腔念珠菌病是由于念珠菌属感染所引起的口腔黏膜疾病。白色念珠菌(Candidaalbicans)是一种寄生在正常人群口腔、呼吸道、消化道以及生殖道等部分的机会性致病真菌。张程等[1]对118例口腔念珠菌进行病理研究,发现白色念珠菌感染占73.7%。由于广谱抗生素的广泛应用,导致许多患者的免疫力下降,破坏正常菌群平衡,使口腔中白色念珠菌的感染率明显上升[2]。
桔梗皂苷D(platycodin D,PD)是从中药桔梗提取分离的一种三萜单体,作为桔梗的主要有效成分之一,具有降血糖血脂、抗炎、抗肿瘤及免疫调节等多种药理作用[3-4]。付凯等[5]对桔梗皂苷元进行抑菌研究,发现其对大肠杆菌、金黄色葡萄球菌、绿脓假单胞菌和鼠伤寒沙门氏菌均有一定的抑制作用,其中对大肠杆菌及金黄色葡萄球菌的抑制作用较强,但并未对白色念珠菌进行相关的研究。
本实验通过体外观察不同浓度桔梗皂苷D对白色念珠菌黏附KB细胞的情况,为桔梗皂苷D临床上用于治疗口腔黏膜白色念珠菌感染提供实验依据。
材 料 和 方 法
1 实验材料与试剂
KB细胞为永生化的口腔上皮细胞株,来源于口咽癌上皮细胞,是目前国际通用的口腔上皮细胞模型,购自中国医学科学院天津血液病研究所;白色念珠菌(ATCC®10231TM)购自南京便诊生物科技有限公司;沙氏培养基购自北京陆桥技术有限公司;桔梗皂苷D购自上海源叶生物科技有限公司;RPMI-1640培养液和胎牛血清购自Solarbio;台盼蓝购自Sigma;抗人β-防御素2 (human β-defensin 2, HBD-2)及GAPDH抗体购自Santa Cruz。
2 方法
2.1 白色念珠菌菌悬液的制备 将白色念珠菌(ATCC®10231TM)菌株接种于沙氏液体培养基,37 ℃摇床培养48 h,150 r/min,当白色念珠菌生长至对数期,3 000 r/min离心15 min,溶于无血清的RPMI-1640培养液,调整菌悬液浓度为1×109/L备用,台盼蓝排斥实验证明活菌数大于95%。
2.2 KB细胞的培养 将KB细胞置于5% CO2培养箱,37 ℃培养24 h,当细胞长满瓶底约90%时,换新鲜培养液。取处于对数生长期的细胞,加入0.25%胰酶消化,重悬计数,调整细胞密度至5×109/L,加入含10%胎牛血清的培养液,制成细胞悬液,调整浓度为5×108/L备用。
2.3 MTT法检测桔梗皂苷对KB细胞存活率的影响 将浓度为5×108/L的KB细胞置于96孔培养板,加入桔梗皂苷D使其在培养液中最终浓度为:0、10、20、40、80、160和500 mg/L(其中以0 mg/L作为正常对照组),置于37 ℃、5 % CO2培养箱中培养24 h,加入MTT溶液继续培养4 h,弃去培养液,每孔加入二甲基亚砜150 μL终止反应,在波长570 nm处测定吸光度(A)值,每浓度设3个复孔,设空白对照组。计算各浓度对KB细胞的存活率,存活率(%)=实验组平均A值/对照组平均A值×100%。
2.4 白色念珠菌的黏附与活力的测定 将上述KB细胞接种于培养皿中,置于5% CO2培养箱,37 ℃培养,待细胞铺满皿底约80%,加入浓度为1×109/L的白色念珠菌悬液4 mL,分别加入桔梗皂苷D溶液0、5、10、20 μmol/L,共同培养,并于24 h后取出盖玻片,PBS洗涤,于无水乙醇中固定15 min,革兰氏染色,倒置在显微镜下观察,计算黏附在KB细胞的白色念珠菌数。台盼蓝排斥实验检测念珠菌活力和菌丝转换率。
2.5 ELISA法检测细胞培养上清液中IL-18与HBD-2的蛋白含量 取培养至对数生长期的KB细胞,制成细胞悬液,培养,使细胞贴壁,细胞形成单层后吸取培养液。实验分为KB细胞对照(control,Con)组,加入1×109/L孢子相白色念珠菌及浓度为0、5、10、20 μmol/L的桔梗皂苷D溶液组,加入1×109/L菌丝相白色念珠菌及浓度为0、5、10、20 μmol/L的桔梗皂苷D溶液组。继续培养12 h,取上清液,按照ELISA试剂盒说明书操作,于492 nm处测吸光值,计算IL-18与HBD-2的相应蛋白含量。
2.6 荧光定量PCR测定KB细胞中HBD-2的mRNA表达 采用TRIzol法提取各组总RNA,逆转录合成cDNA,于实时荧光定量PCR仪上进行扩增,HBD-2的上游引物为5’-CCAGCCATCAGCCATGAGGGT-3’,下游引物为5’-GGAGCCCTTTCTGAATCC GACA-3’;β-actin的上游引物为5’-AGCGAGCATCCCCCAAAGTT-3’,下游引物为5’-GGGCACGAAGGCTCATCATT-3’;反应条件为:95 ℃ 15 s,60 ℃ 60 s,63 ℃ 5 min,40个循环。PCR扩增完成后,标准曲线和扩增曲线由PCR仪器自动生成,所得结果直接在荧光定量操作系统中进行比较分析,目标基因的相对定量用2-ΔΔCt计算。
2.7 Western blot实验 收集各组细胞,加入裂解液,收集蛋白并定量,上样,进行SDS-PAGE电泳,电泳结束后,转移至PVDF膜,加入含5%脱脂奶粉的TBST溶液,室温放置1 h,加入相应 I 抗,4 ℃孵育过夜,再加入相应 II 抗,室温孵育1 h,ECL显色,成像扫描分析系统测定蛋白条带的积分吸光度。
3 统计学处理
采用SPSS 15.0统计软件对所有实验数据进行分析,实验数据以均数±标准差(mean±SD)表示,多组间数据采用单因素方差分析,各组均数间两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 显微镜观察白色念珠菌与KB细胞黏附
显微镜下观察可见正常KB细胞呈现扁平多角形,排列紧密,呈“铺路石”状;KB细胞感染白色念珠菌后,菌丝形态的白色念珠菌占绝大部分;加入桔梗皂苷D共同培养后,随着桔梗皂苷D浓度的增加,菌丝状态的白色念珠菌的数量逐渐减少,见图1。

Figure 1. The effect of platycodin D on the adhesion ofCandidaalbicanswith KB cells (×200). A: normal KB cells; B: the KB cells adhered byCandidaalbicans; C: the KB cells adhered byCandidaalbicansafter treated with 20 μmol/L platycodin D.
图1 桔梗皂苷D对白色念珠菌黏附KB细胞的影响
2 桔梗皂苷D对KB细胞存活率的影响
MTT实验结果显示,随着桔梗皂苷D浓度的增加,KB细胞的存活率没有显著变化,但当桔梗皂苷D到达500 mg/L时,KB细胞的存活率略微下降,但并不具有统计学显著性,见图2。
3 白色念珠菌黏附数、菌活力、菌丝转换率与桔梗皂苷D浓度的关系
如表1所示,在24 h之后,随着桔梗皂苷D浓度的增加,细菌黏附数和菌活力均降低;菌丝转换率由(91.54±2.71)%降低至(52.41±3.16)%,差异具有统计学意义(P<0.05)。

Figure 2. The effect of platycodin D (PD) on the viability of KB cells. Mean±SD.n=6.
图2 桔梗皂苷D对KB细胞存活率的影响
表1 白色念珠菌黏附数、菌活力、菌丝转换率与桔梗皂苷D浓度的关系
Table 1. The relationship of platycodin D (PD) concentration with adherent numbers, bacterial activity and conversion ofCandidaalbicans(Mean±SD.n=6)

ConcentrationofPDAdherentnumberBacterialactivity(%)Conversionrate(%)0μmol/L225±1299.25±0.4291.54±2.715μmol/L202±8∗88.24±0.38∗75.63±3.49∗10μmol/L161±9∗82.05±0.58∗63.98±3.41∗20μmol/L122±6∗68.36±1.36∗52.41±3.16∗
*P<0.05vs0 μmol/L group.
4 KB细胞中IL-18与HBD-2蛋白含量的变化
未加桔梗皂苷D培养的KB细胞感染白色念珠菌后,培养上清液中IL-18与HBD-2蛋白含量显著高于对照组(P<0.05),随着加入桔梗皂苷D的浓度逐渐升高,孢子相与菌丝相组的IL-18与HBD-2蛋白含量逐渐降低,见图3、4。我们用Western blot法进一步检测KB细胞中HBD-2蛋白表达的变化,结果显示KB细胞自身的HBD-2 蛋白表达量少,当白色念珠菌黏附KB细胞后,HBD-2蛋白表达量显著上升(P<0.05),加入桔梗皂苷D干预后,孢子相组与菌丝相组的KB细胞HBD-2蛋白表达均随桔梗皂苷D浓度增加而减少(P<0.05),见图5。
5 KB细胞中HBD-2的mRNA表达
KB细胞自身HBD-2的mRNA表达量少,当白色念珠菌黏附KB细胞后,HBD-2的mRNA表达量迅速上升(P<0.05),加入桔梗皂苷D干预后,孢子相组与菌丝相组的KB细胞HBD-2的mRNA表达均随桔梗皂苷D浓度增加而减少(P<0.05),见图6。

Figure 3. The content of IL-18 in the culture supernatants of KB cells. Mean±SD.n=6.*P<0.05vscontrol (Con) group;#P<0.05vs0 μmol/L (spore form) group;△P<0.05vs0 μmol/L (hyphal form) group.
图3 KB细胞培养上清液中IL-18蛋白的含量

Figure 4. The content of HBD-2 in the culture supernatants of KB cells. Mean±SD.n=6.*P<0.05vscontrol (Con) group;#P<0.05vs0 μmol/L (spore form) group;△P<0.05vs0 μmol/L (hyphal form) group.
图4 HBD-2蛋白在KB细胞培养上清液中的含量
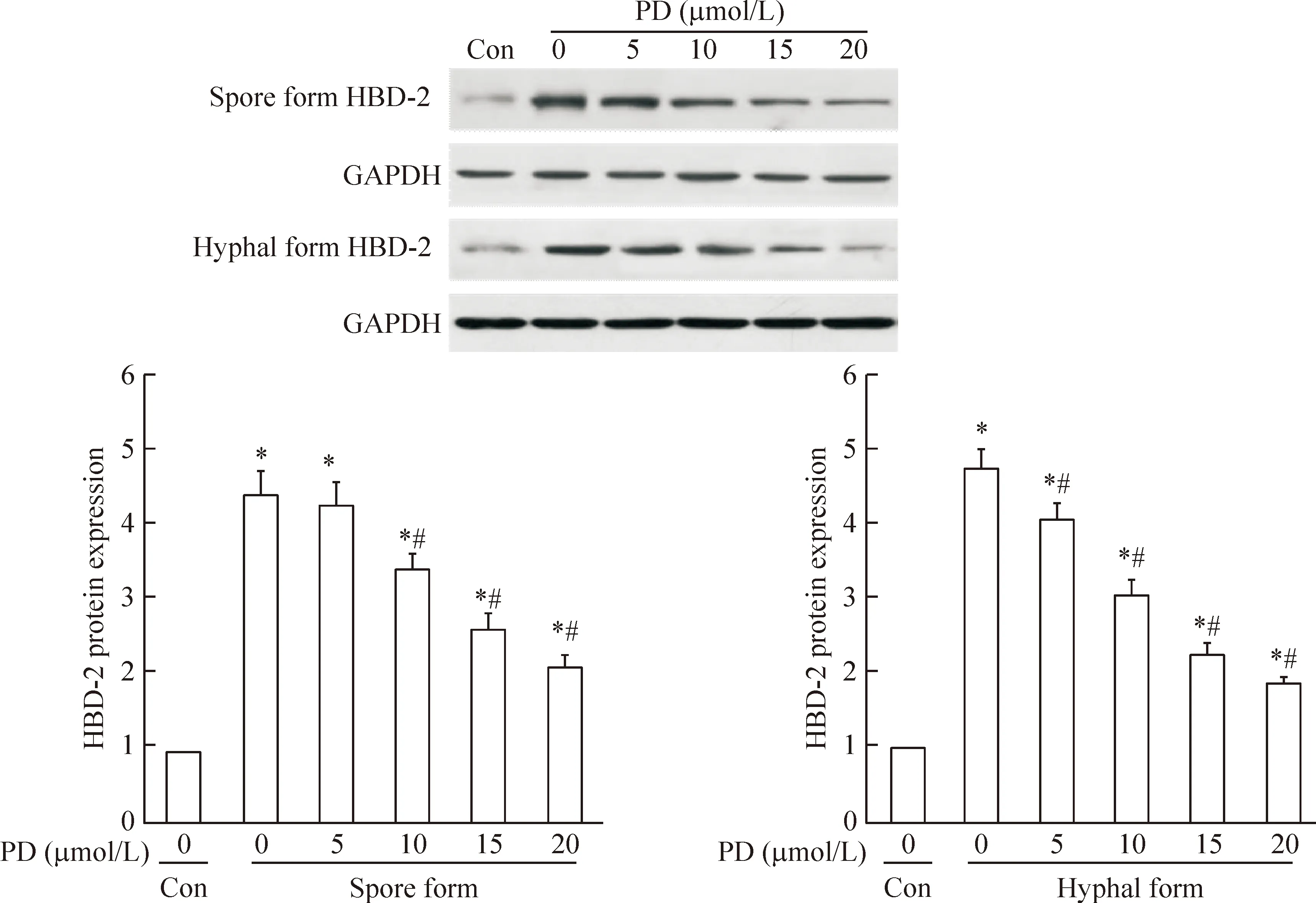
Figure 5. The protein expression of HBD-2 in the KB cells. Mean±SD.n=6.*P<0.05vscontrol (Con) group;#P<0.05vs0 μmol/L group.
图5 HBD-2 蛋白在KB细胞中的表达
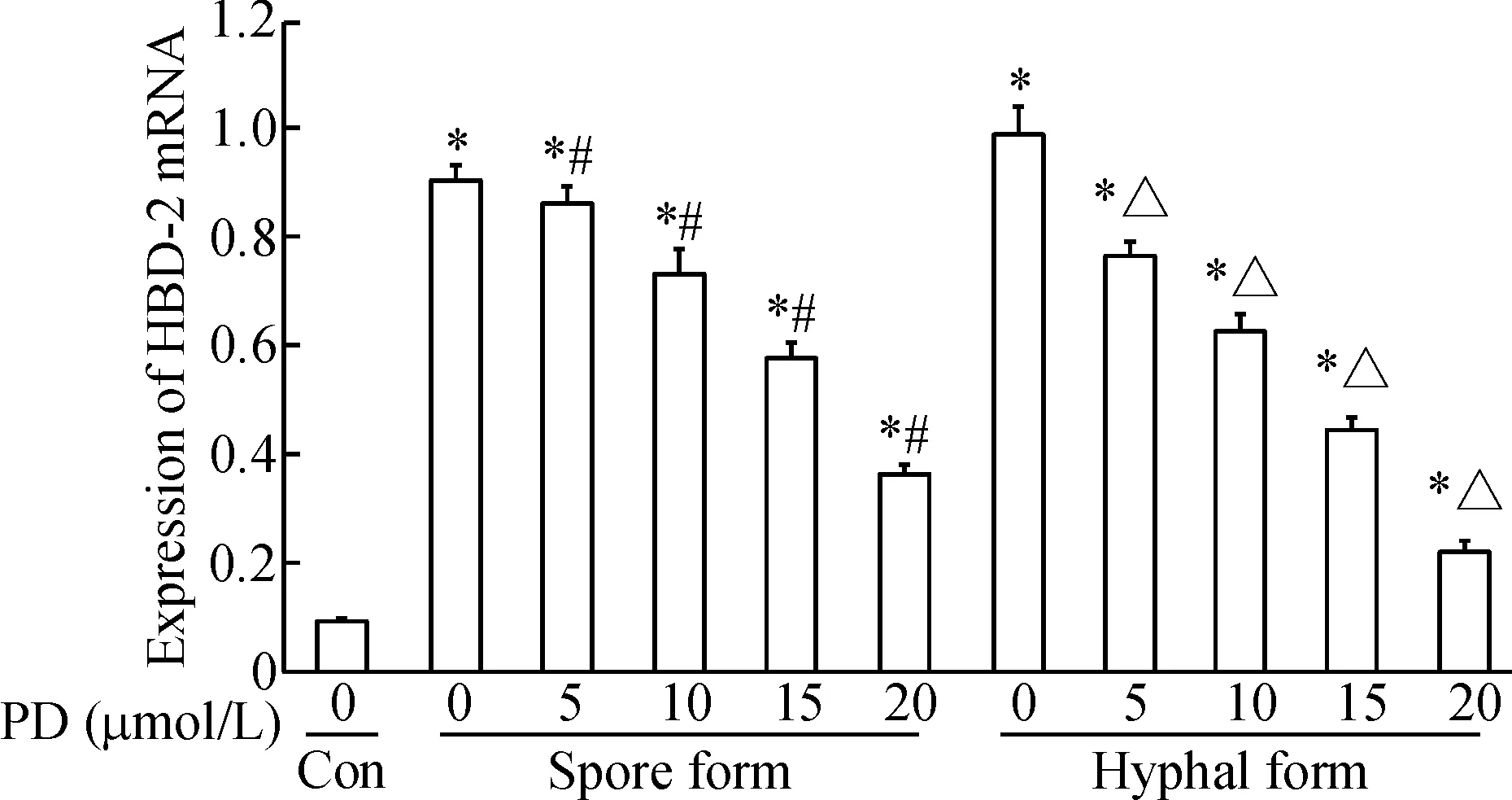
Figure 6. The mRNA expression of HBD-2 in the KB cells. Mean±SD.n=6.*P<0.05vscontrol (Con) group;#P<0.05vs0 μmol/L (spore form) group;△P<0.05vs0 μmol/L (hyphal form) group.
图6 HBD-2 mRNA在KB细胞中的表达
讨 论
白色念珠菌的毒力因子主要包括黏附、菌丝形成、表型转换等,对白色念珠菌致病性起重要作用。白色念珠菌具有孢子相和菌丝相两种基本形态,菌丝更容易持续黏附在上皮细胞的表面。有研究表明[6-7],菌丝相的白色念珠菌更具有致病性,对宿主的黏附能力更强。本实验结果表明,500 mg/L桔梗皂苷D对KB细胞不存在毒性,因此,本实验中所采用的桔梗皂苷D的剂量对黏膜上皮细胞不具有毒性。随着桔梗皂苷D浓度的增加,白色念珠菌由孢子相向菌丝相改变逐渐减少,表明桔梗皂苷D能够抑制白色念珠菌由孢子相向菌丝相转变,并使白色念珠菌对KB细胞的黏附能力下降。台盼蓝排斥实验结果显示白色念珠菌均是以活体的形式侵入KB细胞,但随着桔梗皂苷D的浓度增加,白色念珠菌黏附数显著减少,由此推测桔梗皂苷D可能具有抑菌作用。
IL-18是一个重要的免疫调节因子。Tardif等[8]在人类正常口腔黏膜组织和唾液腺中检测到IL-18。白色念珠菌感染口腔黏膜组织后,IL-18的表达显著升高。本实验结果显示桔梗皂苷D能够抑制IL-18的蛋白表达,可能是通过减少白色念珠菌与口腔上皮细胞的相互作用,使得上皮细胞IL-18的表达减少。
人β-防御素是具有广谱抗菌(包括念珠菌)活性的小分子阳离子多肽,对机体的免疫作用具有重要的影响[9]。HBD-2在念珠菌病颊黏膜上皮中的表达水平比健康颊黏膜高[10]。普遍认为HBD-2在被感染的局部大量释放,直接杀伤病原微生物,当扩散后其杀菌能力下降,进而产生趋化活性,使更多的白细胞到达被感染的组织清除病原微生物[11]。本实验研究发现,KB细胞自身的HBD-2表达少,白色念珠菌显著诱导HBD-2的表达,与桔梗皂苷D共同培养后,HBD-2的表达均呈现了下降。但其机制尚未十分清楚。有研究发现病原微生物细胞壁上具有某些免疫反应的激活分子,通过激活宿主上皮细胞的某些识别受体,如Toll样受体,从而产生免疫应答因子,如TNF、IL-1、IL-12等。
综上所述,桔梗皂苷D能够抑制白色念珠菌对口腔黏膜上皮细胞的黏附作用,可能通过参与口腔黏膜上皮细胞的免疫抑制作用而降低白色念珠菌对口腔黏膜的感染。
[1] 张 程, 郝 飞. 118株口腔致病念珠菌病原学特征及药敏结果分析[J]. 中国真菌学杂志, 2009, 4(2):87-89.
[2] Robinson TP, Bu DP, Carrique-Mas J, et al. Antibiotic resistance is the quintessential one health issue[J]. Trans R Soc Trop Med Hyg, 2016, 110(7):377-380.
[3] Meng Y, Yang Y, Lu W, et al. The inhibition of platycodin D onMycoplasmapneumoniaeproliferation and its effect on promoting cell growth after anti-Mycoplasmapneumoniaetreatment[J]. Front Cell Infect Microbiol, 2015, 4:192.
[4] Yu JS, Kim AK. Platycodin D induces apoptosis in MCF-7 human breast cancer cells[J]. J Med Food, 2010, 13(2):298-305.
[5] 付 凯. 桔梗皂苷元提取分离及活性研究[D]. 长春: 吉林农业大学,2013.
[6] Alnuaimi AD, Ramdzan AN, Wiesenfeld D, et al.Candidavirulence and ethanol-derived acetaldehyde production in oral cancer and non-cancer subjects[J]. Oral Dis, 2016,22(8):805-814.
[7] Cabral V, Znaidi S, Walker LA, et al. Targeted changes of the cell wall proteome influenceCandidaalbicansability to form single- and multi-strain biofilms[J]. PLoS Pathog, 2014, 10(12):e1004542.
[8] Tardif F, Goulet JP, Zakrazewski A, et al. Involvement of interleukin-18 in the inflammatory response against oropharyngeal candidiasis[J]. Med Sci Monit, 2004, 10(8):BR239-BR249.
[9] Zaga-Clavellina V, Ruiz M, Flores-Espinosa P, et al. Tissue-specific human beta-defensins (HBD)-1, HBD-2 and HBD-3 secretion profile from human amniochorionic membranes stimulated withCandidaalbicansin a two-compartment tissue culture system[J]. Reprod Biol Endocrinol, 2012, 10:70.
[10]Sawaki K, Mizukawa N, Yamaai T, et al. Immunohisto-chemical study on expression of alpha-defensin and beta-defensin-2 in human buccal epithelia with candidiasis[J]. Oral Dis, 2002, 8(1):37-41.
[11]廖 伟, 钱桂生, 雷 撼, 等. 脂多糖诱导人气道上皮细胞hBD-2表达及核转录因子κB活性的变化[J]. 中国病理生理杂志, 2007, 23(1):71-75.
(责任编辑: 林白霜, 罗 森)
Platycodin D protects oral epithelial cells against infection of Candida albicans
ZHU Li-fen, WANG Bing
(DepartmentofStomatology,ChongqingHospitalofTraditionalChineseMedicine,Chongqing400010,China.E-mail: 187014511@qq.com)
AIM: To investigate the effect of platycodin D onCandidaalbicansinfection in oral epithelial cells. METHODS: The viability of the oral squamous carcinoma KB cells was detected by MTT assay after treated with different concentrations of platycodin D. The KB cells were infected withCandidaalbicans, and then were incubated with platycodin D at different concentrations. Adherent numbers of theCandidaalbicanswere counted by Gram staining, and the bacterial activity and conversion were measured by Trypan blue staining. Furthermore, the protein levels of IL-18 and human β-defensin 2 (HBD-2) were analyzed by ELISA, and the expression of HBD-2 at mRNA and protein levels was determined by RT-qPCR and Western blot, respectively. RESULTS: The viability of the KB cells was not affected by platycodin D at the concentrations used. The adherent numbers, bacterial activity and conversion were decreased by treatment with platycodin D in a dose-dependent manner. In addition, the protein level of IL-18 in the culture supernatant and the mRNA expression of HBD-2 in the KB cells were also reduced after platycodin D treatment.CONCLUSION: Platycodin D has a bacteriostasis effect and prevents oral epithelial cells fromCandidaalbicansinfection.
Platycodin D; Oral epithelial cells;Candidaalbicans
1000- 4718(2017)01- 0161- 05
2016- 04- 11
2016- 11- 07
R363; R379
A
10.3969/j.issn.1000- 4718.2017.01.027
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 023-67063949; E-mail: 187014511@qq.com
——辨别味之苦甜

