沉默附睾P34H基因对小鼠精子P34H表达和精子透明质酸酶活性的影响*
马晓萍, 高晓勤, 丁贤胜, 戴研平
(1贵州医科大学组织胚胎学教研室,贵州 贵阳 550004; 2遵义医药高等专科学校组织胚胎学教研室,贵州 遵义 563006; 3六盘水市人民医院病理科,贵州 六盘水 553000)
沉默附睾P34H基因对小鼠精子P34H表达和精子透明质酸酶活性的影响*
马晓萍1, 2, 高晓勤2△, 丁贤胜3, 戴研平1
(1贵州医科大学组织胚胎学教研室,贵州 贵阳 550004;2遵义医药高等专科学校组织胚胎学教研室,贵州 遵义 563006;3六盘水市人民医院病理科,贵州 六盘水 553000)
目的: 通过慢病毒介导的RNA干扰(RNAi)敲低P34H表达,分析其对小鼠精子P34H表达和精子透明质酸酶(HYD)活性的影响。方法: 构建3种附睾精子P34H shRNA慢病毒表达载体GV-P34H-shRNA-1、GV-P34H-shRNA-2和GV-P34H-shRNA-3,提取阳性克隆质粒测序,转染HEK293T细胞,生产慢病毒颗粒。将3种重组慢病毒及阴性对照病毒分别注入小鼠附睾中,用real-time PCR和Western blot法分别检测其对P34H mRNA和蛋白的沉默效果。采用免疫荧光法观察P34H蛋白在小鼠精子上的定位,改良透明质酸钠-明胶底物膜法检测小鼠精子HYD活性(HYD阳性反应率和HYD活性强度)。结果: 测序结果证实3种慢病毒载体均包装成功。感染小鼠附睾后,P34H的mRNA及蛋白表达量均较阴性感染组和正常对照组明显降低(P<0.05);其中以GV-P34H-shRNA-1作用最为显著,精子P34H阳性表达率和HYD活性均较阴性感染组和正常对照组明显降低(P<0.05),而阴性感染组和正常对照组相比差异无统计学显著性。结论: 附睾P34H基因沉默可抑制小鼠附睾中精子P34H阳性表达率和HYD活性。
P34H; RNA干扰; 透明质酸酶
近年来,附睾生理学及生物化学研究越来越被学者们重视。附睾是哺乳动物精子成熟、获得受精及运动能力、贮存和保护精子的场所;睾丸中的精子只有在通过附睾的过程中,与管腔微环境中特异表达的蛋白质不断地相互作用,才能最终获得前向运动能力、透明带结合能力及受精能力[1]。P34H是由附睾上皮分泌并定位于精子顶体部位的精子表面蛋白,P34H能够介导精子和透明带的结合,并可作为精子成熟的标志物,而且低水平的附睾P34H蛋白与原发性男性不育相关[2]。
当精子获能时,顶体释放顶体酶水解卵子透明带,能使精子顺利地通过[3]。透明质酸酶(hyaluronidase, HYD)能够溶解放射冠细胞外基质,使颗粒细胞松散,放射冠分解,并且还能水解透明带表面精子尾部周围一定区域,使得精子尾部能够自由摆动,为精卵融合、形成受精卵创造条件[4]。各种原因引起透明质酸酶活性下降或影响精子获能与发生顶体反应,均造成精子受精能力下降[5-6]。
RNA干扰(RNA interference,RNAi)作为一项可以高效地、特异地降解靶基因mRNA的实验技术已经被广泛应用于基因功能的研究,RNAi通过导入细胞的siRNA,降解同源mRNA,高效、特异性阻断目的基因表达[7-8]。
目前对于干扰小鼠附睾P34H基因是否会对精子P34H阳性表达率和精子透明质酸酶活性产生影响尚未见相关报道。为此我们构建P34H的慢病毒shRNA表达载体转染小鼠附睾,研究转染后P34H的表达。通过实时荧光定量PCR和Western blot实验筛选能明显降低附睾P34H表达水平的RNA干扰载体,观察敲低P34H表达后对小鼠精子P34H阳性表达率和精子透明质酸酶活性的影响,以探明P34H基因对小鼠生殖功能影响的分子机制,为进一步研究由精子成熟异常引起的不育症提供实验基础和理论依据,也将为男性避孕药的研制开发提供新的靶点和依据。
材 料 和 方 法
1 主要材料与试剂
慢病毒载体GV248购自上海吉凯基因化学公司;混合包装载体质粒(pGag/Pol、pRev、pVSV2G)购自Genscript; HEK293T细胞为本课题组保存;大肠杆菌DH5α、限制性内切酶AgeI和EcoRI等均为TaKaRa产品;real-time PCR试剂盒、 cDNA逆转录试剂盒、Marker DL 2000限制性内切酶(BamHI/AgeI)、T4DNA连接酶、DNA聚合酶,质粒提取试剂盒、胶回收试剂盒及PCR产物回收试剂盒均购自QIAGEN;TRIzol购自Gibco;Lipofectamine 2000 购自Invitrogen;山羊抗P34H I抗、β-actin、过氧化物酶(horseradish peroxidase, HRP)标记的兔抗山羊IgG和荧光抗体Alexa Fluor® 647标记的驴抗羊IgG购自Abcam;5周龄的SPF级雄性NIH小鼠购于北京维通利华实验动物技术有限公司。
2 主要方法
2.1 P34H-shRNA慢病毒干扰载体的构建 根据GenBank报道的人附睾特异P34H基因序列(GenBank: AF515625.1),并结合RNAi靶标选择原则及网站预测评估,选择了3个RNAi的靶标位点,分别为:(1)位于开放读码框(open reading frame, ORF)293~312 bp的5’-GGCCTTTGACAGATCCTTT-3’;(2)位于ORF 387~406 bp的5’-GCCATCGTGAATGTCTCCA-3’;(3)位于ORF 420~438 bp的5’-GCGGGCAGTAACTAACCAT-3’。根据预测出来的靶向P34H的siRNA靶向结合序列,以及GV248载体系统特点,每一个靶向序列设计2对互补的单链DNA,包括siRNA的正义链和反义链,选择的酶切位点为AgeI和EcoRI,合成寡核苷酸正义链和反义链。siRNA-1正义链序列为 5’-CACCGGCCTTTGACAGATCCTTTTTCAAGACGAAAGGATCTGTC-AAAGGCCTTTTTTG-3’,反义链序列为5’-AGCTCAA-AAAAGGCCTTTGACAGATCCTTTCGTCTTGAAAAAG-GATCTGTCAAAGGCC-3’;siRNA-2正义链序列为5’-CACCGCCATCGTGAATGTCTCCATTCAAGACGTGGA-GACATTCACGATGGCTTTTTTG-3’,反义链序列为5’-AGCTCAAAAAAGCCATCGTGAATGTCTCCACGTCTTGAATGGAGACATTCACGATGGC-3’;siRNA-3正义链序列为5’-CACCGCGGGCAGTAACTAACCATTTCAAGACGATGGTTAGTTACTGCCCGCTTTTTT-G-3’,反义链序列为5’-AGCTCAAAAAAGCGGG-CAGTAACTAACCATCGTCTTGAAATGGTTAGTTACT-GCCCGC-3’。将这些单链DNA送至武汉巴菲尔生物公司,合成P34H纯化的shRNA Oligo片段并设计合成阴性对照(negative control, NC)-shRNA (5’-TTCTCCGAACGTGTCACGT-3’)表达重组质粒标准品。将合成好的shRNA Oligo溶解并稀释成终浓度100 μmol/L。应用PCR仪使正义链、反义链退火形成双链,退火条件为: 95 ℃ 4 min, 72 ℃ 30 min(缓慢冷却至4 ℃,即得到双链目的DNA 片段)。用限制性内切酶AgeI和EcoRI,对慢病毒载体GV248进行双酶切,得到的产物经琼脂糖电泳分离、割胶回收和纯化,将其与退火形成的RNAi寡核苷酸双链在22 ℃水浴中进行连接反应。转化DH5α,在含氨苄青霉素的LB培养板上37 ℃培养过夜。进行菌液PCR筛选阳性克隆,并测序鉴定(Invitrogen)。
2.2 慢病毒包装与滴度测定 首先制备编码慢病毒颗粒的重组病毒质粒及其混合包装载体质粒,将4种质粒载体分别进行高纯度无内毒素抽提,按Invitrogen的Lipofectamine 2000的使用说明进行HEK293T细胞转染,转染后8 h更换为完全培养基,培养48 h,收集含慢病毒颗粒的细胞上清液,对其浓缩得到高滴度的慢病毒浓缩液,最后在HEK293T细胞中根据病毒的预期滴度,对其进行倍比稀释,测定和标定病毒滴度。制备的病毒滴度为 5×108TU/L。
2.3 慢病毒载体感染小鼠附睾组织 5 周龄的雄性 NIH 小鼠经腹腔注射戊巴比妥钠麻醉后,剪开皮肤并暴露出附睾,按分组(正常对照组、GV-NC-shRNA阴性感染组、GV-P34H-shRNA-1感染组、GV-P34H-shRNA-2感染组及GV-P34H-shRNA-3感染组)将10 μL病毒液分别注射到双侧附睾。每组8只小鼠,模型处理完毕后送动物房常规饲养。2周后处死动物,迅速无菌切取附睾行下一步检测。
2.4 Real-time PCR检测各组P34H mRNA的表达量 提取各组附睾组织总RNA,测定RNA的浓度和纯度,逆转录为cDNA,在real-time PCR 中作为模板。以real-time PCR检测各组P34H mRNA的表达量。P34H的上游引物序列为5’-CCATAGCGTCTACTGCTCCA-3’,下游引物序列为 5’-CGGTTCAGCATAGTCTTGGC-3’,产物174 bp;β-actin的上游引物序列为5’-AGCGAGCATCCCCCAAAGTT-3’,下游引物序列为5’-GGGCACGAAGGCTCATCATT-3’,产物285 bp。引物由上海生工生物有限公司合成。PCR反应条件为:50 °C 2 min;95 °C 10 min; 95 °C 30 s、60 °C 30 s,共40 个循环。通过2-ΔΔCt法计算相对表达量。
2.5 Western blot实验检测各组 P34H蛋白的表达量 提取附睾组织总蛋白,取40 μg,经12% SDS-PAGE 分离,在200 mA下转膜(PVDF膜) 70 min,5%脱脂奶粉封闭液中4 ℃过夜封闭,TBST洗膜3次。加P34H I抗(1∶1 000稀释),4 ℃孵育过夜;次日用HRP标记的兔抗山羊IgG孵育2 h。TBST 轻摇洗膜后,ECL显色。暗室曝光显示特异的蛋白信号,依据ECL化学发光试剂盒操作说明进行显影、定影。利用凝胶图像分析系统对胶片进行分析。
2.6 精子标本处理和间接免疫荧光法 分离一侧附睾尾部,放入预热37 ℃PBS中剪碎,待精子游出,用上游法制备精子悬液,室温下以600×g离心洗涤10 min,将沉淀物悬浮于BWW培养液中,调精子密度为2×109/L,于37 ℃、 5 % CO2培养箱中孵育获能3 h。将PBS洗涤后的精液涂片,室温干燥后,用2%多聚甲醛固定20 min,PBS洗涤后用5 % BSA(PBS 配制)在湿盒内封闭60 min,加 I 抗(山羊抗P34H I抗,1∶200稀释),4 ℃过夜,PBS洗涤后加1∶200稀释的 II 抗(Alexa Fluor®647标记的驴抗羊IgG),室温下避光孵育2 h,PBS洗涤后封片。在激光扫描共聚焦显微镜下观察并摄片,各组涂片在镜下分别随机选取数个视野摄片并计数精子P34H标记阳性率,每组计数200个精子。
2.7 透明质酸酶反应阳性率及活性强度 采用改良透明质酸钠-明胶底物膜片[5],将上述已制备的精子悬浮液用PBS洗涤后涂于底物膜片上,放入37 ℃恒温、恒湿箱中孵育3 h。终止孵育后,于光学显微镜下均匀选取每份精子孵育片的5、6个视野观察200个精子的头部,其周围出现晕环者视为透明质酸酶阳性反应,计算精子透明质酸酶阳性率,并测量每个精子头部晕环直径的大小,计算平均反应直径(μm),作为判断透明质酸酶活性强度的指标。
3 统计学处理
使用SPSS 17.0软件进行数据的统计学处理,实验数据以均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析,两两比较采用LSD检验,以P<0.05为差异有统计学意义。
结 果
1 GV-P34H-shRNA重组质粒的DNA的测序结果
将PCR阳性克隆进行DNA测序,结果与预期DNA序列相符(图1),表明合成的P34H shRNA寡核苷酸链序列插入正确,说明DNA重组成功。
2 慢病毒干扰小鼠附睾P34H表达对P34H mRNA表达的影响
各组重组慢病毒颗粒感染小鼠附睾后,P34H-shRNA-1/2/3感染组P34H mRNA的表达水平均较正常对照组和NC-shRNA阴性感染组显著降低(P<0.05);其中以P34H-shRNA-1组下调最为明显;正常对照组和NC-shRNA阴性感染组中P34H mRNA的表达差异无统计学显著性,见图2。

Figure 1. The sequence analysis of GV-P34H-shRNA positive recombinant plasmid clones. A: P34H-shRNA-1 (5’-GGCCTTTGACAGATCCTTT-3’); B: P34H-shRNA-2 (5’-GCCATCGTGAATGTCTCCA-3’); C: P34H-shRNA-3 (5’-GCGGGCAGTAACTAACCAT-3’).
图1 GV-P34H-shRNA重组质粒阳性克隆的DNA测序结果
3 慢病毒干扰小鼠附睾P34H表达对P34H蛋白表达的影响
各组重组慢病毒颗粒感染小鼠附睾后,P34H-shRNA-1/2/3感染组P34H 蛋白的表达水平均较正常对照组和NC-shRNA阴性感染组显著降低(P<0.05);其中以P34H-shRNA-1组下调最为明显;正常对照组和NC-shRNA阴性感染组中P34H蛋白的表达差异无统计学显著性,见图3。
4 慢病毒干扰小鼠附睾P34H表达对附睾精子P34H阳性表达率的影响
附睾头部注射慢病毒后所有小鼠都存活。取附睾尾部精子在荧光显微镜下检测,间接免疫荧光染色显示精子P34H阳性表达为精子顶体部荧光分布均匀而明亮;而精子P34H缺失表达则为精子顶体部荧光强度较弱或无荧光。P34H-shRNA-1/2/3感染组小鼠精子P34H阳性表达率与正常对照组和NC-shRNA阴性感染组相比,均显著降低(P<0.05);其中以P34H-shRNA-1组下降最为明显;在正常对照组和NC-shRNA阴性感染组中差异无统计学显著性,见图4。

Figure 2. The mRNA levels of P34H in mouse epididymis after transfection with GV-P34H-shRNA were detected by real-time PCR. Mean±SD.n=3.*P<0.05vscontrol group.
图2 GV-P34H-shRNA感染小鼠附睾组织对P34H mRNA表达的影响

Figure 3. The protein levels of P34H in mouse epididymis after transfection with GV-P34H-shRNA were detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图3 GV-P34H-shRNA感染小鼠附睾组织对P34H 蛋白表达的影响

Figure 4.The percentage of P34H positive rate in mice sperm after transfection with GV-P34H-shRNA were detected by indirect immunofluorescent staining. A: positive localization of P34H in the sperm head ; B: corresponding figure A of DIC; C: lack of P34H expression in the sperm head; D: corresponding figure C of DIC.Mean±SD.n=3.*P<0.05vscontrol group.
图4 GV-P34H-shRNA感染小鼠附睾组织对精子P34H阳性表达率的影响
5 慢病毒干扰小鼠附睾P34H表达对精子HYD活性的影响
取附睾尾部精子涂片后在光学显微镜下检测,P34H-shRNA-1/ 2/ 3感染组小鼠精子HYD阳性反应率和活性强度与正常对照组和NC-shRNA阴性感染组相比,均显著降低(P<0.05);小鼠精子HYD阳性反应率和活性强度在P34H-shRNA-1组下降最为明显;在正常对照组和NC-shRNA阴性感染组中差异无统计学显著性,见图5。
讨 论
精子运动能力的形成、顶体功能的完善、代谢类型的转变、精卵的识别和融合等一系列程序化成熟功能的获得都是在附睾微环境中完成的[9-10],附睾管腔微环境中将近80%的组分在附睾的头部及体部组织合成,表明附睾头部及体部特异表达的基因在精子成熟中发挥重要的作用[11]。附睾的主要功能是使精子获得受精能力,而目前关于在附睾体部表达参与调控精子受精能力的基因还报道较少。为了探索P34H对小鼠精子功能的影响,我们在此采取RNAi技术在整体动物水平敲低P34H基因的表达,比较其对精子透明质酸酶活性的变化。
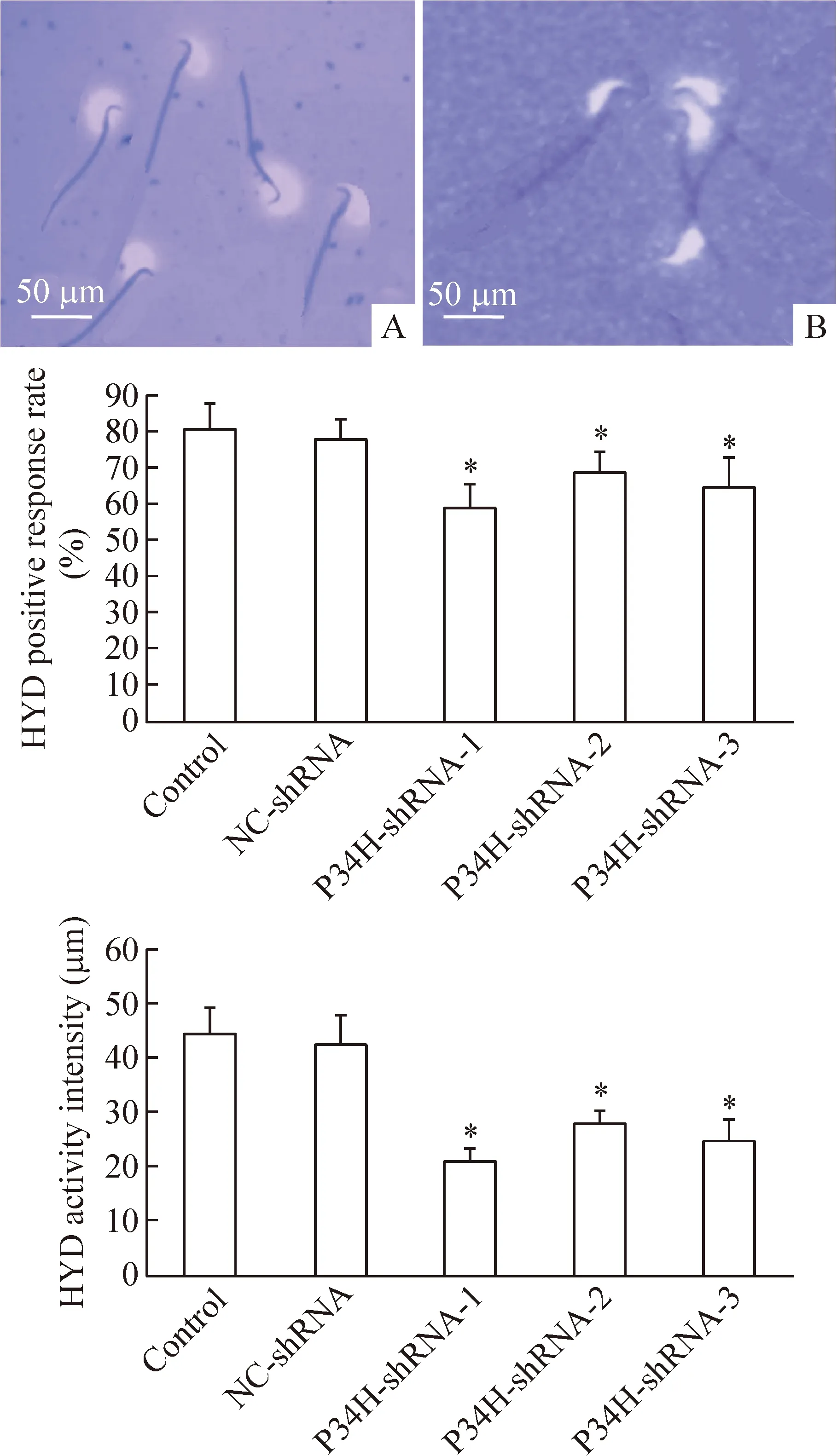
Figure 5. The HYD positive response rate and HYD activity intensity in mice sperm after transfection with GV-P34H-shRNA were detected by modified sodium hyaluronate gelatin membrane. A: control group; B: group with P34H-shRNA-1 transfection. Mean±SD.n=3.*P<0.05vscontrol group.
图5 GV-P34H-shRNA感染小鼠附睾对HYD阳性反应率、HYD活性强度的影响
慢病毒载体系统能将携带的片段整合到宿主基因组产生持久稳定的表达,具有感染范围广且干扰效果高的特点,可以稳定表达siRNA并长时间抑制目的基因的表达,是一种理想的在整体动物水平研究目的基因功能的基因干扰载体系统[12]。本研究在此构建P34H的慢病毒干扰载体,在实验中将慢病毒表达质粒GV-P34H-shRNA与混合包装载体质粒共转HEK293T细胞,包装干扰P34H基因表达的慢病毒,在整体动物水平敲低P34H表达。将3个靶向干扰P34H表达的慢病毒干扰载体转染小鼠附睾组织并分析各条备选序列的慢病毒载体的干扰效果。各靶序列对应的慢病毒载体都能特异地敲减靶器官P34H的mRNA表达、蛋白表达和精子头部P34H的阳性表达率,其中,本实验中P34H-shRNA-1敲减P34H的mRNA及蛋白表达效能最优。
本实验结果显示,P34H基因沉默各组中精子的HYD阳性反应率和活性强度明显低于正常对照组。正常对照组的精子头部出现明显的晕环,数量较多、直径较大,而P34H基因沉默组的精子头部晕环数量减少,晕环的直径变小。这些现象表明,沉默P34H基因对小鼠附睾精子HYD阳性反应率和活性强度有明显抑制作用。精子顶体内透明质酸酶在受精过程中起着重要的作用,透明质酸酶活性低的精子人工授精成功率也较低[13]。因此,我们认为沉默P34H基因将会抑制小鼠精子HYD活性,进而影响精子和透明带的结合,造成精子受精能力下降。
本研究结果显示,P34H基因沉默可通过抑制精子头部P34H阳性表达率和精子透明质酸酶活性来影响雄性小鼠的生殖功能。这一研究结果有助于探明引起不育的病因,为解决精子功能异常所引起的不育以及为P34H是否可以作为男性避孕疫苗候选分子提供基础理论和实验依据。
[1] 李世佳, 石 慧, 李建远, 等. 附睾精子结合蛋白1在男性生殖中的研究进展[J]. 检验医学与临床, 2012, 9(19):2476-2478.
[2] Legare C, Thabet M, Heard S, et a1. Effect of vasectomy on P34H messenger ribonucleie acid expression along the human excurrent duct: are flection on the function of the human epididymis[J]. Biol Reprod, 2001, 64(2):720-727.
[3] Howes L, Jones R. Interactions between zona pellucida glycoproteins and sperm proacrosin/acrosin during fertilization[J]. J Reprod Immunol, 2002, 53(1-2):181-192.
[4] 郑立宏, 杨 丹, 高晓勤. 精液中一氧化氮含量对精子顶体内透明质酸酶的影响[J]. 解剖学杂志, 2012, 35(6):718-720.
[5] 王 珂, 高晓勤, 刘鲜林. 改良固定底物膜法对精子顶体透明质酸酶检测的研究[J]. 中华检验医学杂志, 2007, 30(8):882-885.
[6] 马晓萍, 高晓勤, 杨燕平, 等. 人精子顶体内顶体蛋白酶和透明质酸酶对男性生育力的影响[J]. 检验医学, 2014, 29(3):258-261.
[7] 张新晨, 杨维良, 徐华锋.小干扰RNA对胃癌细胞葡萄糖调节蛋白94表达的抑制作用[J].中华实验外科杂志, 2007, 24(5):543-545.
[8] 张新晨, 杨维良, 徐华锋.应用RNA干扰技术抑制PDE-5A-3基因在人阴茎海绵体平滑肌细胞表达[J].中华实验外科杂志, 2006, 23(5):579-581.
[9] Dacheux JS, Gatti JL. Epididymal cell secretory activities and the role of proteins in boar sperm maturation[J]. Theriogenology, 2005, 63(2):319-341.
[10]卢 苇, 张晓燕, 张巧霞, 等. 5α-还原酶Ⅱ在附睾细胞系PC1和DC2中的表达特征[J]. 生殖与避孕, 2011, 31(1):6-9.
[11]Gatti JL, Castella S, Dacheux F, et al. Post- testicular sperm environment and fertility[J]. Anim Reprod Sci, 2004, 82-83:321-339.
[12]刘 悦, 郝玉娥, 詹轶群, 等. 人甘油激酶慢病毒干涉载体的构建和表达[J].南方医科大学学报, 2012, 32(5): 614-617.
[13]Abduf Aziz M, Maclusky NJ. Hyaluronidase activity in human semen:correlation with fertilization[J]. Ferial Steral, 1995, 64(2):147-149.
(责任编辑: 陈妙玲, 余小慧)
Effects of epididymal P34H gene silencing on expression of P34H and activity of hyaluronidase in mouse sperm
MA Xiao-ping1, 2, GAO Xiao-qin2, DING Xian-sheng3, DAI Yan-ping1
(1DepartmentofHistologyandEmbryology,GuizhouMedicalUniversity,Guiyang550004,China;2DepartmentofHistologyandEmbryology,ZunyiMedicalandPharmaceuticalCollege,Zunyi563006,China;3DepartmentofPathology,TheFirstPeople’sHospitalofLiupanshui,Liupanshui553000,China.E-mail:gxq550301@163.com)
AIM: To investigate the effects ofP34Hgene silencing on the expression of P34H and activity of hyaluronidase (HYD) in mouse sperm.METHODS: The recombinant plasmid series of P34H targeted short hairpin RNA (shRNA) were constructed by GV248 plasmids vector. These recombinant plasmids were transformed into DH5α competent cells, and the plasmids were taken from DNA sequencing analysis. The HEK293T cells were co-transfected with shRNA and lentiviral packaging plasmids. The 3 kinds of recombinant lentiviruses and negative control lentiviruses were used to inject into the mouse epididymis and the expression of P34H at mRNA and protein levels was detected by real-time PCR and Western blot, respectively. The location of P34H protein on the mouse spermatozoa was determined by indirect immunofluorescent staining using P34H antibody. The positive rate and activity intensity of HYD was detected by modified sodium hyaluronate-gelatin membrane. RESULTS: DNA sequencing analysis confirmed that the 3 P34H-shRNA sequences were successfully inserted into the lentiviral vectors. P34H expression in epididymis tissue was significantly decreased at both mRNA and protein levels compared with those of the non-transfected and normal control vectors (P<0.05). The GV-P34H-shRNA-1 played a significant role in reducing the percentage of P34H positive rate and the activity of HYD in mouse sperm. The silencing effect did not significantly differ between the non-transfected and normal control vectors. CONCLUSION: Silencing ofP34Hsignificantly inhibits the percentage of P34H positive rate and the activity of hyaluronidase in mouse sperm.
P34H; RNA interference; Hyaluronidase
1000- 4718(2017)01- 0133- 06
2016- 06- 22
2016- 09- 21
贵州省科技计划项目(黔科合LH字[2015]7567号); 贵州省科技创新人才团队项目(黔科合人才团队[2014]4005号)
R363
A
10.3969/j.issn.1000- 4718.2017.01.022
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0851-28925881; E-mail: gxq550301@163.com

