脑间变性星形细胞瘤术后放疗同步应用替莫唑胺化疗临床研究
尚春迎
辽宁省辽阳市中心医院肿瘤内科(辽阳111000)
脑间变性星形细胞瘤术后放疗同步应用替莫唑胺化疗临床研究
尚春迎
辽宁省辽阳市中心医院肿瘤内科(辽阳111000)
目的:探讨脑间变性星型细胞瘤术后调强放疗并同步替莫唑胺化疗的临床疗效及影响预后的相关因素。方法:对25例术后经病理确诊的脑间变性星型细胞瘤患者进行回顾性分析,所有患者均进行调强放疗并同步整合加量技术,并同步口服替莫唑胺进行化疗,随访2年期总生存率,对影响脑间变性星型细胞瘤术后预后的独立因素进行评估。结果:本研究中位随访时间为41.8个月,所有患者中位生存时间12.4个月,1年、2年总生存率分别为67.9%、58.5%;未观察到与治疗相关的死亡,血液学毒性主要表现血小板、白细胞减少,不良反应为头痛、呕吐恶心, I~II度骨髓抑制率为84.00%,III度骨髓抑制率为16.00%,未发现IV度骨髓抑制;单因素分析显示:性别、手术切除情况、肿瘤位置等对脑间变性星型细胞瘤术后患者预后的影响无统计学意义(P>0.05),年龄、WHO分级、KPS评分、术前化疗情况等因素对脑间变性星型细胞瘤术后患者预后影响有统计学意义(P<0.05);多因素分析结果显示:WHO分级(P=0.002)、KPS评分(P=0.036)是影响脑间变性星型细胞瘤术后患者预后的独立因素。结论:脑间变性星型细胞瘤术后调强放疗并同步替莫唑胺化疗临床效果确切,WHO病理分级和术前KPS评分是影响其预后的独立因素。
脑间变性星型细胞瘤是颅内最常见的恶性胶质瘤之一,手术切除是其首选治疗方法,但单纯手术的治疗效果仍欠满意[1]。本研究就脑间变性星型细胞瘤术后调强放疗并同步替莫唑胺化疗的临床疗效和影响预后的相关因素进行分析,现报告如下。
资料与方法
1 一般资料 我院于2010年12月至2012年11月术后经病理确诊脑间变性星型细胞瘤患者25例,WHO分级肿瘤分级为III级和IV级,其中男14例,女11例,年龄45~62岁,平均(51.2±9.6)岁,WHOIII级17例,IV级8例,KPS评分≥80分15例,KPS评分<60分10例,术前接受放疗2例,术前接受化疗3例。
2 治疗方法 所有患者均在术后3~4 周进行调强放疗并同步整合加量技术,中心在模拟机下确定,采用面膜固定体位,增强扫描用行层为5mm的头部螺旋CT进行。靶区勾画:结合术前MRI,病灶范围GTV包及T1加权增强区,GTV外扩2cm(包及T2加权增强区) 为CTV。考虑存在摆位误差和系统误差,一方面避开重要危险器官,一方面通过计划系统,在CTV和GTV外扩3~5mm后 自动生成PCTV和PGTV。处方剂量为PCTV 50Gy/25次,2.0Gy/次;PGTV 60Gy/25次,2.4Gy/次。计划要求:至少95%等剂量曲线包括PGTV,<20%的PGTV接受110%的处方剂量,<1%的靶区外体积接受大于110%的处方剂量,≥1%的靶区内体积接受小于93%的处方剂量[2]。靶区和计划由物理师和医师共同确认,放疗在模拟机下经复核验证野后开始进行。所有患者在放疗开始时即同步口服替莫唑胺0.15g/( m2·d)进行化疗,连服5d,1个周期为4周,最多连服6个周期。
3 随访及评价指标 第一次复查在患者放疗后4周进行,以后复查每3个月进行1次,经颅磁共振扫描、肝肾功能及血常规为主要复查内容[3];并随访2年期总生存率,根据美国国家癌症研究所(NCI)CTCAEWH v3.0和放射肿瘤协作组(RTOG)不良事件通用毒性标准对相关副作用进行评价。

结 果
1 脑间变性星型细胞瘤术后放疗及同步化疗患者生存及不良反应 本研究随访时间截止2014年11月,中位随访时间41.8个月,所有患者中位生存时间12.4个月,1年、2年总生存率分别为67.9%、58.5%;未观察到与治疗相关的死亡,血液学毒性:血小板减少13例,占52.0%;白细胞减少22例,占88.0%。不良反应:头痛21例,占84.0%;呕吐19例,占76.0%;恶心23例,占92.0%; I~II度骨髓抑制21例,骨髓抑制率为84.00%,III度骨髓抑制4例,骨髓抑制率为16.00%,未发现IV度骨髓抑制。
2 脑间变性星型细胞瘤术后患者预后影响因素的单因素分析 见表1。单因素分析显示:性别、手术切除情况、肿瘤位置等对脑间变性星型细胞瘤术后患者预后的影响无统计学意义(P>0.05),年龄、WHO分级、KPS评分、术前化疗情况等因素对脑间变性星型细胞瘤术后患者预后影响有统计学意义(P<0.05)。

表1 脑间变性星型细胞瘤术后患者预后 影响因素的单因素分析
3 脑间变性星型细胞瘤术后患者预后影响因素的多因素分析 见表2。将单因素分析有意义的WHO分级、KPS评分、术前放疗情况、术前化疗情况4种因素进行多因素分析,结果显示:WHO分级(P=0.002)、KPS评分(P=0.036)是影响脑间变性星型细胞瘤术后患者预后的独立因素。
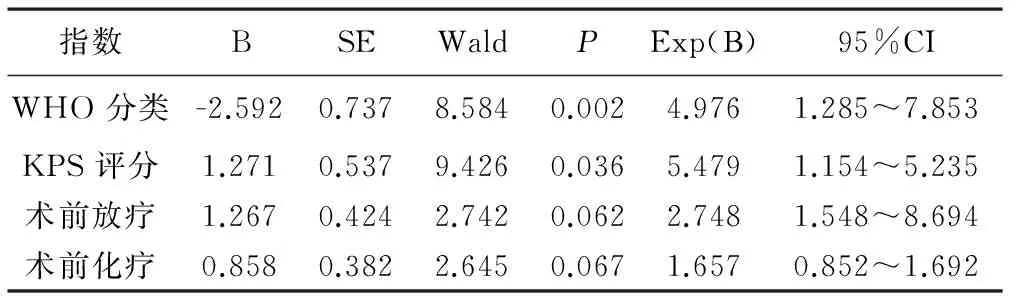
表2 脑间变性星型细胞瘤术后患者预后 影响因素的多因素分析
讨 论
脑间变性星形细胞瘤是恶性胶质瘤中最常见的类型,手术切除为其首选治疗方法,但因受解剖结构的限制,肿瘤不易被完全切除,单纯手术效果一般,术后进行放化疗综合治疗已成为其治疗的标准模式[3]。
调强放疗技术目前已在临床广泛应用,与传统三维适形放疗技术和常规放疗技术相比,研究发现:调强放疗技术可以提高脑恶性胶质瘤放疗剂量,且对肿瘤靶区周围正常组织的放射剂量可以起到明显降低作用,使重要器官和组织可以得到保护[4]。调强放疗技术的应用目是利用其可以有效保护正常组织的优势,提高肿瘤靶区放疗剂量,进而提高肿瘤局控率,以此提高患者定期生存率[5]。作为恶性脑胶质瘤进行化疗的一线药物,替莫唑胺可以通过血脑屏障,与传统亚硝脲类化疗药物比,具有较高的治疗有效率、胃肠道和骨髓抑制等不良反应较轻的优势[6]。调强放疗联合替莫唑胺化疗可以使二者相互增敏、作用互补,减少肿瘤耐药发生,从而提高治疗效果[7]。
本研究25例脑间变性星形细胞瘤患者术后调强放疗同步替莫唑胺化疗治疗,中位随访时间41.8个月,所有患者中位生存时间12.4个月,1年、2年总生存率分别为67.9%、58.5%;未观察到与治疗相关的死亡,血液学毒性主要表现血小板、白细胞减少,不良反应主要表现为头痛、呕吐恶心, I~II度骨髓抑制率为84.00%,III度骨髓抑制率为16.00%,未发现IV度骨髓抑制;这与Lin[8]的研究结果一致。提示联合调强放疗同步替莫唑胺化疗治疗后,脑间变性星形细胞瘤术后患者的2年总生存率具有较高,且不良反应和毒副作用较轻,在治疗过程中具有较好依从性,是较好的脑间变性星形细胞瘤术后患者的治疗模式。
单因素分析显示:年龄、WHO分级、KPS评分、术前化疗情况等因素对脑间变性星型细胞瘤术后患者预后影响有统计学意义;多因素分析结果显示WHO分级、KPS评分是影响脑间变性星型细胞瘤术后患者预后的独立因素。这与Torres[9]的研究结论相符。WHO分级III级者,与WHO分级IV级者相比病情较轻,更易经过综合治疗后获益,预后相对较好;KPS评分≥80分者提示该部分患者具有较好的综合体质素质,因此对放疗及化疗的耐受性较好,因此生存率相对较高。有关脑间变性星形细胞瘤术后调强放疗联合替莫唑胺同步化疗合理的放疗、化疗剂量及量-效之间的关系、更远期的生存疗效还需在临床中进一步观察研究。
[1] Shah B,Sharma P,Brahmbhatt A,etal. Study of levosimendan during off-pump coronary artery bypass grafting in patients with LV dysfunction :a double-blind randomized study[J].Indian J Pharmacol,2014,46(1):29-34.
[2] Wang Y, Tian Y, Wan H,etal.Differences between braianstem gliomas in juvenile and adult rats[J].Oncol Lett ,2013,6(1):246-250.
[3] Weller M, Cloughesy T, Perry JR,etal. Standards of care for treatment of recurrent glioblastoma--are we there yet[J].Neuro-oncology,2013,15(1):4-27.
[4] Valduvieco I,Verger E,Bruna J,etal.Impact of therapy delay on survival in glioblastoma [J].Clin Transl Oncol, 2013,15(4):278.
[5] Maeda A,Nakata M,Yasuda K,etal. Influence of vascular endothelial growth factor single nucleotide polym orphisms on non-small cell lung cancer tum or angiogenesis[J].Oncol Rep,2013,29(1):39-44.
[6] Tassi-Bracco S,Abrantes J,Gennari P,etal. Endovascular treatment of early recurrent ischemic stroke following intravenous thrombolysis[J].Am J Emerg Med,2013,31(3):639.
[7] Tabata C,Shibata E,Tabata R,etal.Serum HMGBI as a prognostic maker for malignant pleural mesothelioma[J].BMC Cancer,2013,13:205.
[8] Lin ZX. Glioma-related edema: new insight into molecular mechanismsand their clinical implications [J].Chin J Cancer,2013, 32(1): 49-52.
[9] Torres DS,Abrantes J,Brandao-Mello CE. Cognitive assessment of patients minimal hepatic encephalopathy in Brazil[J]. Metab Brain Dis,2013,28(3):473-483.
(收稿:2016-08-10)
Clinical study of temozolomide chemotherapy period between brain radiation therapy after adjustment anaplastic astrocytoma
Shang Chunying.
Department of Oncology,Liaoyang Central Hospital of Liaoning Province(Liaoyang111000)
Objective: To investigate the brain degeneration of astrocytomas and postoperative IMRT for the same period of the clinical efficacy of temozolomide chemotherapy and related prognostic factors, reference and basis for interventions. Methods: Treated by pathologically confirmed 25 cases of degenerative brain astrocytoma patients in this study, the clinical data were retrospectively analyzed. All patients underwent IMRT and increase the amount of synchronous technology integration, and the same period of oral temozolomide chemotherapy, followed up for 2-year overall survival, and the influence of independent factors degeneration of brain cells after tumor star prognosis evaluation. Results: In this study follow-up period ended in November 2014, with a median follow-up time of 41.8 months, the median survival time for all patients 12.4 months, 1 year, 2-year overall survival rates were 67.9%, 58.5%; not observed treatment-related deaths, mainly hematological toxicity of platelets, leukopenia, adverse reactions were headache, vomiting, nausea, I-II myelosuppression was 84.00%, the degree of bone marrow suppression was 16.00 percent III, IV degree not found bone marrow suppression; univariate analysis showed that the effects of gender, surgery, the tumor location transgender astrocytomas postoperative prognosis of patients was not statistically significant between the brain (P>0.05), age, WHO classification, KPS score, preoperative factors such as chemotherapy circumstances statistically significant (P<0.05) influence degeneration astrocytomas prognosis among patients brain; multivariate analysis showed that WHO classification (P=0.002), KPS score (P=0.036) affect the brain anaplastic astrocytomas independent factors of postoperative prognosis. Conclusion: degenerative brain astrocytomas postoperative IMRT and temozolomide chemotherapy earlier clinical exact effect, WHO tumor grade and preoperative KPS score was an independent prognostic factor in its impact.
Brain neoplasms/drug therapy Brain neoplasms/radiotherapy Postoperative Antineoplastic agents/therapeutic use @ Between brain degeneration astrocytomas @Temozolomide
脑肿瘤/药物疗法 脑肿瘤/放射疗法 手术后期间 抗肿瘤药/治疗应用 @ 脑间变性星型细胞瘤 @替莫唑胺
R739.41
A
10.3969/j.issn.1000-7377.2017.01.030

