珠江口3种鲸豚的MHC-I基因多态性研究
余新建, 张西阳, 林文治, 周蕊莲, 吴玉萍
珠江口3种鲸豚的基因多态性研究
余新建1, 2, 3, 4, 张西阳1, 2, 3, 4, 林文治1, 2, 3, 4, 周蕊莲1, 2, 3, 4, 吴玉萍1, 2, 3, 4
(1. 南海生物资源开发与利用协同创新中心, 广东珠海 519082; 2. 广东省海洋资源与近岸工程重点实验室, 广东珠海 519082; 3. 珠海市海洋生物资源与环境重点实验室, 广东珠海 519082; 4. 中山大学海洋科学学院, 广东珠海 519082)
旨在了解珠江口栖息的中华白海豚()、宽脊江豚()和点斑原海豚()免疫相关基因()的多态性及其表达情况, 以期为这3种鲸豚的保育工作提供基础资料。通过克隆测序的方法, 首次证实基因在这3种鲸豚体内表达。选择压力分析, 表明基因在这3种鲸豚中均受到强烈的正选择作用, 提示其具有重要的免疫功能。3种鲸豚的基因在系统发育树上相互混杂在一起, 表明基因存在跨物种多态性。结合选择压力分析和跨物种多态性, 发现基因受到平衡选择作用。珠江口3种鲸豚基因多态性可能由平衡选择维持。
鲸豚;(); 表达; 平衡选择
主要组织相容性复合体(,)是存在于大部分脊椎动物基因组中与免疫功能密切相关的一个基因家族。基因通过编码不同的细胞表面受体, 识别并结合抗原, 并将其递呈到效应细胞, 从而激发一系列的免疫应答反应。根据其结构组成、组织表达类型及进化史的差异,基因家族又可分为Ⅰ类、Ⅱ类和Ⅲ类3个亚家族。其中,类分子多表达在有核细胞表面, 在对细胞内病原体(主要是病毒)的免疫防御中扮演着重要角色。基因是脊椎动物中最具多态性的功能基因, 其中病原体介导的平衡选择被认为是维持基因家族的等位基因多样性的主要原因[1]。基因多样性水平的降低会削弱种群对突发性传染性病原体的抵抗力和生存力[2]。因此, 对野生动物尤其是保护物种的基因多样性研究已成为近年来的热点。
目前, 国内有关脊椎动物基因的研究比较多, 如应用在半滑舌鳎()的辅助育种研究中[3]。哺乳动物基因的研究主要集中在陆生动物, 如大熊猫()、恒河猴()等[4-5]。然而有关海洋哺乳动物, 如鲸豚类基因的研究则较少。目前中国有关中华白海豚()、宽脊江豚()、点斑原海豚()类基因的研究涉及多个水域[6-8]。张西阳等[9]对珠江口中华白海豚基因的研究发现其基因多样性较低, 推测原因可能是该种群历史上经历了长期的瓶颈效应。但尚未发现有关珠江口水域这3种鲸豚基因研究的报道。
近年来, 珠江口鲸豚感染病原体的情况时有报道。香港的中华白海豚、宽脊江豚和宽吻海豚()中, 64头鲸豚中有29%的个体发现病原体感染的情况[10]。另有研究发现2头中华白海豚受病原体感染[11]。遗传多样性降低会造成中华白海豚对环境的适应力下降[12], 可能导致其易感染病原体。病原体具有引起动物大规模死亡的风险[13-14]。因此, 对濒危物种的基因多态性的研究, 对于探讨环境中的病原体对该物种的威胁及该物种在抵抗疾病和适应环境变化等方面的能力具有重要意义。
本研究通过对珠江口水域的中华白海豚、宽脊江豚和点斑原海豚的基因进行表达分析和克隆测序, 以探究这3种常见鲸豚的基因是否表达及基因多态性, 并通过选择压力分析和系统发育树分析, 初步探讨形成这种基因多态性特征的机制。
1 材料和方法
1.1 实验材料
本研究选用搁浅死亡于珠江口的中华白海豚、宽脊江豚、点斑原海豚新鲜肌肉样本。样本取得后立即保存于Trizol中及–80℃中。
1.2 实验方法
总RNA的提取参照RNAisoTMPlus(TaKaRa), 经琼脂糖凝胶电泳和微量紫外分光光度计检测其完整性和浓度, 用PrimeScript RT-PCR Kit(TaKaRa)将提取的RNA用Oligo(dT)引物逆转录为互补链DNA (Complementary DNA, cDNA)。采用经典酚-氯仿法提取基因组DNA(Genomic DNA, gDNA)。
1.3 PCR扩增、产物的纯化、克隆及测序
使用2对引物DoLA-F/R和I2F/R分别扩增3种鲸豚的基因表达序列及其外显子2序列, 产物经1.2%的琼脂糖凝胶电泳检验目的片段。引物信息见表1。PCR反应体系包含6.88 μL ddH2O, 2×GC buffer I 12.5 μL, dNTP(10 mmol/L)2 μL, BSA(200 m g/L) 1.50 μL, 正、反引物(20 μmol/L)各0.5 μL, LA Taq 0.12 μL, 模板DNA(约100 mg/L) 1.00 μL。PCR反应程序为: 95℃预变性5 min; 95℃变性1 min, 55/50℃退火1 min, 72℃延伸4 min, 共35个循环; 然后72℃延伸10 min。PCR产物经1.2%琼脂糖电泳检测后, 用Agarose Gel DNA Purification Kit试剂盒(TaKaRa)纯化回收。

表1 MHC-I表达片段及外显子2片段的扩增所用引物
*: 引文的引物为简并引物, 本研究根据表达序列对引物有所修改
纯化后的DNA连接上pMD-19载体(TaKaRa), 转化感受态大肠杆菌DH5α 菌株。待平板上长出菌落, 利用蓝白斑筛选的方法挑出至少15个白色阳性菌落, 送至北京六合华大基因科技股份有限公司广州测序部进行双向测序。
1.4 数据分析
采用BioEdit软件[17]进行序列比对, 以确定变异位点及等位基因。等位基因的命名参照家猫的命名原则: 一个新的等位基因的确定, 需要在同一个体的至少两个克隆中出现, 或者在不同个体中出现[18]。为了分析物种间基因的系统发育关系, 使用Modeltest 3.7确定最合适的核酸替代模型[19]; 以家牛()作为外群, 使用MrBayes3.2软件构建系统发育树[20]。使用MEGA6计算平均核苷酸差异。使用DNAsp软件和MEGA 6软件对基因外显子2及其肽结合区(Peptide Binding Region, PBR)进行选择压力分析[21-22]。
2 结果与分析
2.1基因的表达和序列变异
本研究从中华白海豚(1例)、宽脊江豚(2例)和点斑原海豚(1例)肌肉组织中均成功提取高质量的RNA和DNA。通过使用特异性引物DoLA-F和DoLA-R对cDNA进行扩增, 证实基因在3种鲸豚肌肉组织中的表达。中华白海豚、宽脊江豚和点斑原海豚肌肉组织中分别检测到5、4和6条cDNA序列(822 bp) (GenBank: KU757454-KU757468),均包含完整的外显子2(1~271 bp)、外显子3(272~546 bp)和外显子4(547~ 822 bp)。所有序列均未检测到插入、缺失和终止子, 表明所有的序列都来源于基因组中的功能性分子。使用I2F和I2R引物从相同个体基因组DNA中扩增基因外显子2序列。这些cDNA序列与gDNA序列均完全配对。
从中华白海豚、宽脊江豚和点斑原海豚基因组中分别扩增得到6、5和6个等位基因(147 bp), 变异位点数分别为32(21.8%)、23(15.6%)和28个(19.0%), 相应的氨基酸序列变异位点数为18(36.7%)、16(32.7%)和17个(34.7%), 大部分变异位点集中在基因的功能区, 如PBR区(表2)。珠江口中华白海豚有4个等位基因与其他水域中华白海豚一致[8](GenBank: EF375575, EF375576, EF375579, EF375580)。珠江口宽脊江豚中有2个等位基因与其他水域宽脊江豚一致(GenBank: DQ843624, DQ843625)[7]。新发现的基因命名如下: 中华白海豚为(GenBank: KU759499、KU759500); 宽脊江豚为(GenBank: KU759501- KU759503); 点斑原海豚为(GenBank: KU759504- KU759509)。
2.2系统发育
对基因核苷酸替代模型进行分析后, 采用AIC(Akaike Information Criterion)分析结果中的TVM+I+G模型构建系统发育树。珠江口3种鲸豚与灰鲸()、印度-太平洋瓶鼻海豚()、条纹原海豚()、赫氏海豚()等序列相似度都在90%以上。灰鲸作为须鲸, 其基因单独聚为1支(Mysticeti)(图1)。其他齿鲸基因主要聚为5支(Odontoceti Ⅰ~Ⅴ), 但并没有明显的种属聚类趋势, 不同物种的等位基因分散聚合, 表现出明显的跨物种多态性。例如其中1支为宽脊江豚(Ⅳ), 另外4支中均有宽脊江豚基因存在(图1)。分支Ⅰ中均发现中华白海豚、宽脊江豚、点斑原海豚和赫氏海豚基因相互交叉(如与分别聚合后形成1支); 分支Ⅱ和Ⅴ中也与此类似(图1)。
: DQ190936;: EU024810~EU024816;: AF149216;: AF149219;: AF149220;: AF188615;: DG843624;: DG843625;: DQ843630;: DQ843634; Neph-I*17: DQ843640;: DQ843653;: DQ843655;: DQ843656;: EF375575 ~EF375580;: EU698989;: EU698990;: EU698992 ~EU698996
2.3 选择作用
使用DNAsp软件对中华白海豚、宽脊江豚和点斑原海豚的基因外显子2分析Tagima’值, 发现中华白海豚(0.114 14,>0.10)、宽脊江豚(0.376 64,>0.10)和点斑原海豚(1.06748,>0.10)的值均大于0(表3), 但是统计学差异并不显著, 不能排除无正选择作用存在的零假设。而使用MEGA 6.0软件的检验对3种鲸豚的外显子2及其肽结合区(PBR)进行选择压力分析(表4), 发现中华白海豚、宽脊江豚和点斑原海豚基因外显子2及其PBR区的非同义替代率(N)显著高于同义替代率(S), 均达到显著水平(<0.05)甚至极显著水平(<0.01), 提示正选择作用的存在[23]。而点斑原海豚基因外显子2非PBR区也显示出较高的值(N/S), 且达到极显著水平(<0.01), 提示其整个外显子2区都受到正选择作用。
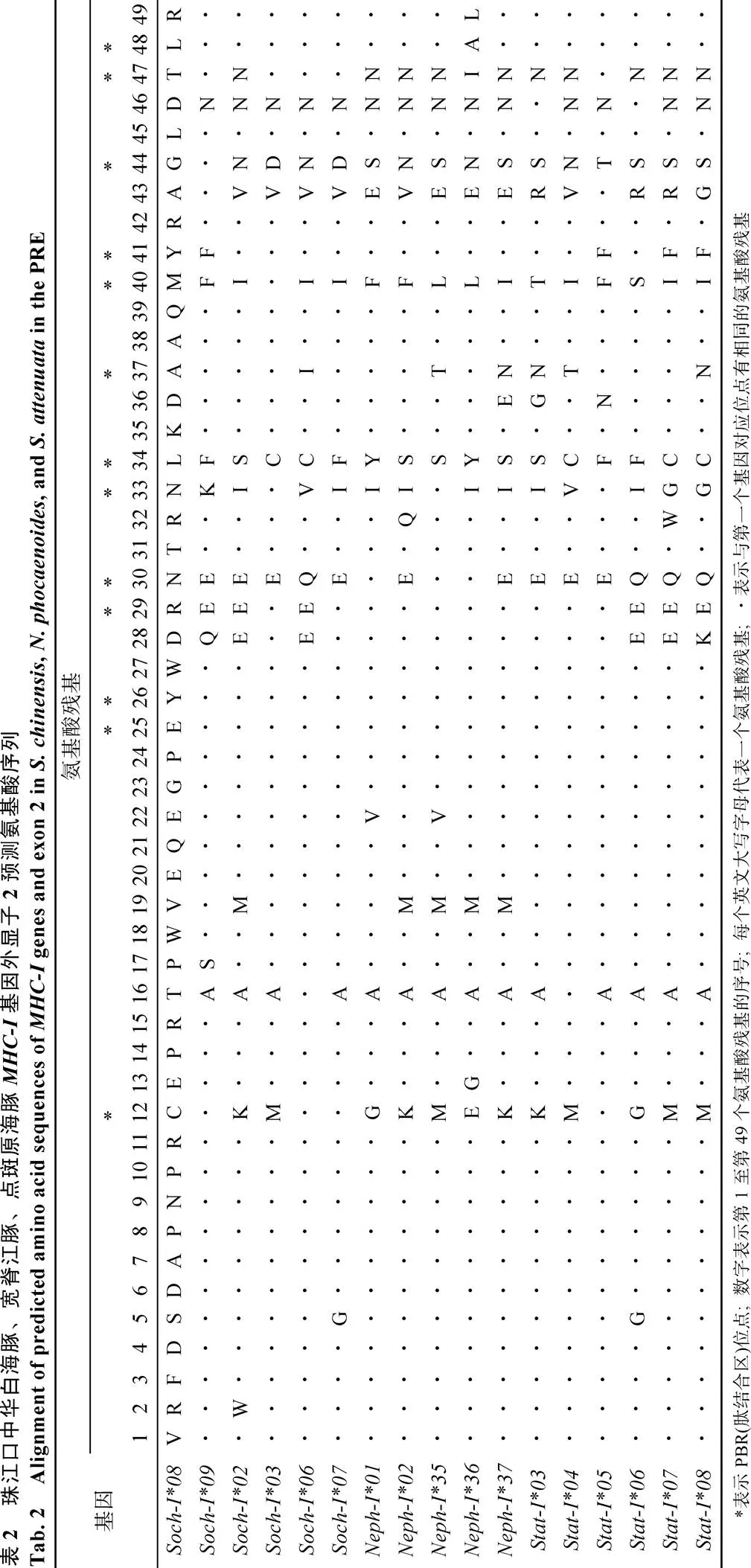
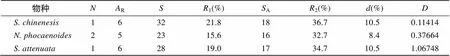
表3 珠江口中华白海豚、宽脊江豚、点斑原海豚MHC-I基因的多态性和选择作用参数
: 个体数量;R: 等位基因丰度;: 差异的碱基位点数;1:占总碱基数的比例;A: 差异的氨基酸位点数;2:A占总氨基酸残基数的比例;: 平均核苷酸差异;: Tajima检测统计值
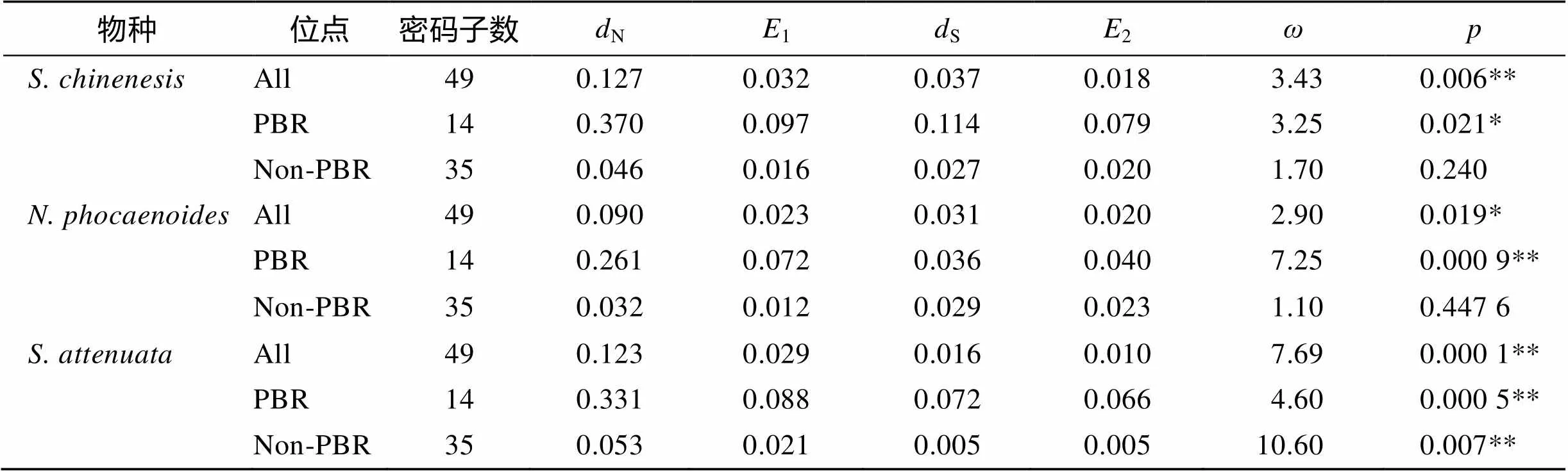
表4 珠江口3种鲸豚MHC-I基因、PBR区和非PBR区非同义替代与同义替代的估计值
N、S均根据Nei-Gojobori方法计算;N: 非同义替代率的估计值;S: 同义替代率的估计值;1、2: 1 000次重复计算N、S的标准误差;为N/S;为使用检验时接受零假设的可能性; *:<0.05, 显著水平; **:<0.01, 极显著水平
3 讨论
3.1 基因表达
本研究通过从新鲜样本肌肉中获取cDNA和gDNA, 扩增测序后发现这些cDNA序列与对应的gDNA外显子序列完全匹配, 排除假基因的可能性, 确认基因在珠江口3种常见鲸豚体内表达。一般来说, 脊椎动物均表达基因。目前, 关于鲸豚基因表达的研究还比较少。例如赫氏海豚[24], 在2个个体中仅发现1个共同的基因cDNA。有趣的是多种海豚中仅发现1~2条cDNA[15, 24], 而本研究中3种鲸豚均表达4条以上基因cDNA。这可能与珠江口生存的海豚接触病原体机会较高有关[25]。
3.2 基因位点数及基因变异
本研究的中华白海豚、点斑原海豚每个个体含有6个等位基因, 估计中华白海豚、点斑原海豚均至少有3个基因座位。这与Xu等人对中华白海豚基因座位估计的数目一致[8]。目前鲸豚中只有窄脊江豚()基因座位数被确定为4个, 然而各基因座位序列之间相似度较高[26]。
将珠江口中华白海豚种群与厦门等水域种群相比, 本研究发现有2个独有的等位基因, 但未发现厦门等水域共有的1个等位基因(GenBank: EF375574)[8]。与其他等位基因差异较大。
3.3 平衡选择
平衡选择作用于珠江口3种鲸豚基因主要有以下两方面的依据[27]。一方面是本研究的中华白海豚、宽脊江豚和点斑原海豚的基因外显子2和PBR区均检测到正选择作用。另一方面是本研究中的3种鲸豚基因存在跨物种多态性。一般来说平衡选择趋向于提高种群杂合度和在维持基因较高多样性中扮演重要角色[28-29]。中华白海豚、宽脊江豚和点斑原海豚均检测到多个等位基因, 结果与之吻合。PBR区具有重要功能是其检测到强烈平衡选择作用的原因, 而处于其毗连区的非PBR区的突变位点也可能更容易被保留[30]。这可能是导致在点斑原海豚的基因的非PBR区也检测到选择作用的原因。
3.4 跨物种多态性
系统发育树显示中华白海豚、宽脊江豚和点斑原海豚的基因外显子2序列并不按照物种分开, 而是与其他的鲸豚混杂在一起, 提示跨物种多态性的存在。跨物种多态性是指一些相同的或相似的等位基因在不同物种中同时存在。一般有3种可能的机制来解释这个现象。第一种机制是亲缘关系较近的物种具有相似的等位基因被认为是来自于共同祖先, 这种跨物种等位基因在物种形成之前就存在不同物种世系中[31]。本研究的3种鲸豚都隶属于齿鲸亚目, 它们亲缘关系较近, 所以跨物种多态性有可能是共同祖先造成。同样的机制也在其他鲸豚中发现[7]。第二种机制是趋同进化, 生物在应对相同的环境压力而产生相同的适应性变化[32]。尽管本研究的中华白海豚、宽脊江豚、点斑原海豚均为近岸型鲸豚, 但它们生存环境的特性并不相同, 因而面临不同的病原体压力。然而赫氏海豚、条纹原海豚为远洋性齿鲸, 其生存环境与近岸环境可能有较大差别。因而趋同进化并不适用于解释其基因跨物种多态性。第三种机制是渗透杂交。海豚较其他哺乳动物容易产生可育后代[33], 例如宽吻海豚和长吻真海豚()[34]。但通过多年对珠江口中华白海豚的监测, 我们并没有发现任何潜在的杂交后代。
综上所述, 珠江口水域的中华白海豚、宽脊江豚和点斑原海豚均生活在具有较大的病原体压力的近海环境中,基因的表达对于其抵抗病原体感染具有重要作用。珠江口的中华白海豚、宽脊江豚和点斑原海豚基因受到病原体介导的平衡选择作用, 对于维持基因多态性具有重要意义。3种鲸豚之间的基因存在跨物种多态性, 可能来源于它们的共同祖先。考虑到日益严峻的环境趋势[35-36],珠江口水域的中华白海豚、宽脊江豚和点斑原海豚的保育工作仍然任重道远。
致谢: 感谢香港海洋公园保育基金(OPCFHK)和广东珠江口中华白海豚国家级自然保护区管理局的大力支持。
[1] Prugnolle F, Manica A, Charpentier M, et al. Pathogen-driven selection and worldwideclass I diversity[J]. Current Biology, 2005, 15(11): 1022-1027.
[2] Radwan J, Biedrzycka A, Babik W. Does reduceddiversity decrease viability of vertebrate populations?[J] Biological Conservation, 2010, 143(3): 537-544.
[3] 牛宝珍, 杜民, 陈松林. 10 个半滑舌鳎家系基因多态性初步研究[J]. 海洋科学, 2015, 39(12): 70-76.Niu Baozhen, Du Min, Chen Songlin. Polymorphisms and balancing selection in the half-smooth tongue sole,[J]. Marine Sciences, 2015, 39(12): 70-76.
[4] 万玉玲, 季芳, 饶军华, 等. 中国不同地域恒河猴型部分等位基因的调查[J]. 动物学杂志, 2007, 42(2): 1-5. Wan Yuling, Ji Fang, Rao Junhua, et al. Typing of severalalleles of rhesus monkeys derived from different regions of China[J]. Chinese Journal of Zoology, 2007, 42(2): 1-5.
[5] Zhu Ying, Sun Dandan, Ge Yunfa, et al. Isolation and characterization of class Igenes in the giant panda ()[J]. Chinese Science Bulletin, 2013, 58(18): 2140-2147.
[6] Xu Shixia, Sun Peng, Zhou Kaiya, et al. Sequence variability at threeloci of finless porpoises ()[J]. Immunogenetics, 2007, 59(7): 581- 592.
[7] Xu Shixia, Ren Wenhua, Li Shuzhen, et al. Sequence polymorphism and evolution of three cetaceangenes[J]. Journal of Molecular Evolution, 2009, 69(3): 260-275.
[8] Xu Shixia, Zhang Peng, Li Shuzhen, et al. A preliminary analysis of genetic variation at threeloci of the Indo-Pacific humpback dolphin ()[J]. Acta Theriologica Sinica, 2009b, 29(4): 372.
[9] Zhang Xiyang, Lin Wenzhi, Zhou Ruilian, et al. Low major histocompatibility complex class II variation in the endangered Indo-pacific humpback dolphin (): inferences about the role of balancing selection[J]. Journal of Heredity, 2016, 107(2): 143-152.
[10] Parsons E, Jefferson T. Post-mortem investigations on stranded dolphins and porpoises from Hong Kong waters[J]. Journal of Wildlife Diseases, 2000, 36(2): 342- 356.
[11] Jefferson T, Hung S, Lam P. Strandings, mortality and morbidity of Indo-Pacific humpback dolphins in Hong Kong, with emphasis on the role of organochlorine contaminants[J]. Journal of Cetacean Research and Management, 2006, 8(2): 181-193.
[12] Lin Wenzhi, Chang Lihong, Frère C H, et al. Differentiated or not? An assessment of current knowledge of genetic structure ofin China[J]. Journal of Experimental Marine Biology and Ecology, 2012, 416: 17-20.
[13] 宋微波, 王崇明, 王秀华, 等. 栉孔扇贝大规模死亡的病原研究新进展[J]. 海洋科学, 2001, 25(12): 23-26. Song Weibo, Wang Congming, Wang Xiuhua, et al. New research progress on massive mortality of cultured scallop[J]. Marine Sciences, 2001, 25(12): 23-26.
[14] Van Bressem M F, Duignan P J, Banyard A, et al. Cetacean morbillivirus: current knowledge and future directions[J]. Viruses, 2014, 6(12): 5145-5181.
[15] Shirai K, Sakai T, Oike T. Molecular cloning of bottle-nosed dolphin ()class I cDNA[J]. Journal of Veterinary Medical Science, 1998, 60(10): 1093-1096.
[16] Floresramirez S, Urbanramirez J, Miller R. Major histocompatibility complex class I loci from the gray whale ()[J]. Journal of Heredity, 2000, 91(4): 279-282.
[17] Hall T A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J]. Nucleic Acids Symposium Series, 1999, 41: 95-98.
[18] Kennedy L J, Ryvar R, Gaskell R M, et al. Sequence analysis ofalleles indomestic cats from the United Kingdom[J]. Immunogenetics, 2002, 54(5): 348-352.
[19] Posada D, Crandall K. MODELTEST: testing the model of DNA substitution[J]. Bioinformatics, 1998, 14(9): 817-818.
[20] Ronquist F, Teslenko M, Van d M P, et al. MrBayes 3.2: efficient Bayesian phylogenetic inference and model choice across a large model space[J]. Systematic Biology, 2012, 61(3): 539-542.
[21] Bjorkman P J, Saper M A, Samraoui B, et al. Structure of the human class I histocompatibility antigen,-[J]. Nature, 1987, 329(6139): 506-512.
[22] Tamura K, Stecher G, Peterson D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology & Evolution, 2013, 30(4): 576-577.
[23] Figueroa F, Gúnther E, Klein J.polymorphism pre-dating speciation[J]. Nature, 1988, 335(6187): 265- 267.
[24] Heimeier D, Baker C S, Russell K, et al. Confirmed expression ofclass I and class II genes in the New Zealand endemic hector's dolphin ()[J]. Marine Mammal Science, 2008, 25(1): 68-90.
[25] 闫冬, 陈加林, 郑锐强, 等. 珠江口中华白海豚主要栖息地的细菌菌群结构[J]. 海洋环境科学, 2013, 32(1): 49-53. Yan Dong, Chen Jialin, Zheng Ruiqiang, et al. Bacterial community structure of main habitat forin the Zhujiang Estuary[J]. Marine EnvironmentalScience, 2013, 32(1): 49-53.
[26] Ruan Rui, Wan Xiaoling, Zheng Yang, et al. Assembly and characterization of theclass I region of the Yangtze finless porpoise ()[J]. Immunogenetics, 2016, 68(1): 77-82.
[27] Hughes A L, Nei M. Pattern of nucleotide substitution at major histocompatibility complex class I loci reveals overdominant selection[J]. Nature, 1988, 335(6186): 167-170.
[28] Hedrick P W. Balancing selection and[J]. Genetica, 1998, 104(3): 207-214.
[29] Muirhead C A. Consequences of population structure on genes under balancing selection[J]. Evolution, 2001, 55(8): 1532-1541.
[30] Charlesworth D. Balancing selection and its effects on sequences in nearby genome regions[J]. PLoS Genet, 2006, 2(4): e64.
[31] Klein J. Origin of major histocompatibility complex polymorphism: the trans-species hypothesis[J]. Human Immunology, 1987, 19(3): 155-162.
[32] Kriener K, O'hUigin C, Tichy H, et al. Convergent evolution of major histocompatibility complex molecules in humans and New World monkeys[J]. Immunogenetics, 2000, 51(3): 169-178.
[33] Amaral A, Sequeira M, Martínez-Cedeira J, et al. New insights on population genetic structure offrom the northeast Atlantic and phylogenetic relationships within the genus inferred from two mitochondrial markers[J]. Marine Biology, 2007, 151(5): 1967-1976.
[34] Zornetzer H R, Duffield D A. Captive-born bottlenose dolphin × common dolphin (×) intergeneric hybrids[J]. Canadian Journal of Zoology, 2003, 81(10): 1755-1762.
[35] 周涛, 韩彬, 刘新民, 等. 南中国海海水中多环芳烃的分布特征及源分析[J]. 海洋科学, 2014, 38(8): 39- 45. Zhou Tao, Han Bin, Liu Xinmin, et al. Distribution and origin of polycyclic aromatic hydrocarbons in the sea water of the South Sea[J]. Marine Sciences, 2014, 38(8): 39-45.
[36] Gui Duan, Yu Riqing, He Xuan, et al. Bioaccumulation and biomagnification of persistent organic pollutants in Indo-Pacific humpback dolphins () from the Pearl River Estuary, China[J]. Chemosphere, 2014, 114(22): 106-113.
Study ofpolymorphism in three cetaceans from the Pearl River Estuary, China
YU Xin-jian1, 2, 3, 4, ZHANG Xi-yang1, 2, 3, 4, LIN Wen-zhi1, 2, 3, 4, ZHOU Rui-lian1, 2, 3, 4, WU Yu-ping1, 2, 3, 4
(1. South China Sea Bio-Resource Exploitation and Utilization Collaborative Innovation Center, Zhuhai 519082, China; 2. Guangdong Provincial Key Laboratory of Marine Resources and Coastal Engineering, Zhuhai 519082, China; 3. Zhuhai Key Laboratory of Marine Bioresources and Environment, Zhuhai 519082, China; 4. School of Marine Sciences, Sun Yat-Sen University, Zhuhai 519082, China)
To gain the basic knowledge about cetacean conservation, we assessed the polymorphism and expression of the immunologic gene() in three cetaceans (,, and) around the Pearl River Estuary. We first confirmed the expression ofgenes in the three cetaceans by cloning and sequencing. After selection pressure analysis, we found that relatively strong positive selections have acted ongenes in these three cetaceans, suggesting their important immunologic function. Phylogenetic analysis showed that thegenes of the three cetaceans did not cluster to three branches according to species but were mixed up, which implies the existence of trans-species polymorphism (TSP). Together with the results of selection pressure analysis and TSP, we suggest that intense balancing selection has acted ongenes in these three cetaceans, which further maintained the polymorphism ofgenes.
cetaceans;(); expression; balancing selection
(本文编辑: 刘珊珊)
Apr. 24, 2016
[National Natural Science Foundation of China, No.41276147, No.41576128; Chinese White Dolphin Conservation Action Plan of the Ministry of Agriculture, No.2015; Ocean Park Conservation Fund Hong Kong, No.2013]
Q953
A
1000-3096(2016)10-0126-08
10.11759/hykx20160424001
2016-04-24;
2016-08-30
国家自然科学基金项目(41276147, 41576128); 农业部中华白海豚保护行动计划(2015); 香港海洋公园保育基金(2013)
余新建(1991-), 男, 江西抚州人, 硕士研究生, 主要从事海洋鲸豚保护遗传学研究, 电话: 15820590518, E-mail: earthclean@ 163.com; 张西阳, 与第一作者同等贡献, 博士研究生, 主要从事海洋鲸豚保护遗传学研究; 吴玉萍, 通信作者, 教授, E-mail: exwyp@ mail.sysu.edu.cn

