不同盐度条件下亚硝酸态氮与非离子氨对花鲈幼鱼的毒性实验
韩 枫, 黄杰斯, 温海深, 张美昭, 李吉方, 张凯强, 王 伟
不同盐度条件下亚硝酸态氮与非离子氨对花鲈幼鱼的毒性实验
韩 枫, 黄杰斯, 温海深, 张美昭, 李吉方, 张凯强, 王 伟
(中国海洋大学水产学院, 山东青岛266003)
在水温为25~31℃、pH 7.70~8.17、溶解氧≥5.0mg/L、自然光照的条件下, 作者采用半静水法研究了亚硝酸态氮与非离子氨在不同盐度条件下对花鲈(幼鱼(50.33 g±4.35 g)的急性毒性、半致死量浓度、安全质量浓度及不同盐度条件下氨氮胁迫对花鲈幼鱼耗氧率与排氨率的影响。结果表明, 花鲈幼鱼在盐度0、10、20时, 亚硝酸盐安全浓度分别为16.357、52.540、58.622 mg/L, 总氨氮安全浓度分别为0.794、4.625、5.163 mg/L, 非离子氨安全浓度分别为0.584、2.313、1.951 mg/L。实验结果说明, 盐度和氨氮联合胁迫对花鲈幼鱼的耗氧率、排氨率有显著影响, 盐度10时耗氧率和排氨率最低。
盐度; 花鲈()幼鱼; 亚硝酸态氮; 非离子氨; 急性毒性; 安全浓度; 氨氮胁迫
花鲈(), 又称海鲈, 寨花等, 曾用学名, 隶属鲈形目(Perciformes)、科(Serranidae)、花鲈属()。花鲈适温适盐性广, 在咸淡水、低盐度的河口地区有生长速度快, 肉质好等特点。在高密度养殖条件下, 水体富营养化、水中无机氮含量较高、盐度突变等因素引起病害频发的现象日益突出, 影响了花鲈产业健康发展。养殖水体中无机氮主要以非离子氨、铵态氮、亚硝酸氮和硝酸盐氮的形式存在, 其中亚硝酸态氮与非离子氨对于水生生物有着较大的毒害作用, 会抑制其生长与代谢[1-3], 是制约高密度养殖发展的主要因素之一。鱼类对氨氮的敏感性与所处环境的盐度相关, 水体中Na+和Ca2+的浓度会作用于鳃从而改变氨氮的通透性[4]。鱼类在早期生活阶段由于代谢能力相对较弱, 对环境变化较为敏感。本实验以花鲈幼鱼为实验材料, 主要研究不同盐度条件下亚硝酸态氮、非离子氨对花鲈幼鱼的急性毒性、半致死质量浓度和安全质量浓度; 探索不同盐度和氨氮联合胁迫对花鲈幼鱼耗氧率和排氨率的影响。通过该项研究, 查明花鲈幼鱼对亚硝酸氮和非离子氨敏感性程度, 为花鲈苗种培育过程中水质调控及提高花鲈幼鱼成活率提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 实验鱼
花鲈幼鱼来自珠海斗门河口渔业研究所, 为人工培育的苗种。经4个月的池塘养殖后(盐度0~5), 选取健康、活泼且个体大小相近(平均体质量50.33 g± 4.35 g)、发育程度相同的1 000尾幼鱼暂养于室内玻璃钢桶中, 并经过7 d驯化使环境盐度逐渐从4分别降低或提高至0、10、20。稳定后暂养7 d, 日投喂两次海水鱼配合饲料(粗蛋白≥41.0%), 日投喂量为体质量的4%, 每日换水100%。
1.1.2 实验环境条件
实验所需海水取自珠海近海; 淡水为珠海自来水厂供应的自来水。实验用水由海水与充分曝气的自来水依据所需盐度不同按一定比例配置而成。实验过程中水温变化范围为25~31℃; pH 7.70~8.17; 溶解氧≥5.0mg/L ; 实验采用室内自然光照。
1.1.3 实验药品与配置
实验用氯化铵 (NH4Cl) 和亚硝酸钠 (NaNO2) 为分析纯, 根据实验所需配制成相应浓度的非离子氨、亚硝酸氮的暴露溶液。具体规格与成分见表1。
1.2 实验方法
1.2.1 不同盐度下亚硝酸氮与非离子氨的急性毒性实验
急性毒性实验采用半静水法, 即每24 h更换全部实验液。为了避免饵料成分的影响, 实验前24 h停止投喂饵料, 实验期间不投饵, 微充气, 实验在30 L水箱中进行。为了确定浓度的大致范围, 先做预实验, 分别找出不同盐度条件下亚硝酸氮和非离子氨24 h的绝对致死浓度与最小致死浓度。
表1 试剂的规格和成分
依据预实验所得到的24h 绝对致死浓度和最小致死浓度, 以等对数间距法设置实验药物浓度。盐度0、10、20中每个盐度每个药物设5个浓度组和1 个对照组, 每个浓度组设3 个平行组, 每个浓度放鱼8 尾。在曝露过程中观察其行为、中毒症状和死亡效应。以镊子夹取花鲈幼鱼尾部无反应为死亡标准, 死亡个体及时从水中取出。
实验处理96 h。实验的前8 h 连续观察, 而后定时观察鱼的中毒症状, 记录其死亡率, 实验期间随时捞出死亡个体。
1.2.2 不同盐度下氨氮胁迫对花鲈幼鱼耗氧率和排氨率的影响
实验前48h停止投饵。呼吸代谢实验使用聚乙烯薄膜盖于水箱上方, 并密封, 取水采用虹吸的方式进行。实验分为0、10、20 3个盐度梯度, 每个盐度设5个浓度组(0、5、10、15、20 mg/L氨氮)处理, 每个处理3个平行, 每个平行放2尾鱼。另外每个浓度设置1个没有鱼的空白组。每次实验在每日12点进行, 温度25~31℃。实验开始后, 先进行120 min衰减处理适应环境呼吸, 使鱼恢复到正常稳定的状态, 避免移动鱼体带来慌乱造成实验结果误差。衰减处理后停氧封闭呼吸室, 并虹吸取水样, 60 min后再次虹吸取样(根据不同盐度、溶解氧情况, 虹吸间隔时间为30~60 min)。
1.2.3 数据采集
记录各组24、48、72、96 h的死亡率, 以=(′–)/(1–)计算平均死亡率(′为实验组死亡百分数,为对照组死亡百分数,为经校正后的死亡百分数)。采用碘量法测定溶解氧; 采用次氯酸钠氧化法测定氨氮浓度, 参考《海水水质标准》(GB3097- 1997)[5]采用换算氨氮浓度的方式计算非离子氨浓度。
1.3 数据分析
运用SPSS(19.0)对96h死亡率进行回归分析。以浓度的常用对数为横坐标, 死亡率的概率为纵坐标, 求出概率单位与实验液质量浓度对数的回归方程、各药物的半致死质量浓度(LC50)及各自的95% 可信限, 安全浓度=0.1×96hLC50。运用SPSS(19.0)对耗氧率和排氨率进行ANOVA单因素方差分析, 并进行DUNCAN多重比较, 以<0.05为有显著性差异; 所有数据用平均数±标准差表示(MeanSD), 最后用EXCEL2013作图。
2 结果
2.1 不同盐度下亚硝酸氮对花鲈幼鱼的急性毒性
2.1.1 死亡率
在不同盐度条件下, 暴露于不同亚硝酸氮浓度中的花鲈幼鱼96 h内的死亡率见表2。
从表2中可知, 各盐度组别的空白对照组中, 花鲈幼鱼死亡率均为0%。同一盐度下, 随着暴露浓度的增加, 死亡率升高; 同一盐度和暴露浓度下, 随着暴露时间的延长, 死亡率增加; 盐度、亚硝酸氮暴露浓度、亚硝酸氮暴露时间均对花鲈幼鱼的死亡率有影响。进行亚硝酸氮暴露后, 花鲈幼鱼出现一系列应激行为, 其中高浓度亚硝酸氮暴露组的中毒症状主要体现为: 运动活力降低、逐渐失去平衡; 瞳孔外圈灰色褪去, 体色发黑; 最后停止运动, 沉于箱底。
2.1.2 半致死浓度和安全浓度
如表3所示, 不同盐度下亚硝酸氮对花鲈幼鱼的96h LC50分别为: 盐度0时为16.357 mg/L, 盐度10时为52.540 mg/L, 盐度20时为58.622 mg/L。亚硝酸氮的毒性随着盐度的增加而降低, 但并无线性关系。花鲈幼鱼在盐度0、10、20时的亚硝酸氮安全浓度分别为1.636、5.254、5.862 mg/L。因此, 在盐度0~20时, 花鲈幼鱼对亚硝酸氮的敏感性随着盐度的降低而升高。
2.2 不同盐度下非离子氨对花鲈幼鱼的急性毒性
2.2.1 死亡率
在不同盐度条件下, 暴露于不同氨氮浓度中的花鲈幼鱼96 h内的死亡率见表4。

表2 不同盐度条件下亚硝酸氮对花鲈幼鱼的急性毒性
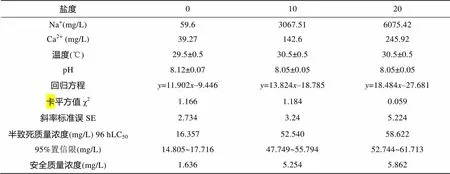
表3 不同盐度条件下亚硝酸氮对花鲈幼鱼半致死浓度LC50和安全质量浓度
各盐度的对照组中, 花鲈幼鱼均未出现死亡。同一盐度下, 随着暴露浓度的增加, 死亡率升高; 同一盐度和暴露浓度下, 随着暴露时间的延长, 死亡率增加; 盐度、氨氮暴露浓度、氨氮暴露时间均对花鲈幼鱼的死亡率有影响。进行氨氮暴露后, 花鲈幼鱼出现一系列应激行为, 其中高浓度氨氮暴露组的中毒症状主要体现为: 运动活力降低、逐渐失去平衡, 嘴大张、鳃盖张开, 体色发黑, 最后呼吸减弱, 侧卧于箱底。
2.2.2 半致死浓度与安全浓度
如表5所示, 不同盐度下总氨氮对花鲈幼鱼的96h LC50分别为: 盐度0时为7.941 mg/L; 盐度10时为46.254 mg/L; 盐度20时为51.632 mg/L; 在盐度0~20时, 总氨氮对花鲈幼鱼的毒性随着盐度的升高而减小; 花鲈幼鱼在盐度0、10、20时的总氨氮安全浓度分别为0.794、4.625、5.163 mg/L。因此, 在盐度0~20时, 花鲈幼鱼对总氨氮的敏感性随着盐度的升高而降低。不同盐度下非离子氨对花鲈幼鱼的96 hLC50分别为: 盐度0时为0.584 mg/L; 盐度10时为2.313 mg/L; 盐度20时为1.951 mg/L; 在盐度0~20时, 非离子氨对花鲈幼鱼的毒性随着盐度的升高先减小后增大; 花鲈幼鱼在盐度0、10、20时的非离子氨安全浓度分别为0.058、0.231、0.195 mg/L。因此, 在盐度10时, 花鲈幼鱼对非离子氨的敏感性最低。
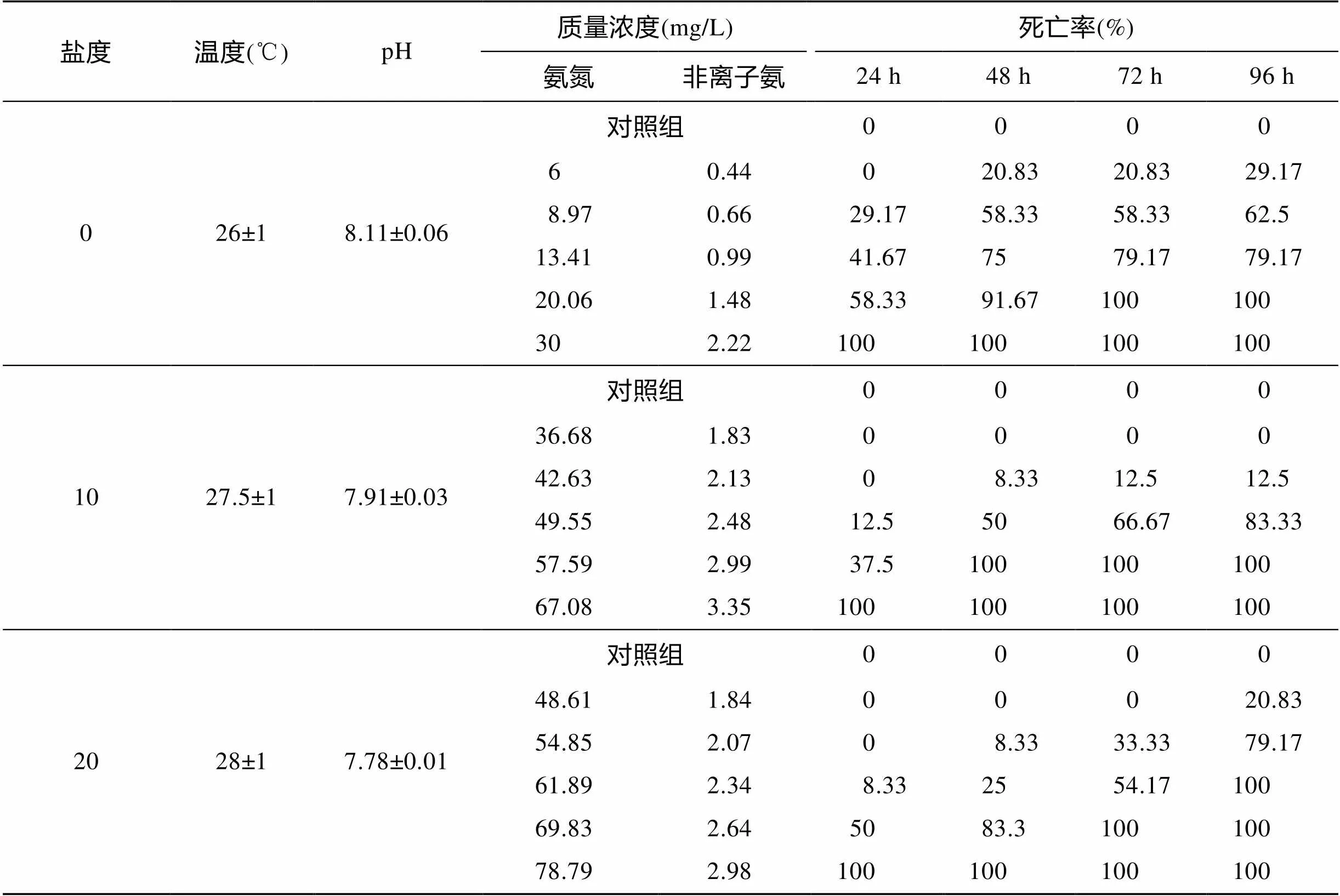
表4 不同盐度条件下非离子氨对花鲈幼鱼的急性毒性
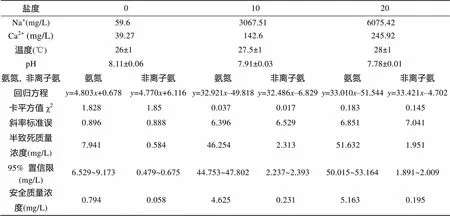
表5 不同盐度条件下非离子氨对花鲈幼鱼半致死浓度LC50和安全质量浓度
2.3 不同盐度下氨氮胁迫对花鲈幼鱼耗氧率的影响
同一盐度条件下, 随着氨氮浓度的增加, 耗氧率升高; 在0~15 mg/L的氨氮胁迫组中, 盐度10组的耗氧率最低, 盐度20组耗氧率最高; 在20 mg/L的氨氮胁迫组中, 盐度10组的耗氧率虽低于另外两组, 但与盐度0组的耗氧率无显著性差异(>0.05) (图1)。
数值用平均值±标准差表示, 标有不同字母的数值表示显著差异(<0.05) , 否则表示差异不显著(>0.05)
Values are mean ± SD. Different letters indicate significant difference (0.05), otherwise not significantly different (0.05)
2.4 不同盐度下氨氮胁迫对花鲈幼鱼排氨率的影响
同一盐度条件下, 随着氨氮浓度的增加, 排氨率降低; 在0~10 mg/L的氨氮胁迫组中, 盐度10组的排氨率最低, 盐度20组排氨率最高; 在15~20 mg/L的氨氮胁迫组中, 盐度10组的排氨率最低, 0盐度组和20盐度组的排氨率没有显著性差异(>0.05)(图2)。
3 讨论
3.1 不同盐度下亚硝酸氮对花鲈幼鱼的毒性影响
本实验中发现随着盐度的升高, 花鲈幼鱼对于亚硝酸氮敏感性降低, 耐受度升高。高盐度对亚硝酸盐毒性的缓解与以往对于广盐性海洋鱼类的研究结论相一致, 针对欧洲鳗鲡()[6]、美国红鱼()[7]、虱目鱼()[8]等的研究均得出类似结论。亚硝酸氮的毒理作用为: 生物生活环境中的亚硝酸氮浓度累积到一定程度, 可进入鱼体循环系统, 氧化血红蛋白中的Fe2+为Fe3+, 从而降低血红蛋白运输氧气的能力, 进而造成组织缺氧, 严重至窒息死亡。当环境中盐度较高时, Cl–浓度较高, 可以阻碍NO2-N从鳃和肠等组织中进入血液, 从而降低了NO2-N的对于生物运输氧的影响[9-11]; 也有研究认为高盐度中较高浓度的Ca2+也可以降低NO2-N的毒性[12]。
数值用平均值±标准差表示, 标有不同字母的数值表示显著差异(<0.05), 否则表示差异不显著(>0.05)
Values are mean ± SD. Different letters indicate significant differences (0.05), otherwise not significantly different (0.05)
3.2 不同盐度下非离子氨对花鲈幼鱼的毒性影响
氨氮在养殖水体中以离子铵(NH4+)和非离子氨(NH3)的形式存在, 两者可以相互转化, 其所占的比例受到压力、温度、盐度、pH的影响。研究证明非离子氨(NH3)的毒性是离子铵(NH4+)的300~400倍[13], 所以氨氮的毒性作用主要是由非离子氨(NH3)引起的。非离子氨的毒理作用为: 非离子氨不带电荷, 为脂溶性, 可通过鱼的鳃细胞膜进入机体, 导致鱼鳃对气体的通透性增加, 刺激鱼体兴奋, 使鱼发生痉挛[14]。另外环境氨氮增加会抑制鱼类的氨排泄, 血液中氨氮含量增加会导致血液pH上升、对鱼鳃表皮细胞以及鱼类其他组织细胞造成损伤[15]; 体液中NH4+取代K+, 天冬氨酸(NMDA)受体感受器过度活化, Ca2+大量进入细胞, 导致细胞死亡[16]。
本研究中发现花鲈幼鱼在盐度0~20时, 其对总氨氮的敏感性随着盐度(Na+浓度、Ca2+浓度)的升高而降低。在盐度10时, 花鲈幼鱼对非离子氨的敏感性最低。由于非离子氨在总氨氮中所占比例受到盐度等环境因子的影响, 花鲈幼鱼对总氨氮和非离子氨的敏感性出现了不同的变化规律, 在此仅对非离子氨进行讨论。本研究结果与缘边鲳鲹()[17]、北美鲳鲹()[18]中的研究结果相同, 这是因为高盐度环境中, Na+、Ca2+浓度较高, 有利于氨氮通过鳃上NH4+_Na+离子泵排出体外[19]; 另外广盐性硬骨鱼类, 其体液等渗点相当于盐度10~13[20], 在接近等渗点盐度时呼吸代谢水平相对较低, 耗氧率低、能量消耗少有利于机体在受到环境胁迫时维持自身内环境稳定。本研究结果与机鲻()[8]、条纹锯鮨()[20]中的研究结果不同, 可能是由于处理的盐度过高、与等渗点盐度差异较大, 掩盖了渗透压对非离子氨毒性影响(表6)。
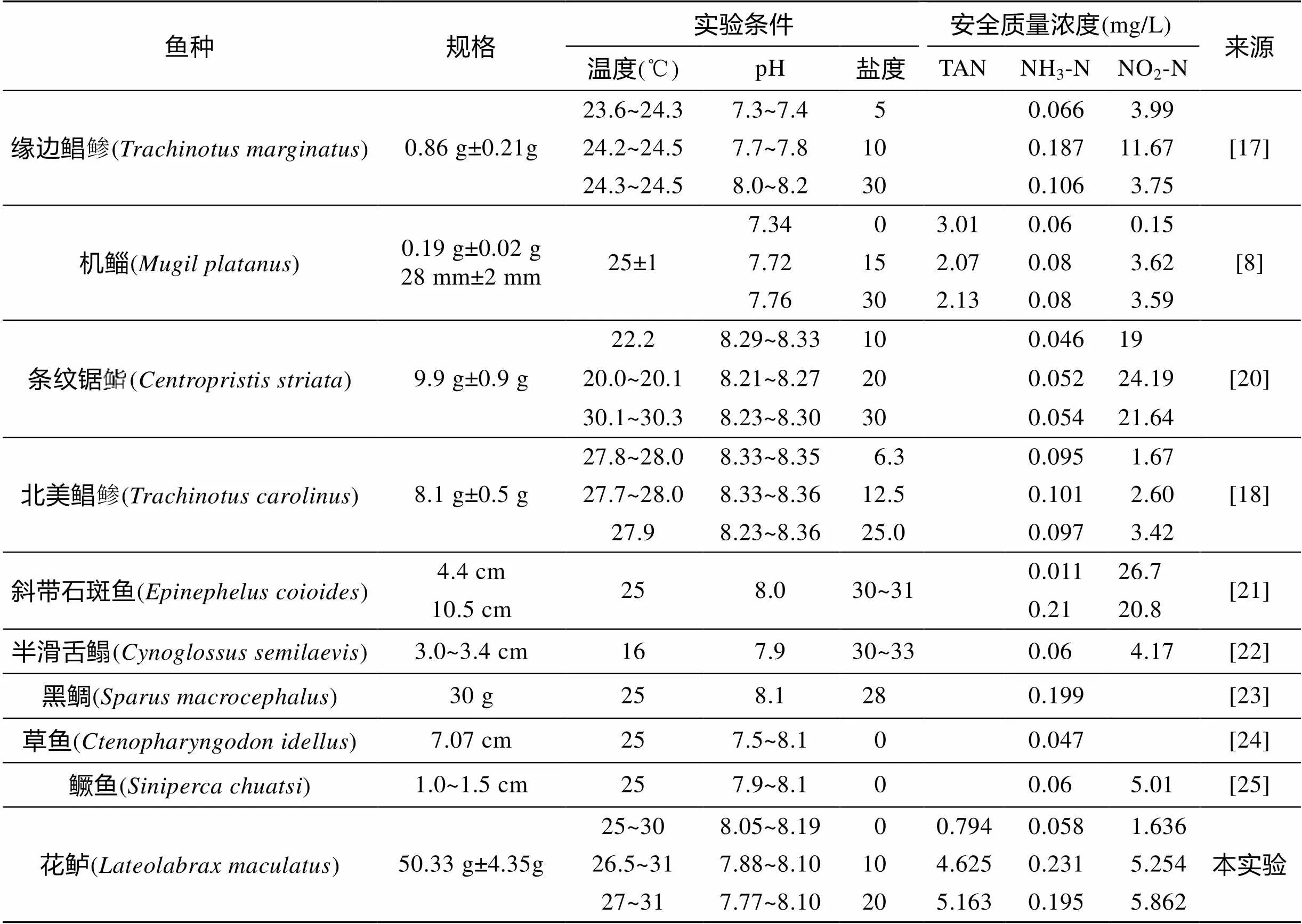
表6 不同鱼类对亚硝酸氮和非离子氨的安全质量浓度
3.3 不同盐度下氨氮胁迫对花鲈幼鱼耗氧率和排氨率的影响
本实验在不同盐度条件下的氨氮胁迫对花鲈幼鱼耗氧率和排氨率的影响中发现: 盐度、氨氮胁迫浓度、对幼鱼的耗氧率、排氨率有显著影响; 同一盐度条件下, 随着氨氮浓度的增加, 耗氧率升高, 排氨率降低。
这是因为氨氮胁迫抑制了鱼类血液中氨氮向外排放, 且需要提高代谢维持体内内环境稳定。在0~15 mg/L的氨氮胁迫组中, 盐度10组的耗氧率最低, 盐度20组耗氧率最高, 这与花鲈等渗点接近盐度10有关, 此盐度下花鲈可以减少因为调节渗透平衡所需要的能耗; 在20 mg/L的氨氮胁迫组中, 0盐度组和10盐度组的耗氧率没有显著性差异, 这可能是由于氨氮排放的耗氧需求逐渐增加, 抵消了10盐度组调节渗透平衡耗氧的节余。在0~10 mg/L的氨氮胁迫组中, 盐度10组的排氨率最低, 盐度20组排氨率最高, 同样是因为盐度10接近花鲈的等渗点; 在15~20 mg/L的氨氮胁迫组中, 盐度10组的排氨率最低, 0盐度组和20盐度组的排氨率没有显著性差异, 可能是15mg/L氨氮胁迫已达到盐度0时的花鲈幼鱼致死浓度, 造成花鲈幼鱼代谢紊乱。本研究结果与在军曹鱼()的研究中[26]所得结论相似。
3.4 盐度和氨氮联合胁迫对花鲈幼鱼的影响
本研究表明花鲈幼鱼在盐度0、10、20时, 亚硝酸盐安全浓度分别为16.357、52.540、 58.622 mg/L; 总氨氮安全浓度分别为0.794、4.625、5.163 mg/L; 非离子氨安全浓度分别为0.584、2.313、1.951 mg/L。盐度、氨氮胁迫浓度、均对花鲈幼鱼的耗氧率、排氨率有显著影响。花鲈在低盐度的河口地区有生长速度快, 肉质好等特点, 低盐度池塘养殖模式在中国南方得到广泛推广, 但是低盐度水体也会导致花鲈对氨氮的敏感性增加, 特别是在雨季时, 更应该加强养殖水质的调控管理。
[1] Chen J C, Lin C Y. Responses of oxygen consumption, Ammonia-N excretion and Urea-N excretion ofexposed to ambient ammonia at different salinity and pH levels[J]. Aquaculture, 1995, 136(3): 243-255.
[2] Huchette S M H, Koh C S, Day R W. Growth of juvenile blacklip abalone () in aquaculture tanks: effects of density and ammonia[J]. Aquaculture, 2003, 219(2): 457-470.
[3] Lemarié G, Dosdat A, Covès D, et al. Effect of chronic ammonia exposure on growth of European seabass () juveniles[J]. Aquaculture, 2004, 229(1-4): 479-491.
[4] Costa L D F, Miranda-Filho K C, Severo M P, et al. Tolerance of juvenile pompanoto acute ammonia and nitrite exposure at different salinity levels[J]. Aquaculture, 2008, 285(1): 270-272.
[5] 国家环境保护总局. GB3097-1997, 海水水质标准[S]. 北京: 中国标准出版社, 2002, 21. Ministry of Environmental Protection of the People’s Republic of China, GB3097-1997, Marine water quality standard[S]. Beijing: Standards Press of China, 2002, 21.
[6] Saroglia M G, Scarano G, Tibaldi E. Acute toxicity of nitrite to sea bass () and European eel ()[J]. Journal of the World Mariculture Society, 1981, 12(2): 121-126.
[7] Wise D J, Tomasso J R. Acute toxicity of nitrite to red drum: effect of salinity1[J]. Journal of the World Aquaculture Society, 1989, 20(4): 193- 198.
[8] Sampaio L A, Wasielesky W, Miranda-Filho K C. Effect of salinity on acute toxicity of ammonia and nitrite to juvenile[J]. Bulletin of Environmental Contamination and Toxicology, 2002, 68(5): 668-674.
[9] Tomasso J R. Toxicity of nitrogenous wastes to aquaculture animals[J]. Reviews in Fisheries Science, 1994, 2(4): 291-314.
[10] Grosell M, Jensen F B. Uptake and effects of nitrite in the marine teleost fish[J]. Aquatic Toxicology, 2000, 50(1): 97-107.
[11] Tomasso J R, Wright M I, Simco B A, et al. Inhibition of nitrite-induced toxicity in channel catfish by calcium chloride and sodium chloride[J]. The Progressive Fish-Culturist, 1980, 42(3): 144-146.
[12] 魏东, 白东清, 乔秀亭, 等. 亚硝酸盐对长尾墨金丝神仙幼鱼的急性毒性试验[J]. 水利渔业, 2007, 27(6): 98, 116. Wei Dong, Bai Dongqing, Qiao Xiuting, et al. Acute toxic effects of nitrite on juvenile[J]. Reservoir Fisheries, 2007, 27(6): 98, 116.
[13] Thurston R V, Phillips G R, Russo R C, et al. Increased toxicity of ammonia to rainbow trout () resulting from reduced concentrations of dissolved oxygen[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1981, 38(8): 983-988.
[14] Randall D J, Wright P A. Ammonia distribution and excretion in fish[J]. Fish Physiology and Biochemistry, 1987, 3(3): 107-120.
[15] Armstrong D A, Chippendale D, Knight A W, et al. Interaction of ionized and un-ionized ammonia on short-term survival and growth of prawn larvae,[J]. The Biological Bulletin, 1978, 154(1): 15-31.
[16] Randall D J, Tsui T K N. Ammonia toxicity in fish[J]. Marine Pollution Bulletin, 2002, 45(1): 17-23.
[17] Costa L D F, Miranda-Filho K C, Severo M P, et al. Tolerance of juvenile pompanoto acute ammonia and nitrite exposure at different salinity levels[J]. Aquaculture, 2008, 285(1): 270-272.
[18] Weirich C R, Riche M. Acute tolerance of juvenile Florida pompano,L., to ammonia and nitrite at various salinities[J]. Aquaculture Research, 2006, 37(9): 855-861.
[19] Maetz J, Romeu F G. The mechanism of sodium and chloride uptake by the gills of a fresh-water fish,II. Evidence for NH4+/Na+and HCO3–/Cl–exchanges[J]. The Journal of General Physiology, 1964, 47(6): 1209-1227.
[20] Weirich C R, Riche M A. Tolerance of juvenile black sea bassto acute ammonia and nitrite exposure at various salinities[J]. Fisheries Science, 2006, 72(5): 915-921.
[21] 郑乐云. 氨氮和亚硝酸盐对斜带石斑鱼苗的急性毒性效应[J]. 海洋科学, 2012, 36(5): 81-86. Zheng Leyun. Acute toxic effects of ammonia and nitrite onfry[J]. Marine Sciences, 2012, 36(5): 81-86.
[22] 徐勇, 张修峰, 曲克明, 等. 不同溶氧条件下亚硝酸盐和氨氮对半滑舌鳎的急性毒性效应[J]. 海洋水产研究, 2006, 27(5): 28-33. Xu Yong, Zhang Xiufeng, Qu Keming, et al. Acute toxic effects of nitrite and ammonia onat different dissolve oxygen levels[J]. Marine Fisheries Research, 2006, 27(5): 28-33.
[23] 龙章强. 黑鲷幼鱼对氨氮胁迫的生理响应及其维生素C的营养需求研究[D]. 上海: 华东师范大学, 2008. Long Zhangqiang. The physiological responses to ammonia stress and vitamin C requirement of juvenile black seabream ()[D]. Shanghai: East China Normal University, 2008.
[24] 周永欣, 张甫英, 周仁珍. 氨对草鱼的急性和亚急性毒性[J]. 水生生物学报, 1986, 10(1): 32-38. Zhou Yongxin, Zhang Fuying, Zhou Renzhen. Acute and subacute toxic effect of ammonia on[J]. Acta Hydrobiologica Sinica, 1986, 10(1): 32-38.
[25] 陈瑞明. 铵态氮和亚硝酸盐氮对鳜鱼苗的急性毒性试验[J]. 水利渔业, 1998, 1: 17-20. Chen Ruiming. Acute toxic effects of nitrite and ammonium on juvenile[J].Reservoir Fisheries, 1998, 1: 17-20.
[26] Barbieri E, Doi S A. Acute toxicity of ammonia on juvenile cobia (, Linnaeus, 1766) according to the salinity[J]. Aquaculture International, 2012, 20(2): 373-382.
Toxicity of unionized ammonia and nitrite on juvenileaccording to salinity
HAN Feng, HUANG Jie-si, WEN Hai-shen, ZHANG Mei-zhao, LI Ji-fang, ZHANG Kai-qiang, WANG Wei
(Fisheries College, Ocean University of China, Qingdao 266003, China)
The toxicity of unionized ammonia and nitrite on juvenile(weighing 50.33 ± 4.35 g) was studied at different salinity levels of 0, 10, and 20. The effects of salinity (0, 10 and 20) and ammonia exposure (0, 5, 10, 15 and 20 mg/L) on oxygen consumption and ammonia excretion of juvenilewere also evaluated.The results showed that the safe concentration values of nitrite forat salinity levels of 0, 10 and 20 were 16.357, 52.540 and 58.622 mg/L, respectively. The safe concentration values of ammonia–N (unionized plus ionized ammonia as nitrogen) forat salinity levels of 0, 10 and 20 were 0.794, 4.625 and 5.163 mg/L, respectively. The safe concentration values of ammonia–N (unionized plus ionized ammonia as nitrogen) forat salinity levels of 0, 10 and 20 were 0.584, 2.313 and 1.951 mg/L, respectively. The oxygen consumption and ammonia excretion of juvenilewere significantly affected by salinity and ammonia exposure. Oxygen consumption and ammonia excretion reached the minimum values at salinity level of 10.
Salinity; juvenile; nitrite; unionized ammonia; acute toxicity; safe concentration; ammonia exposure
(本文编辑: 谭雪静)
Sept. 20, 2015
[Key Projects in the National Science & Technology Pillar Program during the Twelfth Five-year Plan Period, No. 2011BAD13B03]
S968.25
A
1000-3096(2016)10-0008-08
10.11759//hykx20150920001
2015-09-20;
2016-01-07
国家“十二五”国家科技支撑计划重大项目课题(2011BAD13B03)
韩枫(1992-), 男, 内蒙古通辽人, 硕士研究生, 主要从事鱼类生理学研究, E-mail: hanfeng21g@foxmail.com; 温海深, 通信作者, 教授, E-mail: wenhaishen @ouc.edu.cn

