番茄转录因子基因SlYAB2 a 的克隆、表达及亚细胞定位分析
胡廷章,秦 娟,陈再刚,黄小云
(重庆三峡学院 生命科学与工程学院,重庆 404100)
番茄转录因子基因SlYAB2 a 的克隆、表达及亚细胞定位分析
胡廷章,秦 娟,陈再刚,黄小云
(重庆三峡学院 生命科学与工程学院,重庆 404100)
为了研究番茄SlYAB2a基因的功能及其在番茄生长发育中的分子机理,以番茄的cDNA为模板,利用RT-PCR技术从番茄中克隆到SlYAB2a基因,该基因编码的蛋白质由192个氨基酸残基组成,蛋白质的分子量为21.35 kDa,等电点是8.79,平均亲水系数是-0.487。SlYAB2a蛋白质的6~165位氨基酸残基形成Pfam:YABBY结构域,在20~47位有1个C2C2锌指结构域,在122~181位有1个螺旋-环-螺旋结构域。二级结构分析表明SlYAB2a蛋白分子中,α-螺旋占19.79%、β-折叠占14.06%、其余66.15% 为不规则卷曲。蛋白多序列比对表明SlYAB2a与马铃薯、林烟草、酿酒葡萄、大豆、拟南芥、甘蓝型油菜、花药野生稻、玉米和小麦YABBY2的一致性分别为98%,78%,71%,65%,64%,64%,58%,57%,57%,说明SlYAB2a蛋白与来源于双子叶植物的YABBY2一致性较高,而与来源于单子叶植物的一致性较低。通过聚类分析发现YABBY2蛋白明显分为单子叶和双子叶2个亚类,SlYAB2a蛋白属于双子叶亚类,与马铃薯、潘那利番茄、绒毛状烟草、林烟草等的YABBY2蛋白序列亲缘关系较近。实时定量RT-PCR 分析结果表明,在番茄植物的不同生长发育时期,根、茎、叶、花、果实中,都有SlYAB2a基因表达;并且在花和青熟果实中,SlYAB2a基因表达水平远远高于其他组织。说明SlYAB2a基因在花和果实的发育过程中起着重要作用。洋葱表皮细胞瞬时表达结果表明SlYAB2a蛋白定位于细胞核中。
番茄;SlYAB2a;基因克隆;表达分析;亚细胞定位
高等植物的叶和花属于侧生器官,极性建立的过程是侧生器官形态建成中的核心问题,也是植物发育生物学研究的热点。侧生器官的形成起始于植物的顶端分生组织,器官分化过程中需要建立基-顶轴、近-远轴和中-侧轴3个体轴极性[1]。在侧生器官发育中,近-远轴分化非常关键,因此,这一过程的研究备受关注。在植物中已经分离出一系列在近-远轴极性建立中起重要作用的基因。如MYB 家族中的PHAN和AS1 基因及其同源异型结构域-亮氨酸拉链蛋白基因PHB、PHV、REV促进近轴面分化;KAN 家族中KAN1、KAN2、KN3基因和YABBY 家族中的YAB2、YAB3、FIL、CRC基因与侧生器官远轴面的分化有关,这类基因的突变将导致侧生器官极性分化功能丧失和异常侧生分生组织形成[2]。
YABBY是种子植物特有的一类转录因子,在控制侧生器官远-近轴极性建立中发挥重要作用,参与植物叶、枝和花的发育[3]。已经从拟南芥[4-5]、水稻[6-7]、小麦[8]、玉米[9]、大白菜[10]、箭叶淫羊藿[11]、豌豆[12]、菜薹[13]等许多植物中分离到YABBY基因家族成员。YABBY家族基因编码一段N端含有1个C2C2锌指结构域且C端含有1个螺旋-环-螺旋YABBY结构域的转录因子[4]。拟南芥植物有CRC、FIL(YAB1)、YAB2、YAB3、INNER NO OUTER(INO)和YAB5 6个YAB基因家族成员,分为CRC、YAB2、FIL/YAB3、INO和YAB5 5个亚家族。根据基因的表达模式也将5个亚家族分为两类:一类包含CRC和INO,它们只在花器官中表达;而另一类包括FIL、YAB2和YAB5,它们也在营养组织中表达[14]。酵母双杂交研究表明,拟南芥营养组织表达的YAB2、YAB3和YAB5蛋白可以与SLK1、SLK2和SLK3蛋白互作,FIL、YAB3和YAB5与LUG 和LUH可以互作[15]。LUG-YAB复合物阻止KNOX在叶中表达,LUG-YAB也可以调节转录因子CUC活性,进而调节LAS基因;LUG-YAB复合物也调控KANs、ETT/ARF4基因。LUG-YAB复合物在保持叶的极性和分生组织活性上发挥作用[15]。
本试验以番茄(SolanumlycopersicumMill.Cv.Ailsa Craig,AC++)为试材,根据查找到的SlYAB2a基因候选序列,克隆到SlYAB2a基因的cDNA序列,分析了该基因编码的蛋白序列,进一步检测了SlYAB2a基因的表达模式及其表达蛋白的亚细胞定位。
1 材料和方法
1.1 植物试材及其SlYAB2a基因的克隆
试验在重庆三峡学院园艺植物生理生化实验室进行,试验时间为2014 年3-10 月。将番茄种子播种到装有营养土的花钵中,于自然条件下生长。分别取番茄幼苗的根、茎、叶,以及成苗植株的成熟叶、花、青熟期果实和成熟红果,用于提取RNA。
采用TRIzol法提取各个组织的总RNA,RNAase-Free H2O 溶解RNA,利用紫外分光光度计法测定其浓度和纯度,用1.0%变性琼脂糖凝胶电泳的结果判断RNA的完整性。SuperscriptTMⅢ RNase H-Reverse Transcriptase kit(Invitrogen,USA)用于合成cDNA。
根据查找到的SlYAB2a(Accession No.AK328263) 基因的候选序列,采用在线工具(http://www.bio-soft.net/sms/)预测基因序列的开放阅读框(ORF),在ORF 两端设计扩增编码区的上游引物YAB2a F(5′-CTTTTACTTCTAATTCTTCGATCCG-3′)和下游引物YAB2a R(5′-TAATTAATAGAGACCAATTGTTTTC-3′),以番茄幼苗的cDNA为模板进行SlYAB2a基因CDS 序列的扩增。PCR 反应程序为:94 ℃ 2 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 60 s,32次循环;72 ℃延伸5 min。用1% 琼脂糖凝胶电泳分离PCR扩增产物,回收预期大小的扩增产物进行克隆、转化和测序鉴定。
1.2SlYAB2a序列分析及蛋白质结构分析
SlYAB2a基因核苷酸翻译采用序列处理在线工具(http://www.bio-soft.net/sms),用SMART进行蛋白质的结构域分析(http://smart.embl-heidelberg.de/),氨基酸成分、蛋白分子量、等电点、不稳定系数、脂溶指数和亲水系数利用在线工具(http://web.expasy.org/protparam),一致性和同源性计算利用NCBI网站GenBank数据库的Blast程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi),在线构建蛋白亲水性图谱(http://ipsort.hgc.jp)、预测二级结构(http://www.ibi.vu.nl/programs)和预测蛋白的胞内定位(http://wolfpsort.seq.cbrc.jp/),多序列比对和进化树构建采用在线工具(http://www.ebi.ac.uk/Tools/msa/clustalo)。
1.3 RT-PCR检测SlYABa基因的表达
以cDNA为模板,用引物YAB2a qf(5′-ATCATC ATCCTCTTCTACAA-3′)和 YAB2a qr(5′-TTGCTTG CCTTTATCCTTTG-3′)进行定量PCR反应,扩增SlYAB2a基因片段的长度为165 bp。以番茄Actin基因作为内标基因同时进行定量PCR反应,参照GenBank中番茄的Actin序列(U60480),设计引物ActinF(5′-TGAAATGTGACGTGGATATTAGG-3′)和ActinR(5′-TGAGGGAAGCCAAGATAGAGC-3′),扩增的ACTIN1基因片段长度应为201 bp。琼脂糖凝胶电泳检测PCR扩增产物和引物的特异性。定量PCR分析的反应体系和反应程序参考胡廷章等[16]的方法,所有PCR 反应都设3次重复。
1.4 SlYAB2a 的亚细胞定位
依据SlYAB2a基因序列,设计带有酶切位点SacⅠ的上游引物YAB2a yf(5′-AATGCGAGCTCCTTTTAC TTCTAATTCTTCGATCCG-3′)和酶切位点BamH Ⅰ的下游引物YAB2a yr(5′- AATCGGGATCCATAGAG ACCAATTGTTTTC-3′),扩增基因的编码序列,克隆到pCAMBIA1301-GFP 载体的SacⅠ/BamH Ⅰ酶切位点之间,得到pCAMBIA1301-SlYAB2a-GFP重组表达载体。利用农杆菌EHA105介导的洋葱表皮细胞的转化[17]。28 ℃孵育24 h 后,用共聚焦显微镜(Nikon Eclipse TE2000-E)观察和拍照,照片的分析和处理采用EZ-C1 software 软件。
2 结果与分析
2.1 克隆SlYAB2a基因全长cDNA 序列
利用RT-PCR技术,从番茄幼苗中扩增出预期大小的序列片段(图1)。测序结果表明,分离到的片段长度为 636 bp,与预测的序列一致。证明克隆到的片段为所需的目的片段,命名为SlYAB2a。
2.2 SlYAB2a蛋白质特性分析
利用生物学信息软件分析SlYAB2a 蛋白质特性。番茄SlYAB2a包含1个579 bp读码框,编码的蛋白肽链由192个氨基酸残基组成,包含20 种氨基酸,其中Ser为27 个(14.1%),远远高于第二的Ile和Pro(都为13 个,占6.8%),含量最低是Trp,只有1个(0.5%)。蛋白肽链的分子量为21.35 kDa,等电点是8.79。蛋白的不稳定参数为59.30,属于典型的不稳定蛋白;脂溶指数(Aliphatic index)为69.58,是脂溶蛋白。SlYAB2a蛋白的平均亲水系数是-0.487。用在线网站http://ipsort.hgc.jp构建的蛋白亲水性图谱也显示该蛋白N-末端有2个疏水区域,C-末端有3个亲水区域,且大部分区域亲水性比较强,倾向于亲水性的蛋白(图2)。因此,该蛋白为亲水蛋白。分析SlYAB2a蛋白的二级结构表明,SlYAB2a蛋白分子中,α-螺旋占19.79%、β-折叠占14.06%、其余66.15% 为不规则卷曲。亚细胞定位分析表明,SlYAB2a 蛋白定位于细胞核。
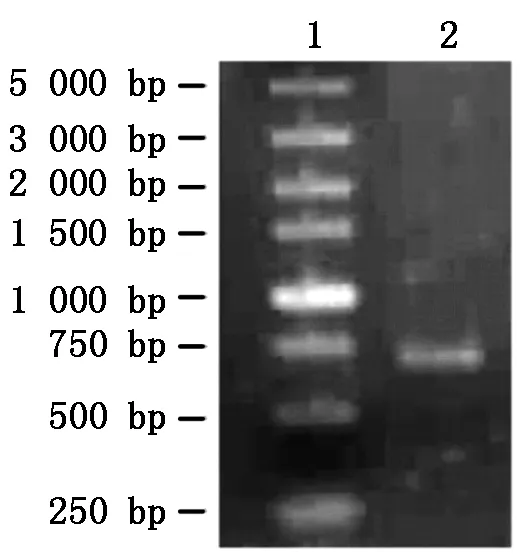
1.DNA分子量标准;2.RT-PCR扩增产物。1.DNA Marker;2.Product of RT-PCR.
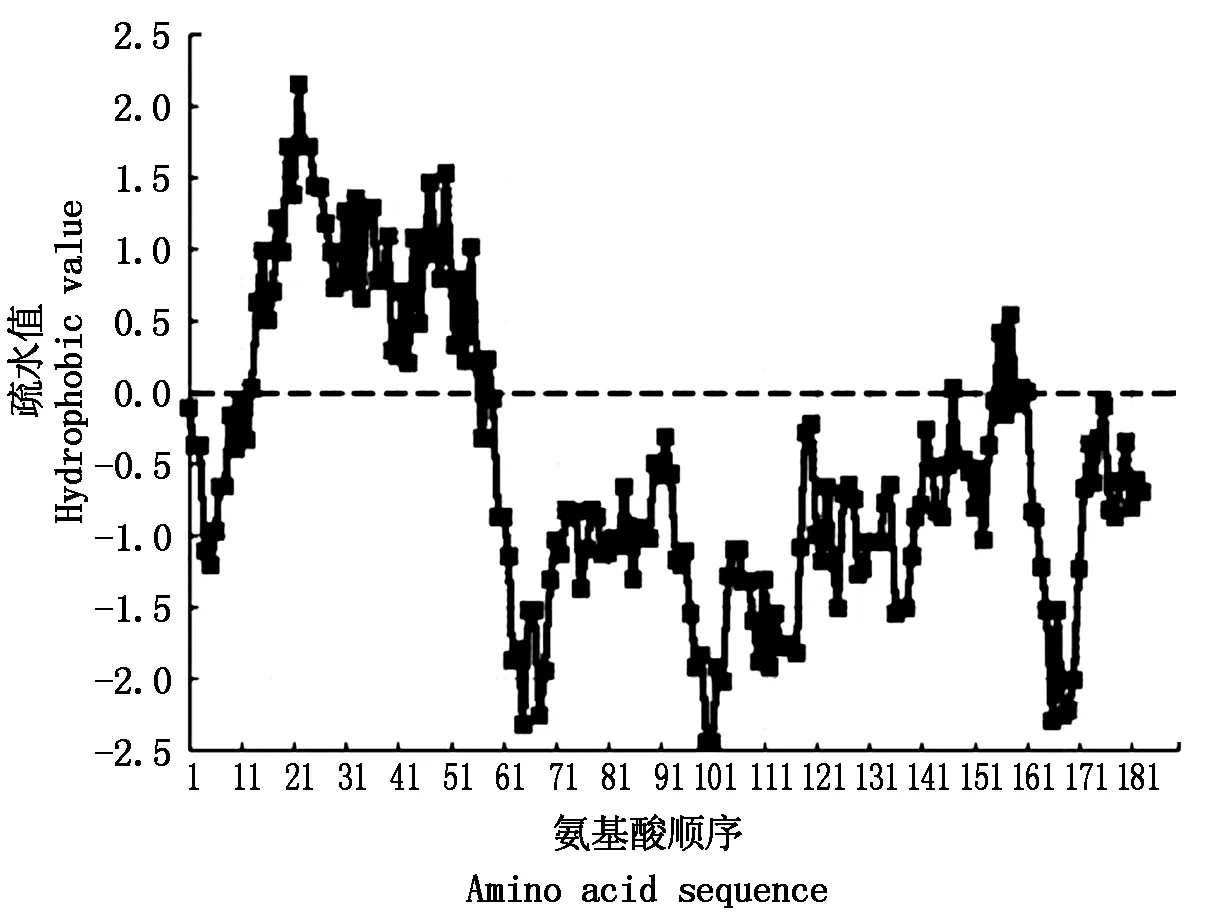
图2 SlYABa蛋白的疏水性/亲水性分析Fig.2 Hydrophobicity/hydrophilicity profile of SlYAB2a
在NCBI上Blast 分析表明该蛋白与多种植物的YABBY2转录因子有较高同源性。对SlYABa 功能域结构分析表明,该蛋白质具有YABBY转录因子家族的结构特征,即在6~165位氨基酸具有Pfam:YABBY(PFAM accession number:PF04690)结构域,在靠近N端的20~47位氨基酸有1个C2C2锌指结构域(SMART accession number:SM00184),在靠近C端122~181位氨基酸有1个螺旋-环-螺旋结构域(SMART accession number:SM00674)(图3)。

图3 SlYAB2a基因的核苷酸序列及推测的氨基酸序列Fig.3 Nucleotide sequence and deduced amino acid sequence of SlYAB2a gene

★.SlYAB2a;星号.完全相同的氨基酸残基;冒号.高度保守的氨基酸残基;圆点.不太保守的氨基酸残基;破折号.为了实现更好的比对。GenBank 登录号:拟南芥.NP_001077490;甘蓝型油菜.XP_013710950;大豆.XP_006594909;酿酒葡萄.XP_010651638;番茄.XP_004241356;马铃薯.XP_006361110;林烟草.XP_009792037;玉米.ACG32970;花药野生稻.XP_006650352;小麦.ABW80974。
★.SlYAB2a;Asterisk.Identical residues;Colon.Highly conserved residues;Dot.Weakly conserved residues;Dash.Gaps introduced for optimal alignment.The GenBank accession No.Arabidopsisthaliana.NP_001077490;Brassicanapus.XP_013710950;Glycinemax.XP_006594909;Vitisvinifera.XP_010651638;Solanumlycopersicum.XP_004241356;Solanumtuberosum.XP_006361110;Nicotianasylvestris.XP_009792037;Zeamays.ACG32970;Oryzabrachyantha.XP_006650352;Triticumaestivum.ABW80974.
图4 SlYAB2a与其他植物YABBY2蛋白的氨基酸序列对比分析
Fig.4 Analysis of Alignment of deduced SlYAB2a protein with other YABBY2 proteins from plants
2.3 SlYAB2a蛋白序列的同源比对和系统进化树分析
用不同植物来源YABBY2蛋白的氨基酸序列进行同源性比对分析,表明它们的同源性较高(图4)。在靠近N端的锌指结构域和在靠近C端的螺旋-环-螺旋结构域比较保守(图3)。一致性分析表明SlYAB2a与马铃薯、林烟草、酿酒葡萄、大豆、拟南芥、甘蓝型油菜、花药野生稻、玉米和小麦YABBY2的一致性分别为98%,78%,71%,65%,64%,64%,58%,57%,57%。说明YABBY2与双子叶植物YABBY2的一致性高,而与单子叶植物来源的一致性较低。
为了了解SlYAB2a蛋白与不同植物来源YABBY2蛋白间的亲缘关系,构建了系统进化树,结果表明:YABBY2蛋白分为明显的2个亚类,即单子叶亚类和双子叶亚类。SlYAB2a编码的蛋白属于双子叶亚类,与马铃薯、潘那利番茄、绒毛状烟草、林烟草等的YABBY2蛋白序列亲缘关系较近(图5)。

★.SlYAB2a;紧接在物种名后的为蛋白的GenBank上登录号。★.SlYAB2a;The accession No.in GenBank is next to the scientific names of the organism.
2.4SlYAB2a在番茄组织中的表达
定量RT-PCR分析表明,在番茄幼苗的根、茎、幼叶,以及成苗植株的成熟叶、花、青熟果实和成熟红果都能检测到SlYAB2a基因的表达,说明SlYAB2a基因在番茄植株的不同组织中都能表达。但SlYAB2a在不同组织中的表达量存在很大差异。在番茄的根、茎中只有少量的表达,表达最低;而在花和青果中的表达远远高于其他的组织器官,分别达到根的74.76,39.90倍;特别是花中的最高,达到青果的1.87倍(图6)。说明SlYAB2a基因在番茄植物的花和果实发育中起着重要作用。
2.5 SlYAB2a蛋白的亚细胞定位
通过农杆菌EHA105介导将载体转化至洋葱表皮细胞内,结果表明,被pCAMBIA1301-GFP 载体转化的洋葱表皮细胞内的绿色荧光分布在细胞膜、细胞质、细胞核中,在被pCAMBIA1301-SlYAB2a-GFP 载体转化的洋葱表皮细胞中检测到绿色荧光只分布在细胞核中(图7),推测番茄SlYAB2a 蛋白定位于细胞核。

图6 实时定量 RT-PCR 分析番茄SlYAB2a基因的表达模式Fig.6 Quantitative real-time RT-PCR analysis of the expression profiling of SlYAB2a gene
3 结论与讨论
根据查找到的番茄SlYAB2a基因候选序列,采用RT-PCR技术从番茄中克隆到SlYAB2a基因的cDNA序列。其推测的蛋白质具有YABBY转录因子家族的结构特征,即有Pfam:YABBY结构域,在靠近N端有1个C2C2锌指结构域,在靠近C端有1个螺旋-环-螺旋结构域。说明SlYAB2a属于植物YABBY蛋白家族。同源性分析表明,与SlYAB2a同源性较高的YABBY2蛋白来源于马铃薯、林烟草、酿酒葡萄、大豆、拟南芥。系统进化树分析表明,SlYAB2a与双子叶植物的YABBY2蛋白亲缘关系近,而与单子叶植物的YABBY2蛋白亲缘关系相对较远,与马铃薯YABBY2的亲缘关系最近。亚细胞定位研究表明SlYAB2a蛋白定位于细胞核。进一步说明SlYAB2a属于转录因子YABBY家族的YABBY2亚家族。
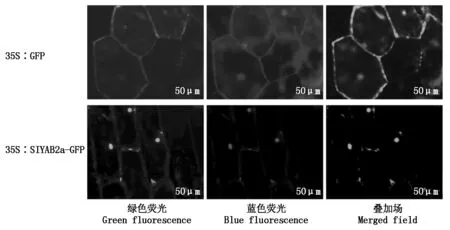
图7 GFP 和SlYAB2a 基因分别在洋葱表皮细胞中的瞬时表达Fig.7 The transient expression of GFP and SlYAB2a gene in onion epidermal cells
已有的研究表明,植物YABBY家族基因的表达模式各不相同,在植物发育和形态建成中具有不同的功能。FIL(YAB1)/YAB3和YAB5亚家族主要参与叶的形态建成,与双子叶植物和单子叶禾本植物的叶片发生有关[8,18]。拟南芥FIL、YAB2、YAB3和YAB5基因主要在侧生器官远轴组织中表达,它们在激活薄层生成,抑制顶端分生组织生长以及叶边缘形成中是不可或缺的[14,18]。拟南芥FIL是参与正调控和负调控的双功能转录因子,控制侧生器官的发育[19]。拟南芥FIL和YAB3基因突变引起包括叶序畸形的一系列缺陷表型[20],异位表达FIL或YAB3基因引起远轴型细胞的异常分化[5]。大白菜的BraYAB1-702基因在拟南芥中的异位表达,引起拟南芥叶弯曲,抑制SAM,延迟花期[10]。菜薹CtYABBY1是雄性不育的负调控基因,也是温度敏感基因,低温处理可以提高该基因的表达,恢复植物的繁殖能力[13]。小麦TaYAB1基因和野生葡萄VpYABBY1基因在拟南芥中的表达引起叶片近轴面细胞趋向于远轴面的特征[8,21]。水稻YAB3是叶细胞生长和分化不可缺少的[7];水稻TOB1属于YAB3亚家族,在水稻小穗发育中起重要作用[22]。拟南芥CRC在蜜腺及心皮远轴面中特异表达,控制蜜腺及心皮的发育[4,23]。豌豆CRC控制心皮、柱头和蜜腺的发育[12]。花菱草基因EsCRC在心皮的发育和萼片的形成中起着重要作用[11]。水稻基因DROOPING LEAF(DL)属于CRC/DL亚家族,DL突变体表现为心皮转化为雄蕊和叶片的中脉缺失[6,24]。拟南芥INO在外珠被层表达,INO亚家族主要参与远轴端外珠被的形态建成,在被子植物外被形成过程中起着关键作用[25]。已有的研究结果表明,YABBY家族基因在种子植物形态建成中发挥重要作用,YABBY参与植物侧生器官叶和花的发育。
在本研究定量PCR分析结果表明,SlYAB2基因在番茄的根、茎、叶、花和果实中均有表达,但在花和青果中的表达明显高于其他的组织器官。基因在组织器官中的表达与其行使的功能是密切相关的。当1个基因在某一组织或器官中特异表达或表达显著高于其他部位时,该基因往往在这一组织或器官行使的功能是不可或缺的。由于YABBY家族基因在种子植物形态建成中发挥重要作用。因此,有理由相信SlYAB2a转录因子在番茄花和果实发育的调控中发挥重要的作用。下一步将通过转基因技术,验证SlYAB2a在植物体内的生理功能。
[1] Eshed Y,Baum S F,Perea J V,et al.Establishment of polarity in lateral organs of plants[J].Current Biology,2001,11(16):1251-1260.
[2] Morioka K,Yockteng R,Almeida A M,et al.Loss of YABBY2-Like gene expression May underlie the evolution of the laminar style in canna and contribute to floral morphological diversity in the zingiberales[J].Frontiers in Plant Science,2015,6:1106.
[3] Bartholmes C,Hidalgo O,Gleissberg S.Evolution of theYABBYgene family with emphasis on the basal eudicotEschscholziacalifornica(Papaveraceae) [J].Plant Biology,2012,14(1):11-23.
[4] Bowman J L,Smyth D R.CRABS CLAW,a gene that regulates carpel and nectary development inArabidopsis,encodes a novel protein with Zinc finger and helix-loop-helix domains[J].Development,1999,126(11):2387-2396.
[5] Siegfried K R,Eshed Y,Baum S F,et al.Members of theYABBYgene family specify abaxial cell fate inArabidopsis[J].Development,1999,126(18):4117-4128.
[6] Yamaguchi T,Nagasawa N,Kawasaki S,et al.TheYABBYgene DROOPING LEAF regulates carpel specification and midrib development inOryzasativa[J].The Plant Cell,2004,16(2):500-509.
[7] Dai M,Hu Y,Zhao Y,et al.A WUSCHEL-LIKE HOMEOBOX gene represses aYABBYgene expression required for rice leaf development[J].Plant Physiology,2007,144(1):380-390.
[8] Zhao W,Su H,Song J,et al.Ectopic expression ofTaYAB1,a member of YABBY gene family in wheat,causes the partial abaxialization of the adaxial epidermises of leaves and arrests the development of shoot apical meristem inArabidopsis[J].Plant Sci,2006,170(2):364-371.
[9] Juarez M T,Twigg R W,Timmermans M C.Specification of adaxial cell fate during maize leaf development[J].Development,2004,131(18):4533-4544.
[10] Zhang X L,Yang Z P,Zhang J,et al.Ectopic expression of BraYAB1-702,a member ofYABBYgene family in Chinese cabbage,causes leaf curling,inhibition of development of shoot apical meristem and flowering stage delaying inArabidopsisthaliana[J].International Journal of Molecular Sciences,2013,14(7):14872-14891.
[11] Sun W,Huang W,Li Z,et al.Characterization of a crabs claw gene in basal eudicot species epimedium sagittatum (berberidaceae) [J].International Journal of Molecular Sciences,2013,14(1):1119-1131.
[12] Fourquin C,Primo A,Martínez-Fernández I,et al.The CRC orthologue fromPisumsativumshows conserved functions in carpel morphogenesis and vascular development[J].Annals of Botany,2014,114(7):1535-1544.
[13] Zhang X L,Zhang L G.Molecular cloning and expression of the male sterility-relatedCtYABBY1 gene in flowering Chinese cabbage (BrassicacampestrisL.ssp chinensis var.parachinensis) [J].Genetics and Molecular Research,2014,13(2):4336-4347.
[14] Eckardt N A.YABBY genes and the development and origin of seed plant leaves[J].The Plant Cell,2010,22(7):2103.
[15] Stahle M I,Kuehlich J,Staron L,et al.YABBYs and the transcriptional corepressors LEUNIG and LEUNIG_HOMOLOG maintain leaf polarity and meristem activity in Arabidopsis[J].The Plant Cell,2009,21(10):3105-3118.
[16] 胡廷章,陈再刚,杨俊年,等.辣椒CaCOI1基因的克隆、表达及其序列分析[J].园艺学报,2012,39(4):713-720.
[17] 刘肖飞,梁卫红.根癌农杆菌介导的GFP在洋葱表皮细胞定位研究[J].河南师范大学学报:自然科学版,2009,37(1):123-125,150.
[18] Sarojam R,Sappl P G,Goldshmidt A,et al.DifferentiatingArabidopsisshoots from leaves by combined YABBY activities[J].The Plant Cell,2010,22(7):2113-2130.
[19] Bonaccorso O,Lee J E,Puah L,et al.FILAMENTOUS FLOWER controls lateral organ development by acting as both an activator and a repressor[J].BMC Plant Biology,2012,12(1):832-838.
[20] Goldshmidt A,Alvarez J P,Bowman J L,et al.Signals derived fromYABBYgene activities in organ primordia regulate growth and partitioning ofArabidopsisshoot apical meristems[J].The Plant Cell,2008,20(5):1217-1230.
[21] Xiang J,Liu R Q,Li T M,et al.Isolation and characterization of twoVpYABBYgenes from wild ChineseVitispseudoreticulata[J].Protoplasma,2013,250(6):1315-1325.
[22] Tanaka W,Toriba T,Ohmori Y,et al.The YABBY gene TONGARI-BOUSHI1 is involved in lateral organ development and maintenance of meristem organization in the rice spikelet[J].The Plant Cell,2012,24(1):80-95.
[23] Lee J Y,Baum S F,Oh S H,et al.Recruitment of CRABS CLAW to promote nectary development within the eudicot clade[J].Development,2005,132(22):5021-5032.
[24] Ohmori Y,Toriba T,Nakamura H,et al.Temporal and spatial regulation of DROOPING LEAF gene expression that promotes midrib formation in rice[J].The Plant Journal,2011,65(1):77-86.
[25] Lora J,Hormaza J I,Herrero M,et al.Seedless fruits and the disruption of a conserved genetic pathway in angiosperm ovule development[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(13):5461-5465.
Cloning,Expression and Subcellular Localization Analysis of SlYAB 2 a Gene from Tomato
HU Tingzhang,QIN Juan,CHEN Zaigang,HUANG Xiaoyun
(School of Life Science and Engineering,Chongqing Three Gorges University,Chongqing 404100,China)
In order to study the function and molecular mechanism ofSlYAB2ain growth and development of tomato.The cDNA sequence ofSlYAB2awas cloned from tomato by RT-PCR.Bioinformatics analysis showed thatSlYAB2aencodes a putative polypeptide of 192 amino acids with a calculated molecular mass of 21.35 kDa,a theoretical pI of 8.79,and a grand average of hydropathy value of-0.487.SlYAB2a protein was predicted to possess a Pfam:YABBY domain architecture at position 6-165,a C2C2zinc finger-like domain at position 20-47,and a helix-loop-helix domain at position 122-181.Secondary structure analysis revealed that SlYAB2a protein contains 19.79% α-helical domains,14.06% β-sheet domains,and 66.15% random coil.The analysis of protein multiple sequence alignments showed that the percent identity of the SlYAB2a with members of group YABBY2 fromSolanumtuberosum,Nicotianasylvestris,Vitisvinifera,Glycinemax,Arabidopsisthaliana,Brassicanapus,Oryzabrachyantha,ZeamaysandTriticumaestivumwere 98%,78%,71%,65%,64%,64%,58%,57% and 57%,respectively;which suggested the percent identity of the SlYAB2a with other members of group YABBY2 from dicotyledon was higher than that from monocotyledon.The analysis of phylogenetic relationship showed that YABBY2 was easily separated into two distinct subgroups,that was dicotyledon subgroup and monocotyledon subgroup.SlYAB2a belonged to dicotyledon subgroup and was most closely related to members of group YABBY2 fromSolanumtuberosum,Solanumpennellii,NicotianatomentosiformisandNicotianasylvestris.The expression ofSlYAB2awas determined by Real-time quantitative RT-PCR.The result showed that theSlYAB2agene was transcribed in different tissue organ.The expression level ofSlYAB2ain flowers and mature green fruits was much higher than that in any other analyzed tissue organs.These results suggested that SlYAB2a might be involved in flower and fruit development.Following transient expression of SlYAB2a in onion epidermal cells,SlYAB2a was found to be localized in the nucleus.
Tomato;SlYAB2a;Gene cloning;Expression analysis;Subcellular localization
2016-06-01
重庆市教育委员会科学技术研究项目(KJ131101);重庆市万州区科学技术项目(201403063);重庆三峡学院科学研究计划项目(15PY03)
胡廷章(1965-),男,四川简阳人,教授,博士,主要从事植物生理生化与分子生物学研究。
Q78;S641.03
A
1000-7091(2016)06-0076-07
10.7668/hbnxb.2016.06.012

