胃癌根治术后患者远期生存情况及预后影响因素分析
刘会东 王 鹏 阚永丰
胃癌根治术后患者远期生存情况及预后影响因素分析
刘会东 王 鹏 阚永丰
目的探讨胃癌根治术后患者远期生存情况及预后的影响因素。方法选择2008年7月至2010年7月医院收治的79例行胃癌根治术的胃癌患者作为研究对象,对患者进行远期随访,记录患者远期生存情况;以患者年龄、TMN分期、肿瘤直径、浸润深度、术后辅助放化疗、术后癌胚抗原(carcino-embryonic antigen,CEA)水平等作为观察指标,筛选出影响患者预后的危险因素。结果至末次随访,79例胃癌患者死亡45例,患者中位生存时间为37.2个月;1、3、5年生存率分为别94.3%、53.7%、25.4%。单因素分析显示,年龄、TMN分期、浸润深度、术后辅助放化疗、术后CEA水平均与患者预后有关(P均<0.05);多因素分析显示TMN分期、浸润深度是影响胃癌患者预后的独立危险因素(P均<0.05)。结论胃癌根治术后患者远期生存率较低,TMN分期、浸润深度是影响胃癌患者预后的独立危险因素。
胃癌;手术;生存率;预后;影响因素
胃癌是全世界范围内最常见的恶性肿瘤之一,据WHO调查[1]显示,全球每年约有100万新增病例,其死亡率居各类肿瘤的第二位。目前胃癌根治性手术被认为是治疗胃癌的主要手段[2],然而手术并非是影响胃癌患者预后的唯一因素,手术后患者的预后及生存期受到多种因素的影响,因此了解胃癌根治术后患者的生存情况,并观察患者预后的影响因素,对指导胃癌的诊疗及术后康复具有重要意义。鉴于此,本研究对医院收治的行胃癌根治术的患者进行长期随访,观察术后患者的远期生存情况,并探讨影响患者预后的独立危险因素,现将研究成果报道如下。
资料与方法
一、一般资料
本研究经医院伦理委员会批准,选取2008年7月至2010年7月医院收治的79例行胃癌根治术的胃癌患者作为研究对象,男47例,女32例;年龄26~78岁,平均(61.5± 6.1)岁;其中低分化腺癌38例,印戒细胞癌29例,中分化腺癌10例,黏液腺癌2例。纳入标准:①符合《新编常见恶性肿瘤诊治规范》[3]中胃癌的诊断标准,并经病理学证实;②按照美国癌症联合委员会[4](American JointCommitteeon Cancer, AJCC)胃癌病理分期标准,分为Ⅰ期18例、Ⅱ期21例、Ⅲ期29例,Ⅳ期11例;③根据美国东部肿瘤协作组[5](Eastern Cooperative Oncology Group,ECOG)标准,评分均为0~1分;④初治胃癌患者,入院后均行胃癌根治术;⑤术前取得患者知情同意,并签署知情同意书。排除标准:①预计生存期< 3个月或合并远处转移者;②入组前进行过胃癌相关治疗;③免疫缺陷或自身免疫性疾病者;④合并其他恶性肿瘤者。
二、方法
1.分析方法
以患者年龄、TMN分期、肿瘤直径、浸润深度、术后辅助放化疗、术后血清癌胚抗原(carcino-embryonic antigen, CEA)水平等作为观察指标,筛选出影响患者预后的危险因素。
2.随访
79例患者均获得随访,随访至2015年12月,随访以门诊复查、电话回访等方式,起始日期以术后第2天开始计算。
三、观察指标
记录患者生存率,其中OS:从确诊胃癌至末次随访或死亡时间;TTP:从胃癌开始治疗至疾病进一步进展时间;生存率:采用Kaplan-M eier法计算1年、3年、5年生存率。
四、统计学方法
采用SPSS 21.0统计学软件进行数据处理,患者生存分析采用Kaplan-Meier法,组间比较采用Log-Rank test,多因素采用Cox回归模型,以P<0.05为差异具有统计学意义。
结 果
一、胃癌患者生存情况
至末次随访,79例胃癌患者死亡45例,患者中位生存时间为37.2个月;1、3、5年生存率分为别94.3%、53.7%、25.4%,见图1。
二、胃癌患者预后单因素分析
单因素分析显示,年龄、TMN分期、浸润深度、术后辅助放化疗、术后CEA水平均与患者预后有关(P<0.05),见表1。其中年龄>60的患者中位生存期显著低于年龄40~60岁者和年龄<40岁者(图2);TMN分期越高,中位生存期越短(图3);肿瘤直径≥5 cm者中位生存期显著低于肿瘤直径<5 cm者(图4);浸润深度越深,中位生存期越短(图5);术后联合放化疗患者中位生存期显著延长(图6);术后血清CEA水平越高,中位生存期越短(图7)。

图1 79例胃癌患者根治术后生存曲线
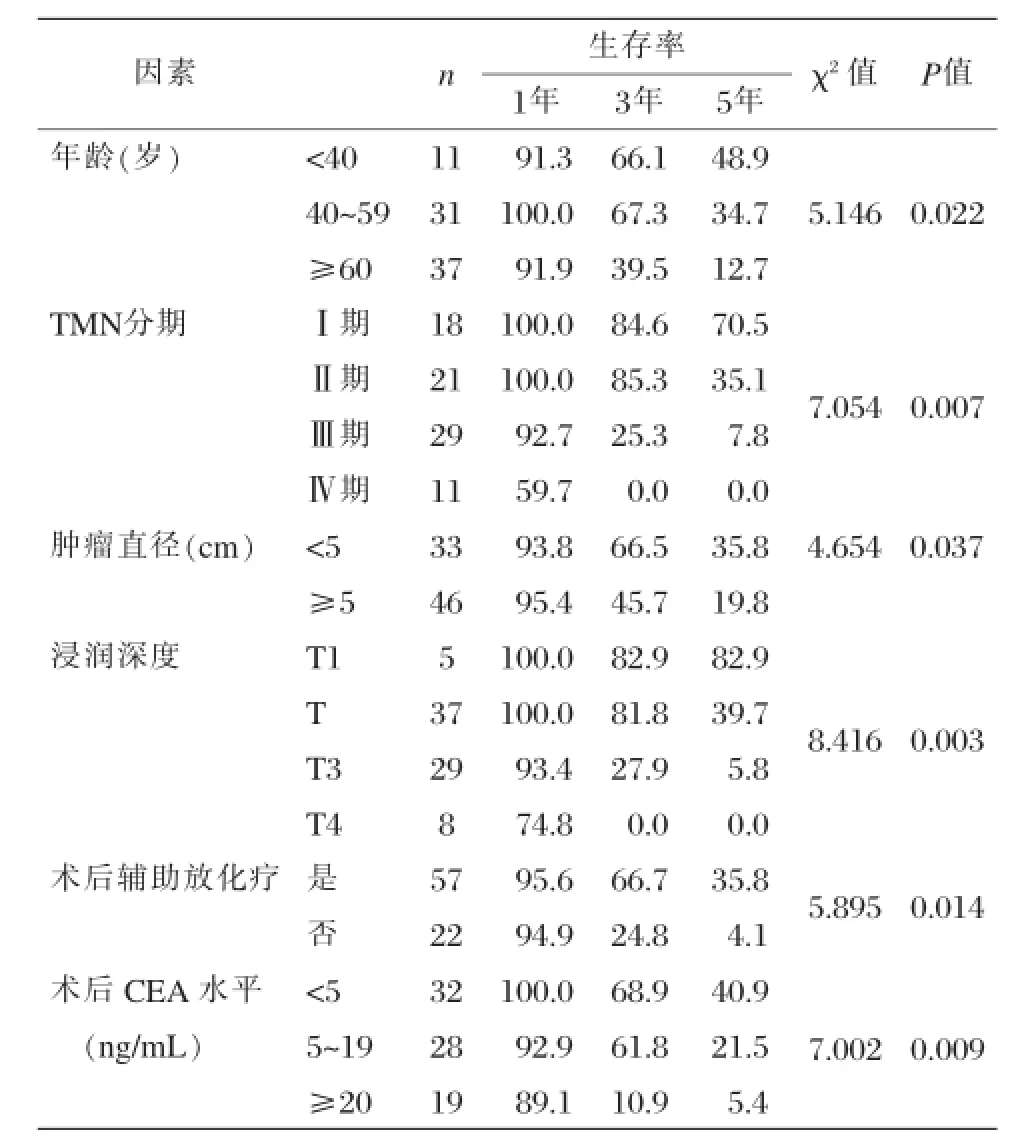
表1 胃癌患者预后单因素分析(%)

图2 不同年龄段胃癌患者生存期比较

图3 不同TMN分期胃癌患者生存期比较
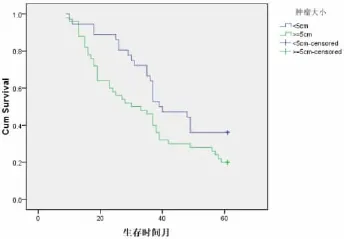
图4 不同肿瘤直径胃癌患者生存期比较

图5 不同浸润深度胃癌患者生存期比较
三、模型参数描述
将上述分析的单因素纳入Cox回归模型,得出P= 0.000,说明Cox比例模型合适,见表2。

表2 模型参数描述
四、胃癌患者预后多因素分析
将单因素分析中与预后相关的指标代入Cox回归模型,结果显示TMN分期、浸润深度是影响胃癌患者预后的独立危险因素(P<0.05),见表3。

图6 不同治疗方式胃癌患者生存期比较

图7 术后不同CEA水平胃癌患者生存期比较

表3 胃癌患者预后多因素分析
讨 论
胃癌是全世界最常见的恶性肿瘤之一,WHO调查[6]显示我国胃癌发病率约占世界的42%。由于早期胃癌临床症状不明显,多是患者就诊时已经是Ⅲ~Ⅳ期,从而影响患者的预后。胃癌根治术被认为是治疗胃癌的主要措施之一,然而多数患者术后预后较差,因此分析影响患者预后的影响因素,从而制定针对性的治疗措施成为临床研究的热点。张帆等[7]报道称Ⅲ~Ⅳ期胃癌根治术患者5年生存率约为27.4%,本研究显示胃癌1、3、5年生存率分为别94.3%、53.7%、25.4%,与其结论基本一致,提示胃癌远期预后较差。
既往对胃癌术后是否联合放化疗存在争议,如左东等[8]的Meta分析结果在一定程度上支持对患者术后联合放化疗,然而患者临床获益并不明显。近年来随着研究的深入,越来越多的学者建议对术后患者行放化疗。Lino等[9]研究显示,希罗达联合草酸铂能够显著提高胃癌根治术后患者的3年无病生存率,单纯手术3年生存率为61%,而联合化疗的患者3年生存率则提高至74.1%。由于胃癌复发转移的部位主要集中于肝脏、肺部及腹腔淋巴结等,有学者[10]提出进展期胃癌患者术后腹腔灌注化疗能够提高患者中位生存期。本研究亦证实未联合术后放化疗的胃癌患者5年生存率仅为4.1%,而联合放化疗患者5年生存率为35.8%,多因素分析也证实术后辅助放化疗是患者预后的保护因素,证实了辅助放化疗对胃癌手术的联合作用。辅助放化疗不仅能够缩小原发病灶,还能进一步巩固手术的疗效,对于术区切除不完全病灶、微转移灶均有抑制作用。因此术后联合放化疗在提高患者生存时间、降低复发率方面具有明显优势。
临床分期亦是影响患者预后的主要因素之一,TMN分期包括有淋巴结转移及浸润深度,临床分期越晚,患者预后越差[11-12]。徐建波等[13]报道显示Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期胃癌患者5年生存率分为别82.7%、59.3%、22.4%、1.7%,说明临床分期越早,患者生存率越高。因此对于早期有手术指征的患者应早期行手术治疗,而晚期患者则应考虑术后联合放化疗,以提高患者的生存期。有研究[14]显示,肿瘤浸润深度与预后的相关性远高于其他影响因素,当病变仅局限于黏膜及周围黏膜层时,其远期生存率高达85%以上,而随着浸润深度的增加,当侵犯至周围器官时,其5年生存率降低至5%以下。本研究显示,侵犯至黏膜及黏膜下层患者5年生存率为82.9%,而侵至浆膜下层者5年生存率为39.7%,当侵犯至周围邻近组织其5年生存率降低至0%,说明浸润深度亦是影响患者预后的主要因素之一。当然目前对浸润深度是否是预后的影响因素依然存在争议,对于此类患者手术标准尚未统一,加之术后化疗不规范等均可能影响患者的预后,这也需要进一步分层分析。
综上所述,胃癌根治术后患者远期生存率较低,TMN分期、浸润深度;对于预后较差的患者,可以考虑选择术后辅助放化疗的治疗方案。
[1]Endo S,Dousei T,Yoshikawa Y,et al.Gastric neuroendocrine tumors in our institutions according to the WHO 2010 classification [J].IntSurg,2012,97(4)∶335-339.
[2]Jeong O,Park YK.Effectof intravenous iron supplementation for acute postoperative anemia in patients undergoing gastrectomy for gastric carcinoma∶A pilot study[J].Ann Surg Oncol,2014,21(2)∶547-552.
[3]中国抗癌协会.新编常见恶性肿瘤诊治规范-胃癌分册[M].北京∶北京医科大学中国协和医科大学联合出版社,1999:7-8.
[4]HariDM,Leung AM,Lee JH,etal.AJCC cancer stagingmanual 7th edition criteria for colon cancer∶Do the complexmodifications improve prognostic assessment?[J].JAm Coll Surg,2013,217(2)∶181-190.
[5]Martinez-Salamanca JI,ShariatSF,Rodriguez JC,etal.Prognostic role of ECOG performance status in patientsw ith urothelial carcinoma of the upperurinary tract∶An internationalstudy[J].BJU Int, 2012,109(8)∶1155-1161.
[6]Flucke U,Mönig SP,Baldus SE,etal.Differences between biopsy-or specimen-related Lauren andWorld Health Organization classification in gastric cancer[J].World JSurg,2002,26(2)∶137-140.
[7]张帆,郝迎学,唐波,等.不同浆膜受侵犯面积胃癌患者行腹腔镜胃癌根治术对腹腔微转移的影响[J].中华消化外科杂志,2015, 14(5)∶400-404.
[8]左东,王钢,陆艺,等.胃癌根治术中完整网膜囊切除对术后局部复发率及生存率影响的Meta分析[J].华中科技大学学报(医学版),2013,42(6)∶724-728.
[9]Lino-Silva LS,Salcedo Hernández RA,Molina-Frías E.M ixed gastric carcinomaw ith intestinaland cribriform patterns∶A distinctive pathologic appearance associated w ith poor prognosis in advanced stagesand apotentialmimickerofmetastatic breastcarcinoma[J].Int JSurg Pathol,2013,21(1)∶6-14.
[10]李欣.老年胃癌患者术后腹腔热灌注化疗联合静脉化疗的疗效和安全性[J].中国老年学杂志,2015,35(13)∶3642-3644.
[11]TokunagaM,Sano T,Ohyama S,etal.ClinicopathologicalCharacteristicsand SurvivalDifference Between Gastric Stump Carcinoma and Primary Upper Third Gastric Cancer[J].JGastrointest Surg, 2013,17(2)∶313-318.
[12]包佳琪,赵兴胜,乌云高娃,等.替吉奥联合奥沙利铂方案与FOLFOX6方案辅助化疗在可切除II/Ⅲ期胃癌围术期患者中的比较研究[J].癌症进展,2014,(1)∶70-74,92.
[13]徐建波,何裕隆,吴晖,等.青年胃癌患者临床病理特征和预后分析[J].中华胃肠外科杂志,2013,16(2)∶160-162.
[14]张煜,马力文.114例Ⅲ期胃癌患者术后长期生存情况及预后因素分析[J].中华肿瘤杂志,2013,35(11)∶863-866.
2016-03-24)
(本文编辑:梁卫江)
10.3969/j.issn.1672-2159.2016.05.021
100043首都医科大学石景山教学医院北京市石景山医院普外科
北京市自然科学基金(7132209)

