EMT在大肠癌细胞奥沙利铂耐药中的作用及分子机制研究
向德兵,董 蕻,全 晋,孙贵银△,李梦侠,王 东
(1.重庆市江津区中心医院肿瘤科 402260;2.第三军医大学大坪医院野战外科研究所肿瘤中心,重庆 400042)
EMT在大肠癌细胞奥沙利铂耐药中的作用及分子机制研究
目的 探讨上皮-间叶转化(EMT)在大肠癌耐药中的作用及分子机制。方法 采用药物浓度递增的方法建立大肠癌LOVO细胞奥沙利铂(L-OHP)耐药细胞株LOVO/L-OHP,免疫荧光和蛋白质印迹法(Westernblot)检测LOVO和LOVO/L-OHP细胞E-cadherin和Vimentin表达;Westernblot检测核转录因子Snail、Twist表达;噻唑蓝(MTT)检测细胞增殖。结果 与LOVO细胞比较,LOVO/L-OHP皮表型消失,细胞膜E-cadherin表达减弱(22.63±3.25)%(P<0.01),获得间叶细胞表型,表达Vimentin(475.42±58.36)%(P<0.01)。LOVO/L-OHP细胞株Twist表达轻度增加(116.42±18.36)%(P>0.05),Snail表达显著增加(382.18±41.33)%(P<0.01)。siSnail上调E-cadherin表达(246.82±31.57)%(P<0.01),下调Vimentin表达(28.75±3.96)%(P<0.01);siSnail显著增强LOVO/L-OHP细胞株L-OHP化疗敏感性,对照组和siSnail组的IC50分别为23.75μg/mL和12.42μg/mL。结论EMT在大肠癌细胞L-OHP耐药中可能起重要作用,抑制EMT可恢复耐药细胞化疗敏感性。
结直肠肿瘤;上皮细胞;奥沙利铂;RNA,小分子干扰;Snail
大肠癌是我国最常见的恶性肿瘤之一,化疗是大肠癌综合治疗的主要方法之一,奥沙利铂是大肠癌的一线化疗药物,但肿瘤细胞获得性耐药是肿瘤化疗失败的主要原因,其发生机制目前仍不十分清楚。上皮-间叶转化(epithelial-mesenchymal transition,EMT) 现象在上皮源性肿瘤细胞中普遍存在,其重要特征就是肿瘤细胞的细胞膜E-cadherin、β-catenin等上皮标记表达缺失,获得间叶细胞表型,表达Vimentin,细胞黏附能力减弱,迁移和侵袭能力增强。近年的研究显示,EMT可能参与了肺癌、胰腺癌和乳腺癌等肿瘤细胞耐药[1-4]。本项目建立大肠癌奥沙利铂耐药细胞株,比较耐药细胞和亲本细胞表型差异及EMT信号途径关键分子(E-cadherin、Vimentin、Snail、Twist等)的表达差异, 抑制EMT信号途径对耐药细胞化疗敏感性的影响,以期获得EMT参与大肠癌耐药的证据。
1 材料与方法
1.1 材料 人大肠癌LOVO细胞株引自美国ATCC。LipofectAmineTM2000转染试剂购自美国Invitrogen公司。鼠抗人β-actin单克隆抗体、MTT和二甲亚砜(DMSO)购自美国Sigma公司,鼠抗人E-cadherin、Vimentin、Snail和Twist单克隆抗体购自美国Santa Cruz公司,抗鼠IgG-HRP二抗、IgG-TRITC二抗和化学发光试剂购自美国Pierce公司,RPMI 1640培养基、胎牛血清、胰蛋白酶购自美国Hyclone公司。奥沙利铂(L-OHP)购自江苏恒瑞医药有限公司。
1.2 方法
1.2.1 大肠癌L-OHP耐药细胞株LOVO/L-OHP的建立 采用药物浓度递增的方法。取对数生长期LOVO细胞,调整细胞密度为1×105/mL,加入终浓度为0.5 μg/mL的L-OHP培养液连续作用48 h,弃去上清液;加入不含L-OHP的培养液继续培养,消化传代,再用含终浓度为0.5 μg/mL的L-OHP培养液连续作用细胞48 h。如此反复换液、传代,逐步提高L-OHP的浓度 ,当细胞在含2 μg/mL的L-OHP培养液中稳定生长时,以含加倍浓度大剂量L-OHP作用LOVO细胞,最终获得对L-OHP耐药的LOVO细胞,即LOVO/L-OHP。
1.2.2 Snail siRNA表达质粒构建和细胞转染 Snail siRNA和对照siRNA序列根据课题组以前的文献[5],两端分别引入BamHⅠ和HindⅢ酶切位点粘端,分别合成发卡样单链DNA,退火后与siRNA载体pSilencer连接。随机选取两个转化菌隔夜培养,抽提质粒,对插入序列进行测序。得到重组载体pSilencer-Snail siRNA和pSilencer-Control siRNA,简称siSnail 和siCon。按LipofectAmineTM2000操作说明转染LOVO/L-OHP细胞。转染12 h后换液,加入含有抗生素的完全培养基37 ℃、50 mL/L CO2培养24 h进行实验。
1.2.3 噻唑蓝(MTT)法检测细胞存活率 常规培养LOVO/L-OHP细胞,以4×103/孔接种于96孔板培养,24 h后吸除原培养液,更换新RPMI 1640培养液,以0~100 μmol/L的L-OHP处理细胞,另设只加培养液,不加细胞和药物的为空白组。每组3个复孔。将各组细胞继续培养72 h后,进行MTT实验,每孔加20 μL MTT (5 g/L)溶液,继续培养4 h,终止培养,弃上清,每孔加入DMSO 150 μL,振荡10 min,使结晶充分溶解,用酶标仪在490 nm波长处测定各孔的吸光度(A)值。
1.2.4 免疫荧光染色 对数期生长的LOVO及LOVO/L-OHP细胞接种于6孔板内盖玻片上,每孔1×105个细胞,培养48 h后免疫荧光染色检测E-cadherin和Vimentin表达。盖玻片预冷甲醇固定10 min,磷酸盐缓冲液(PBS)冲洗2次,0.5% Triton X-100室温15 min,PBS冲洗2次,然后以30 mL/L正常山羊血清工作液封闭30 min,吸掉封闭液,加入鼠抗人一抗(1∶1 000)溶液,4 ℃过夜。PBS冲洗2次,加入羊抗小鼠IgG-TRITC二抗溶液(稀释度1∶500),37 ℃孵育30 min。PBS冲洗2次,加入200 μg/mL RNA酶,室温下孵育30 min;加入5 μmol/L 核酸荧光染料TOPRO-3复染 5 min,PBS冲洗2次。自然晾干切片,缓冲甘油封片,在Leica TCS SP激光共聚焦显微镜下观察和扫描。以PBS替代一抗作为阴性对照。
1.2.5 Western blot分析 收集细胞,常规提取细胞总蛋白。取等量蛋白样品进行SDS-PAGE电泳(分离胶浓度为10%,积层胶浓度为5%)。电泳后转移至PVDF膜,5 %脱脂奶粉封闭后,加入一抗,4 ℃孵育过夜后室温下摇床孵育1 h,加入HRP标记的羊抗小鼠二抗,室温下摇床孵育1 h。以ECL 试剂盒显色。用Bio-Rad公司Quantity one凝胶扫描分析系统扫描X线片,Labwork 3.0图像分析软件进行图像分析,测定各条带光密度值,结果以积分光密度值(IOD)表示。
1.3 统计学处理 以CalcuSyn Demo Version 2统计软件计算IC50。以SPSS 17.0 版专用统计分析程序对各组数据进行单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 大肠癌LOVO/L-OHP细胞形态学改变 建立了大肠癌L-OHP耐药细胞株LOVO/L-OHP,形态学观察发现其发生了EMT,上皮细胞特性消失,具有间叶细胞形态学特点,细胞极性消失,排列松散,出现较多伪足。见图1。

图1 耐药细胞株LOVO/L-OHP细胞形态学(×400)
2.2 大肠癌LOVO/L-OHP细胞E-cadherin和Vimentin表达 免疫荧光检测结果显示LOVO/L-OHP上皮表型消失,细胞膜E-cadherin表达减弱,获得间叶细胞表型,表达Vimentin,见图2。Western blot结果与免疫荧光结果一致,分别以LOVO细胞的E-cadherin和Vimentin表达水平为100%,LOVO/L-OHP细胞E-cadherin表达水平为(22.63±3.25)%(P<0.01),Vimentin表达水平为(475.42±58.36)%(P<0.01),见图3。

图2 免疫荧光检测LOVO/L-OHP细胞E-cadherin和Vimentin表达(×200)
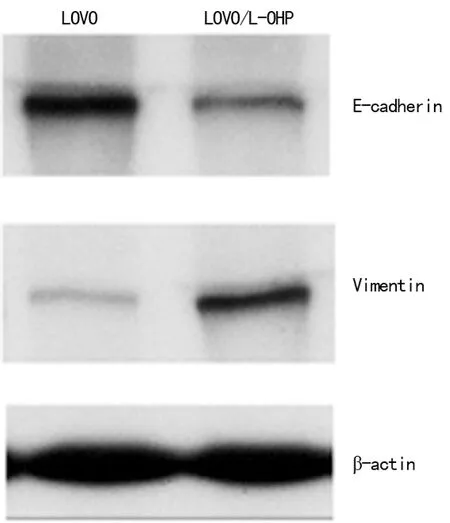
图3 Western blot检测LOVO/L-OHP细胞E-cadherin和Vimentin表达
2.3 大肠癌LOVO/L-OHP细胞Snail和Twist表达 分别以LOVO细胞的Snail和Twist表达水平为100%,LOVO/L-OHP细胞Snail表达水平为(382.18±41.33)%(P<0.01),Twist表达水平为(116.42±18.36)%(P>0.05)。见图4。
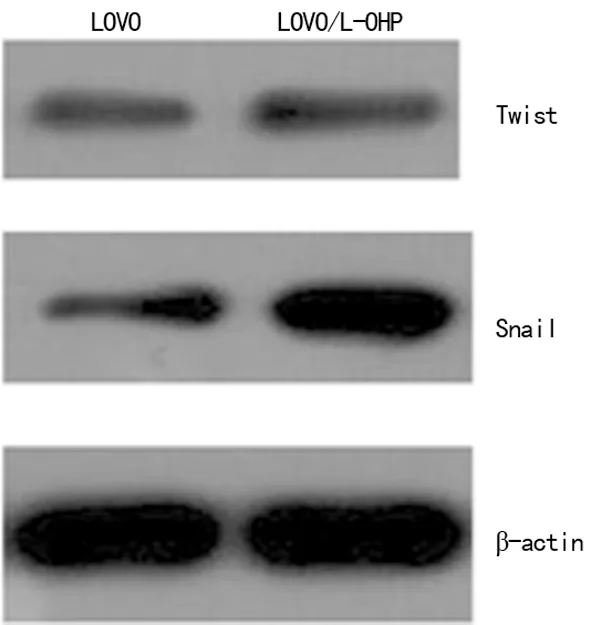
图4 Western blot检测LOVO/L-OHP细胞Snail和Twist表达
2.4 siSnail对LOVO/L-OHP细胞E-cadherin和Vimentin表达的影响 siSnail和对照siCon转染LOVO/L-OHP细胞48 h后,Western blot检测LOVO/L-OHP细胞E-cadherin和Vimentin表达,分别以对照组siCon的E-cadherin和Vimentin表达水平为100%,siSnail组E-cadherin 表达水平为(246.82±31.57)%(P<0.01),Vimentin表达水平为(28.75±3.96)%(P<0.01)。见图5。

图5 Western blot检测LOVO/L-OHP细胞转染siSnail后E-cadherin和Vimentin表达

图6 不同剂量L-OHP处理后LOVO/L-OHP细胞存活曲线
2.5 siSnail体外增强LOVO/L-OHP细胞L-OHP化疗敏感性 L-OHP作用72 h后LOVO/L-OHP细胞的存活曲线图可见,随着L-OHP浓度的增加,LOVO/L-OHP细胞存活率逐渐下降,与对照组siCon比较,siSnail组下降更明显,L-OHP每个剂量点均差异有统计学意义(P<0.05)。siCon和siSnail 组的IC50分别为23.75 μg/mL和12.42 μg/mL。见图6。
3 讨 论
EMT是指上皮组织丧失上皮特征而获得间叶的表型,是上皮细胞在特定的生理或病理情况下向间叶细胞转分化的现象,是胚胎发育和创伤修复等过程中的基础过程。大量的研究发现EMT在肿瘤细胞的侵袭和转移中起关键作用[6]。新近研究发现EMT在肿瘤化疗耐药中可能起更重要的作用[7]。顺铂和培美曲塞耐药的肺癌细胞、氟尿嘧啶耐药的乳腺癌细胞、吉西他滨耐药的胰腺癌细胞等均出现了典型的EMT形态学改变和表型特征[1-4],且抑制EMT可恢复耐药细胞化疗敏感性[4]。因此上皮源性肿瘤细胞发生EMT在化疗药物耐药中可能发挥重要作用,进一步探讨EMT在大肠癌细胞L-OHP耐药中的作用及分子机制具有重要的意义。
本研究建立了大肠癌L-OHP耐药细胞株LOVO/L-OHP,形态学观察发现LOVO/L-OHP细胞的上皮细胞特性消失,具有间叶细胞形态学特点,出现较多伪足。免疫荧光及Western blot检测结果显示LOVO/L-OHP细胞E-cadherin表达减弱,获得间叶细胞表型,表达Vimentin。因此大肠癌L-OHP耐药细胞出现了典型的EMT表型特征。Li等[8]研究发现阿霉素耐药的大肠癌细胞也发生了EMT,其机制与阿霉素上调TGF-β信号有关;Toden等[9]在氟尿嘧啶耐药的大肠癌细胞也观察EMT现象,且抑制EMT可恢复耐药细胞化疗敏感性。EMT 的机制主要由于上皮细胞本身或周围微环境改变,导致一系列信号传导途径激活,细胞核内相关转录因子发挥调控作用。不同程度的上皮细胞转化过程是由精确的细胞内信号转导机制调控,细胞外多种信号通过与细胞表面特异受体结合,活化不同的核内转录因子,这些转录因子的共同特征是含有能识别靶基因启动子上的E-box基序的DNA 结合序列,从而调节靶基因表达,启动EMT。Snail已被证明与上皮性肿瘤进展过程中触发EMT有关,是EMT发生的关键点。Snail的表达与E-cadherin的减少或缺失相关,而且充当E-cadherin 转录的直接抑制子[10]。Twist 是另一个调控EMT 的重要转录因子,其诱导EMT的机制即通过E-box基序直接或间接结合E-cadherin启动子,从而抑制E-cadherin表达[11]。本研究发现,与亲代大肠癌LOVO细胞比较,LOVO/L-OHP细胞Snail表达显著增强(P<0.01),Twist表达轻微升高(P>0.05)。进一步构建siSnail表达质粒,转染LOVO/L-OHP细胞后可逆转EMT,E-cadherin 表达上调(P<0.01),Vimentin表达下调(P<0.01),且siSnail可显著增强LOVO/L-OHP细胞L-OHP化疗敏感性。因此,研究结果显示大肠癌L-OHP耐药及EMT可能主要是通过Snail转录因子发挥作用。
综上所述,本研究证实大肠癌L-OHP耐药细胞发生EMT,上皮表型消失,获得间叶细胞表型,其机制可能与L-OHP诱导Snail表达升高有关。本研究为深入探索大肠癌细胞L-OHP耐药的分子机制及逆转策略提供了实验数据。
[1]Liang SQ,Marti TM,Dorn P,et al.Blocking the epithelial-to-mesenchymal transition pathway abrogates resistance to anti-folate chemotherapy in lung cancer[J].Cell Death Dis,2015,6(5):e1824.
[2]Wang H,Zhang G,Zhang H,et al.Acquisition of epithelial-mesenchymal transition phenotype and cancer stem cell-like properties in cisplatin-resistant lung cancer cells through AKT/β-catenin/Snail signaling pathway[J].Eur J Pharmacol,2014,723(2):156-166.
[3]Zhang WJ,Feng ML,Zheng GP,et al.Chemoresistance to 5-fluorouracil induces epithelial-mesenchymal transition via up-regulation of Snail in MCF7 human breast cancer cells[J].Biochem Biophys Res Commun,2012,417(2):679-685.
[4]Namba T,Kodama R,Moritomo S,et al.Zidovudine,an anti-viral drug,resensitizes gemcitabine-resistant pancreatic cancer cells to gemcitabine by inhibition of the Akt-GSK3 beta-Snail pathway[J].Cell Death Dis,2015,6(3):e1795.
[5]Zhuo W,Wang Y,Zhuo X,et al.Knockdown of snail,a novel Zinc finger transcription factor,via RNA interference increases a549 cell sensitivity to cisplatin via JNK/mitochondrial pathway[J].Lung Cancer,2008,62(1):8-14.
[6]Torzilli PA,Bourne JW,Cigler TA.A new paradigm for mechanobiological mechanisms in tumor metastasis[J].Semin Cancer Biol,2012,22(5/6):385-395.
[7]Fischer KR,Durrans A,Lee S,et al.Epithelial-to-mesenchymal transition is not required for lung metastasis but contributes to chemoresistance[J].Nature,2015,527(7579):472-476.
[8]Li JP,Liu H,Yu JP,et al.Chemoresistance to doxorubicin induces epithelial-mesenchymal transition via upregulation of transforming growth factor signaling in HCT116 colon cancer cells[J].Mol Med Rep,2015,12(1):192-198.
[9]Toden S,Okugawa Y,Jascur T,et al.Curcumin mediates chemosensitization to 5-fluorouracil through miRNA-induced suppression of epithelial-to-mesenchymal transition in chemoresistant colorectal cancer[J].Carcinogenesis,2015,36(3):355-367.
[10]Blanco MJ,Moreno-Bueno G,Sarrio D,et al.Correlation of snail expression with histological grade and lymph node status in breast carcinomas[J].Oncogene,2002,21(20):3241-3246.
[11]Yang J,Mani SA,Donaher JL,et al.Twist,a master regulator of morphogenesis,plays an essential role in tumor metastasis[J].Cell,2004,117(7):927-939.
The role and molecular mechanism of epithelial-mesenchymal transition in chemoresistance to oxaliplatin in colorectal cancer cells*
XiangDebing1,DongHong1,QuanJin1,SunGuiyin1△,LiMengxia2,WangDong2
(1.DepartmentofOncology,JiangjinCentralHospital,Chongqing402260,China;2.CancerCenter,ResearchInstituteofFieldSurgery,DapingHospital,ThirdMilitaryMedicalUniversity,Chongqing400042,China)
Objective To investigate the role and molecular mechanism of epithelial-mesenchymal transition (EMT) in chemoresistance to oxaliplatin in colorectal cancer cells.Methods Oxaliplatin resistant LOVO/L-OHP cells were established by gradually increasing the concentration of oxaliplatin and intermittent treatment with high-dose concentration on parental cells (LOVO).The expression of E-cadherin and Vimentin was detected by indirect immunofluorescence and Western blot analysis.The expression of Snail and Twist was detected by Western blot analysis. cell proliferation was detected by MTT.Results Compared with LOVO cells,the epithelial phenotype of LOVO/L-OHP cell line was lost,and the expression of E-cadherin was decreased (22.63±3.25)% (P<0.01),an increase in the mesenchymal marker Vimentin (475.42±58.36)%(P<0.01).LOVO/L-OHP cell line Twist expression was slightly increased (116.42±18.36)% (P>0.05),Snail expression was significantly increased (382.18±41.33)% (P<0.01).The expression of siSnail increased E-cadherin (246.82±31.57)% (P<0.01).The expression of Vimentin (28.75±3.96)% (P<0.01);siSnail significantly enhanced sensitivity to oxaliplatin based chemotherapy in LOVO/L-OHP cell line,IC50control group and siSnail group were 23.75 μg/mL and 12.42 μg/mL.Conclusion EMT may play an important role in chemoresistance to oxaliplatin in colorectal cancer cells,inhibition of EMT can restore chemosensitivity of resistant colorectal cancer cells
colorectal neoplasms;epithelial cells;oxaliplatin;RNA,small interfering;Snail
� 著·
10.3969/j.issn.1671-8348.2016.36.002
国家自然科学基金资助项目(30972874);重庆市卫生和计划生育委员会科研项目(2011-2-445,2011-2-447,2012-1-106,2012-2-381)。 作者简介:向德兵(1972-),主任医师,博士,主要从事大肠癌信号转导和实验治疗研究。△
E-mail:Sunriseok@126.com。
向德兵1,董 蕻1,全 晋1,孙贵银1△,李梦侠2,王 东2
(1.重庆市江津区中心医院肿瘤科 402260;2.第三军医大学大坪医院野战外科研究所肿瘤中心,重庆 400042)
R
A
1671-8348(2016)36-5045-04
2016-07-18
2016-09-16)

