鸡腺胃型传染性支气管炎的诊治与基因序列分析
(广东温氏佳润食品有限公司,广东省畜禽健康养殖与环境控制企业重点实验室,广东新兴 527400)
鸡腺胃型传染性支气管炎的诊治与基因序列分析
邰 镝,刘旭晨,周 全,李芳雯
(广东温氏佳润食品有限公司,广东省畜禽健康养殖与环境控制企业重点实验室,广东新兴 527400)
从广东省某鸡场疑似腺胃型传染性支气管炎病死鸡的腺胃中分离到一株病毒,初步鉴定为QX型传染性支气管炎病毒(IBV)。通过疫苗免疫与其他辅助措施,疫病得到有效控制。但动物回归试验表明,IBV毒株单独感染并不能导致鸡产生腺胃炎症状。
腺胃型 ;传染性支气管炎;诊治;序列分析
传染性支气管炎(Infectious bronchitis,IB)是由传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起的急性、高度接触性传染病。由于IBV的易变性,不同地区、不同时期流行的IBV毒株差异很大。虽然1996年国内首次报道了一种发生于肉用仔鸡的“腺胃型”IB,但IBV感染是否是诱发腺胃炎的直接原因尚不能下定论。2016年1月广东省某肉鸡饲养场饲养的麻黄鸡突然发生以雏鸡采食量异常降低、腺胃肿胀、发育不良为临床症状的疾病,并分离到IBV。为确定毒株是否是导致雏鸡发生腺胃炎的原因,遂对其进行纤突蛋白基因S1的测序、基因分型和动物回归试验。
1 材料与方法
1.1 病料来源、临床症状与解剖病变
病鸡主要表现为9日龄雏鸡采食量异常降低,羽毛松乱,干脚脱水,但死淘率正常,18日龄后料量恢复正常,但部分鸡体型消瘦,发育不良,养殖过程中产生大量弱小与残次鸡,占5%~20%比例不等,上市时料肉比上升0.3,长速较正常鸡群慢4~7天。剖检病死鸡时发现腺胃肿胀、腺胃壁增厚水肿,挤压腺胃乳头有黄白色脓性分泌物,部分鸡发生输尿管尿酸盐沉积,胸腺、法氏囊萎缩,胰腺坏死。
1.2 主要材料与试剂
Axy体液病毒DNA/RNA小量试剂盒与AxyPrep DNA凝胶回收试剂盒,购自爱思进生物技术(杭州)有限公司;一步法RT-PCR试剂盒,购自宝生物(大连)工程有限公司。
1.3 SPF鸡胚和SPF鸡
9~11日龄SPF鸡胚与10日龄SPF鸡胚,购自于广东大华农动物保健品股份有限公司。
1.4 病毒分离与鉴定
无菌操作,取肿大严重的腺胃,冲洗后用匀浆器匀浆。按1:5比例加入灭菌生理盐,并加入青霉素1 000 U/mL、链霉素1 000 ug/mL,37 ℃放置30 min,并在常温与-20 ℃反复冻融3次。8 000 r/min离心15 min后收集上清液,用一次性过滤器过滤除菌。用此分离液接种10日龄SPF鸡胚,尿囊腔接种,每胚接种0.2 mL,培养36~48 h,另设接种生理盐水空白对照组,置于37 ℃ 温箱孵育。将24 h内的死胚弃去,120 h后观察未死亡的鸡胚变化;收集尿囊液,尿囊腔接种 10 日龄 SPF鸡胚,观察并记录死亡与侏儒胚数量,盲传6代。
1.5 鸡胚半数感染量( EID50)测定
取 20 枚 9~11日龄 SPF 鸡胚分为 4 组。将盲传第6代病毒液按10-3~10-6倍比稀释,每个稀释度接种5 枚 SPF 鸡胚,0.1 mL/枚。在孵化箱中孵化6 d,接种24 h 后照蛋。接种后 24 h 内死亡的鸡胚判为非特异性死亡,以后每天照胚 2 次,观察鸡胚状况并记录死亡情况,死亡鸡胚放在 4 ℃条件下保藏。24 h 后鸡胚死亡为感染,同时观察活鸡胚胎,出现失水、蜷缩、发育小等特异性病痕为感染。按照 Read-Muench 方法计算该病毒的 EID50。
1.6 动物回归试验
10日龄 SPF 雏鸡15只,分为2组。第1组10 只,通过滴鼻接种103EID50的病毒尿囊液1 mL/只;第2组5只,为空白对照组,滴鼻接种生理盐水1 mL/只。2组雏鸡分别放在2个隔离器中饲养,连续观察14 d,比较两组鸡群的临床表现、发病情况以及死亡率,并进行剖检。
1.7 S1 基因RT-PCR 扩增和序列测定
1.7.1 引物的设计与合成。参照GenBank 中公布的S1基因序列,设计并合成1对引物。预期扩增目的片段大小为 1 668 bp,由生工生物工程(上海)有限公司合成。上游引物(P1):AAGACTGAACAAAAGACCGACT;下游引物(P2):CAAAACCTGCCATAACTAACATA。
1.7.2 RNA 提取。具体方法参照Axy体液病毒DNA/RNA小量试剂盒说明书。
1.7.3 RT-PCR。参照TaKaRa RNA PCR Kit(AMV)说明书进行反转录。PCR 的反应条件为:94 ℃变性 1 min,52.5 ℃退火 1 min,72 ℃延伸2 min,共25个循环;72 ℃ 延伸 10 min。
1.7.4 序列测定。将纯化的 PCR 产物克隆入pGEM-T载体,送交大连宝生物工程有限公司测序。
2 结果与分析
2.1 病毒分离鉴定及EID50结果
将病料接种鸡胚进行盲传的第1代未发现明显病变,从第3代开始出现侏儒胚。随着传代次数的增加,鸡胚病变现象越来越明显,表现为侏儒胚,死亡鸡胚出血、充血,死胚羊膜增厚,表面混浊,胚体蜷缩,趾爪紧抱头部。第6代鸡胚尿囊液EID50测定结果为10-4.3,毒价为104.3EID50/0.1 mL。
2.1 动物回归试验
10只 10 龄 SPF 雏鸡攻毒后,第4天出现拉稀,排黄白色水样粪便,第6 天出现死亡,死亡率10%;剖检肾脏出血肿大,并有严重的尿酸盐沉积,但未发现有腺胃水肿病变。5只对照组正常。
2.2 S1 基因的克隆和序列分析
经序列测定,克隆的 PCR 产物包含1 640 bp的完整阅读框。经序列同源性比对分析,该毒株S1基因与疫苗毒株W93、4/91、28/86、D90、H120、LDT3、M41和基因核苷酸序列同源性分别为 77.2%、78.1%、77.3%、94.3%、77.3%、85.2%和77.1%(图1、图2)。
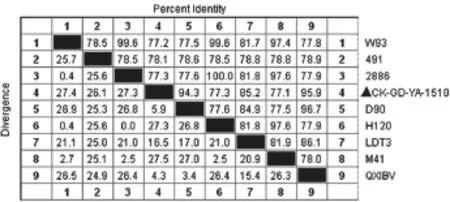
图1 S1基因的同源性比对分析
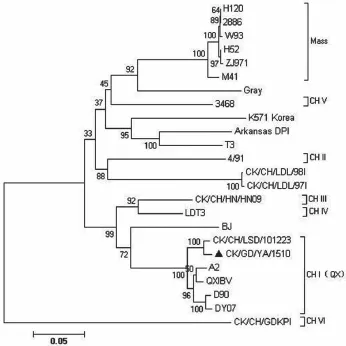
图2 S1基因序列分析
3 综合治疗
采用下述方法治疗7天后,未有新发病例出现,鸡群采食量恢复正常;20天后弱小雏鸡与残次鸡数量明显减少;30天后全场恢复正常。
3.1 免疫程序调整与紧急免疫
为使育雏期鸡群尽快获得针对IBV的特异性抗体,在5日龄与10日龄,使用大华农新胜威疫苗进行常规免疫,滴眼1头份/只;患病鸡群进行紧急免疫,滴眼1.5头份/只
3.2 使用抗生素防止继发感染
IB可引起鸡免疫力低下,抗病力下降,因此每日使用阿莫西林与硫酸新霉素,防止其继发或并发细菌性疾病
3.3 增加采食量,加速尿酸盐排泄
针对鸡群采食量下降症状,使用大蒜素与益生素增加鸡群采食量,并使用碳酸氢钠加速尿酸盐排泄,以缓解症状,同时补充维生素B与维生素A。
3.4 改善饲养环境
适当降低饲养密度,做好通风,减少应激因素,保持鸡舍温度恒定,并提高1~2 ℃,将精神沉郁的病鸡隔离饲养。
4 讨论
目前,由于 IB 疫苗所带来的免疫压力,国内流行的 IBV毒株在持续不断地进化[1]。根据研究报道,可引起腺胃型IB的基因型有Mass基因型[2](如H95与ZJ971)、T3[3]与QX基因型[4](如QXIBV、DYIBV与FCIBV)。目前QX 型毒株已经成为国内流行的主要基因型,并且仍有进一步扩大的趋势。该型毒株感染鸡群后,根据临床症状和解剖病变可表现为呼吸型、肾型与腺胃型。但迄今为止国内外对腺胃型IB发生的原因尚无定论[5]。根据已发表的文献,可能导致该病的因素包括生物学因素(如,传染性支气管炎病毒、传染性法氏囊病毒、淋巴细胞白血病病毒、网状内皮组织增生症病毒等)和非生物学因素(如,低纤维素日粮、真菌毒素等)两大类。
本病例以雏鸡腺胃肿胀、腺胃乳头溃疡为特征,主要表现为喂料量异常减少、生长发育不良等症状。实验室诊断表明本病例为QX型IBV感染,并通过调整免疫程序与其他辅助措施,疾病得到良好的控制与治疗。但通过动物回归试验发现,单独感染IBV并不能导致腺胃炎的发生。虽然在攻毒之前进行外源病毒检查时并未发现有其他常见病原体的污染,但并不能完全排除其他未知病原在致病过程中的潜在作用,对此仍需要深入研究。
[1] AWAD F,CHHABRA R,GANAPATHY M B K. An overview of infectious bronchitis virus in chickens[J]. Worlds Poultry Science Journal,2014,70(2):375-384.
[2] XIAO C T,LIU R,SONG Z Y,et al. Genomic characterization of a proventriculitis-associated infectious bronchitiscoronavirus[J]. virus Genes,2010,40(3):421-422.
[3] YU L,JIANG Y,LOW S,et al. Characterization of three infectious bronchitis virus isolates from China associated with proventriculus in vaccinated chickens[J]. Avian Diseases,2001,45(2):416-424.
[4] 王玉东,王永玲,张国中,等. 三株腺胃型传染性支气管炎病毒分离毒株对鸡的致病性试验[J]. 中国兽医科学,2015,45:195-201.
[5] 张小荣,程靖华,陈启稳,等. 鸡腺胃分离的传染性支气管炎病毒基因型与致病性研究[J].扬州大学学报(农业与生命科学版),2014,33(4):6-9.
(责任编辑:朱迪国)
Diagnosis and Treatment of Proventriculus Type Infectious Bronchitis and Its Gene Sequence Analysis
Tai Di,Liu Xuchen,Zhou Quan,Li Fangwen
(Guangdong Wen's Jagreen Foodstuffs Co.,Ltd,Guangdong Key Laboratory for Animal Health and Environmental Control,Xinxing,Guangdong 527400)
In a chicken farm of Guangdong province,one strain of virus was isolated from the proventriculus of a dead chicken,the death reason of which was suspected to be proventriculus-type infectious bronchitis. According to the preliminary identifcation,this strain was proventriculus type infectious bronchitis virus(QX IBV). Then the disease was controlled through vaccination and other supplementary measures. However,animal regression test results showed that the avian proventriculitis could not be induced by IBV infection alone.
proventriculus type;infectious bronchitis;diagnosis and treatment;sequence analysis
book=94,ebook=100
S852.23
B
1005-944X(2017)01-0094-03
10.3969/j.issn.1005-944X.2017.01.026

