金丝桃苷与DNA结合方式的研究*
乔春玉,张重越,孙艳涛,闫 鹏,肖 雪,朱传勇
(1.黑龙江工程学院 材料与化学工程学院,黑龙江 哈尔滨 150050;2.黑龙江中医药大学 附属第一医院 病理科,黑龙江 哈尔滨 150040;3.吉林师范大学 化学学院,吉林 四平136000)
金丝桃苷与DNA结合方式的研究*
乔春玉1,张重越2,孙艳涛3,闫 鹏1,肖 雪1,朱传勇1
(1.黑龙江工程学院 材料与化学工程学院,黑龙江 哈尔滨 150050;2.黑龙江中医药大学 附属第一医院 病理科,黑龙江 哈尔滨 150040;3.吉林师范大学 化学学院,吉林 四平136000)
研究了黄酮类化合物—金丝桃苷与DNA的相互作用,通过对紫外吸收光谱、熔点温度和黏度的测定,确定了其结合机理。实验结果表明,当金丝桃苷与DNA结合后紫外吸收峰在一定程度上发生了变化。通过熔点曲线和黏度测试进一步验证了金丝桃苷与DNA的结合机理,确定了二者的结合方式是嵌入式结合。
金丝桃苷;DNA;吸收光谱;熔点
前言
脱氧核糖核酸(DNA)是生物体中最基本的遗传物质,同时也是一种非常重要的生物大分子,DNA分子构象和结构的变化在生物体系方面发挥着重要作用。小分子与DNA的作用的研究方法有很多,近年来的相关的报道越来越多[1~3]。DNA与生物的生长,发育以及癌变等异常活动相关。绝大多数药物分子在生物体内的靶向目标都是DNA,通过与DNA的相互作用来控制DNA参与的转录、翻译等过程,从而改变DNA的结构和性质。因此,通过研究药物小分子与DNA的相互作用可以了解药物作用机理,从而进行药物体外筛选,利用药物的构效关系能够进行结构改造,从而设计出活性更高、毒副作用更低的新药。
目前普遍认为:小分子与DNA的非共价键作用包括静电结合、沟区结合和嵌入式结合三种作用方式,前两者也可统称为非嵌入结合方式[4]。
1 实验部分
1.1 试剂
鲑鱼精DNA;金丝桃苷(结构式如图1所示);BR缓冲溶液;文中涉及到的试剂均为分析纯,实验用水为二次蒸馏水。
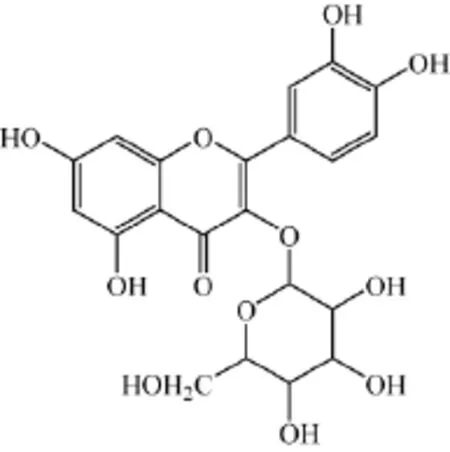
图1 金丝桃苷的结构式Fig.1 The molecular structure of hyperoside
1.2 仪器
GBC Cintra 10e紫外-可见光谱仪;乌氏黏度计;pHS-3C数字酸度计;电子恒温水浴锅。
1.3 实验方法
分别对金丝桃苷溶液和DNA进行紫外可见吸收光谱测定,再固定金丝桃苷的浓度,向其溶液中加入DNA后,在相同条件下,测定混合液的紫外可见吸收光谱。
分别测定DNA溶液以及DNA-金丝桃苷混合液的最大紫外吸收峰,在20~100℃时,每隔2~5℃记录一次读数,突跃中点的温度即为DNA的熔点(Tm)。
在25℃下,使用乌氏黏度计测定药物对DNA黏度的影响,即固定DNA溶液的浓度,改变金丝桃苷的浓度,分别测定缓冲溶液以及DNA与金丝桃苷混合溶液流经毛细管的时间,平行记录三组数据。
2 结果与讨论
2.1 紫外-可见吸收光谱研究
图2是金丝桃苷(a)、DNA(b)以及DNA-金丝桃苷混合液(c)的紫外可见吸收光谱图。
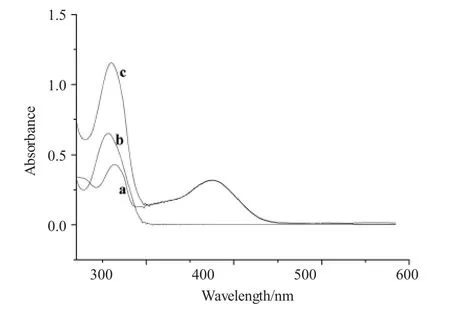
图2 金丝桃苷(a)、DNA(b)和DNA-金丝桃苷(c)的吸收光谱图Fig.2 The absorption spectra of hyperoside(a),DNA(b)and DNA-hyperoside(c)
由图2可以看出,加入DNA后,吸收峰在一定程度上发生了变化,但是变化并不是很明显,由此可以说明药物与DNA之间发生了结合反应,但是二者以何种方式结合还不能说明。
2.2 DNA熔点的研究
为了判断金丝桃苷与DNA的结合方式,实验进一步考查了金丝桃苷对DNA熔点的影响。本实验采用研究DNA熔点曲线的经典方法——紫外法。DNA的熔点又称为熔解温度(melting temperature)通常用Tm表示,是DNA加热变性,使DNA的双螺旋结构失去一半时的温度。DNA变性时,物理化学性质将随之发生改变,表现为增色效应(即ε增大的现象)。当DNA达到Tm时,分子内有50%的双链结构被打开,也就是说增色效应达到一半时的温度。
实验中分别对DNA、DNA-金丝桃苷进行了熔点测定,从20~100℃不断记录各温度时体系的吸光度并绘制成曲线,如图3所示。一般情况下,小分子与DNA相互作用能够影响其熔点Tm,若是嵌入式作用则能使DNA的双螺旋结构更加稳定,Tm会增加5~8℃,而非嵌入作用则不会使熔点温度有明显的增加[5]。由图3可以看出,当DNA溶液中加入金丝桃苷后,DNA的熔点明显增加。由此我们可以推断出,金丝桃苷与DNA是以嵌入式结合在一起的。
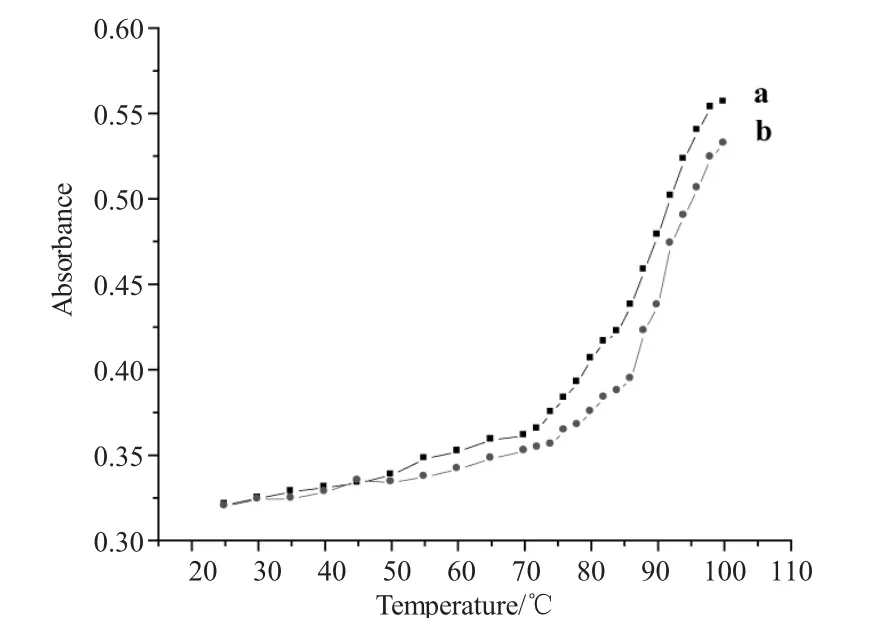
图3 金丝桃苷加入前(a)后(b)DNA的熔点曲线Fig.3 The melting points curves of DNA in the absence of hyperoside(a)and in the presence of hyperoside(b)
2.3 黏度实验
黏度法即流体力学法是研究药物小分子与DNA作用模式的另一种最有力的实验方法,因为它对DNA的长度变化比较敏感[6]。一般来说,如果药物分子与DNA通过经典嵌插方式作用时,DNA相邻碱基对的距离会变大以容纳插入配体,导致DNA双螺旋链伸长,由此使DNA溶液的黏度增大[7];当药物分子与DNA以静电、沟槽结合等非嵌插方式与DNA作用时,DNA溶液的黏度无明显变化;以部分插入方式与DNA作用时,则可能使DNA的双螺旋链弯曲或褶皱,长度减小,因而其黏度下降[8]。
在室温下测定了金丝桃苷对DNA黏度的影响。测试液的相对黏度按下式计算:
η=(t-t0)/t0
其中t0为缓冲液流经毛细管所需的时间,t为DNA溶液(含不同浓度的金丝桃苷)流经毛细管所需的时间,η0为未加金丝桃苷时DNA溶液的相对黏度。根据Cohen和Eisenberg理论[9],以(η/η0)1/3对结合比率r(r=[金丝桃苷]/[DNA])作图,可以得到金丝桃苷对DNA溶液黏度的影响,如图4所示。结果表明,随着金丝桃苷浓度的增加,DNA溶液的黏度增大了。这种行为进一步说明,这药物与DNA的结合方式是嵌入式的。
A Study on the Interactions of Hyperoside with DNA
QIAO Chun-yu1,ZHANG Chong-yue2,SUN Yan-tao3,YAN Peng1,XIAO Xue1and ZHU Chuan-yong1
(1.College of Material and Chemical Engineering,Heilongjiang Institute of Technology,Harbin 150050,China;2.Department of Pathology,First Affiliated Hospital,Heilongjiang University of Chinese Medicine,Harbin 150040,China;3.College of Chemistry,Jilin Normal University,Siping 136000,China)
The interactions of flavonoids with DNA,such as hyperoside with fish sperm DNA were studied.The bonding mechanism was confirmed by the UV-absorption spectrum,melting temperature and viscosity measurement.The experimental results indicated that when bonded to DNA,the absorption peak of hyperoside had changed in a certain extent.The studies on the melting temperature(Tm)curves and viscosity measurements had also verified the bonding mechanism of hyperoside to DNA,and the bonding mode was confirmed to be intercalative bonding.
Hyperoside;DNA;absorption spectrum;melting temperature
R 968
A
1001-0017(2016)06-0439-03
2016-05-12 *基金项目:黑龙江省教育厅科学技术研究项目(编号:12541674)
乔春玉(1980-),女,黑龙江齐齐哈尔人,博士,讲师,研究方向:分析化学。E-mail:jingjing_3939@sina.com.

