聚焦超声联合微泡开放血脑屏障机制及监测方法的研究进展
王敏,沈圆圆,汪天富,陈思平,刁现芬
医学超声关键技术国家地方联合工程实验室(深圳市, 518060)广东省生物医学信息检测与超声成像重点实验室(深圳市, 518060)深圳大学医学院生物医学工程系(深圳市, 518060)
聚焦超声联合微泡开放血脑
屏障机制及监测方法的研究进展
王敏,沈圆圆,汪天富,陈思平,刁现芬
医学超声关键技术国家地方联合工程实验室(深圳市, 518060)广东省生物医学信息检测与超声成像重点实验室(深圳市, 518060)深圳大学医学院生物医学工程系(深圳市, 518060)
聚焦超声联合微泡能够瞬时、 局部和可逆地开放血脑屏障, 该方法现已成为靶向投递药物治疗脑部疾病的一个研究热点。该文在详细介绍了血脑屏障的发现及其功能的基础上, 介绍了聚焦超声联合微泡开放血脑屏障的可能机制, 并分析对比了三种典型的血脑屏障开放监测方法(示踪剂法、 医学影像学监测法和基于空化效应的监测法), 最后对聚焦超声联合微泡开放血脑屏障的机制及其监测方法进行了展望。
聚焦超声; 微泡造影剂; 开放血脑屏障; 监测方法
0 引言
19世纪末, Paul Ehrlich发明了活体染色法, 在他将一种水溶性染料注入动物的循环系统后, 发现动物身体除脊髓和脑部外的其他所有器官均被染色, 而脊髓和脑却不着色, 因而猜想可能存在某种屏障保护着大脑和神经组织。若干年后, Paul Ehrlich的学生Edwin Goldman发现能进一步证明这种屏障存在的证据, 在他将一种名为台盼蓝(trypan blue)的活性染色剂直接注入脑脊液中后, 发现只有大脑细胞被染成蓝色, 而其他器官不着色[1]。这些现象都明显展现出脑和身体其他组织有一层屏障。20世纪初期, Lewandowsky在研究亚铁氰化钾能否渗透入脑的实验中, 正式提出用脑血管障壁或血脑屏障(blood-brain barrier, BBB)去解释几乎没有亚铁氰化钾进入脑组织这一现象。之后的许多研究发现也都能证明BBB的存在[2]。但直到1965年, 随着第一部扫描电镜(SEM)的出现, 才真正揭开BBB的神秘面纱。
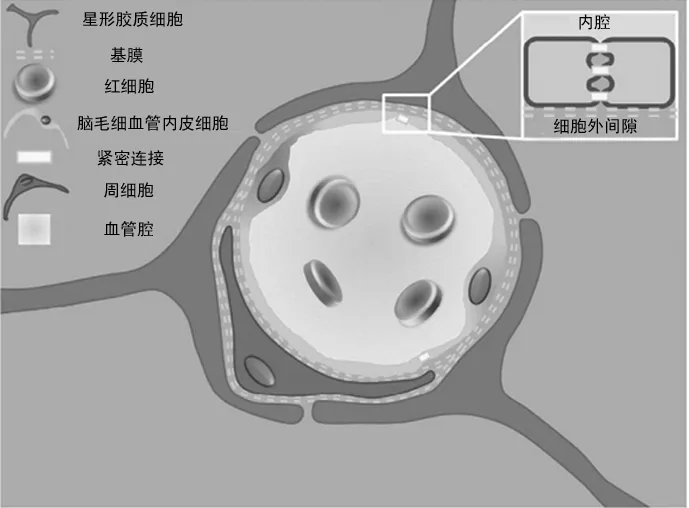
图1 BBB生物学结构图[3]Fig.1 Biological structure of the BBB[3]
BBB是外周循环系统与中枢神经系统(Central Nervous System,CNS)之间的分界, 它可以防止血液中有害物质进入脑组织, 是维持脑脊髓液代谢平衡的独特构造, 如图1所示。它是由脑毛细血管内皮细胞及其细胞间所组成的紧密连接、 完整的基膜、 周细胞以及星形胶质细胞脚板围成的神经胶质膜所构成[3]。BBB独特的屏障功能主要归功于紧密连接的存在, 紧密连接是由一些蛋白质构成的, 主要包括claudins(紧密连接蛋白), occludins(闭合蛋白), JAMs(Junctional Adhesion Molecules, 连接黏附分子), ZO-1(Zonula Occludens Protein-1, 闭锁小带蛋白-1)、 ZO-2、 ZO-3等[4], 这些蛋白质能够选择性限制某些溶质的通过, 一般来讲只有分子量小于400 Da、 高脂溶性、 无毒性、 带正电等物质有可能通过紧密连接进入脑内[5]。
BBB的存在虽保护了脑组织免受有毒药物的伤害, 但也阻碍了药物进入脑组织对脑部疾病的治疗[6]。为此, 人们对如何将药物送入脑部组织进行了深入的研究。目前, 传送药物进入脑部组织的主要策略有三种[3], 一是合成能够进入脑部的新型小分子药物; 二是使用侵入性的导管将药物送入脑中; 三是无创、 可逆地开放BBB。一般而言, 只有少数的疾病能够使用小分子药物来治疗; 而用侵入式的方法传送药物会有一些副作用, 例如静脉注射渗透性药物如甘露醇会使药物在正常组织中浓度过高, 产生毒副作用[5]; 局部穿刺会损伤大脑; 经鼻腔给药不能实现脑组织靶向给药[5,7]等。因此, 科研人员希望安全有效地开放BBB将药物投递入脑去治疗脑部疾病。
聚焦超声(Focused Ultrasound,FUS)联合微泡(Microbubble,MB)的药物传输技术利用MB的载药功能及其空化效应能够更好增加大脑的渗透性, 提高药物投递的效率, 已经成为一种无创开放BBB靶向送药入脑的有效方法[5,13,18]。然而, FUS联合MB开放BBB在有些情况下是不安全的, 当超声能量过大或者辐照时间过长时会引起脑组织损伤, 例如血管壁水肿、 出血甚至坏死[34]。只有准确掌握组织生理病理结构并实时监测FUS作用于组织所致损伤的程度和范围, 才能真正达到无创、 安全和有效开放BBB的目的。可见, 探讨FUS联合MB开放BBB的安全有效参数及对其开放过程进行监测是保证无创、 可逆开放BBB治疗脑部疾病的关键。本文在介绍FUS联合MB开放BBB机制的基础上, 分别总结介绍了示踪剂法、 医学影像学法和空化效应法三种监控BBB开放效果的监测方法, 可为FUS联合MB开放BBB提供参考。
1 FUS联合MB开放BBB的机制
FUS联合MB开放BBB的可能机制一直是科学家关注的焦点之一。早在20世纪50年代, Barnard等在研究超声的强度对中枢神经系统的影响时, 发现使用高强度的超声能引起血脑屏障通透性的改变。随后的研究人员用活性染料台盼蓝和放射性物质示踪等检测方法也证实FUS能够开放血脑屏障。他们推测可能是高压力幅值条件下的 超声空化效应产生的机械力破坏了BBB[8], 也可能是超声波热效应所致[9]。单独注射MB也可能导致BBB的开放。1999年, Mychaskiw等[10]将一种用于心脏造影的MB经鼠颈动脉注射至脑循环时, 发现鼠的BBB遭到破坏。之后Rooker等[11]也在实验中得到相同结果, 他们认为可能的原因是氟碳气体对细胞膜的直接效应所致, MB溶液独特的构成包括了辛酸和软脂酸, 这类脂肪酸的毒性也可能破坏BBB内皮细胞继而开放BBB。无论是单独使用超声还是单独使用MB, 其安全开放BBB的情况下均难以使较多的大分子药物进入脑组织。2001年, Hynynen 等[12]使用自制的MB造影剂来加强FUS无创性开放BBB的效果, 结果表明: 与单独使用FUS相比, MB的使用大大减少了无创性开放血脑屏障所需要的FUS强度, 并且血脑屏障在 24 h之内就完全恢复正常。之后的研究者也尝试超声联合MB开放BBB, 均取得了较好的效果[18,32,34], 但超声联合MB是如何开放BBB的确切机制仍未能明确。
目前学者普遍认为, BBB的开放与MB在FUS作用下的空化行为有关。超声MB造影剂作为一种空化核, 它在超声波作用下产生的空化效应主要分为两种形式: 第一类为稳态空化(Stable Cavitation), 在低声压下, MB在FUS场下产生周期性的压缩和膨胀, 当作用于血管壁时会产生机械剪切力和微射流效应; 第二类则为惯性空化(Inertial Cavitation), 在高声压下, 气泡压缩膨胀会到达极限, 瞬间爆破产生局部高温、 高压和高能量冲击波, 导致高压射流的产生[13]。研究证明, 惯性空化产生的效应对BBB开放的作用不大, 有时其产生剧烈的生物学效应甚至会损伤正常组织, 而稳态空化的效应更有利于BBB开放, 并且它产生的效应相对来说更容易预知、 更可控[3]。
为了从更微观的细胞水平, 探索超声联合MB开放BBB的机制, 如图2所示。科研工作者通过大量离体、 活体实验发现, MB稳定的振荡产生的机械力会造成了血管的收缩与膨胀, 同时也改变了内皮细胞的细胞骨架及其细胞间的连接。概括来讲, 这些效应使BBB开放是通过了三个机制——破坏紧密连接、 诱导转胞吞作用、 脑毛细血管内皮细胞内的声孔效应。通过电镜观察[14]显示, 紧密连接蛋白-1(Claudins-1)、 紧密连接蛋白-5(Claudins-5)、 Occludins和Claudins在FUS辐照后数量减少了, 同时位置分布也发生变化, 最显著的是claudins再也不沿着内皮细胞壁聚合, 这表明它不再作用于紧密连接的合成; 此外, 还观察到示踪剂辣根过氧化酶(HRP)渗透到内皮细胞之间, 这说明紧密连接不再封闭从血管到脑实质的细胞旁途径(Paracellular Passage)。近几年, Jalili等[15]发现在FUS作用下组成紧密连接的occludin和ZO-1的蛋白质水平没有改变, 但是两者的相互作用遭到破坏, 影响了BBB的完整性使其开放, 同时还激活了在神经元细胞中的一种蛋白激酶Akt的信号通路。这些实验结果说明, 可以通过破坏组成紧密连接的蛋白质及其之间的相互作用可以使BBB开放, 且药物通过细胞旁途径穿过BBB是通过破坏紧密连接实现的。

图2 FUS联合MB开放BBB的细胞学机制[3]Fig.2 Cellularmechanism of focused ultrasoundmediated blood-brain barrier disruption[3]
除了细胞旁途径, 在FUS作用下, 物质还可以通过跨细胞途径(Transcellular Transport)运输方式穿过BBB。Sheikov等[16]发现施加FUS后, BBB的内皮细胞上有胞质通道和大量的囊泡, 这说明胞内吞作用增加了。类似的研究中[17], 采用高分辨率显微镜结合高速摄像机观察记录到在超声场中MB的振荡造成了内皮细胞的形变, 且仅在畸形细胞中观察到染色加深, 表明MB的振荡在内皮细胞膜上产生小孔, 导致了药物的摄取。重庆医科大学的邓金木博士[18]在FUS联合MB建立动物模型时使用非律平(Filipin)进行干扰, 发现脑毛细血管内皮细胞上的小窝蛋白-1(Caveolin-1)表达增多, 且Caveolin-1 的表达水平相较于未用非律平干扰组低, 同时血脑屏障的开放程度也比未干扰组明显降低, 证明血脑屏障的开放程度与Caveolin-1 的表达水平一致, 且小凹蛋白是最有可能的胞转运途径。
随着一些新技术的发展, 研究者[19]用双光子显微镜这种独特的方式观察验证了细胞旁途径和跨细胞途径的存在, 总结得出药物在FUS的作用下通过BBB要么是通过一个快的途径(小于10 min), 要么是通过一个慢的途径(大于10 min), 并假设快的途径很有可能是通过细胞旁路途径(紧密连接破坏), 慢的途径很可能是跨细胞途径(诱导转胞吞作用和声孔效应)。
概括来讲, FUS联合MB开放BBB的可能机制有: 超声产生的机械力破坏了BBB, 超声波热效应所致, 氟碳气体对细胞膜的直接效应所致, MB的毒性破坏BBB内皮细胞继而开放BBB, 超声波作用下产生的空化效应, 超声联合MB破坏了内皮细胞的细胞骨架与细胞间的连接、 诱导转胞吞作用和声孔效应等。是其中一种作用机制导致BBB开放, 还是多种效应联合作用导致BBB开放, 目前仍不明确。尽管FUS联合MB开放BBB的确切机制不够明确, FUS联合MB能够增强BBB渗透率并将治疗药物投递入脑[27]却是事实, 这一领域的研究必将有利于脑部疾病的更好治疗[32,34]。
2 FUS联合MB开放BBB效果的监测方法
2.1 示踪剂监测法
研究者常使用一些示踪剂去观察BBB的开放情况, 常用的示踪剂有伊文思蓝[18,20](Evans Blue,EB)、 荧光素钠[20](Sodium Fluorescein)、 辣根过氧化物酶(HRP)[14,20]以及白蛋白[21]等。
理想的示踪剂具有特点是代谢慢, 无毒, 不依附于其他物质——例如在血浆与组织中的蛋白质, 有多种粒径大小可选择, 从肉眼到电镜的范围内均可以被观察到, 而且还可以量化。然而, 很少有一种示踪剂能满足理想示踪剂的所有特点, 也即不能满足所有的实验目的, 因此研究者会使用两种及以上的示踪剂去评估BBB的开放情况。为了更方便研究者选择合适的示踪剂, 这里总结了常见示踪剂的优缺点, 如表1所示。

表1 常用BBB示踪剂的特点[22]Tab.1 Characteristics of common blood-brain barrier markers[22]
现有的研究中, 衡量 BBB 开放的指标大多数采用EB、 组织病理学和电镜观察, 而这些方法仅限于离体标本或者活体动物实验研究, 不能用于临床。因此, 如下所述的监测BBB开放的方法被研究者应用。
2.2 医学影像学监测法
将医学影像设备如磁共振(MRI)、 B超、 CT与FUS相结合, 可以解决示踪剂不能应用于临床的遗憾, 通过这些设备不但可以更精确定位, 同时还能实时监控超声波照射过程中脑组织的变化。目前, 常用的经医学影像设备引导的监控方式主要有B超和MRI。因CT使用时会有辐射, 一般不采用CT作为监控设备。
超声影像技术具有安全、 费用低、 操作方便、 实时等优势, 不仅可以获取软组织的高分辨率图像, 还可以对心脏和血管的功能进行实时动态分析。因而, 超声影像技术已广泛地应用于引导FUS治疗过程[23]。经超声引导的FUS(Ultrasound guided FUS, USgFUS)由于具有实时性好、 价格低廉、 与FUS设备兼容等优点, 现已成为临床治疗和科学研究的一个热点, 其监控原理是将FUS辐照靶区后, 其B超声像图即刻有强回声的出现作为一个单元治疗完成的标志。但是, 对于该强回声出现的原因尚不清楚, 目前普遍认为出现强回声主要是聚焦超声致靶区空化产生的空化泡所致[24]。此外, USgFUS在治疗中也有些缺陷, 首先, FUS的治疗参数设置是基于实验、 理论模型和临床经验。其次, 不能实现定位以及治疗过程中温度变化的在线监控, 这些会导致FUS辐照能量过强或过弱, 甚至有可能因为定位误差导致根本没有作用于病灶, 从而影响治疗效果[25]。
经MRI引导的FUS(MRI guided FUS, MRIgFUS)的出现可以解决这些问题, MRI对温度变化非常敏感, 利用计算机技术, 可以实现在线监测治疗过程中温度的变化, 通过这些信息得知能量变化从而调整辐照参数, 避免对组织的过度照射。最重要的是, MRI能够精确地掌握病灶的大小及位置, 这是光凭外科医生的眼睛是做不到的[26]。这些优点使得MRI已经成为FUS联合MB开放BBB中不可或缺的一环, 通过MRI常规图像以及温度图像可对整个治疗过程实施监测, 形成了从定位规划、 超声照射、 能量传递、 检测效果等各种信息的反馈闭合等, 使我们真正地做到靶向、 局部、 微创和实时地给药, 例如Arvanitis等[27]就利用一个商业的经颅MRIgFUS进行超声发射、 定位与监控, 也利用MRI造影剂的溢出量观察BBB的开放情况, 实现了对大鼠脑部靶向安全的给药, 但是相比于USgFUS它有个缺点是其使用成本很高。因此, 研究者可以根据自己的需求选择合适的医学影像设备引导FUS联合MB靶向开放BBB并对整个治疗过程进行监控。
2.3 基于空化效应的监测法
现在认为FUS开放BBB的最主要的机制是空化效应, 在空化发生过程中, 空化泡振荡会发出丰富的声信息: 基波、 谐波、 次谐波、 超谐波和宽带噪声, 以及超声的非线性传播也会产生谐波信息[28]。通常认为非谐波的高频宽带噪声是惯性空化发生的标志, 而次谐波是稳态空化的标志[29]。因此可以通过观察空化效应的发生情况来反映BBB的开放情况。基于空化效应的监测方法主要有声学、 光学及声化学等监测方法。
声学监测法分为主动空化监测(Active Cavitation Detection, ACD)与被动空化监测(Passive Cavitation Detection,PCD)两种[30]。ACD监测法是以一个较低频的FUS探头诱发空化效应, 再相对发射探头的其他位置放置一个较高频的探头来监测空化效应。监测探头对着可能发生空化效应的区域持续发射脉冲波, 并监测其回波信号。ACD系统可利用常用的B超设备作为监测设备, 并由此生成二维B超图像, 能得到空化效应发生的位置, 但是缺点是信噪比低。PCD监测方法的架构与主动式监测方法类似, 只是监测探头不发射超声波, 仅接收空化效应发生时的声发射信号, PCD监测法只需一个平面接收换能器, 装置简单, 且信噪比和灵敏度较高, 最重要的是还能做定量分析。
光学检测方法主要是直接测量超声空化泡的动力学行为, 例如Mie散射或高速摄影[31], 其中高速摄影是运用高速摄影机直接拍摄微气泡之变化, 摄影时的时间解析度必须足够高(帧率>50 MHz)[32]。该方法一般多用在实验室研究透明液体中尺寸较大的空化泡对超声驱动的动力学响应, 系统复杂, 对操作人员的要求也较高。
声化学检测方法主要是用一些化学试剂与空化作用后产生的一些物质反应, 用产生的可见现象来表明空化效应的发生。例如对苯二甲酸(Terphthalic Acid, TA)法检测超声空化效应, 其原理是TA水溶液是非荧光性物质, 一旦超声强度达到空化阈值便会裂解水分子产生羟自由基(0H ), 对苯二甲酸根离子会与0H 相结合, 形成具有荧光性的羟基对苯二甲酸根离子(HTA), 它是具有较稳定的强荧光性物质[33]。通过对HTA荧光强度检测, 即可研究不同实验条件下的声空化规律。
这些BBB开放情况的监测方法都各有其利弊, 示踪剂法虽然可以从细胞学水平观察BBB开放时的情况, 但是有些示踪剂会对人体有害; 医学影像学法定位, 监控效果都较好, 但是不能探测BBB开放过程中空化效应特征且一般价格昂贵; 基于空化效应的监测法虽然方法多样, 但是不能探测BBB开放时除空化效应外的其他生物学效应。因此研究人员在使用时一般都综合使用这些监测方法, 使FUS联合MB开放BBB时更加安全、 高效。例如, 哥伦比亚课题组[34]就利用PCD测得的信号经过数据处理后, 用惯性空化剂量、 基于谐波的稳态空化剂量、 基于高次谐波的稳态空化剂量及空化信噪比这4个量化指标去说明FUS联合MB去开放BBB的整个空化效应的特征; 再利用B超可视化MB破裂的过程, 同时确保FUS换能器焦点处于靶区; 最后利用MRI监控整个BBB开放过程是否有脑组织出血和水肿。
3 展望
尽管目前对FUS联合MB技术及其生物学效应已进行了深入研究, 但将其应用于脑部疾病的临床治疗仍有许多问题有待解决。首先, FUS联合MB开放BBB的确切机制仍不十分清楚, 导致现有关于超声联合MB开放血脑屏障研究虽然较多, 但大多是处于动物实验的阶段, 因此有必要进行更深入的研究, 以明确超声与MB相互作用使BBB通透性增加的各种作用机制, 从而使该技术安全有效地用于脑部疾病的治疗。其次, 鉴于人头骨较厚且不均匀, 超声波在穿过颅骨时发生严重衰减和畸变, 这是该技术的一大局限, 需要研究更多的解决方案。最后, 如何在体进行实时有效的BBB开放监测和探索适合体化BBB开放的物理参数和相应的“阈限值”, 这是需要一个医学、 电子技术、 工程学相结合而共同努力完成的课题。我们相信, 随着上述问题的解决, FUS联合MB这种无创性技术会更加高效、 安全和普及, 成为治疗人类脑部疾病的有力武器。
[1] Thomas P Davis. History of Blood-Brain Barrier[EB/OL]. (2013-04-25)[2016-06-27]http://davislab.med. arizona.edu/content/history-blood-brain-barrier.
[2] Leshan R, Milner T, Pfaff D W. Blood Brain Barrier[M]// Neuroscience in the 21st Century. 2013:1621-1629.
[3] Timbie K F, Mead B P, Price R J. Drug and gene delivery across the blood-brain barrier withfocused ultrasound[J]. Controll Release, 2015,219:61-75.
[4] Bauer H C, Krizbai I A, Bauer H, et al. "You Shall Not Pass"-tight junctions of the blood-brainbarrier[J]. Front in Neurosci, 2014,8(8): 392-392.
[5] Burgess A, Hynynen K. Noninvasive and targeted drug delivery to the brain using focused ultrasound[J]. Acs Cheml Neurosc, 2013, 4(4):519-526.
[6] Betsholtz C. Physiology: Double function at the blood-brain barrier[J]. Nature, 2014,509(7501): 432-433.
[7] Brar V, Kaur G. Biopolymers as carriers for nasal drug delivery[J]. Polymer-Plastics Tech and Eng, 2014, 53(14) :1518-1531.
[8] Abraham C S, Harada N, Deli M A, et al. Transient forebrain ischemia increases the blood-brain barrier permeability for albumin in stroke-prone spontaneously hypertensive sats[J]. Cell Molecul Neurob, 2002, 22(4):455-462.
[9] Mcdannold N, Vykhodtseva N, Jolesz F A, et al. MRI investigation of the threshold for thermally induced blood-brain barrier disruption and brain tissue damage in the rabbit brain[J]. Magn Reson Med, 2004, 51(5):913-923.
[10] Mychaskiw G, II, Badr A E, Zhang J, et al. Optisoncauses disruption of the blood-brain barrier in rats. Circulation, 2000,91(4): 798-803.
[11] Rooker S, Van Reempts J, Van Deuren B, et al. Ultrasound agents may open the blood-brain barrier in rats and aggravate pathologic consequences of experimental head trauma[J]. Neuropathology, 2003,23(3),210-213.
[12] Hynynen K, McDannold N, Vykhodtseva N, et al. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits[J]. Radiology,2001,220(3):640-696.
[13] Piper R J, Hughes M A, Moran C M, et al. Focused ultrasound as a non-invasive intervention for neurological disease: a review [J]. Brit J Neurosurg, 2016:1-8.
[14] Sheikov N, McDannold N, Sharma S, et al. Effect of focused ultrasound applied with an ultrasound contrast agent on the tight junctional integrity of the brain microvascular endothelium[J]. Ultrasound Med Biol, 2008,34, 1093-1104.
[15] Jalali S, Huang Y, Dumont DJ, et al. Focused ultrasound-mediated BBB disruption is associated with anincrease in a ctivation of AKT: an experimental study in rats[J]. BmcNeurology, 2010,10(1):1-10.
[16] Sheikov N, McDannold N, Jolesz F, et al.Brain arterioles show more active vesicular transport blood-borne tracer molecules than capillaries and venules after focused ultrasound-evoked opening of the blood-brain barrier[J]. Ultrasound Med Biol, 2006,32(9):1399-1409.
[17] Wamel A V, Kooiman K, Harteveld M, et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation[J]. J Control Release, 2006,112(2):149-155.
[18] 邓金木. 聚焦超声联合微泡开放血脑屏障的机制研究[D]. 重庆:重庆医科大学,2013.
[19] Nhan T, Burgess A, Cho E E, et al. Drugdelivery to thebrain by focused ultrasound induced blood-brain barrier disruption: quantitative evaluation of enhanced permeability of cerebral vasculature using two-photon microscopy[J].J Control Release, 2013,172(1):274-280.
[20] Kaya M, Ahishali B. Assessment of permeability in barrier type of endothelium in brain using tracers: Evans blue, sodium fluorescein, andhorseradish peroxidase[J]. Meth in Molecul Biol, 2011, 763(763):369-382.
[21] O'Shea E, Urrutia A, Green A, et al.Current preclinicalstudies on neuroinflammation and changes in blood-brain barrier integrity by MDMA and methamphetamine[J]. Neuropharmacology, 2014, 87:125-134
[22] Saunders N R, Dziegielewska K M, Habgood M D, et al. Markers for blood-brain barrier integrity: how appropriate is Evans blues in the twenty-first century and what are the alternatives[J]. Front Neurosci, 2015,9:3-8.
[23] Tavakkoli J, Sanghvi N, Sanghvi N. Ultrasound-guided HIFU and Thermal Ablation[M]. Therapeutic Ultrasound: Mechanisms to Applications. 2011.
[24] Mclaughlan J, Rivens I, Leighton T, et al. A study of bubble activity generated in Ex vivo, tissue by high intensity focused ultrasound[J]. Ultrasound Med Biol, 2010, 36(8):1327-44.
[25] Liu H L, Mcdannold N, Hynynen K. Focal beam distortion and treatment planning in abdominal focused ultrasound surgery[J]. Med Phy, 2005, 32(5):1270-1280.
[26] Jolesz F A. MRI-guided focused ultrasound surgery[M]// MRI-guided focused ultrasound surgery /. Informa Healthcare, 2008.
[27] Arvanitis C D, Livingstone M S, Vykhodtseva N, et al. Controlled ultrasound-induced blood-brain barrier disruption using passive acoustic emissions monitoring[J]. Plos One, 2012, 7(9):e4578..
[28] Harvey G, Gachagan A, Mutasa T. Review of high-power ultrasound-industrial applications and measurement methods[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2014, 61(3):481-495.
[29] Johnston K, Tapia-Siles C, Gerold B, et al. Periodic shock-emission from acoustically driven cavitation clouds: A source of the subharmonic signal[J]. Ultrasonics, 2014, 54(8):2151-2158.
[30] 高玮甫. 相变液滴汽化的声学特征信号研究[D]. 台湾:清华大学生医工程与环境科学系,2015.
[31] 周利斌,张大臣,姜鹏飞,等. 一种基于Mie散射的颗粒物浓度测量方法[J]. 科技导报, 2014(18):22-25.
[32] Lu M, Shi Y, Fang L, et al. Enhanced-cavitation heating protocols in focused ultrasound surgery with broadband split-focus approach[J]. IEEE Tran Ultrason, Ferroelectr Freq Control, 2014,61(4): 631-646.
[33] Ashton Acton Q. Hydroxides-advances in research and application: 2013 Edition[M]. Atlanta Georgia: Scholarly Editions, 2013.
[34] Wu S Y, Tung Y S, Marquet F, et al. Transcranial cavitation detection in primates during blood-brain barrier opening-a performance assessment study [J]. IEEE Trans Ultrason Ferroelectr Freq Control. 2014,61(6): 966-978.
Progress of Mechanisms and Monitoring Methods of Opening Blood-brain Barrier Using Focused Ultrasound Combined with Microbubbles
WANG Min, SHEN Yuanyuan, WANG Tianfu,CHEN Siping, DIAO Xianfen
National-Regional Key Technology Engineering Laboratory for Medical Ultrasound (Shenzhen, 518060) Guangdong Key Laboratory for Biomedical Measurements and Ultrasound Imaging (Shenzhen, 518060) Department of Biomedical Engineering, School of Medicine, Shenzhen University (Shenzhen, 518060)
The blood-brain barrier (BBB) could be opened by focused ultrasound combined with microbubbles transiently, noninvasively and locally. Recently, this method has become a new strategy for brain-targeted drug delivery. In this paper, firstly, the discoveries and functions of the BBB were described in detail. Secondly, the possible mechanism of opening BBB using focusing ultrasound combined with microbubble was introduced. Then, three monitoring methods for the BBB opening, that is, the tracer method, medical imaging monitoring method and the monitoring method based on cavitation effect were reviewed. Finally, the mechanism of the BBB opening by focusing ultrasound combined with microbubbles and its monitoring methods were prospected.
focused ultrasound, microbubble contrast agent, blood brain barrier opening, monitoring methods
10.3969/j.issn.1674-1242.2016.04.005
王敏,E-mail: 1219421323@qq.com
R445.1
A
1674-1242(2016)04-0198-06
2016-10-09)