蛭龙活血通瘀胶囊对脑出血大鼠脑组织AQP-4、MMP-9及TIMP-1蛋白表达的影响
王 蔚 杜 渊 白 雪 杨思进
西南医科大学附属中医医院 646000 四川泸州市春晖路16号
·实验研究·
蛭龙活血通瘀胶囊对脑出血大鼠脑组织AQP-4、MMP-9及TIMP-1蛋白表达的影响
王 蔚 杜 渊 白 雪 杨思进
西南医科大学附属中医医院 646000 四川泸州市春晖路16号
目的:观察蛭龙活血通瘀胶囊对脑出血大鼠脑组织AQP-4、MMP-9、TIMP-1蛋白表达的影响,探讨蛭龙活血通瘀胶囊对脑组织的保护作用机制。方法:将45只SD大鼠随机分为5组:假手术组,模型组,蛭龙活血通瘀胶囊高、中、低剂量组,各组又分为12 h、48 h、72 h 3个亚组。采用自体尾部血注入法制备脑出血大鼠模型,Western blot法检测AQP-4、MMP-9、TIMP-1蛋白的表达。结果:与模型组比较,蛭龙活血通瘀胶囊各剂量组AQP-4、MMP-9蛋白表达均有不同程度的降低,TIMP-1蛋白表达均有不同程度的升高,具有显著性差异(P<0.01);蛭龙活血通瘀胶囊各剂量组之间比较,低、中剂量组在各时间点脑组织AQP-4、MMP-9、TIMP-1蛋白表达与高剂量组差异有显著性意义(P<0.01)。结论:蛭龙活血通瘀胶囊能够明显降低脑出血大鼠脑组织AQP-4、MMP-9蛋白的表达,并升高TIMP-1蛋白的表达,该作用存在一定的量效关系,蛭龙活血通瘀胶囊高剂量组作用最为明显。
蛭龙活血通瘀胶囊;脑出血;AQP-4;MMP-9;TIMP-1;实验研究
脑出血是常见的内科急症,临床病理研究证实,脑出血急性期恶化和死亡的主要原因是脑水肿及出血[1]。脑出血后在出血区域形成血肿,对周围脑组织造成压迫,引起颅内的急性占位效应,并对周围的脑组织产生进一步的损害,因此脑水肿被认为是脑出血后最重要的继发性病理变化之一。研究表明,水通道蛋白-4(aquaporins-4,AQP-4)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、基质金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase-1,TIMP-1)与脑水肿密切相关,参与了多种疾病所引起的脑水肿的病理过程[2-4]。蛭龙活血通瘀胶囊具有益气活血、化瘀通络功效,本实验观察其对大鼠脑出血后脑组织AQP-4、MMP-9、TIMP-1蛋白表达的影响,旨为揭示其治疗脑出血的作用机理。现将结果报道如下。
1 实验材料
1.1 动物 清洁级雄性健康SD大鼠45只,体重250~300 g,由西南医科大学动物实验中心提供,实验动物使用许可证号为SYXK(川)2013-065。动物按照每笼5只进行饲养,室温22±2℃,湿度30%~40%,常规饲料喂养,自由摄食及饮水。
1.2 药物及试剂 蛭龙活血通瘀胶囊由黄芪、水蛭、地龙、大血藤、桂枝等药物组成,规格为每粒0.4 g,相当于每粒含生药2.625 g,由西南医科大学附属中医医院制剂室提供,批号为20151201;兔抗AQP-4多克隆抗体 (Santa Cruze,Sc-20812);兔抗MMP-9多克隆抗体(proteintech,10375-2-AP);鼠抗TIMP-1单克隆抗体(Minipore,MAB3300);蛋白 marker(Thermo fermentas,SM0431);β-action抗体(中杉金桥,TA-09);G250考马斯亮蓝溶液(上海生工,A602151-0250);Immobilon Western Chemiluminescent HRP Substrate(曝光液,Minipore,WBKLS0100)。
1.3 仪器 大鼠脑立体定位仪(安徽正华生物仪器设备有限公司);Thermo 991-80℃超低温冰箱(美国赛默飞世尔);IMS-40全自动雪花制冰机(常熟雪珂电器有限责任公司);KJ201-BS型震荡器(江苏康健医疗用品有限公司);DYY-10C电泳仪(北京六一仪器厂);Y-SPCT型水平电泳槽(北京君艺东方);BioMate 3S紫外分光光度计(美国Thermo Fisher Lab-Serv);ChemiDoc XRS凝胶成像系统(美国Bio-Rad)。
2 方法
2.1 动物分组与造模 将45只SD大鼠按随机数字表法分为5组:假手术组,模型组,蛭龙活血通瘀低、中、高剂量组(分别简称为“ZL低剂量组”“ZL中剂量组”“ZL高剂量组”),每组9只。并按指标检测的时间划分为12 h、48 h、72 h 3个亚组,每亚组3只。大鼠术前禁食12 h,称重麻醉后断尾取尾部自体血50 μl。将大鼠用立体定位仪俯卧位固定,备皮消毒,暴露手术区域,沿头皮正中纵行切开约10 mm,用30%双氧水腐蚀骨膜,参照文献[5]方法,并根据《脑立体定位图谱》[6]进行尾壳核定位(矢状缝右侧旁开3.0 mm,前囟前0.2mm处),用微量进样器按5μl/min的速度缓慢匀速注入自体血,留针15 min后缓慢退针,骨蜡封闭颅骨,缝合头皮。假手术组只进针,不注血。参照文献[7]“5分制法”对大鼠进行神经功能缺损评分。以评分为1~3分认为造模成功,0分则认为造模失败,4分和死亡大鼠均被剔除并根据分组进行相应补充。假手术组大鼠在术后清醒后无明显神经功能缺损症状,评分为0分。
2.2 给药 大鼠麻醉自然苏醒后进行灌胃。各药物组均给予蛭龙活血通瘀胶囊药物的等体积和相应的浓度进行灌胃。蛭龙活血通瘀胶囊成人的临床用药量为3.6 g/d,按照人体用量的5倍、10倍、20倍定为低、中、高剂量。成人体重按60 kg计算,换算成各药物组大鼠的每日用药量,分别为0.3 g/(kg·d)、0.6 g/(kg·d)、1.2 g/(kg·d)。大鼠的灌胃体积为3 ml,给药次数为1次/日。模型组、假手术组给予等体积(3 ml)的生理盐水灌胃,给药次数同药物组。
2.3 脑组织 AQP-4、MMP-9、TIMP-1蛋白的表达 采用蛋白质印迹法(Western blot)。称取0.05 g脑组织提取蛋白,以考马斯亮蓝比色法测定蛋白浓度并经凝胶染色检测提取蛋白质量。按照Western blot操作步骤:制胶→电泳→转膜→封闭→一抗孵育→二抗孵育,孵育完毕用TBST缓冲液冲洗PVDF膜 3次,每次 5 min,将PVDF膜倒扣在曝光液中,约1 min后通过凝胶成像系统进行信号检测。蛋白的相对表达量为蛋白灰度值与内参β-actin灰度值的比值。
2.4 统计方法 应用SPSS 13.0统计软件进行统计分析。计量资料采用均数±标准差(x±s)表示,组间比较采用单因素方差分析(Oneway ANOVA),多重比较采用LSD及Dunnett法。以P<0.05为差异有统计学意义。
3 结果
3.1 蛭龙活血通瘀胶囊对AQP-4蛋白的影响 见表1。
表1显示,假手术组大鼠脑组织中有微量的AQP-4蛋白表达,在12 h、48 h及72 h的表达量无明显差异(P>0.05);与假手术组相比,模型组及ZL低、中、高剂量组各时间点AQP-4蛋白的表达均明显升高,差异具有统计学意义(P<0.01);模型组术后AQP-4蛋白表达呈进行性升高,72 h时最为显著;与模型组相比,ZL各剂量组AQP- 4蛋白表达均有不同程度的降低,具有显著性差异(P<0.01),其中以ZL高剂量组降低最为显著,明显低于ZL低、中剂量组(P<0.01)。
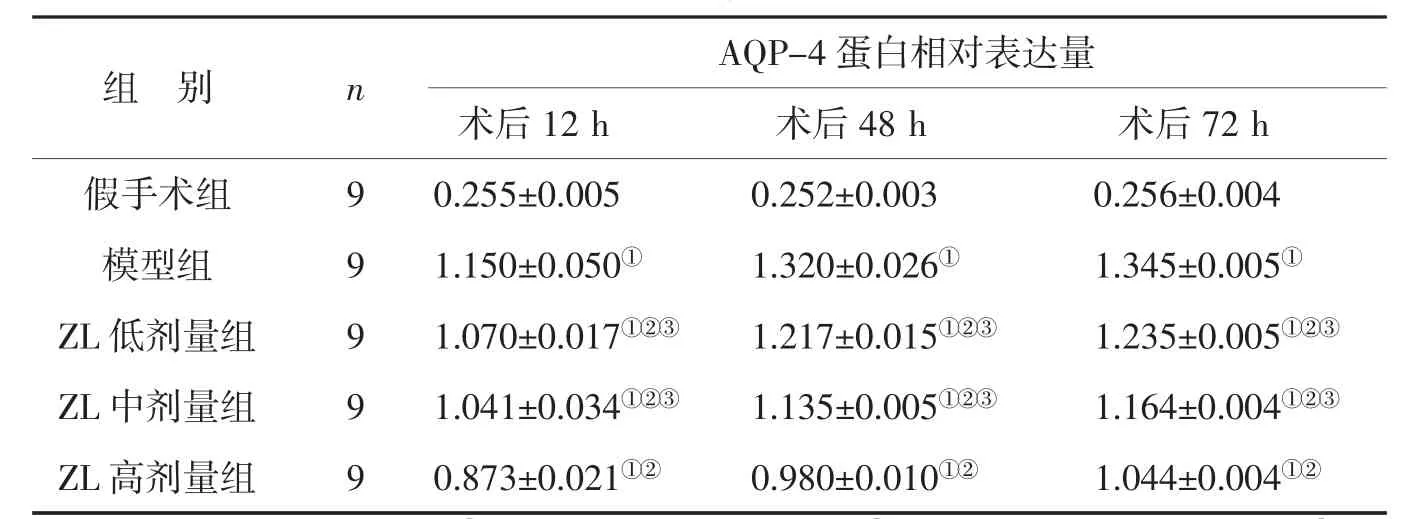
表1 各组大鼠脑组织AQP-4蛋白相对表达量比较 (x±s)
3.2 蛭龙活血通瘀胶囊对MMP-9蛋白的影响 见表2。

表2 各组大鼠脑组织MMP-9蛋白相对表达量比较 (x±s)
表2显示,假手术组大鼠脑组织中MMP-9蛋白有少量的表达,术后12 h、48 h及72 h时表达比较差异无统计学意义(P>0.05);与假手术组比较,模型组及ZL低、中、高剂量组各时间点MMP-9蛋白表达均明显升高,差异具有统计学意义(P<0.01);模型组脑组织MMP-9蛋白表达于术后48 h时达到高峰,72 h时略有下降;与模型组相比,ZL各剂量组MMP-9蛋白表达均降低,具有显著性差异(P<0.01),尤以ZL高剂量组下降最为显著,明显低于低、中剂量组(P<0.01)。
3.3 蛭龙活血通瘀胶囊对TIMP-1蛋白的影响 见表3。

表3 各组大鼠脑组织TIMP-1蛋白相对表达量比较 (x±s)
表3显示,假手术组大鼠脑组织中TIMP-1蛋白仅有微量的表达,且在术后12 h、48 h及72 h时的表达量比较差异无统计学意义(P>0.05);与假手术组比较,模型组及ZL低、中、高剂量组大鼠各时间点TIMP-1蛋白表达均明显升高,差异具有统计学意义(P<0.01);模型组大鼠脑组织TIMP-1蛋白表达在术后48 h时上升明显并达到高峰,72 h时略有下降;与模型组相比,ZL各剂量组TIMP-1蛋白表达均有显著升高,具有显著性差异(P<0.01),其中以ZL高剂量组升高最为显著,明显高于低、中剂量组(P<0.01)。
4 讨论
AQP-4又称为汞不敏感水通道蛋白(mercury insensitive water channel,MIWC),是水通道蛋白家族中的一员[8]。AQP-4在中枢神经系统分布上最显著的特点是呈极性分布,具有高度选择性[9]。AQP-4有两个主要表达区域,一个是位于形成胶质界膜的致密星形胶质细胞足突上,其参与形成与脑脊液接触的软脑膜和室管膜的表面屏障;另一个是位于包绕血管周围的星形胶质细胞的足突上,并在与血管直接接触的足突上呈极性分布[10]。AQP-4的这种分布特点提示其在维持大脑水的平衡中发挥了重要作用,AQP-4是胶质细胞与脑脊液以及血管间的水调节和转运的重要结构基础[11]。研究表明[12],脑出血后血肿周围AQP-4表达的升高导致脑水肿加剧、血脑屏障通透性破坏、神经功能缺损,提示AQP-4的动态变化与脑水肿、脑损伤发生发展过程密切相关。
MMP-9又被称为明胶酶 B(gelatinase-B),是一种依赖金属锌离子的金属酶,MMP-9参与组织发育与重构,胚胎形成,创伤修复,血管新生等多种生理过程[13]。近年的研究表明,MMP-9与脑血管疾病关系密切,在脑出血后脑水肿的形成和发展中发挥重要作用[3]。研究显示,MMP-9定位于神经元、血管内皮细胞和胶质细胞,在脑出血时MMP-9含量增加[14]。内源性MMP-9来自星形胶质细胞和小胶质细胞,外源性MMP-9来自内皮细胞、渗出的中性粒细胞和巨噬细胞。MMP-9启动后,可以通过降解细胞外基质成分,从而对血脑屏障完整性造成破坏。在对脑组织、血浆、脑脊液和血肿抽吸液等MMPs蛋白水平的检测结果发现[15-16],MMP-9于出血后数小时开始升高,达到峰值后很快降低,与脑损害后脑水肿出现的高峰一致。
TIMP-1属于基质金属蛋白酶组织抑制因子(Tissue inhibitor of metalloproteinase,TIMPs)家族,是一类对基质金属蛋白酶(metalloproteinase,MMPs)活性进行抑制的生物大分子物质[17]。TIMP-1的主要作用是抑制胶原酶的活性,同时抑制基质分解素和明胶酶B(MMP-9)[18-19]。TIMP-1能够抑制大部分的MMPs[20]。脑出血时MMPs被活化,打破了MMPs与TIMPs之间的动态平衡,进而促进了脑水肿的形成和脑细胞死亡[21]。TIMP-1与脑出血后脑水肿密切相关。王复新等[22]研究大鼠脑出血周边组织MMP-9和TIMP-1表达对脑水肿的影响,结果发现脑出血后脑组织含水量于72 h达到高峰,EB含量在 48 h达到高峰,MMP-9和TIMP-1表达在48 h达到高峰,血脑屏障在各时间点均有破坏,提示脑出血后MMP-9表达可导致血脑屏障的通透性增加,而TIMP-1通过抑制MMP-9的表达以减轻脑水肿。
本研究结果显示,脑出血模型大鼠在术后12 h、48 h及72 h脑组织中AQP-4、MMP-9、TIMP-1蛋白的表达均有明显上升,其中,AQP-4蛋白表达呈进行性升高,在72 h时升高最为明显,MMP-9、TIMP-1蛋白表达也有明显升高,在48 h时上升明显并达到高峰,在72 h时略有下降。而蛭龙活血通瘀胶囊低、中、高剂量干预组在术后12 h、48 h及72 h时大鼠脑组织AQP-4、MMP-9蛋白的相对表达量均有不同程度的下降,而TIMP-1蛋白的相对表达量有所升高,与模型组比较,均具有显著性差异(P<0.01)。结果显示,蛭龙活血通瘀胶囊能够明显降低脑出血大鼠脑组织AQP-4、MMP-9蛋白的表达,同时升高TIMP-1蛋白的表达,且该作用存在一定的量效关系,ZL高剂量组作用最为明显。蛭龙活血通瘀胶囊能够下调AQP-4、MMP-9蛋白在脑组织的表达,上调TIMP-1蛋白的表达,因而具有脑保护作用。
[1]黄友岐.神经病学[M].北京:人民卫生出版社,1994:155.
[2]夏文政,胡韶山.水通道蛋白4与脑水肿研究进展[J].现代生物医学进展,2015,15(4):768-770.
[3]姚晓利,唐兴江.MMP-2、MMP-9与脑出血的研究进展[J].西南军医,2010,12(5):925-927.
[4]赵辉,李传玲,王庆广,等.实验性脑出血血肿周围脑组织基质金属蛋白酶组织抑制剂-1的表达及其与脑水肿的关系[J].临床神经病学杂志,2008,21(6):431-433.
[5]Rosenberg G B.Collgenose-induced intracerebral hemorrhage in rat[J].Stroke,1990,21(5):801-807.
[6]包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991:35.
[7]Zea longa E L,Weinstein P R,Carlson S,etal.Reversibalmiddle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[8]谢杰,王伟,李伊为.水通道蛋白-4的分子生物学研究进展[J].解剖学研究,2003,25(4):302-305.
[9]Venero J L,Vizuete M I,Machado A,et al.Aquaporins in the centralneroous system[J].Prog Neurobiol,2001,63(3):121-130.
[10]Yasui M.Aquaporin frombasic to clinical medicine:roles in brain edema[J].No To Hattatsu,2011,43:191-194.
[11]杨文茜,潘冰冰,王云姣,等.水通道蛋白4的研究进展[J].中国实用医药,2009,4(20):238-241.
[12]卢敏,郑威楠.水通道蛋白AQP-4与脑水肿[J].农垦医学,2012,34(3):254-258.
[13]万娟,谭小进.基质金属蛋白酶-9在冠心病中的作用研究进展[J].现代医药卫生,2013,29(5):731-733.
[14]Paver C,Henry S,Del Bigio M R,et al.Intracerebral hemorrhage induces macrophage activation and matrix metalloproteinases[J].Ann Neurol,2003,53(6):731-742.
[15]Horstmann S,Su Y,Koziol J,et al.MMP-2 and MMP-9 levels in peripheralblood aftersubarachnoid hemorrhage[J].Neurol Sci,2006,251(1):82-86.
[16]田力,刘海峰,滕伟禹.大鼠实验性脑出血后基质金属蛋白酶2和9的表达[J].中国动脉硬化杂志,2006,14(3):221-223.
[17]张增谦,赵炜莉.血清TIMP-1检测的临床应用[J].医学综述,2004,10(3):138-140.
[18]褚云香,郑勇.MMP-1,TIMP-1及其在肝纤维化中的作用[J].国际消化病杂志,2006,26(3):109-112.
[19]邹海峰,刘洋,徐华锋,等.TIMP-1在肝纤维化形成过程中的作用[J].哈尔滨医科大学学报,2005,39(5):25-28.
[20]杜玲,孙俊,刘建生,等.TIMP-1 B细胞表位的预测和鉴定[J].中国病理生理杂志,2012,28(10):1917-1920.
[21]何志捷,黄子通.基质金属蛋白酶与内科急危重症[J].实用医学杂志,2007,23(6):918-919.
[22]王复新,何琳琳,张淑萍.大鼠脑出血周边组织MMP-9、TIMP-1表达对脑水肿的影响[J].中国临床神经科学,2007,15(5):519-522.
(2016-10-20收稿/编辑 陈明伟)
The Effect ofZhilonghuoxuetongyu(ZLHXTY)Capsule on the Protein Expression of AQP-4,MMP-9 and TIMP-1 in Brain Tissue in Rats after Cerebral Hemorrhage
Wang Wei Du Yuan Bai Xue Yang Sijin
The Affiliated TCM Hospital of Southwest Medical Hospital NO.16,Chunhui Road,Luzhou City,Sicuan
Objective:To observe the effect of Zhilonghuoxuetongyu(ZLHXTY)capsule on the protein expression of AQP-4,MMP-9 and TIMP-1 in brain tissue after cerebral hemorrhage in rats and to investigate the protective mechanism of ZLHXTY capsule on brain tissue.Methods:Forty-five SD rats were randomly divided into 5 groups:sham operation group,model group,ZLHXTY capsules of high,middle and low dose groups.Each group was divided into three subgroups of 12h,48h and 72h respectively.The rat model of cerebral hemorrhage was prepared by autologous tail blood injection.The expression of AQP-4,MMP-9 and TIMP-1 protein was detected by Western blot.Results:There were significant reductions to different degrees in the protein expression of AQP-4 and MMP-9 in ZLHXTY capsules of each dose group compared with that in the model group;The protein expression of TIMP-1 in ZLHXTY capsules of each dose group was significantly increased to different degrees compared with that in the model group(P<0.01).The protein expression of AQP-4,MMP-9 and TIMP-1 in brain tissue in ZLHXTY capsules of middle and low dose groups was significantly different from that in ZLHXTY capsules of high dose group(P<0.01).Conclusions:ZLHXTY capsule can significantly decrease the expression of AQP-4 and MMP-9 and increase the expression of TIMP-1 protein in brain tissue of rats with cerebral hemorrhage,which has a dose-effect relationship.The high dose group of ZLHXTY capsules has the most obvious effect.
Zhilonghuoxuetongyu(ZLHXTY)capsule;cerebral hemorrhage;AQP-4;MMP-9;TIMP-1;experimental research
R285.5
A
1003-0719(2016)06-0067-04
四川省科技厅项目(编号:2011SZ0322)

