瘦素对HepG2细胞端粒酶及端粒酶反转录酶的调控作用研究
曹坤 李海洋
(1.贵州省肿瘤医院,贵州 贵阳 550002;贵州医科大学附属医院,贵州 贵阳 550004)
瘦素对HepG2细胞端粒酶及端粒酶反转录酶的调控作用研究
曹坤1李海洋2△
(1.贵州省肿瘤医院,贵州 贵阳 550002;贵州医科大学附属医院,贵州 贵阳 550004)
目的 探讨瘦素(leptin)对人肝癌细胞株HepG2的增殖机制及对端粒酶(telomerase,TA)与端粒酶反转录酶(hTERT)活性表达的影响。方法 噻唑蓝(MTT)比色法检测不同浓度leptin作用不同时间对HepG2细胞的增殖影响;流式细胞仪分析其细胞周期;TRAP-PCR银染法检测不同浓度leptin作用HepG2细胞后端粒酶的活性;实时荧光定量PCR、蛋白免疫印迹(Western-blot)分析leptin作用24 h后hTERT mRNA及蛋白水平的表达情况。结果 leptin可以促进HepG2细胞增殖,具有浓度-时间依赖性;流式细胞仪结果显示leptin可以改变HepG2的细胞周期,使S期比例升高;leptin可以活化HepG2细胞端粒酶,上调HepG2 hTERT mRNA及蛋白水平的表达。结论 leptin可能通过上调HepG2 hTERT表达,增强端粒酶活性,改变肝癌细胞株HepG2的生物学行为。
瘦素; HepG2细胞; 端粒酶; 端粒酶反转录酶
肥胖可增加包括肝癌在内的多种肿瘤疾病的风险,由肥胖基因编码的瘦素(leptin)在其中起了重要的作用[1-5]。同时,在永生化的恶性肿瘤细胞中端粒酶(telomerase,TA)活性升高,而正常组织、癌旁组织以及癌前病变等均不表达TA活性。因此有学者认为端粒、TA在肿瘤的发生发展中扮演重要的角色,是肿瘤的治疗靶点[6-7]。本研究使用leptin体外作用肝癌细胞株HepG2,观察leptin对HepG2细胞TA与hTETR表达的影响,并探讨相关机制。报告如下。
1 材料与方法
1.1 材料 leptin购于美国PeproTech公司;人肝癌细胞株HepG2细胞由贵州医科大学官志忠教授课题组赠送;DMEM培养基、胰蛋白酶购于美国HyClone公司;胎牛血清购于杭州四季青生物制品公司;DNA含量检测试剂盒(细胞周期)、TRAP-PCR银染法端粒酶检测试剂盒购于南京凯基生物技术有限公司;实时荧光定量PCR试剂盒购于北京康为世纪生物有限公司;Anti-TERT购于美国ABZOOM公司;hTERT引物由上海生工生物技术公司合成。hTERT引物序列:上游5’-ggaagagtgtct ggagcaagtt-3’,下游5’-acgtagtccatgttcacaatcg-3’,扩增产物长187bp。内参β-actin引物序列:上游5’-ctgggacgacatggagaaaa-3’,下游5’-aaggaaggctgg aagagtgc-3’,扩增产物长564bp。
1.2 实验方法 (1)细胞培养:人肝癌细胞株HepG2用含10%胎牛血清的DMEM培养基在37 ℃、5% CO2培养箱中常规培养。(2)MTT比色法检测细胞增殖:收集对数期细胞,胰酶消化,用含10%胎牛血清的DMEM培养液调整细胞悬液浓度为10×104/ mL,接种于96孔细胞培养板中,每孔100 μL,培养12 h后,换为含0.5%胎牛血清的DMEM培养液过夜后加入leptin干预液。设置3个leptin浓度组(40、80、120 ng/mL),空白对照组加等体积PBS液,每组设5个复孔。分别培养24 h、48 h和72 h(每24 h更换培养基),向每孔中加入20 μLMTT液(5 g/L)继续培养4 h后终止培养。用吸头吸去孔内培养液,每孔加入DMSO 150 μL,置于摇床低速上震荡10 min,充分溶解结晶,在酶联免疫检测仪490 nm波长处测定各孔光吸收值,以空白孔调零。(3)流式细胞仪分析细胞周期:将HepG2细胞接种于6孔培养板中,培养24 h后,更换不含胎牛血清的DMEM培养液过夜,饥饿细胞使其同步化后加入不同浓度leptin作用液(0、40、80、120 ng/mL),继续培养24 h,收集细胞。按照细胞周期试剂盒使用说明70%预冷乙醇固定细胞过夜,4 ℃保存,加入100 μLRNaseA,37 ℃水浴30 min,室温避光30 min,加入400 μL碘化丙啶(PI)避光染色30 min,在流式细胞仪上检测细胞周期,并用随机软件进行分析。(4)TRAP-PCR银染法端粒酶活性检测:按照端粒酶活性检测使用说明书操作,收集作用后的HepG2细胞提取端粒酶,在94 ℃,3 min;94 ℃,30 s;45 ℃,35 s;72 ℃,90 s,5个循环,72 ℃延伸1 min。以上扩增结束后,向各管加入内标模板1 μL,内标引物1 μL。继续进行以下的扩增,94 ℃,60 s;94 ℃,40 s;60 ℃,35 s;72 ℃,50 s,35~36个循环,72 ℃,延伸10 min。10%非变性聚丙烯酰胺凝胶电泳,17.5 V/cm,预跑1~2 h,垂直电泳60 min。银染,数码凝胶图像分析系统照相分析。(5)实时荧光定量PCR检测hTETR-mRNA的表达:收集作用24 h后的HepG2细胞,使用TRIZOL法提取细胞总RNA;cDNA第一链合成试剂盒进行逆转录。实时荧光定量PCR反应采用UltraSYBR Two Step qRT-PCR试剂盒进行,PCR反应条件如下:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火/延伸1 min,共40个循环,整个过程收集荧光,反应结束后,检测样本Ct(Threshold cycle)值。β-actin作为内参,使用2-△△Ct法确定目标基因在mRNA水平的相对表达量。计算△△Ct=(样品Ct均值-内参照Ct均值)-(对照样品Ct均值-对照内参照Ct均值),取2-△△Ct代表样品目标基因mRNA的含量。(6)Western-blot检测hTETR蛋白水平表达:leptin培养基作用HepG2细胞24 h后,收集细胞,采用细胞裂解液常规方法提取蛋白质,定量,聚丙烯酰胺凝胶进行电泳分离,电转移至NC膜,将膜置于5%脱脂奶粉封闭1 h,用1抗室温孵育过夜。洗膜3次后2抗孵育2 h,化学发光法显色,曝光,对蛋白表达进行检测。β-actin作为内参。

2 结 果
2.1 细胞增殖变化 MTT结果显示,随着leptin浓度的增加及作用时间的延长,实验组OD490值较对照组明显升高,并呈浓度—时间依赖性。表明leptin对HepG2细胞具有促进增殖的作用。leptin浓度为120 ng/mL,作用72 h,增殖作用较对照组增强,差异有统计学意义(P<0.05),而浓度为40 ng/mL作用24 h、72 h的OD490与对照组比较差异无统计学意义(P>0.05)。见图1、表1。

注:与对照组比较,﹡P<0.05。
图1 不同浓度leptin作用对HepG2细胞增殖的影响

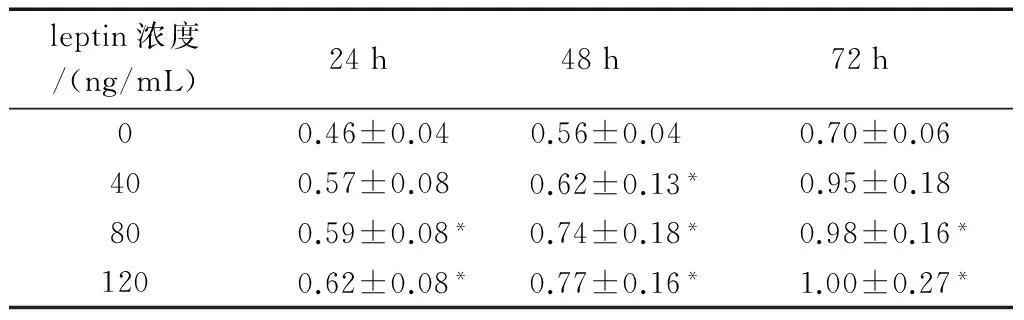
leptin浓度/(ng/mL)24h48h72h00.46±0.040.56±0.040.70±0.06400.57±0.08 0.62±0.13*0.95±0.1880 0.59±0.08* 0.74±0.18* 0.98±0.16*120 0.62±0.08* 0.77±0.16* 1.00±0.27*
注:与对照组比较,﹡P<0.05。
2.2 细胞周期变化 流式细胞术结果显示,随着leptin浓度的增加,S期比例也随之升高,G0/G1期则随着浓度的升高而降低,G2/M期无明显浓度依赖性,实验组与对照组比较,差异有统计学意义(P<0.05),说明leptin可以促进细胞有丝分裂和DNA的合成,向S期转变。见表2。


leptin浓度/(ng/mL)G0/G1期/%S期/%G2/M期/%0 70.09±2.65 19.84±0.71 10.06±2.76 40 69.80±2.71* 21.10±2.26* 9.10±4.80*80 69.56±4.39* 22.24±2.12* 8.20±2.29*120 66.78±2.32* 24.10±1.47* 8.45±2.44*
注:与对照组比较,﹡P<0.05。
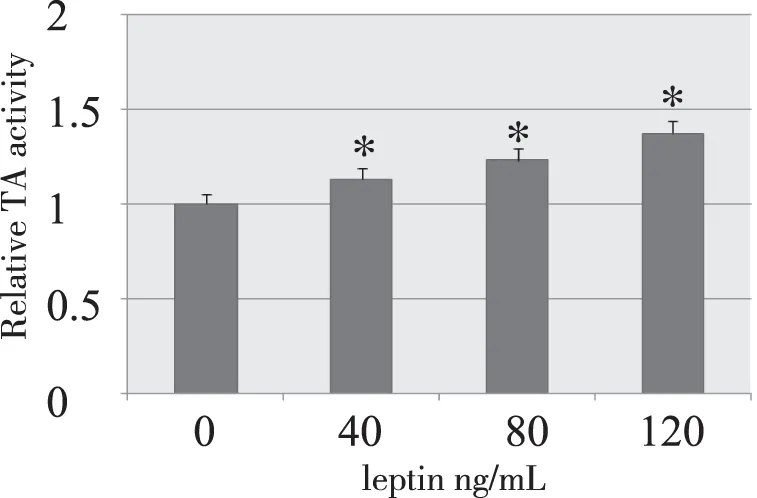
2.3 Leptin对HepG2细胞TA活性的影响 TRAD-PAGE银染结果显示典型的间隔6个bp的端粒酶梯形条带,可以看出不同leptin浓度作用HepG2细胞24 h后的端粒酶活性条带随浓度的递增条带颜色逐渐变深。见图2。通过image lab软件分析其灰度值分别为(20.6±0.67)、(24.87±4.26)、(26.97±0.3)和(30.73±2.86),具有明显的浓度依赖性。见图3。实验组与对照组比较,差异有统计学意义(P<0.05)。

注:1代表对照组;2、3、4为实验组分别为40 ng/mL、80 ng/mL、120 ng/mL。
图2 不同浓度leptin作用对HepG2细胞增殖的影响
注:与对照组比较,﹡P<0.05。
图3 端粒酶半定量灰度分析
2.4 Leptin对HepG2细胞hTETR表达的影响 不同浓度leptin作用HepG2细胞24 h后的mRNA表达见图4。结果显示与端粒酶活性检测结果一致,实验组较对照组可以上调hTERT-mRNA的表达,随leptin浓度增加,hTETR的表达量也随之升高,实验组与对照组比较,差异具有统计学意义(P<0.05)。Western-blot结果亦显示在蛋白水平,leptin上调hTETR的表达,并且存在浓度依赖性。见图5。

注:与对照组比较,*P<0.05。
图4 不同浓度leptin作用对HepG2
细胞hTETR mRNA的影响
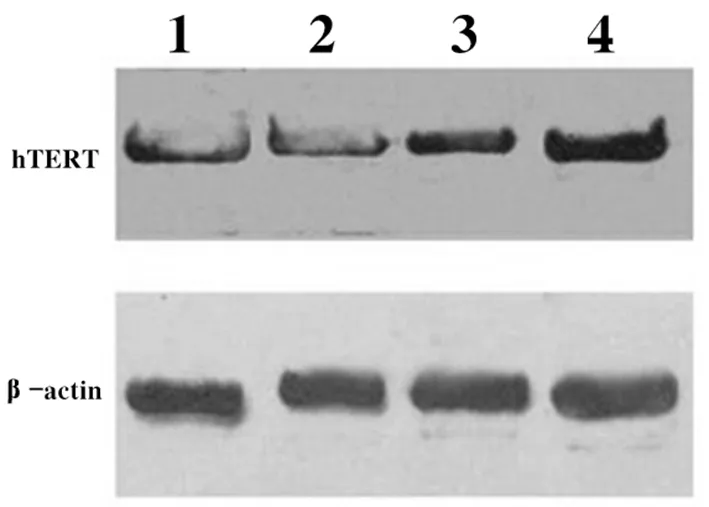
图5 不同浓度leptin作用对HepG2
3 讨 论
流行病学研究[8]结果显示,肥胖是癌症的重要危险因素,肥胖增加包括原发性肝细胞癌在内的多种肿瘤疾病如乳腺癌、子宫内膜癌、食管癌、膀胱癌等的发病率和死亡率。leptin是由肥胖基因编码的蛋白质类激素,具有调节人体代谢等功能。研究发现[9]原发性肝癌(hepatocelluar carcinoma,HCC)组织中的leptin和瘦素受体(OB-R)表达高于癌旁组织、正常组织,但瘦素和OB-R的表达与患者的肿瘤大小、TNM分期、组织学分级、性别、年纪等因素差异无统计学意义。认为leptin和OB-R可能在肝癌组织中双重表达,在HCC的早期发生、发展中起到一定作用。我们检测不同浓度leptin作用不同时间对HepG2细胞的增殖影响,结果显示leptin能够影响肝癌细胞株HepG2的细胞周期,具有促进细胞增殖的作用,且存在浓度—时间依赖性。提示leptin可以作为一种生长因子对肝癌有促进作用。
正常情况下,生殖细胞和干细胞中存在有端粒酶的活性,在其他细胞中则不能检测出端粒酶的活性,而在永生化的恶性肿瘤细胞中端粒酶则再度活化细胞可不休止地分裂增殖,比如在肝癌、胃癌、肠癌中可以检测到较强的端粒酶活性,但在正常组织、癌旁组织以及癌前病变等均检测不到端粒酶活性。因此认为肿瘤细胞的恶性表型的维持需要活化的TA,其中TA的活性又与hTERT密不可分。之前有报道[10-11]称TA和hTERT-mRNA的高表达可能参与了肝脏肿瘤发生和发展。Clark等[12]通过对正常肝组织、慢性病毒性肝炎、肝硬化及HCC患者组织进行leptin与hTERT表达相关性研究,并证实leptin表达与hTERT表达存在明显相关性。我们的实验研究发现在HepG2细胞中,leptin能明显活化TA,随着leptin浓度的提高,TA活性也随之增加。TA表达量与肿瘤的恶性程度存在密切的联系,现已证实在乳腺癌患者中,TA的表达量与肿瘤大小、淋巴结转移相关,活化的TA能明显降低患者的生存率[13]。而在HCC患者中,TA的高表达与肿瘤细胞侵袭也有一定关系。因此,结合我们的实验结果,认为leptin可能通过激活TA,参与了肝癌细胞生物学行为的改变。
hTERT作为TA的限速酶,也被认为是一种肿瘤相关的启动基因,对TA的活化及肝脏肿瘤的发生、发展起着重要作用。我们使用实时荧光定量PCR及Western-blot检测leptin对HepG2细胞hTERT表达的影响,结果显示leptin能够上调hTERT-mRNA及蛋白水平的表达。而最近的一些研究发现,hTERT的功能不仅仅是维持端粒结构。Lee等[14]报道,hTERT能够促进细胞的生存,调控leptin的下游关键基因——细胞周期蛋白(cyclinD1)和血管内皮因子(VEGF),因此我们认为在某种程度上,hTERT可能通过leptin的介导,参与了肿瘤的生长及血管生成,从而影响肿瘤的生物学行为。
本实验研究表明,leptin能促进人肝癌细胞株HepG2的增殖,增强HepG2细胞TA的活性,上调HepG2细胞hTERT-mRNA及蛋白水平表达。leptin可能通过调控端粒酶hTERT来影响肝癌细胞的生物学行为。因此,阻断leptin的信号系统可能可以作为治疗肥胖相关性肿瘤的治疗靶点。
[1] Saxena N K,Vertino P M,Anania F A,et al.Leptin-induced growth stimulation of breast cancer cells involves recruitment of histone acetyltransferases and mediator complex to CYCLIN D1 promoter via activation of Stat3[J].Journal of Biological Chemistry,2007,282(18): 13316-13325.
[2] Choi J H,Park S H,Leung P C K,et al.Expression of leptin receptors and potential effects of leptin on the cell growth and activation of mitogen-activated protein kinases in ovarian cancer cells[J].The Journal of Clinical Endocrinology & Metabolism,2005,90(1): 207-210.
[3] Yuan S S F,Tsai K B,Chung Y F,et al.Aberrant expression and possible involvement of the leptin receptor in endometrial cancer[J].Gynecologic Oncology,2004,92(3): 769-775.
[4] Somasundar P,Frankenberry K A,Skinner H,et al.Prostate cancer cell proliferation is influenced by leptin 1[J].Journal of Surgical Research,2004,118(1): 71-82.
[5] Birmingham J M,Busik J V,Hansen-Smith F M,et al.Novel mechanism for obesity-induced colon cancer progression.[J].Carcinogenesis,2009,30.
[6] Shay J W,Wright W E.Role of telomeres and telomerase in cancer[J]Seminars in Cancer Biology Academic Press,2011,21(6): 349-353.
[7] Buseman C M,Wright W E,Shay J W.Is telomerase a viable target in cancer?[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2012,730(1): 90-97.
[8] Ungefroren H,Gieseler F,Fliedner S,et al.Obesity and cancer[J].Hormone Molecular Biology and Clinical Investigation,2015,21(1): 5-15.
[9] 周晶,雷伟,沈磊,等.瘦素及其受体蛋白在肝癌细胞中的表达及意义[J].武汉大学学报(医学版),2009,30(3):376-378.
[10] Vogel M M K A.The pathogenesis of hepatocellular carcinoma[J].Dig Dis,2014,32: 545-553.
[11] Satra M,Gatselis N,Iliopoulos D,et al.Real-time quantification of human telomerase reverse transcriptase mRNA in liver tissues from patients with hepatocellular cancer and chronic viral hepatitis[J].Journal of Viral Hepatitis,2007,14(1): 41-47.
[12] Clark G M,Osborne C K,Levitt D,et al.Telomerase activity and survival of patients with node-positive breast cancer[J].Journal of the National Cancer Institute,1997,89(24): 1874-1881.
[13] Lee C M,Hsu C Y,Eng H L,et al.Telomerase activity and telomerase catalytic subunit in hepatocellular carcinoma[J].Hepato-gastroenterology,2003,51(57): 796-800
[14] Lee J,Sung Y H,Cheong C,et al.TERT promotes cellular and organismal survival independently of telomerase activity[J].Oncogene,2008,27(26): 3754-3760.
The biological actions of leptin-induced activity of telomerase and telomerase reverse transcriptase in HepG2
CaoKun,LiHaiyang.
GuizhouCancerHospital,Guiyang550004,Guizhou,China.Correspondingauthor:LiHaiyang,Email:haiyang-li@sina.com.
Objective To analyze the biological actions of leptin-induced activity of telomerase in HepG2 liver cancer cells and provide a new explanation for obesity-related HCC.Methods Effects of different concentrations of leptin (40ng/mL,80 ng/mL,120 ng/mL) on HepG2 were detected with colorimetric assay by Methyl thiazol tetrazoliu(MTT)after incubation periods of 24 h,48 h,and 72 h.Flow cytometry was performed to assess cell cycle progression of different concentrations of leptin as stated above after each 24 h incubation period.Telomerase activity after different concentrations of intervention in HepG2 was assessed using TRAP-silver staining Telomerase Detection Kit.mRNA and protein expression level of hTERT after different concentrations of intervention in HepG2 were assessed using real-time RT-PCR and western blot analysis.Results Leptin could improve the proliferation rate of HepG2 cells.The effect was in does and time-depended partly by MTT method.In the flow cytometry analysis,leptin could promote HepG2 cells entering the S phase from the G0/G1 phase.It was found that leptin activated telomerase in a dose-dependent manner.leptin upregulated the expression of Human Reverse Tanscriptase (hTERT) at mRNA and protein levels.Conclusion Leptin could promote the proliferation of HepG2 cells and promote HepG2 cells entering the S phase from the G0/G1 phase.Leptin is a key regulator of the malignant properties of hepatocellular carcinoma cells through modulation of hTERT,a critical player of oncogenesis.
Leptin; Telomerase; Telomerase reverse transcriptase; Liver cancer cell HepG2
贵州省科学技术基金资助项目(黔科合J字[2011]2235号)
R33;R318;R313
A
1000-744X(2016)12-1242-04
2016-10-20)
△通信作者,E-mail:haiyangli@sina.com

