丙泊酚静脉泵注对兔脊髓缺血再灌注损伤的防治作用及其机制
解立杰,黄锦秀,胡霁
(华中科技大学同济医学院附属梨园医院,武汉430077)
丙泊酚静脉泵注对兔脊髓缺血再灌注损伤的防治作用及其机制
解立杰,黄锦秀,胡霁
(华中科技大学同济医学院附属梨园医院,武汉430077)
目的 观察丙泊酚静脉泵注对兔脊髓缺血再灌注损伤(SCIRI)的防治作用,并探讨其作用机制。方法 用随机数字表法将36只日本大耳白兔分为假手术组(Sham组)、缺血再灌注组(IR组)、IR+丙泊酚处理组(IR+P组),各12只;每组设两个观察时间点,分别为再灌注24 h和48 h,每个时点观察6只。Sham组游离暴露腹主动脉(不阻断),IR组和IR+P组动脉夹夹闭腹主动脉30 min建立SCIRI模型;IR+P组于主动脉夹闭前10 min和再灌注即刻分别以微量泵持续静脉泵注丙泊酚(30 mg/kg溶于30 mL生理盐水,输注速度3 mL/min),其余两组在相同时间点以相同的容量、速度泵注生理盐水。三组动物分于术后24 h和48 h按Tarlov评分标准行后肢神经功能评分,然后处死并取其L4~L6段脊髓组织,观察病理变化,用Western blotting和RT-PCR分别检测脊髓组织中脑源性神经营养因子(BDNF)、丝氨酸/苏氨酸蛋白激酶(PKC)ε的蛋白及mRNA。结果 同一时间点,与IR组相比,IR+P组后肢神经功能评分明显增高(P<0.05),脊髓损伤减轻,脊髓组织BDNF、PKCε的蛋白及mRNA表达明显升高(P均<0.05)。结论 丙泊酚静脉泵注对兔SCIRI有一定的防治作用,其作用机制可能是丙泊酚激活了PKCε/PKC信号通路,上调了BDNF的表达。
丙泊酚;脊髓缺血;再灌注损伤;脑源性神经营养因子;丝氨酸/苏氨酸蛋白激酶ε
脊髓缺血再灌注损伤(SCIRI)是胸腹主动脉修复术、胸腹主动脉瘤手术中常见的并发症。在胸腹主动脉修复术中,SCIRI的发生率高达32%[1]。SCIRI引起的一个严重的并发症是截瘫。有效防治SCIRI是临床工作中亟需解决的问题。丙泊酚是常用的静脉麻醉药,主要用于麻醉和镇静。有研究[2]证实丙泊酚对脑及脊髓损伤有一定的修复作用。脑源性神经营养因子(BDNF)对神经具有保护作用,在SCIRI过程中,增加脊髓组织中BDNF表达可以明显改善SCIRI的预后[3],蛛网膜下腔注入BDNF对脊髓组织损伤亦具有显著的修复作用[4]。2015年8月20日~2016年4月20日,我们观察了丙泊酚静脉泵注对兔SCIRI的防治作用,并探讨了其作用机制。现将结果报告如下。
1 材料与方法
1.1 药物、试剂及仪器 丙泊酚。BDNF、丝氨酸/苏氨酸蛋白激酶(PKC)ε一抗,BCA蛋白定量检测试剂盒,TRIzol试剂,反转录试剂盒。微量泵,离心机,荧光定量PCR仪,紫外分光光度计,蛋白质灰度分析软件。
1.2 实验动物及其分组 雄性日本大耳白兔36只,体质量2.0~2.5 kg,用随机数字表法将其分为假手术组(Sham组)、缺血再灌注损伤组(IR组)、IR+丙泊酚处理组(IR+P组),各12只;每组设两个研究时点,分别为再灌注24 h和48 h,每个时点观察6只。实验前所有动物神经系统完好无损,后肢运动功能正常。
1.3 各组实验动物的处理及丙泊酚给予方法 各组实验动物禁食12 h(自由饮水)后3%戊巴比妥钠(30 mg/kg)耳缘静脉注射麻醉,保留自主呼吸,同时耳缘静脉持续输注复方乳酸钠林格液6 mL/(kg·h),持续监测体温,加热毯维持动物体温(38.5±0.5) ℃,股动脉置管监测远端血压。Sham组游离暴露腹主动脉(不阻断),IR组和IR+P组动脉夹夹闭腹主动脉30 min建立SCIRI模型;IR+P组于主动脉夹闭前10 min和再灌注即刻分别以微量泵持续静脉泵注丙泊酚(30 mg/kg溶于30 mL生理盐水,输注速度3 mL/min),其余两组在相同时间点以相同的容量、速度泵注生理盐水。所有动物在手术操作完成后,4万U青霉素肌注预防术后感染,0.25%布比卡因局部浸润镇痛,回笼饲养。
1.4 各组实验动物后肢神经功能评价 再灌注24、48 h时由一位未参与实验动物分组的研究人员对各组各6只动物进行后肢功能评分,评分采用改良Tarlov脊髓损伤评分标准[5]:截瘫、后肢没有运动能力为0分;后肢有微弱的运动功能、微弱的抗重力能力为1分;后肢有较好的抗重力功能但不能拖动为2分;后肢能够拖动,可跳跃,但没有恢复正常为3分;后肢运动功能正常为4分。
1.5 各组实验动物脊髓组织病理学检查 再灌注24、48 h时,后肢神经功能评分结束即刻处死动物(各组各6只),取其L4~L6段脊髓组织,4%甲醛浸泡固定,脱水,石蜡包埋,横断面厚度4 μm切片,HE染色,光学显微镜下观察脊髓组织的形态:损伤的神经元表现为细胞核固缩或溶解,胞质呈嗜伊红染色,胞质中尼氏体减少或消失及神经元周围有空泡形成;正常神经元表现为多角形结构,胞核结构清晰,胞质中尼氏体存在。
1.6 各组实验动物脊髓组织中BDNF、PKCε蛋白检测 采用Western blotting法。取脊髓组织标本,冰上裂解、匀浆,12 000 g离心5 min,取上清液,即总蛋白液,BCA法测定蛋白浓度。等量蛋白样品上样,经12%的SDS-PAGE电泳分离后,电转移至硝酸纤维素膜上,脱脂牛奶封闭后分别加入BDNF、PKCε一抗(1∶1 000 稀释),4 ℃孵育过夜,TBST洗后加入1∶3 000酶标记羊抗小鼠二抗稀释液,室温下孵育30 min,室温下用TBST缓冲液在脱色摇床上洗3次,每次5 min。增强化学发光反应,曝光、显影、定影。凝胶成像系统观察,Alpha软件分析目标蛋白条带的光密度值,GAPDH作内参,目标蛋白条带光密度值与内参条带光密度值的比值标化后表示目标蛋白的相对表达量。
1.7 各组实验动物脊髓组织中BDNF、PKCε mRNA检测 采用RT-PCR法。用TRIzol试剂提取受检脊髓组织总mRNA。按照反转录试剂盒说明对RNA样本进行逆转录获得cDNA。BDNF引物序列:上游5′-CAACGAAGAAAACAATAAGGACGC-3′,下游5′-CGCCGGACCCTCATAGACAT-3′;PKCε引物序列:上游5′-TGGCGTCTCAGAACTGCTCAAG-3′,下游5′-CGCACCCGCTCATACAACTC-3′;GAPDH引物序列:上游5′-CGCCTGGAGAAAGCTGCTA-3′,下游5′-ACGACCTGGTCCTCGGTGTA-3′;扩增片段长度分别为147、165、104 bp。PCR反应体系的配制、反应参数等均按Fast Start Universal SYBR Green Master(Rox)试剂盒说明进行;反应条件:95 ℃、10 min,95 ℃、15 s,60 ℃、60 s,72 ℃、20 s,40个循环。将2-ΔΔCt值标化后表示目标mRNA的相对表达量。

2 结果
2.1 再灌注24、28 h时各组实验动物后肢神经功能评分比较 实验前所有兔子后肢运动功能正常。再灌注24、48 h时,IR+P组、IR组后肢神经功能评分与Sham组相比,P均<0.05;两个时间点IR+P组后肢神经功能评分与IR组相比,P均<0.05。结果详见表1。
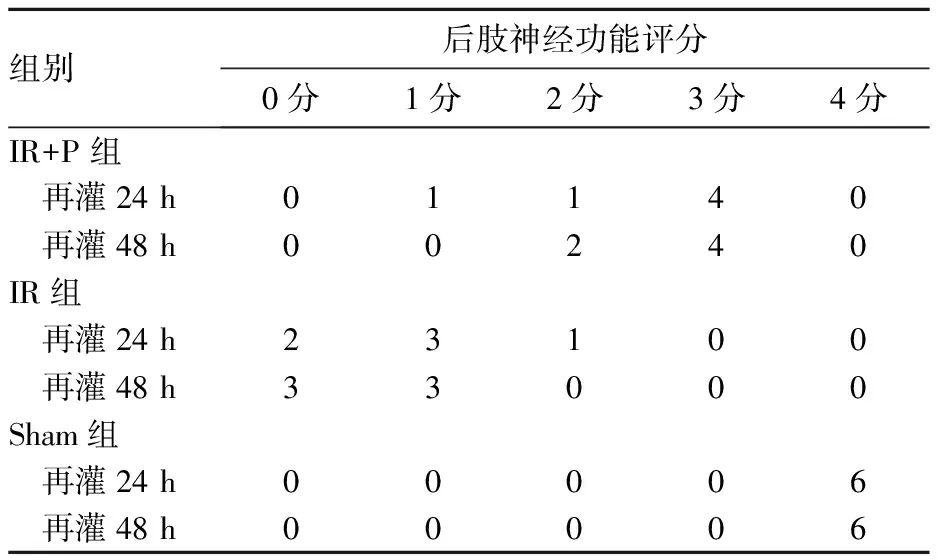
表1 再灌注24、28 h时三组实验动物后肢神经功能
2.2 各组实验动物脊髓组织病理学变化 Sham组再灌注24、48 h时脊髓组织神经元结构完整,轮廓完整,核圆,胞质饱满,核仁清晰(见图1A、D)。IR组再灌注24 h时脊髓组织部分神经元固缩、核溶解、尼氏体明显减少(见图1B);再灌注48h时神经元结构严重破坏,胞核大量溶解,几乎见不到正常运动神经元,部分神经细胞周围可见较多空泡形成(见图1E)。IR+P组再灌注24、48 h时脊髓组织神经元病理变化明显轻于IR组,部分脊髓神经元轻度萎缩,核仁轻度萎缩,少有胞核颜色变淡、消失,细胞肿胀、少许空泡形成,组织损伤明显减轻(见图1C、F)。
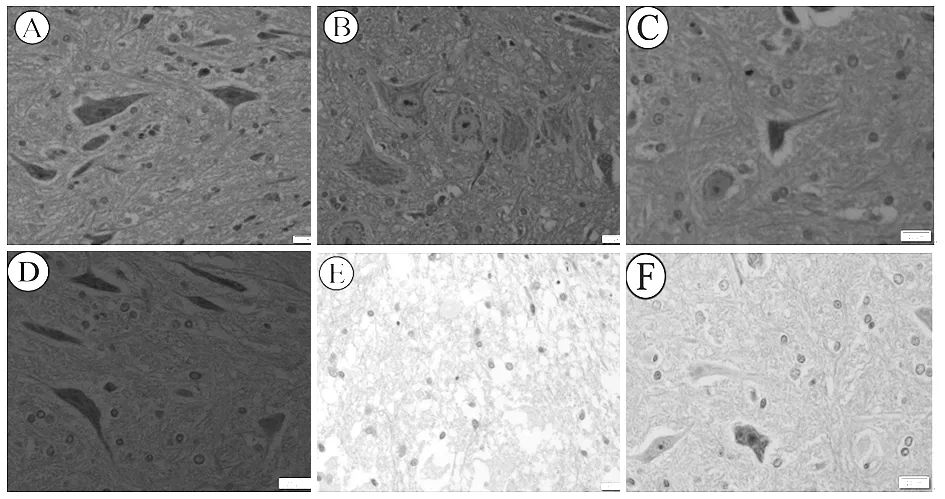
注:A:Sham组,再灌注 24 h;B:IR组,再灌注24 h;C:IR+P组,再灌注24 h;D: Sham组,再灌注48 h;E: IR组,再灌注48 h;F: IR+P组,再灌注48 h。
图1 各时间点各组脊髓组织病理形态(HE染色,400×)
2.3 各组实验动物脊髓组织BDNF、PKCε蛋白的表达比较 再灌注24、48 h时,各组实验动物脊髓组织BDNF、PKCε蛋白的表达比较见表2。

表2 再灌注24、48 h时各组实验动物脊髓组织BDNF、PKCε蛋白的相对表达量比较±s)
注:与Sham组相比,#P<0.05;与IR组相比,*P<0.05。
2.4 各组实验动物脊髓组织BDNF、PKCε mRNA的表达比较 再灌注24、48 h时各组实验动物脊髓组织BDNF、PKCε mRNA的表达比较见表3。

表3 再灌注24、48 h时各组实验动物脊髓组织BDNF、PKCε mRNA的相对表达量比较
注:与Sham组相比,#P<0.05;与IR组相比,*P<0.05。
3 讨论
本研究结果显示,IR+P组兔的神经功能评分明显增高、脊髓损伤明显减轻,说明丙泊酚静脉泵注对兔SCIRI有一定的防治作用。
BDNF作为神经营养因子家族的成员之一,广泛分布于中枢神经系统,在中枢神经系统发育过程中对神经元的生长、分化和维持其正常的生理功能起着关键作用[6]。有研究[7]发现,BDNF与脑组织缺血缺氧损伤有着密切的关系,BDNF能够抑制神经元细胞凋亡,对缺血损伤的脑细胞有一定的保护作用[8]。BDNF在脊髓损伤的发生发展过程中也扮演着极其重要的角色,同时BDNF极有可能对脊髓机械性和缺氧性损伤具有良好的的治疗作用[9]。在大鼠SCIRI过程中,增加其脊髓组织中BDNF表达可以明显改善大鼠的预后[3],同时蛛网膜下腔注入BDNF对损伤脊髓组织亦具有保护作用[4]。有研究[10]发现,丙泊酚可以促进大鼠脑海马组织BDNF的表达,对小鼠脑慢性缺血性损伤具有改善作用。本研究结果显示,丙泊酚静脉泵注后,SCIRI兔的脊髓组织中BDNF表达明显增多。我们推测丙泊芬通过改变BDNF的表达对脊髓组织产生了一定的保护作用,从而减轻了脊髓组织的损伤。
PKC广泛分布于哺乳动物的组织和细胞中,对细胞的生长代谢、增殖分化等发挥重要作用。 PKCε 是PKC的一个亚型。Neumann等[11]发现,用PKCε 预处理可以增加大鼠脑组织BDNF的表达。也有研究[12]证实,丙泊酚对大脑皮质神经元中的PKCε 具有一定的激活作用。本研究发现,给予丙泊酚后,SCIRI兔的脊髓组织中PKCε 表达明显增加,这可能是丙泊酚减轻脊髓损伤的机制之一。
综上所述,丙泊酚静脉泵注对兔SCIRI有一定的防治作用,其作用机制可能是丙泊酚激活了PKCε /PKC信号通路,PKCε 表达增加,进一步促进了BDNF的表达。这一研究结果为临床防治SCIRI提供了新的思路。
[1] Panthee N, Ono M. Spinal cord injury following thoracic and thoracoabdominal aortic repairs [J]. Asian Cardiovasc Thorac Ann, 2015,23(2):235-246.
[2] Yu Q, Hu J, Yang J, et al. Protective effect of propofol preconditioning and postconditioning against ischemic spinal cord injury [J]. Neural Regen Res, 2011,6(12):951-955.
[3] Wang Y, Su R, Lv G, et al. Supplement Zinc as an effective treatment for spinal cord ischemia/reperfusion injury in rats [J]. Brain Res, 2014,1545(4):45-53.
[4] Novikova LN, Novikov LN, Kellerth JO. Survival effects of BDNF and NT-3 on axotomizedrubrospinal neurons depend on the temporal pattern of neurotrophin administration [J]. Eur J Neurosci, 2000,12 (2):776-780.
[5] Fang B, Li X, Sun X, et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption [J]. Int J Mol Sci, 2013,14(5):10343-10354.
[6] Wenjin W, Wenchao L, Hao Z, et al. Electrical stimulation promotes BDNF expression in spinal cord neurons through Ca2+and Erk-dependent signaling pathways [J]. Cell Mol Neurobiol, 2011,31(3):459-467.
[7] Sendtner M, Pei G, Beck M, et al. Developmental motoneuron cell death and neurotrophic factors[J]. Cell Tissue Res, 2000,301(1):71-84.
[8] Zhao J, Xu H, Tian Y, et al. Effect of electroacupuncture on brain-derived neurotrophic factor mRNA expression in mouse hippocampus following cerebral ischemia-reperfusion injury [J]. J Tradit Chin Med, 2013,33(2):253-257.
[9] Weishaupt N, Blesch A, Fouad K. BDNF: the career of a multifaceted neurotrophin in spinal cord injury [J]. Exp Neurol, 2012,238(2):254-264.
[10] Chen G, Fu Q, Cao J, et al. Effect of propofol on brain-derived neurotrophic factor and tyrosine kinase receptor B in the hippocampus of aged rats with chronic cerebral ischemia [J]. Neural Regen Res, 2012,7(21):1645-1649.
[11] Neumann JT, Thompson JW, Raval AP, et al. Increased BDNF protein expression after ischemic or PKC epsilon preconditioning promotes electrophysiologic changes that lead to neuroprotection [J]. J Cereb Blood Flow Meta, 2015,35(1):121-130.
[12] Song C, Xi H, Yang L, et al. Propofol inhibited the delayed rectifier potassium current (I-k) via activation of protein kinase C epsilon in rat parietal cortical neurons[J]. Eur J Pharmacol, 2011,653(1-3): 16-20.
湖北省自然科学基金资助项目(2013CFB086);中央高校基本科研业务专项资金资助项目(2016YXZDO24)。
胡霁(E-mail: hbwhly01@163.com)
10.3969/j.issn.1002-266X.2016.43.012
R744
A
1002-266X(2016)43-0041-03
2016-05-26)

