猪卵巢颗粒细胞分离培养及细胞生物学特性研究
闫益波,李文刚,焦福林,吴志娟,胡广英,周胜花,隋 朝,岳 磊,任毅菲
(山西省农业科学院畜牧兽医研究所,山西太原030032)
猪卵巢颗粒细胞分离培养及细胞生物学特性研究
闫益波,李文刚,焦福林,吴志娟,胡广英,周胜花,隋 朝,岳 磊,任毅菲
(山西省农业科学院畜牧兽医研究所,山西太原030032)
颗粒细胞是研究雌性动物生殖生理、病理、药理和毒理机制的重要细胞模型。采用常规细胞培养的方法,建立猪卵巢颗粒细胞培养系统并研究其生物学特性。结果显示,抽吸法和剖切法分离猪卵巢颗粒细胞各有利弊,但都对细胞的活率影响不显著;有血清的培养效果好于无血清,而且以胎牛血清的效果较好,基础培养基DMEM和TCM199的培养效果相似,以DMEM+10%FBS培养效果最好;形态学观察发现了颗粒细胞贴壁生长和缺乏接触抑制的现象,体外生长曲线符合贴壁细胞的生长特征,DAPI荧光染色法没有检测到支原体污染,细胞生长状态良好。
猪;颗粒细胞;分离;细胞培养
颗粒细胞是卵泡发育和闭锁过程中最重要的体细胞,在卵泡局部微环境调节系统中发挥着重要的作用。早期研究表明,卵泡闭锁的实质是颗粒细胞的凋亡[1-3],只有充分认识了颗粒细胞的生物学特性,才可以进一步认识卵泡和卵子的发育规律。猪作为多胎哺乳动物,每个生殖周期有多个卵泡发育成熟并排卵,是研究雌性哺乳动物卵泡发育的良好动物模型,建立适宜的猪卵巢颗粒细胞分离培养体系不仅为猪卵巢生物学研究建立了体外技术平台,同时为猪卵巢生殖毒理学研究提供细胞试验模型[4-5]。
本研究通过建立适宜的猪卵巢颗粒细胞分离培养系统,为体外研究猪卵巢生理、病理、药理和毒理机制提供研究平台。
1 材料和方法
1.1 试剂与设备
TCM199培养液(T),DMEM培养液(D),胎牛血清(FBS),新生牛血清(NCS),超净工作台,胰蛋白酶,PBS,DAPI,青霉素,链霉素,谷氨酰胺,倒置显微镜,二氧化碳培养箱,离心机等。
1.2 颗粒细胞的分离
采集母猪卵巢,用含双抗的灭菌生理盐水冲洗5次,洗净卵巢上的血污,装入大烧杯并用37℃左右的灭菌生理盐水淹没后带入无菌室。在无菌操作室,放在37℃的水浴锅里保温采集卵巢颗粒细胞。分别使用抽吸法和剖切法分离猪卵巢颗粒细胞。
抽吸法:将清理后的卵巢置于灭菌培养皿中,用带18号针头的一次性注射器抽吸卵巢表面直径2~6 mm和大于6 mm的卵泡中的卵泡液,抽取的卵泡液用洗卵液稀释后,静置5~10 min,在光镜下使用拉制好的玻璃吸管除去卵丘-卵母细胞复合体,剩余脱落颗粒细胞反复吹打后,吸取全部卵泡液和颗粒细胞,置于离心管内以2 000 r/min离心5 min,细胞培养液重悬计数后体外培养。
剖切法:将卵巢置于培养皿中,然后用手术刀片对卵巢皮质进行纵横方向1~2 mm间距的切割,然后用PBS反复冲洗,将冲洗液静置5~10 min,倒出上层清液,然后在光镜下使用拉制好的玻璃吸管除去卵丘-卵母细胞复合体,剩余脱落颗粒细胞反复吹打后,吸取全部卵泡液和颗粒细胞,置于离心管内以2 000 r/min离心5 min,细胞培养液重悬计数后体外培养。
1.3 台盼兰排斥实验检测细胞活率
用离心管收集颗粒细胞,加入胰蛋白酶并辅助机械吹打的方式使分散,PBS洗2遍后,调节细胞为适当密度(1×105个/mL)左右,与0.04%的台盼兰以1∶2的比例混匀,染色1 min后用细胞计数板计数,其中,细胞全部呈蓝色的为死亡细胞,细胞中间透明不着色的为活细胞,细胞的存活率=活细胞数/(活细胞数+死亡细胞数)×100%。
1.4 基础培养基与血清对颗粒细胞培养的效果
设计6种组成培养基,接种后24,48 h在光学显微镜下观察培养颗粒细胞的生长状态。
6组培养基分别为:T.TCM199+100 mmol/L谷氨酰胺+100 IU/mL青链霉素;T+10%FBS. TCM199+100 mmol/L谷氨酰胺+100 IU/mL青链霉素+10%FBS;T+10%NCS.TCM199+100 mmol/L谷氨酰胺+100IU/mL青链霉素+10%NCS;D.DMEM(高糖)+100 mmol/L谷氨酰胺+100 IU/mL青链霉素;D+10%FBS.DMEM(高糖)+100 mmol/L谷氨酰胺+100 IU/mL青链霉素+10%FBS;D+10% NCS.DMEM(高糖)+100 mmol/L谷氨酰胺+100 IU/ mL青链霉素+10%NCS。
1.5 猪颗粒细胞体外培养的细胞形态学观察
分离出颗粒细胞后,使用细胞培养液(DMEM(高糖)+10%FBS+2 mmol/L谷氨酰胺+100 IU/mL青链霉素)调整细胞密度到1×106个/mL,每孔1 mL接种于 24孔培养板中,在 37℃,5% CO2,95%空气,饱和湿度的培养箱中培养,分别于0,24,48 h观察细胞生长状态。
1.6 支原体检测分析
吸除颗粒细胞培养液,PBS冲洗干净,加入终浓度为50 μg/mL的DAPI荧光染色液,37℃,5% CO2,饱和湿度培养箱中染色30 min,去除处理液,PBS冲洗3~5次,去除未结合的DAPI,荧光显微镜下观察。
1.7 颗粒细胞的生长曲线
选取第3代处于对数生长期的细胞,按照2× 104个/mL的密度接种于24孔培养板中,每孔接种1 mL。从接种时间算起,每隔24 h计数3孔内的细胞密度,算出平均值,共计7 d。以培养时间(d)为横坐标、细胞密度为纵坐标作生长曲线。
1.8 数据统计分析
试验数据以平均数±标准差(Mean±SD)表示,全部数据采用SPSS 17.0软件包进行方差分析,P<0.05为差异显著。
2 结果与分析
2.1 猪颗粒细胞的分离
结果显示,抽吸法和剖切法在分离每个卵巢颗粒细胞的时间上差异显著(P<0.05),但是在所得颗粒细胞的活率上差异不显著(P>0.05)(表1)。
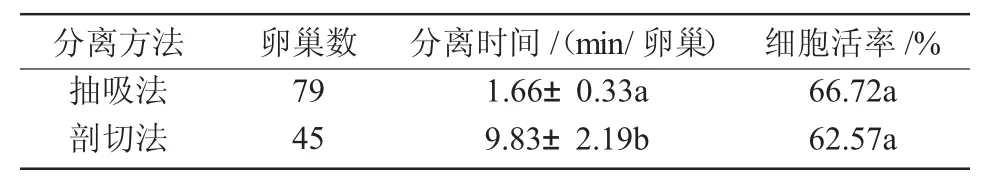
表1 不同分离方法对分离颗粒细胞的影响
2.2 不同基础培养基和血清对猪卵巢颗粒细胞体外培养的影响
结果显示,基础培养培养基TCM199与DMEM培养效果基本相同,有血清培养系统比无血清培养系统中颗粒细胞的贴壁速度快、大小均匀、生长状态好,添加10%FBS的培养基中细胞的生长状态较好,尤其是D+10%FBS培养效果最佳(表2)。

表2 不同培养基对猪卵巢颗粒细胞体外培养形态的影响
2.3 猪颗粒细胞体外培养的细胞形态学观察
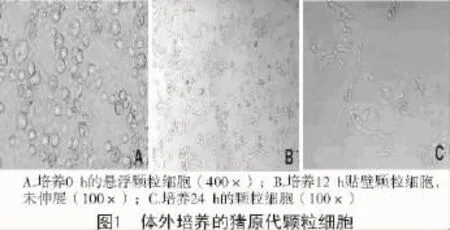
结果显示,悬浮在培养液中的颗粒细胞呈小圆球状,也有的形状不太规则(图1-A);培养12 h后部分颗粒细胞贴壁,未开始伸展(图1-B);培养24 h后猪颗粒细胞呈梭形或不规则状贴壁生长(图1-C)。颗粒细胞生长缺乏接触性抑制,可形成聚集物或呈丘陵样生长。
2.4 传代培养的颗粒细胞支原体污染分析
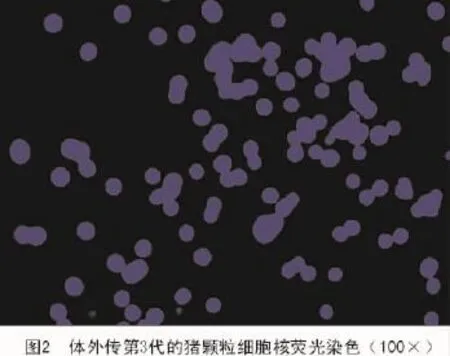
结果显示,传第3代的猪颗粒细胞与荧光染料DAPI染色后,只观察到细胞核发出蓝色荧光,在细胞核和细胞膜之间看不到荧光,表明培养细胞没有发生支原体污染(图2)。
2.5 颗粒细胞的体外生长曲线
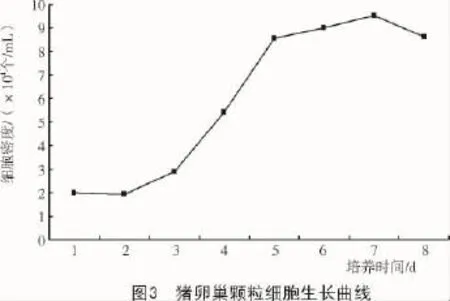
结果显示,接种2 d后细胞数量开始明显增加,第2~4天为对数生长期,第5~7天进入平台期。体外培养的细胞呈现出“潜伏期—对数生长期—停滞期”的生长模式(图3)。
3 讨论
猪繁殖力高,且由于其来源方便、结构和生理与人类的相似及其在畜牧业中的重要地位等诸多优势,使得猪卵巢颗粒细胞成为重要的细胞模型,相应的研究结果可以为人类生殖生理、病理、药理和毒理研究提供良好的试验基础和借鉴,因此,建立完善的猪卵巢颗粒细胞分离培养系统非常重要。目前,猪卵巢颗粒细胞的分离主要有剖切法[6]和抽吸法[7],分离效果还未有定论。本研究发现,在分离时间上剖切法显著好于抽吸法,获得细胞数量相对较大,但是二者获得颗粒细胞的活率差异不显著,表明2种方法各有优势,如果试验所需颗粒细胞数量大,可用剖切法,否则抽吸法比较简单高效。
猪颗粒细胞培养的基础培养基主要有DMEM[8],DMEM/F12[9],TCM199[10-11]和McCoy's 5A[12]等,其中最常见的是DMEM和TCM199,然而适宜猪卵巢颗粒细胞体外长期培养的基础培养基还有待于进一步优选。另外,血清对体外培养的多种细胞的生长、增殖起重要的作用,而牛血清是细胞培养中最常用的天然培养基,也是应用最为广泛的血清制品。本研究表明,单独的基础培养基培养,DMEM和TCM199培养效果都较差,添加血清是必要的,可明显改善2种基础培养基的效果,而且以DMEM和10%胎牛血清的互作效果最好。本研究血清的添加量以常用体细胞培养的10%添加,是否是最佳剂量还有待进一步研究。
悬浮状态的猪颗粒细胞成明亮的球形,12 h后开始贴壁生长,24 h后呈梭形或不规则形状贴壁生长,研究发现,部分颗粒细胞生长缺乏接触性抑制,呈现丘陵样集落生长,这与孙晋艳等[7]的研究结果相似。体外培养细胞的生长过程一般分为潜伏期、对数生长期和停滞期,本研究结果表明,培养的颗粒细胞存在早期生长延缓和晚期生长抑制的现象,符合贴壁细胞的一般生长规律,生长状态良好,生长曲线显示,颗粒细胞的对数生长期大约在第2~4天,这与朱丽等[6,13]的结果相似。
一般来讲,由于环境条件限制或操作不严格,许多细胞系都存在支原体污染现象,导致传代细胞生长缓慢,细胞形态不典型、空泡化和脂滴化等问题。颗粒细胞从卵巢采集到细胞分离进入培养箱,操作过程时间长、步骤多,很容易受到污染,尤其是光镜下难以发现的支原体污染。支原体是介于细菌和病毒之间能独立生活的最小微生物,是体外细胞培养中最常见且不易察觉的污染物[14],污染物高达30%~60%[15]。常见的检测方法是DNA荧光染色法和培养法[16]。本研究显示,传代培养的猪颗粒细胞只观察到细胞核发出蓝色荧光,在细胞核和细胞膜之间看不到荧光,表明培养细胞没有发生支原体污染,验证了培养条件的安全可靠。
[1]Jolly P D,Tisdall D J,Heath D A,et al.Apoptosis in bovine granulosa cells in relation tosteroid synthesis,CAMP response toFSH and LH and follicular atresia[J].BioReprod,1994,51:934-944.
[2]Miki S M,Noboru K,Yoshihiro M,et al.Ultrastructural changes in gronulosa cells in porcine antral follicles undergoing atresia indicate apoptosis cell death[J].J Reprod Dev,1998,44(1):7-14.
[3]William J M.Programmed cell death in preovulatory ovine follicles [J].Biol Reprod,1995,53:8-12.
[4]袁莉芸,朱丽,郭成志,等.玉米赤霉烯酮对猪卵巢颗粒细胞毒性的研究[J].中国兽医学报,2013,33(5):710-714,726.
[5]贺军宇,袁慧,李芳.F-2毒素对体外培养猪卵巢颗粒细胞的毒害及V-E的解毒效果 [J].湖南农业大学学报:自然科学版,2006,32(6):655-657.
[6]朱丽,郭成志,邓思君,等.猪卵巢颗粒细胞分离培养及鉴定[J].中国兽医杂志,2011,47(4):21-22.
[7]孙晋艳,黄洋,张航,等.FSH对体外培养猪卵巢颗粒细胞生长及增殖的影响[J].山西农业科学,2011,39(5):465-470.
[8]Tatsuya H D,Hideki K,Toshiro K B,et al.Haem oxygenase augments porcine granulosa cell apoptosis in vitro[J].J Endocrinol,2004,181:191-205.
[9]Francesca Caloni,Giovanni Ranzenigo,Fausto Cremonesi,et al.Effects of a trichothecene,T-2 toxin,on proliferation and steroid production by porcine granulosa cells[J].Toxicon,2009,54(3):337-344.
[10]Tiemann U,Schneider F,Vanselow J,et al.In vitro exposure of porcine granulosa cells to the phytoestrogens genistein and daidzein:Effects on the biosynthesis of reproductive steroid hormones[J].Reproductive Toxicology,2007,24(3/4):317-325.
[11]Kirkup K M,Mallin A M,Bagnell C A.Inhibition of pig granulosa cell adhesion and growth in vitro by immunoneutralization of epithelial cadherin[J].J Reprod Fertil,2000,120:275-281.
[12]Picton H M,Campbell B K,Hunter MG.Maintenance of oestradiol production and expression of cytochrome P450 aromatase enzyme mRNA in long-termserum-free cultures of piggranulosa cells[J].J Reprod Fertil,1999,115(1):67-77.
[13]赵彦玲,任子利,吴庆侠,等.藏猪颗粒细胞的体外培养研究[J].河南农业科学,2013,42(11):141-144.
[14]刘谋渊,刘岚,赵娇,等.动物细胞培养中支原体污染的检测方法比较研究[J].现代医药卫生,2011,27(5):682-683.
[15]武昱孜,张旭,华利忠,等.支原体对细胞培养污染的研究概况[J].动物医学进展,2013,34(9):112-117.
[16]余华,杜永凤,严玉宝,等.DNA荧光染色法和培养法在支原体检测中的比较[J].安徽农业科学,2010,38(8):4039-4041.
Isolation,Culture and Biological Characteristics of Porcine Ovarian Granulosa Cells
YANYibo,LI Wengang,JIAOFulin,WUZhijuan,HUGuangying,ZHOUShenghua,SUI Chao,YUE Lei,RENYifei
(Institute ofAnimal Husbandry&Veterinary,Shanxi AcademyofAgricultural Sciences,Taiyuan 030032,China)
Ovarian granulosa cells is an important cell model to study the mechanism of reproductive physiology,pathology, pharmacology and toxicology of female animals.The research adopted the method of conventional cell culture to establish the porcine ovarian granulosa cell culture system and study its biological characteristics.The results showed that suction method and split method each had their pros and cons,both had no significant effect on cell viability.The effect of serum was better than that of serum-free,and the effect offetal bovine serumwas better.The culture effect ofDMEMand TCM199 was similar,and the effect ofDMEM+10%FBS was the best.Morphological observation showed that granulosa cells had the characteristics of adherent growth and lack of contact inhibition, the growth curve in vitro was consistent with the growth characteristics of adherent cells,DAPI fluorescence staining method did not detect mycoplasma contamination,the porcine ovarian granulosa cell grewwell.
pig;ovarian granulosa cells;isolation;cell culture
S828
A
1002-2481(2016)06-0825-04
10.3969/j.issn.1002-2481.2016.06.26
2016-02-17
山西省自然科学基金项目(2013011029-4);山西省农业科学院博士研究基金项目(YBSJJ1201)
闫益波(1979-),男,山西临猗人,副研究员,博士,主要从事动物遗传育种与繁殖学研究工作。李文刚为通信作者。

