种猪场猪瘟净化试验
王娟萍,孟帆,姚敬明,吴忻,刘文俊,李红丽,樊振华,米瑞娟
(山西省农业科学院畜牧兽医研究所,山西太原030032)
种猪场猪瘟净化试验
王娟萍,孟帆,姚敬明,吴忻,刘文俊,李红丽,樊振华,米瑞娟
(山西省农业科学院畜牧兽医研究所,山西太原030032)
猪瘟是由猪瘟病毒引起的一种以高热、出血为主要特征的烈性、高度接触性传染病,当前猪瘟的发生表现为种猪的繁殖障碍、持续感染。要从源头上控制规模化猪场的猪瘟疫情,则必须对种猪群进行净化。采用强化免疫、抗体检测、病原检测、淘汰带毒病猪,结合生物安全等管理措施,2014年在某种猪场分2次进行了净化试验。通过对230头母猪、46头公猪、619头后备母猪实施免疫检测净化,共淘汰母猪35头、公猪6头、后备母猪365头,使试验猪群第4次和第5次抗体检测合格率达到100%。
种猪场;猪瘟净化;淘汰净化
猪瘟(Classical Swine Fever,CSF)是由猪瘟病毒(CSFV)引起的一种以高热、出血为主要特征的烈性、高度接触性传染病。我国是猪瘟流行较严重的国家,每年因猪瘟死亡的猪约占病死猪的39.65%,经济损失达100亿元左右[1]。丘惠深[2]利用猪瘟荧光抗体染色技术检测我国13个省(市)29个大、中型猪场的种猪扁桃体,结果表明,所有被检猪场都存在种猪猪瘟带毒,全国种猪猪瘟抗原阳性率平均为11.12%,最高的可达30.7%,最低为4.4%。同一猪场中各类猪群均可遭受猪瘟病毒的感染,采用全场扑灭的办法显然是不符合我国国情,难以做到[3]。由于猪瘟免疫抗体水平低下,导致种猪场猪瘟持续感染,妊娠母猪长期带毒,表现为流产、早产或生产仔猪带毒;带毒公猪可以通过精液传播,因此,要从源头上控制规模化猪场的猪瘟疫情,则必须对种猪群进行净化[4]。2012年国家中长期动物疫病防治规划(2012—2020年)(国办发〔2012〕31号)中,把猪瘟列为优先防治的国内动物疫病(16种)之一。文件要求到2015年部分区域达到净化标准,原种猪场达到净化标准。到2020年进一步扩大净化区域,全国所有种猪场达到净化标准。
在猪瘟净化中,使用的检测方法主要有病毒分离技术、免疫荧光技术、RT-PCR/FQ-PCR分子诊断技术和抗原ELISA检测法等。最常用的是免疫荧光技术,具有操作简单、试剂价格低、快速灵敏等特点。但由于该法需活体采集猪的扁桃体,对猪的应激很大,很多养殖场对此有较大的抗拒心理,一般不肯采用。张健騑等[5]在近年来的实践中摸索出以检测抗体为主、配合检测抗原的猪瘟净化技术。
山西省农业科学院畜牧兽医研究所猪病课题组通过整合猪瘟净化技术的相关报道,采用猪瘟兔化高效细胞疫苗与猪用转移因子强化免疫[6-7]、抗体检测、病原检测、淘汰带毒病猪,结合生物安全等管理措施,在某猪场进行了猪瘟净化试验,以期为今后种猪场猪瘟净化提供技术支持。
1 材料和方法
1.1 试验材料
高效猪瘟活疫苗(细胞源),普莱柯生物工程股份有限公司生产;猪用转移因子免疫增强剂,大连三仪动物药品有限公司生产;猪瘟ELISA抗体检测试剂盒,法国Biochek公司生产,北京天之泰生物科技有限公司提供。病原检测试剂盒,北京世纪元亨动物防疫技术有限公司生产;消毒药,北京瑞先农科技发展有限公司生产。
1.2 试验猪群
在山西省某种猪场选择生产母猪230头、公猪46头、后备母猪619头。
1.3 猪场饲养管理
试验猪场存栏母猪600头,每批选留后备母猪200头,每年选留2~3批,选留标准为第3胎产仔10头以上,没有遗传缺陷的,本品种特征明显,所产仔猪母猪比例在50%以上。第1次在断奶后选留,保持存栏公猪50头,并对外提供精液;每周有24头母猪配种,24头母猪上产床,24头母猪下产床,每月出栏肥猪800~900头。后备母猪在7~8个月、体质量100~110 kg时进行配种。
1.4 试验方法
1.4.1 试验分组2014年3—8月和7—12月进行了2次净化试验。分别选择了5批经产母猪(选择第2,第3胎经产母猪),每批母猪约24头左右;分别选择了5批选留的后备母猪,每批后备母猪约100头左右。
1.4.2 强化免疫对生产母猪在断奶后、配种前用猪用转移因子直接稀释高效猪瘟活疫苗(细胞源),每头猪注射2 mL,进行跟胎免疫。对准备选留的后备母猪,用高效猪瘟活疫苗(细胞源)100头份+75 mL配套稀释液+25 mL猪用转移因子,20日龄时进行第1次免疫,30日龄时进行第2次免疫,每头猪肌肉注射1.1 mL。用高效猪瘟活疫苗(细胞源)100头份+60 mL配套稀释液+40 mL猪用转移因子,60日龄时进行第3次免疫,每头猪肌肉注射1.2 mL。对公猪每季度第1个月第1周用猪用转移因子直接稀释高效猪瘟活疫苗(细胞源),每头猪注射2 mL。
1.4.3 抗体检测对试验经产母猪和公猪在断奶后跟胎免疫前1~2 d、跟胎免疫后15,30,45 d左右,全部抽血进行抗体检测。对初选的后备母猪,在45,60,75,90,120,150,210日龄全部抽血进行抗体检测。
1.4.4 病原检测对2次检测猪瘟抗体阴性的经产母猪、公猪以及猪场有发热、食欲减低、繁殖障碍等临床症状的病猪,用猪瘟病毒PCR检测试剂盒进行病原检测。
1.4.5 淘汰净化对后备母猪2次检测抗体阴性和猪瘟病毒检测阳性的进行淘汰,图1为部分检测样品猪瘟病毒扩增结果。

1.4.6 生物安全措施试验猪场在隔离消毒等方面设施比较先进,对工作人员等管理要求比较严格,生活区、养殖区、粪便处理区、尸体无害化处理等方面布局也比较合理。课题组主要提供优质的戊二醛和碘伏消毒药,坚持每7 d进行一次全场大消毒。对疑似病猪,隔离到专用猪舍,由专人进行饲养管理;对死猪进行无害化处理。
2 结果与分析
2.1 第1次净化结果

表1 第1次猪瘟净化试验公猪猪瘟抗体检测结果

表2 第1次猪瘟净化试验经产母猪猪瘟抗体检测结果
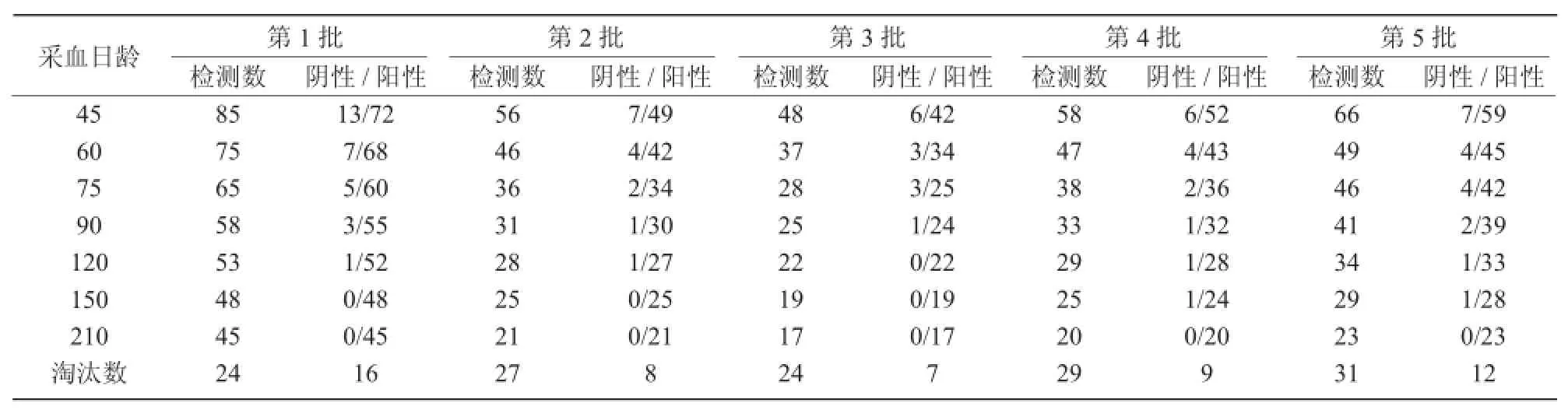
表3 第1次猪瘟净化试验后备母猪猪瘟抗体检测结果
从表1~3可以看出,第1次猪瘟净化试验共检测经产母猪112头,猪瘟抗体第2次至第4次检测阴性的12头,其他原因淘汰8头;共检测公猪46头,猪瘟抗体第2次至第4次检测阴性的2头,其他原因淘汰1头;选留后备母猪313头,因猪瘟抗体不合格淘汰52头,其他原因淘汰135头,共淘汰187头。
2.2 第2次净化结果
从表4~6可以看出,第2次猪瘟净化试验共检测经产母猪118头,猪瘟抗体第2~4次检测阴性的8头,其他原因淘汰7头;公猪在第1次检测的基础上,本次猪瘟抗体检测均为阳性,因其他原因淘汰3头;选留后备母猪306头,因猪瘟抗体不合格淘汰51头,其他原因淘汰127头,共淘汰178头。

表4 第2次猪瘟净化试验公猪猪瘟抗体检测结果

表5 第2次猪瘟净化试验经产母猪猪瘟抗体检测结果

表6 第2次猪瘟净化试验后备母猪猪瘟抗体检测结果
2.3病原检测分析
从表7可以看出,病原检测猪瘟抗体为阴性的母猪和公猪共22头,其中,阳性17头,阳性率为77.27%,证明猪瘟抗体阴性猪可能与感染猪瘟病毒有关,对检测的阳性猪全部淘汰;同时对试验阶段猪场内的81头病死猪也进行了猪瘟病原检测,其中,阳性19份,阳性率为20.99%。
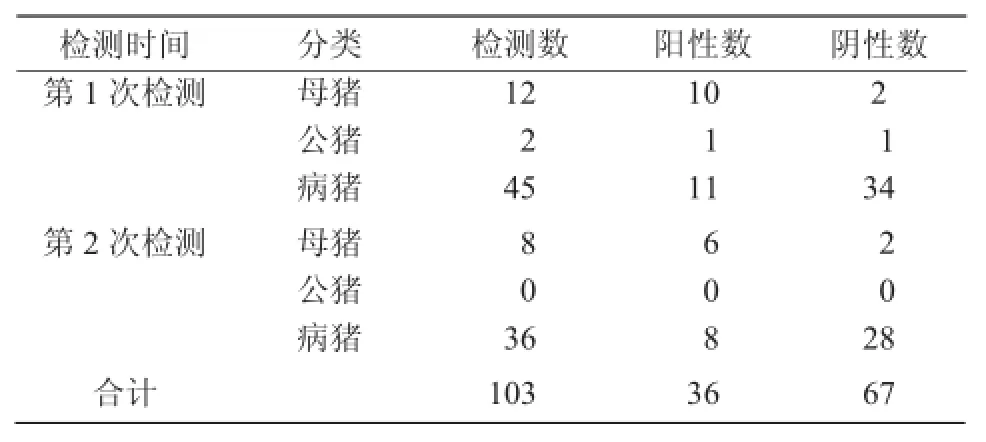
表7 猪瘟净化试验PCR病原检测结果
3 小结与讨论
本研究对230头母猪、46头公猪、619头后备母猪实施了免疫检测净化。共淘汰母猪35头、公猪6头、后备母猪365头,使试验猪群第4,5次抗体检测合格率达到100%,取得了一定的效果。但由于经费等原因没有对全场母猪和后备母猪进行免疫检测淘汰净化,也没有连续跟踪检测下去,今后有条件时应继续开展这方面的研究,不断解决净化过程中存在的问题,完善净化技术。
在净化试验中,本研究参考吴文彩[4]研究的猪瘟抗体检测方法,凡间接血凝抗体水平在1∶16以下(含1∶16)的种猪,均应视为隐性感染。针对山西种猪场猪瘟免疫抗体低下等问题,应用山西省农业科学院畜牧兽医研究所猪病课题组研究的猪瘟兔化高效细胞疫苗与猪用转移因子联合免疫提高免疫抗体水平的技术[6],对试验猪群实施强化免疫,在提高猪群猪瘟免疫抗体的基础上,定期检测猪瘟抗体,对抗体阴性的后备母猪全部淘汰、对抗体阴性的经产母猪和公猪进行猪瘟病原检测,病原检测阳性猪全部淘汰,并结合生物安全防控,开展猪瘟净化。丘惠深[2]研究表明,每180 d净化一次,一般净化后90 d可见初效,180 d效果明显;经3~5次净化后,猪瘟便可得到有效控制。本试验持续了270 d,也取得了一定效果,可供大家参考。
针对我国当前猪瘟的流行现状,实行猪瘟的净化势在必行。根据我国当前的实际情况,既要做到猪瘟的控制与净化,又要减少养猪企业、养猪户的损失[7-8]。应坚持免疫、检测、淘汰相结合的控制与净化的综合防制措施。猪瘟净化是一个综合性的系统工程,需要政府统筹规划科学引导,通过示范带动,达到区域净化并逐步推广。
[1]徐磊.猪瘟兔化弱毒细胞苗和脾淋苗细胞免疫效果的比较[D].福州:福建农林大学,2009.
[2]丘惠深.净化是有效控制我国猪瘟的重要手段[J].猪业科学,2010(3):119.
[3]周绪斌,赵亚荣.规模化猪场猪瘟的净化与防制[J].养猪,2006(3):212-215.
[4]吴文彩.规模化猪场非典型猪瘟的控制与净化[J].广西畜牧兽医,2010(4):221-223.
[5]张健騑,杨傲冰.猪场内部猪瘟净化的实施方案[J].广东饲料,2010,19(1):46-48.
[6]孟帆,王娟萍.猪瘟兔化高效细胞疫苗与猪用转移因子联合免疫程序试验[J].养猪,2015(1):102-104.
[7]孟帆,王娟萍.免疫增强剂对猪瘟疫苗细胞免疫的影响[J].山西农业科学,2015,43(7):881-884.
[8]邱骏,姜杰.当前我国猪瘟的流行现状及控制与净化措施[J].中国猪业,2007(12):32-34.
The Purification Experiment on Classical Swine Fever in Some Pig Farms
WANGJuan-ping,MENGFan,YAOJing-ming,WUXin,LIUWen-jun,LI Hong-li,FANZhen-hua,MI Rui-juan
(Institute ofAnimal Husbandryand Veterinary,Shanxi AcademyofAgricultural Sciences,Taiyuan 030032,China)
Classical swine fever caused by classical swine fever virus was a high fever,bleeding as the main feature of the potent, highlycontagious disease,and classical swine fever occurred currently for swine reproductive disorder and persistent infection.To control the swine flu fromthe source in the scale pig farms,the breeding herd must be purified.The purification experiment had been carried out twice by the immunization,antibody detection,pathogen detection,elimination with poison sick pigs,in combination with the biological safety management in a pig farm in 2014.The 230 sows,46 boars and 619 replacement gilts were implemented immune detection and purification,the result showed that a total of 35 sows,6 boars and 365 replacement gilts were eliminated,the qualified rate of antibody detection ofexperimental pigs fourth and fifth reached 100%,and achieved certain results.
pigfarms;purification ofclassical swine fever;purification and elimination
S858.28
A
1002-2481(2016)04-0524-04
10.3969/j.issn.1002-2481.2016.04.26
2015-11-23
山西省科技攻关项目(20120311022-4);山西省农业科学院重点项目(2013ZD10)
王娟萍(1958-),女,山西太原人,研究员,主要从事畜禽传染病研究工作。孟帆为通信作者。

