小麦幼胚离体培养再生体系的建立
王宇宏,张 彬,王玉国
(1.山西省生物研究所,山西太原030031;2.山西农业大学农学院,山西太谷030801)
小麦幼胚离体培养再生体系的建立
王宇宏1,张 彬2,王玉国2
(1.山西省生物研究所,山西太原030031;2.山西农业大学农学院,山西太谷030801)
选择不同小麦品种的幼胚作为试验材料,对影响其愈伤组织诱导及植株再生的因素进行分析。结果表明,小麦幼胚组培最适胚龄为12~14 d;在最适胚龄下,基因型对胚性愈伤组织的发生频率影响较大,对小麦幼胚培养出愈率的影响并不显著。在加有2,4-D 1mg/L+KT 0.5mg/L的基本培养基中进行继代培养,晋农232、晋农318和晋农234胚性愈伤组织的诱导率最高,分别达74.6%,70.3%和60.8%。此外,培养基中添加一定量的含氮有机物,也可提高胚性愈伤组织的诱导率,即晋农232添加300 mg/L Gln,晋农318添加500 mg/L Gln+300 mg/L CH后,其胚性愈伤组织的诱导率均有显著提高。分化培养中,添加ZT 3mg/L和NAA 1mg/L对晋农232、晋农318和晋农234等3个品种愈伤组织诱导分化的效果最好,其再分化率分别达到72.5%,57.5%和62.5%。生根培养中添加IAA 0.8mg/L的1/2基本培养基可以诱导芽快速生壮根。
小麦;幼胚;愈伤组织;植株再生
小麦(Triticum aestivum L.)属禾本科(Gramineae)麦属(Tritium),是重要的粮食作物之一,是世界上种植面积最广、总产量最高的作物[1]。生物技术的兴起与发展,为改良小麦品种资源提供了新的有效方法。植物组织培养技术为小麦无性系的利用及小麦遗传转化体系的建立提供了技术支持。目前,小麦的离体再生是一项国际难题,只有少数实验室获得了小麦遗传转化体系,这阻碍了小麦基因工程方面的进一步研究。优化小麦组织培养条件,提高植株再生效率是小麦生物技术育种亟待解决的重要课题。小麦幼胚愈伤组织分化能力较其他组织器官高,是进行小麦基因转化的良好受体[2-4]。
本研究以原产于山西省的6个小麦栽培种(晋农232、晋农234、农大189、晋麦48、晋农318、小麦207)作为试验材料,系统研究了影响小麦幼胚愈伤组织诱导及植株再生的因素,旨在探索建立一套合适的植株再生体系最有效的方法。
1 材料和方法
1.1 供试材料
本试验选用了原产于山西省的6个小麦栽培种作为试验材料,其中,晋麦48与农大189由山西农业大学栽培实验室提供,小麦207、晋农232、晋农234与晋农318由山西农业大学遗传育种实验室提供。
1.2 培养基
1.2.1 基本培养基 MSB+3%蔗糖+6%琼脂粉,pH值调至5.8。
1.2.2 愈伤组织的诱导培养基 基本培养基+2,4-D 2mg/L。
1.2.3 继代培养基 (1)基本培养基+2,4-D 1 mg/L+KT 0.5 mg/L;(2)基本培养基+2,4-D 1 mg/L+ABA 0.5 mg/L;(3)基本培养基+2,4-D 1 mg/L;(4)基本培养基+2,4-D 2 mg/L+ABA 0.5 mg/L;(5)基本培养基+2,4-D 6mg/L。
1.2.4 分化培养基 基本培养基+ZT/NAA不同浓度配比(1∶0.5,2∶0.5,2∶1,3∶1,3∶1.5)激素组合或BA/NAA不同浓度配比(1∶0.5,2∶0.5,3∶0.5,1∶1,2∶1,3∶1)激素组合。
1.2.5 生根培养基 1/2 MS培养基(其余的同基本培养基)+不同浓度的IAA和IBA。
1.3 试验方法
1.3.1 无菌外植体的制备 选择生长发育正常且具有代表性的小麦植株作为试验材料,在其开花前进行挂牌标记,并实时观察胚的发育情况。开花10d起隔日取样,剥去籽粒内外颖壳,将去壳后的未成熟种子在无菌条件下先用75%的乙醇溶液消毒30 s,使用无菌水漂洗3~4次后用0.1%的氯化汞溶液消毒15min,再用无菌水重复漂洗3~4次。小心地剥出幼胚作为外植体,此操作要严格按照要求在超净工作台中完成。
1.3.2 愈伤组织的诱导 在超净工作台中将幼胚盾片向上接种于诱导培养基上,每个培养皿接种20枚,封口膜封口,置于室温为(23±1)℃的培养室内进行暗培养。30d后对愈伤组织的出愈率及胚性愈伤组织的诱导率进行统计记录,观察胚性愈伤组织的大小、颜色与质地。具体的统计标准为:胚性愈伤组织表现出表面淡黄、凹凸不平、致密不透明;非胚性愈伤组织表现出表面发白,质地松散。通过比较小麦幼胚胚龄和基因型对幼胚培养出愈率及体细胞胚性无性系产生的影响,筛选出小麦幼胚培养的最佳时期。
愈伤组织出愈率=产生的愈伤组织数/接入的幼胚数×100%;胚性愈伤组织诱导率=胚性愈伤组织数/产生的愈伤组织总数×100%。
1.3.3 继代培养 将诱导获得的愈伤组织接种于含有不同浓度的2,4-D或者另配有不同浓度的ABA,KT的继代培养基上(1.2.3中的(1)~(5)),在室温(23±1)℃下进行暗培养,每隔7d继代培养一次。培养过程中实时观察愈伤组织的色泽、大小和质地;准确记录胚性愈伤组织诱导情况并统计其诱导率,以此为依据,筛选出最适继代培养的激素浓度配比,并在此基础上,添加不同浓度的谷氨酰胺(Gln)、水解酪蛋白(CH)、水解乳蛋白(LH),观察这3种有机物对体细胞无性系产生的影响。
1.3.4 分化培养 将继代培养中产生的胚性愈伤组织接种到含有不同激素配比的分化培养基上,在光强2500lx,光照16h/d,室温26℃的条件下进行分化培养。期间每隔5~7d继代培养一次,观察记录胚性愈伤组织形态变化的特征和时间并计算分化率。
分化率=产生绿色原基的愈伤组织数/接入的愈伤组织数×100%。
1.3.5 生根培养 将分化培养产生的绿芽及其分蘖接种于生根培养基中,在光强2500lx,室温26℃的条件下进行培养。在1/2 MS生根培养基中添加IAA和IBA这2种生长素,观察比较培养基对诱导生根的影响。
2 结果与分析
2.1 愈伤组织的诱导
2.1.1 胚龄对小麦幼胚组织培养的影响 自小麦开花后10d起,隔日取样。将脱去外颖壳后的未成熟种子进行消毒,在无菌条件下剥出幼胚并接种于诱导培养基上,30 d后记录统计愈伤组织诱导率、胚性愈伤组织诱导率和幼胚直接萌发率。
3个小麦品种不同胚龄的幼胚组织培养后的统计结果列于表1。每个品种的出愈率和胚性愈伤诱导率的大小均与胚龄相关。以晋农318为例,胚龄为10~18 d的幼胚出愈率均达到90%以上,随幼胚胚龄的升高出愈率也逐渐升高,在第18天时达到100%;幼胚在胚龄为14,12 d时,胚性愈伤组织形成量显著多于其他胚龄,其胚性愈伤诱导率分别为60.53%和57.85%,而18 d时,胚性愈伤诱导率仅为35%。在培养过程中,对不同品种不同胚龄的小麦幼胚的直接萌发情况进行统计,结果表明,随着胚龄的增加幼胚的直接萌发率呈现上升趋势,胚龄为10 d时,3个品种均未出现萌发现象,晋麦48在整个幼胚培养的过程中直接萌发率较其他2个品种高。综合比较发现,在直接萌发率较高的胚龄下,产生的胚性愈伤组织较少,胚性愈伤组织的诱导率较低。综合分析胚龄与出愈率、胚性愈伤组织诱导率及直接萌发率的相关性,认为最适宜小麦幼胚组织培养的胚龄为12~14d。
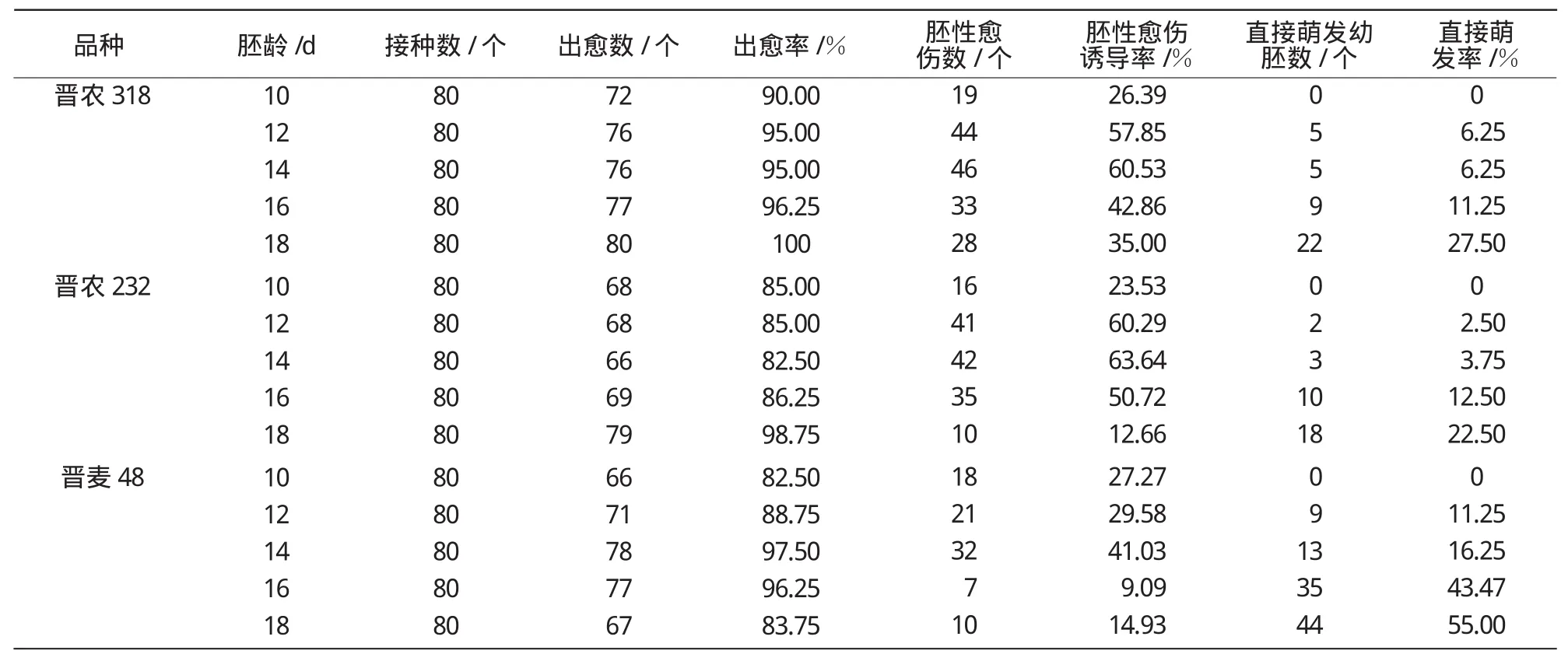
表1 胚龄对小麦幼胚培养特性的影响
2.1.2 基因型对小麦幼胚组织培养的影响 对处于适宜胚龄(12~14 d)的6个小麦品种(系)进行取样、培养,比较各品种幼胚的出愈率和胚性愈伤诱导率,分析基因型对小麦幼胚组织培养的影响(表2)。在最适胚龄条件下,6个小麦品种的幼胚出愈率在92.67%~100%,变异幅度小,因此,供试小麦基因型对其幼胚出愈率的影响并不显著。此外,不同小麦品种幼胚胚性愈伤组织的诱导率存在一定差异,其中,晋农232的诱导率最高,达到64.77%,农大189的诱导率最低,仅为18.79%,二者差异显著,由此可见,基因型对胚性愈伤组织的发生频率有影响。
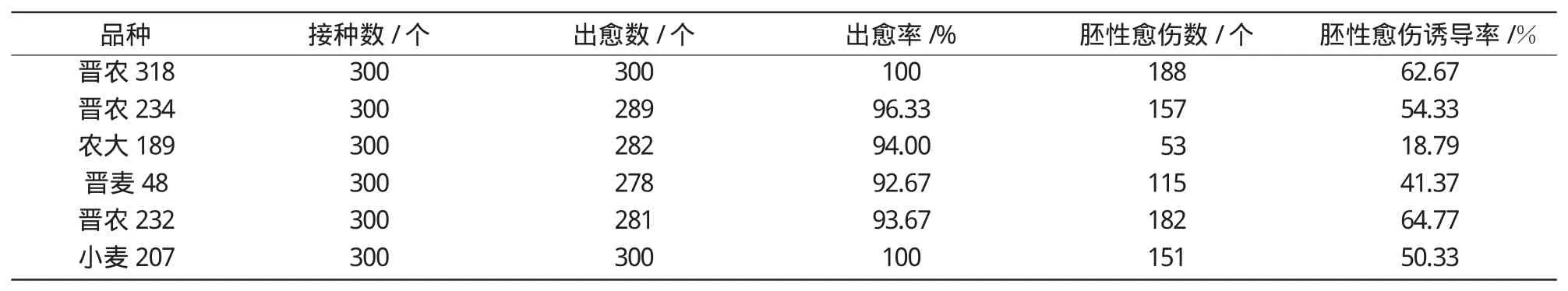
表2 基因型对小麦幼胚培养特性的影响
2.2 继代培养
2.2.1 植物激素对小麦幼胚胚性愈伤组织诱导的影响 为了研究2,4-D,ABA,KT等植物激素种类及浓度对胚性愈伤组织诱导的影响,本试验以晋农232、晋农318、晋农234等3个小麦品种的幼胚诱导15 d所得的愈伤组织为材料进行不同的继代处理,结果如表3所示。在培养基中加入1 mg/L的2,4-D和0.5 mg/L的KT后,3个小麦品种的胚性愈伤组织诱导率均明显高于其他处理,并产生颜色淡黄,表面多瘤状突起的愈伤组织,即典型的胚性愈伤组织。仅在培养基中添加2,4-D,愈伤组织的生长速度随2,4-D浓度的增加而加快,但胚性愈伤组织诱导率呈现下降趋势,由表3可知,当2,4-D为6 mg/L时,3个小麦品种的胚性愈伤组织诱导率均在15%以下,产生的愈伤组织质量明显下降,颜色发白、水渍状严重。
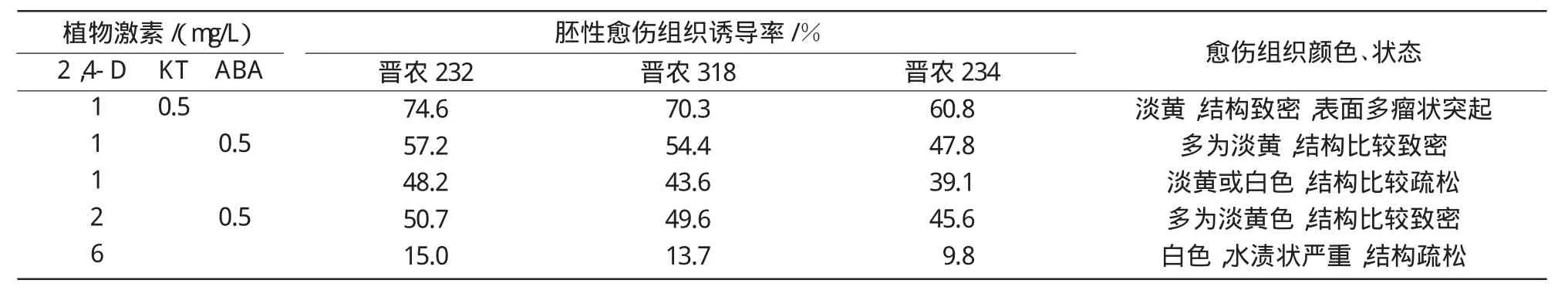
表3 不同植物激素对小麦胚性愈伤组织诱导的影响
2.2.2 不同有机物添加配方对小麦幼胚胚性愈伤组织诱导的影响 本试验以晋农232和晋农318这2个小麦品种的幼胚诱导15 d所得的愈伤组织为供试材料,在诱导培养基上添加相应浓度配比的有机物(Gln,CH,LH)配方如表4所示。
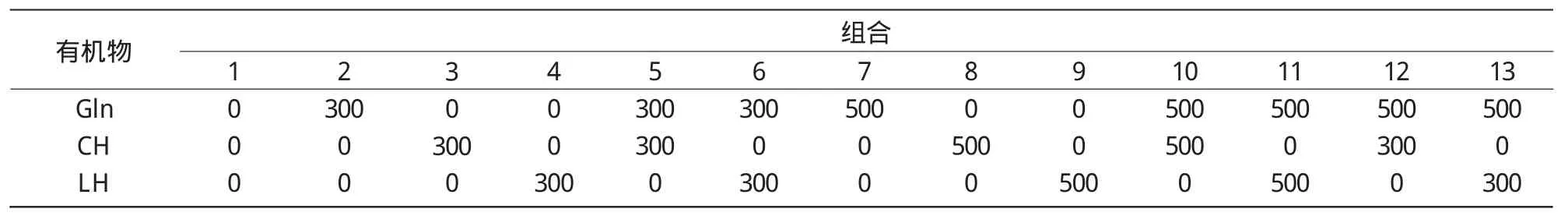
表4 添加不同有机物配方 mg/L
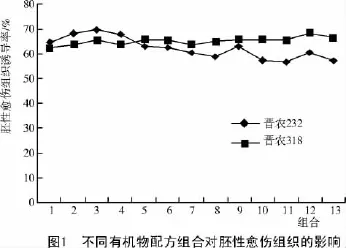
由图1可知,在诱导培养基上添加一定量的有机物配方后,晋农318幼胚的胚性愈伤组织的诱导率较未添加时高。在仅添加300 mg/L或500 mg/L的Gln,CH或LH的培养基中,小麦幼胚胚性愈伤组织的诱导率并无明显差异,但添加CH产生的作用效果略优于LH,Gln的作用相对较弱。同时添加Gln和CH或LH与单独添加其中一种有机物对胚性愈伤组织的诱导效果无明显差异。在加有500mg/L的Gln和300 mg/L的CH的培养基中培养出的胚性愈伤组织诱导率最高。对于晋农232,单独添加300 mg/L的3种有机物对提高胚性愈伤组织诱导率均有一定效果,其中,CH的作用效果更明显。
2.3 分化培养
将上一阶段由继代培养基(1)中诱导产生的胚性愈伤组织分别培养于含有不同激素配比的分化培养基中,比较幼胚愈伤组织分化情况。分化培养期间观察发现,在胚性愈伤组织上首先形成了绿色叶状体,随后由叶状体的基部生成多个绿芽。分化培养35~40d后记录,统计分化率。
2.3.1 不同浓度ZT与NAA配比对小麦幼胚愈伤组织分化的影响 由表5可知:(1)在ZT/NAA的配比为2∶1和3∶1时,最有利于小麦幼胚愈伤组织的分化,分化率均达到50%以上。以晋农232为例,当NAA为0.5 mg/L,ZT分别为1,2 mg/L时,晋农232幼胚愈伤组织的分化率分别为15%和45%,NAA为1 mg/L时晋农232的分化率分别达到了67.5%和72.5%。不同浓度配比的NAA和ZT对晋农318和晋农234这2个小麦品种幼胚愈伤组织分化的影响也有相同的趋势。当ZT达到3 mg/L同时NAA增大到1.5mg/L时,3个小麦品种幼胚的分化率均急剧下降,均低于15%。(2)增加ZT浓度有利于愈伤组织的分化。当ZT为3 mg/L,NAA为1 mg/L时,晋农232、晋农318及晋农234幼胚愈伤组织的分化率分别为72.5%,57.5%和62.5%,均较其他配比组合要高。但当增加NAA浓度时,3个品种的分化率均呈现下降趋势。由此可见,ZT和NAA浓度配比为3∶1时最适宜以上3个小麦品种幼胚愈伤组织的分化。在最适激素配比下品种间也存在差异,其中以晋农232的分化率最高。
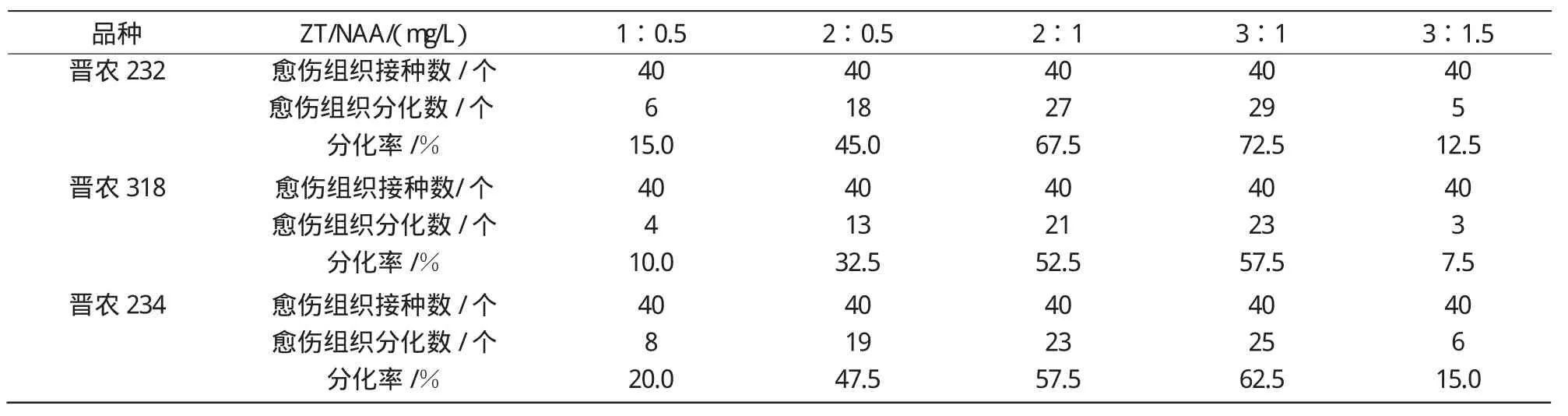
表5 不同ZT/NAA浓度配比对小麦愈伤组织分化的影响
2.3.2 不同浓度BA与NAA配比对小麦幼胚愈伤组织分化的影响 从表6可以看出,在BA和NAA配比中,当BA浓度不变时,提高NAA浓度会抑制愈伤组织的分化。例如,当BA为2 mg/L时,NAA由0.5 mg/L升高到1 mg/L时,3个品种愈伤组织分化率分别由50%降低到22.5%(晋农232),40%降低到10%(晋农318),47.5%降低到17.5%(晋农234)。此外,从表6还可以看出,BA和NAA浓度配比为2∶0.5时,3个品种的幼胚愈伤组织分化率最高,即该浓度配比最适合晋农232、晋农318和晋农234愈伤组织的分化。
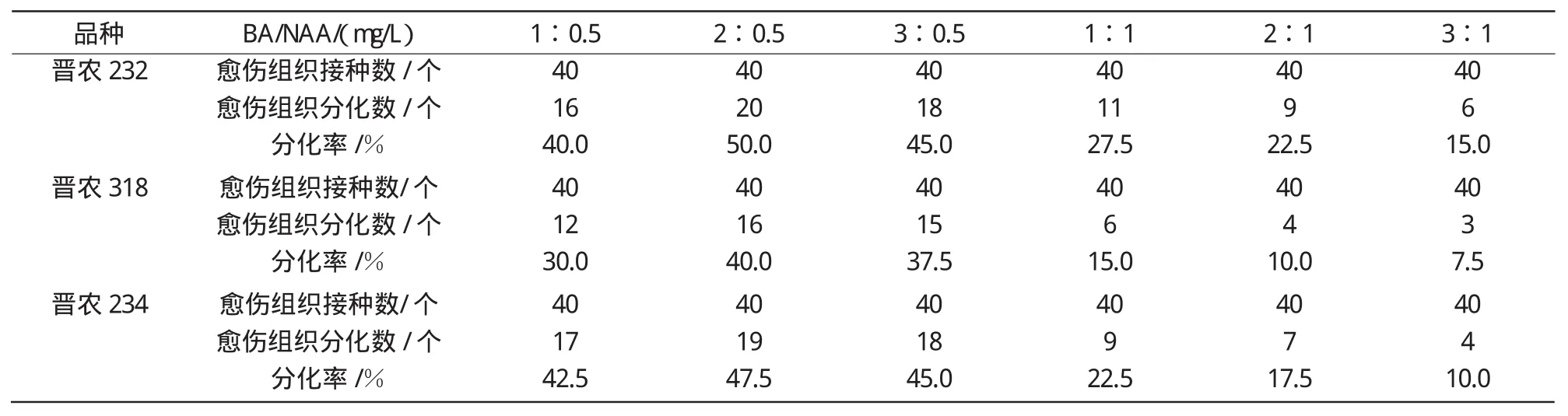
表6 不同浓度NAA与BA配比对小麦愈伤组织分化的影响
综合比较上述2种激素组合(ZT/NAA和BA/ NAA)在各自最适浓度配比下3个品种幼胚愈伤组织的分化情况,只有在同时添加了1 mg/L NAA和3 mg/L ZT后的培养基中培养的3个品种幼胚愈伤组织分化率同时超过50%,晋农232为72.5%,晋农318为57.5%,晋农234为62.5%,因此,以上激素组合配比最佳。在最适激素浓度配比下,以晋农232的分化率最高。
高中物理课堂教学方式方法革新,是应新课标为己任的新式教学方法,也是以互动学习和基础学习为目标的学科系统化教学.高中物理知识点如力和运动的关系、动能概念、 电磁感应、核能等教学内容,需要教学方式上进行创新,才能最大程度实现高中课堂教学效果最大化.为顺应新式教学理念,倡导物理教学方式方法革新,应用合作学习具体教学策略,最终实现学生教学理性变化,注重合作学习方法的合理应用.
2.4 生根培养
本试验以晋农232为供试材料。将其幼胚愈伤组织表面绿芽及其分蘖接种于不同的生根培养基上,在培养过程中,绿芽逐渐伸长并同时产生大量的小根。
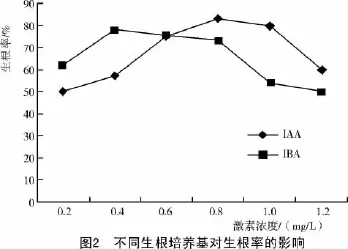
由图2可知,在含有0.8 mg/L IAA的生根培养基中,生根率最高,达到83%。生根培养过程中观察到,此培养基能促进芽快速生根,根系丛生,根系发达,主根粗长健壮,须根多且盘曲;当生根培养基中含0.2 mg/L IAA或1.2 mg/L IAA时,诱导产生的根较少,只有少数短而粗的主根,且生长缓慢。在添加了IBA的生根培养基中,当IBA浓度为0.4mg/L时,芽快速诱导生根,生根率达78%以上,产生的主根多且长,并产生粗长盘曲的少量须根。综上所述,IAA更有利于小麦试管苗生根,最适浓度为0.8 mg/L,其次为IBA,有效浓度为0.4mg/L。
3 结论与讨论
3.1 胚龄对小麦幼胚组织培养的影响
在小麦幼胚组织培养的过程中,外植体幼胚的发育程度在相当大的程度上决定了培养工作的成败和培养效果的好坏。研究者习惯用幼胚“直径大小”[5]或“授粉后胚发育的天数”[6]来表示幼胚的胚龄,其中,“授粉后胚发育的天数”更为客观,应用更广。目前关于小麦幼胚组织培养最适胚龄的研究由于受到品种、栽培条件等因素的限制并无统一结论,王常云等[6]研究认为,烟台地区小麦幼胚培养的有效胚龄为14~20 d,最适胚龄为16 d,与栗现芳等[7]对杂交小麦西杂一号、西杂五号及其亲本的研究结果相同。宋运贤等[8]研究发现,宿9908及皖麦53的最适胚龄为14d。而关于胚龄在幼胚组织培养中的作用有学者认为,胚龄影响了愈伤组织发生的起始部位和强度[9],也有人认为,胚龄影响了愈伤组织的分化率,对幼胚愈伤组织的诱导率并无影响[6]。本试验中选用的3个小麦品种晋农318、晋农232和晋麦48种植于山西省晋中地区,因此,本研究初步认为晋中地区小麦幼胚组织培养的最适胚龄为12~14d。
3.2 基因型对小麦幼胚组织培养的影响
植物基因型作为内因显著影响了植物离体培养过程中胚性愈伤组织和体细胞胚的发生。曾寒冰等[10-13]研究认为,在小麦幼胚培养过程中,诱导愈伤组织及诱导分化上的差异取决于品种的遗传特性。于晓红等[14]研究发现,基因型只影响到愈伤组织的分化率。由此可见,基因型与愈伤组织的分化存在相关性已达成一定的共识,但对于基因型是否影响愈伤组织的出愈率仍无定论。外植体培养过程中,产生了胚性和非胚性2种类型的愈伤组织。小麦的再生植株发生都经过了愈伤组织阶段,有再生能力的胚性愈伤组织在所有愈伤组织中的比例大小直接关系到基因型对分化率的影响,因此,基因型是通过影响胚性发生率来影响再生植株的分化率。
本试验从小麦幼胚愈伤组织出愈率和胚性愈伤诱导率2个方面对基因型所产生的作用进行了分析。结果表明,基因型对胚性愈伤组织诱导率产生了显著影响,而出愈率与基因型并无显著相关性。在最适的胚龄期内对供试的6个品种进行取样、培养,在同一培养基上愈伤组织的诱导率均达到90%以上,但胚性愈伤组织诱导率之间的差异却很明显,晋农232最高,达到64.77%,农大189最低,只有18.75%。
3.3 激素对小麦幼胚组织培养的影响
本试验结果表明,在诱导培养基中添加2 mg/L的2,4-D最佳,而在继代培养基中则是以1 mg/L效果较好。此外,对于另一些激素的作用也有相关的报道,Nabors等[20]在小麦未成熟胚培养试验中,发现细胞分裂素可以显著促进一些品种的胚发生,在含生长素的培养基上添加KT可提高胚性愈伤组织的形成和胚状体的发生。本试验也得出了类似的结果,研究表明,KT显著提高了小麦幼胚胚性愈伤组织诱导率,最适宜浓度为0.5mg/L。
小麦愈伤组织在光照条件下,在分化培养基中先后分化产生分化原基、芽或不定根。不定根和芽的分化顺序将影响植株的再生,只有先分化形成芽,愈伤组织在生根培养基上进一步长出根,才能形成完整的再生植株。因此,有效地诱导芽分化是提高植株再生率的一个重要环节。植物激素在植物组织培养器官或胚状体的分化过程中起到了重要的调节作用。不同作物品种对外源激素的敏感性不同。适宜浓度配比的细胞分裂素和生长素可以有效地控制胚性愈伤组织的分化,形成苗和根,最终获得再生植株。本研究结果表明,针对供试的3个小麦品种,添加一定比例的激素组合ZT/NAA较BA/NAA这一组合对提高幼胚愈伤组织分化率的效果更明显。在生根培养基中添加0.8mg/L IAA和0.4mg/L IBA能诱导芽快速生根,根系健壮。IAA对生根率的作用效果要优于IBA。
4 结论
小麦幼胚愈伤组织诱导过程中,选择胚龄为12~14 d幼胚,胚性愈伤组织诱导率最高;在最佳胚龄条件下,不同基因型小麦的胚性愈伤组织的发生频率不同,因此,诱导率之间也存在较大差异,晋农232和晋农318效果最好,胚性愈伤组织诱导率分别达到64.77%,62.67%。
在小麦幼胚愈伤组织继代培养过程中,在附加了1 mg/L 2,4-D+0.5 mg/L KT激素组合的培养基中培养的晋农232、晋农318、晋农234等3个小麦品种的胚性愈伤组织的诱导率分别达到74.6%,70.3%和60.8%,明显高于其他处理,此外,含氮有机物的添加也可促进胚性愈伤组织的诱导,添加300 mg/L Gln对晋农232以及添加500 mg/L Gln+300 mg/L CH对晋农318胚性愈伤组织诱导率的提高均起到了促进作用。
在小麦幼胚愈伤组织分化培养过程中,NAA 1 mg/L+ZT 3 mg/L是培养基中添加的最理想激素配比。在此条件下,晋农232、晋农234、晋农318等3个小麦品种愈伤组织分化率均较高,分别达到72.5%,62.5%和57.5%。
小麦幼胚离体培养后期,添加0.8 mg/L IAA和0.4 mg/L IBA,可以诱导芽快速生根,且根系健壮,0.8mg/L的IAA的生根效果最佳。
由生根试验结果可知,在无激素的基本培养基上或添加了IAA,NAA,IBA的培养基上,小麦试管苗均能诱导生根,但生根率及根系生长状况存在一定差异。
参考文献:
[1]郭天财.21世纪小麦遗传育种展望:小麦遗传育种国际学术讨论会简讯[J].麦类作物学报,2001(3):11.
[2]左静静,刘少翔,闫贵云,等.小麦幼胚组织培养研究进展[J].中国农学通报,2010,26(19):81-87.
[3]刘少翔,王卉,孙毅,等.小麦幼胚的脱分化状态及再生性能研究[J].华北农学报,2003,18(1):64-67.
[4]赵占军,陈茂盛,王贵娟.胚龄和激素对小麦幼胚组织培养的影响[J].生物技术,2003,13(5):7-8.
[5]蔡体树,田惠琴,林书康,等.基因型和胚龄对小麦未成熟胚离体培养反应的影响[J].遗传学报,1989,16(2):81-88.
[6]王常云,王作全,李晓亮,等.小麦幼胚离体培养育种技术研究[J].麦类作物,1999,19(1):14-16.
[7]栗现芳,马守才,张改生,等.胚龄、NAA浓度、基因型对杂交小麦及其亲本幼胚培养的影响 [J].河南农业科学,2007(6):31-34.
[8]宋运贤,相天宜.小麦幼胚再生体系的建立[J].开封教育学院学报,2016,36(2):280-281.
[9]章力健.小麦为成熟胚诱生大量绿苗的研究初报[J].遗传学报,1987,14(3):175-176.
[10]曾寒冰.小麦未熟胚离体培养的研究:愈伤组织的诱导及再生植株[J].东北农学院学报,1988,19(1):1-8.
[11]李士生,张玉玲.小麦幼穗的组织培养及愈伤组织的分化研究[J].武汉植物学研究,1990,8(4):349-354.
[12]梁竹青,高明蔚.不同小麦基因型对体细胞组织培养的反应[J].中国农业科学,1986(2):42-48.
[13]安海龙,卫志明,黄建秋,等.小麦幼胚培养高效成株系统的建立[J].植物生理学报,2000,36(6):532-538.
[14]于晓红,朱祯,付志明,等.提高小麦愈伤组织分化频率的因素[J].植物生理学报,1999(4):388-394.
[15]李扬,徐凤,柴乖强,等.基本培养基及激素对野生一粒小麦幼胚培养的影响[J].麦类作物学报,2016,36(5):583-585.
[16]李琴,江千涛,魏育明,等.生长素对小麦幼胚组织培养的影响[J].西南农业学报,2006,19(5):806-810.
[17]别晓敏,杜丽璞,佘茂云,等.不同生长素类型及ABA搭配对小麦幼胚再生效果的影响 [J].核农学报,2011,25(5):1023-1028.
[18]王新国,任江萍,李磊,等.不同培养基及激素配比对小麦幼胚离体培养的影响[J].麦类作物学报,2005,25(2):5-8.
[19]王亚馥,崔凯荣,陈克明,等.小麦组织培养中体细胞胚胎发生的细胞胚胎学及淀粉消长动态的研究 [J].实验生物学报,1993,26(3):259-262.
[20] Nabors M W,Heyser J W,Dykes T A,et al.Long duration,high-frequency plant regeneration from cereal tissue cultures[J]. Planta,1983,157(5):385-391.
Establishment of Regeneration System of W heat Immature Embryos Culture in vitro
WANG Yuhong1,ZHANG Bin2,WANG Yuguo2
(1.Biology Institute ofShanxi,Taiyuan 030031,China;2.College ofAgronomy,Shanxi Agricultural University,Taigu 030801,China)
The paper studied wheatimmature embryoswith six cultivars in vitro and the factors of wheatcallus induction and plant regeneration.The resultshowed that the age of immature embryos for its tissue culturewas14-16 d.Among the optimum ageof immature embryos,genotype had little effects on callus induction of immature embryos while it had remarkable effect on the induction frequency of embryogenic callu.Jinnong232 and Jinnong 318 had relatively good culturing characters.The optimum subculturemedium was the basal medium supplementedwith 2,4-D(1mg/L)and KT(0.5mg/L).In thismedium,the induction frequency ofembryogenic callusof Jinnong 232,Jinnong 318 and Jinnong 234 could reach 74.6%,70.3%,60.8%.The optimum hormone concentration added to basal medium for callus differentitation was NAA 1 mg/L and ZT 3 mg/L with a callus differentiation frequency more than 50%.The root formation could be stimulated by halfamountofbasal medium togetherwith 0.8mg/L IAA.
wheat;immature embryos;callus;plant regeneration
Q813.1;S512.1
A
1002-2481(2016)07-0900-07
10.3969/j.issn.1002-2481.2016.07.03
2016-02-29
王宇宏(1979-),女,山西怀仁人,助理研究员,硕士,主要从事农学及土壤生态学研究工作。王玉国为通信作者。

