HFE基因C282Y与H63D突变型与肝癌相关性的Meta分析
李 佟,李时孟,刘 硕,谢 风,丁 军*
(1.吉林大学中日联谊医院新民院区 放射线科,吉林 长春130021;2.吉林大学中日联谊医院 检验科,吉林 长春130033)
*通讯作者
HFE基因C282Y与H63D突变型与肝癌相关性的Meta分析
李 佟1,李时孟2,刘 硕1,谢 风2,丁 军1*
(1.吉林大学中日联谊医院新民院区 放射线科,吉林 长春130021;2.吉林大学中日联谊医院 检验科,吉林 长春130033)
目的 采用Meta分析方法评价HFE基因C28Y与H63D突变型与肝癌发生的相关性。方法 计算机检索PubMed、CNKI、中国知网和万方数据库HFE基因型与肝癌发生相关的病例对照研究,相关文献的查找采用文献追溯方法。检索时限是从建库至2016年1月。按照纳入和排除标准选择文献,并进行提取资料和评价质量,用RevMan 5.0软件进行Meta分析及评估文献的发表偏倚。结果 最终纳入14篇文章,C282Y研究组共纳入病例组2418人,对照组9022人;H63D研究组病例组2208人,对照组6170人。Meta分析结果显示,C282Y研究组等位基因(C vs Y)Y基因的表达为肝癌发生的危险因素[OR=1.58,95%CI(1.06,2.33)],对基因分型进行的分层研究,结果表明与携带CC基因型人群相比,携带YY基因型(YY vs CC)患肿瘤风险增高[OR= 5.71,95%CI(2.81,11.62)]。携带隐性基因型YY与另外两种基因型(YY vs CC+CY)同样增高患肿瘤的风险 [OR=5.71,95%CI(2.81,11.38)]。结论 HFE基因型C282Y突变基因的表达是肝癌发生的危险因素。
肝癌;HFE基因;病例对照;Meta分析
(ChinJLabDiagn,2016,20:2020)
据报道,全世界范围内每年大约有1270万新增癌症病例,而肝癌在癌症相关死因中位居第三位,每年因肝癌死亡人数约为60万人。然而肝癌的潜在发生机制目前尚未完全知晓,可行的治疗手段也很局限。
铁是人体代谢必须的微量元素,参与多种体内生物学过程,体内铁过载时可引起氧化应激导致细胞的凋亡及损伤[1],有研究表明铁过载可能会增加患癌症的风险和死亡率[2,3]。HFE与细胞铁的摄取关系密切,如果表达异常,细胞铁蓄积,可能与肿瘤的发生有关。HFE基因有两种错义突变,即C282Y、H63D,对于HFE 基因突变是否增加肝细胞癌发病风险的研究意见并不一致,一部分研究认为HFE 基因错义突变增加肝细胞癌发病风险,但也有研究认为HFE基因错义突变不增加肝细胞癌的发病风险。综上,本文以HFE为切入点,对HFE错义突变基因与肝癌发病风险进行Meta分析,从而评估二者之间的具体关系。
1 资料与方法
1.1 纳入标准和排除标准
1.1.1 纳入标准 ①文献的内容是关于HFE基因C28Y与H63D位点突变与肝癌相关性的病例对照研究;②能够从病例组和对照组得到基因型频率的细节,或者能够通过提供的信息计算它;③研究目的明确,有研究开展的具体年限,所有的病例均诊断明确,病例组与对照组均采用成组或个体匹配。
1.1.2 排除标准 ①资料单一、抽象、重复发表;②未提供充分原始数据且索取无果,无法得到有效的基因型频率数据;③资料研究涉及动物的研究、摘要或综述。
1.2 检索方法及资料提取
计算机检索PubMed、CNKI、中国知网和万方数据库,检索时限均从建库至2016年1月,纳入已发表的关于HFE基因C28Y与H63D位点突变与肝癌的病例对照研究,检索语种为中文和英文。中文检索词或关键词为“HFE基因”、“肝癌”、“病例对照”。英文检索词为“hemochromatosis gene”或“ HFE”、“polymorphism”或“variant”或“mutation”、“liver cancer”或“carcinoma liver” 。
1.3 文献质量评价
两位评价者采用卡斯尔-渥太华量表(The Newcastle-Ottawa scale,NOS)对纳入文献进行质量评价,如有异议,讨论解决。分别针对研究人群选择、组间可比性和暴露因素这三方面进行评分,评分大于6分为高质量文献(见表3)。
1.4 统计分析
应用RevMan 5.0软件对HFE基因突变与肝癌的关系进行Meta分析,以比值比(OR)为效应指标,计算OR的合并值及95%可信区间。对各个独立研究的OR进行异质性检验,各研究间具有同质性,应用固定效应模型进行合并分析;反之用随机效应模型进行合并分析。由RevMan 5.0软件自动生成倒漏斗图,研究文献的发表偏倚,若漏斗图对称说明发表偏倚可能性较小。所有数据均为双侧检验,P<0.05为有统计学意义。
2 结果
2.1 文献检索结果及纳入研究的基本特征
按照检索策略中的关键词检索出106篇文章,通过评估文献全文,最终有14篇文献符合入选标准。纳入文献均为病例对照研究,C282Y研究组共纳入病例组2418人,对照组9022人,将YY定义为突变型纯合子,CC定义为野生型纯合子,CY为突变型杂合子;H63D研究组病例组2208人,对照组6170人,将DD定义为突变型纯合子,HH定义为野生型纯合子,HD为突变型杂合子。纳入研究基本特征见表1、表2。此外,纳入文献质量评价结果多为9分和8分,有3篇文献为7分,都大于6分,均为高质量文献。
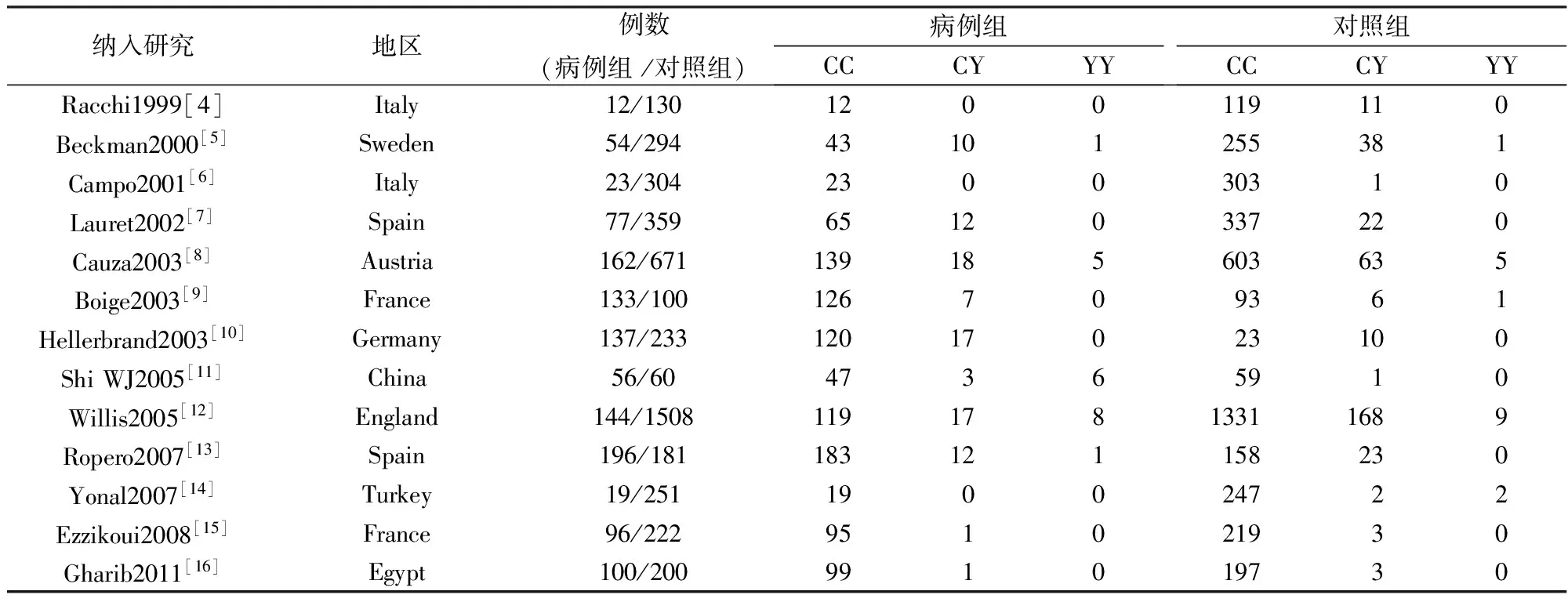
表1 C282Y研究组纳入研究的基本特征
2.2 Meta分析结果
C282Y研究组中等位基因(C vs Y)OR合并值为1.58,95%CI(1.06,2.33),见图1。同时纳入的14篇文献均对基因分型进行了分层研究,对数据合并后进行Meta分析,结果表明与携带CC基因型人群相比,携带YY基因型(YY vs CC)的OR合并值为5.71,95%CI(2.81,11.62),见图2,携带CY基因型(CY vs CC)的OR合并值为1.33,95%CI(0.91,1.96),携带YY或CY基因型(CY+YY vs CC)的OR合并值为1.49,95%CI(1.00,2.20)。携带隐性基因型YY与另外两种基因型(YY vs CC+CY)相比,OR合并值为5.71,95%CI(2.81,11.38),图略。在H63D研究组中,对等位基因进行的Meta分析中(D vs H)OR合并值为1.22,95%CI(0.94,1.58)。对基因型进行的亚组分析中突变纯合子与野生型相比(DD vs HH)OR为1.66,95%CI(0.81,3.40),突变杂合子与野生型相比(DH vs HH)OR为1.28,95%CI(0.99,1.67),突变基因型与野生型相比(DD+DH vs HH)OR为突变纯合子与野生型相比(DD vs HH)OR为1.26,95%CI(0.95,1.68),隐性基因型DD与其他两型相比(DD vs DH+HH)OR为1.55,95%CI(0.80,3.02)。结果表明C282Y研究组中,突变基因的表达是肝癌发生的危险因素,隐性基因型YY的表达也大大增加了肝癌发生的风险。
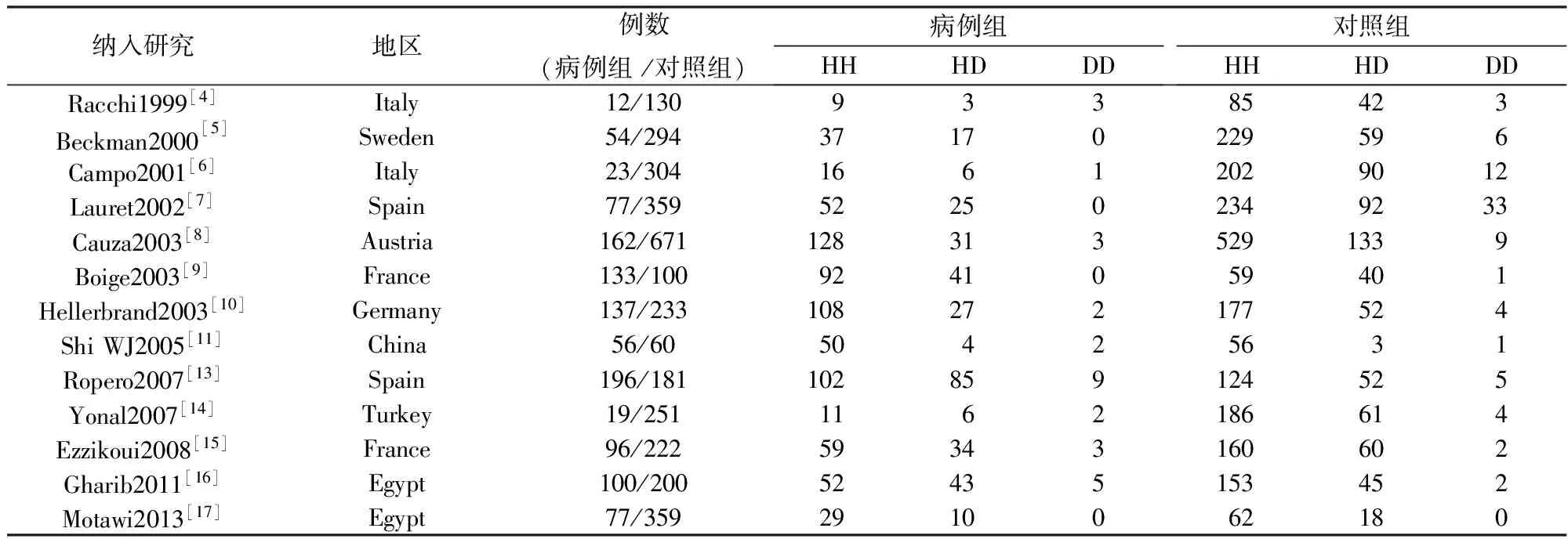
表2 H63D研究组纳入研究的基本特征
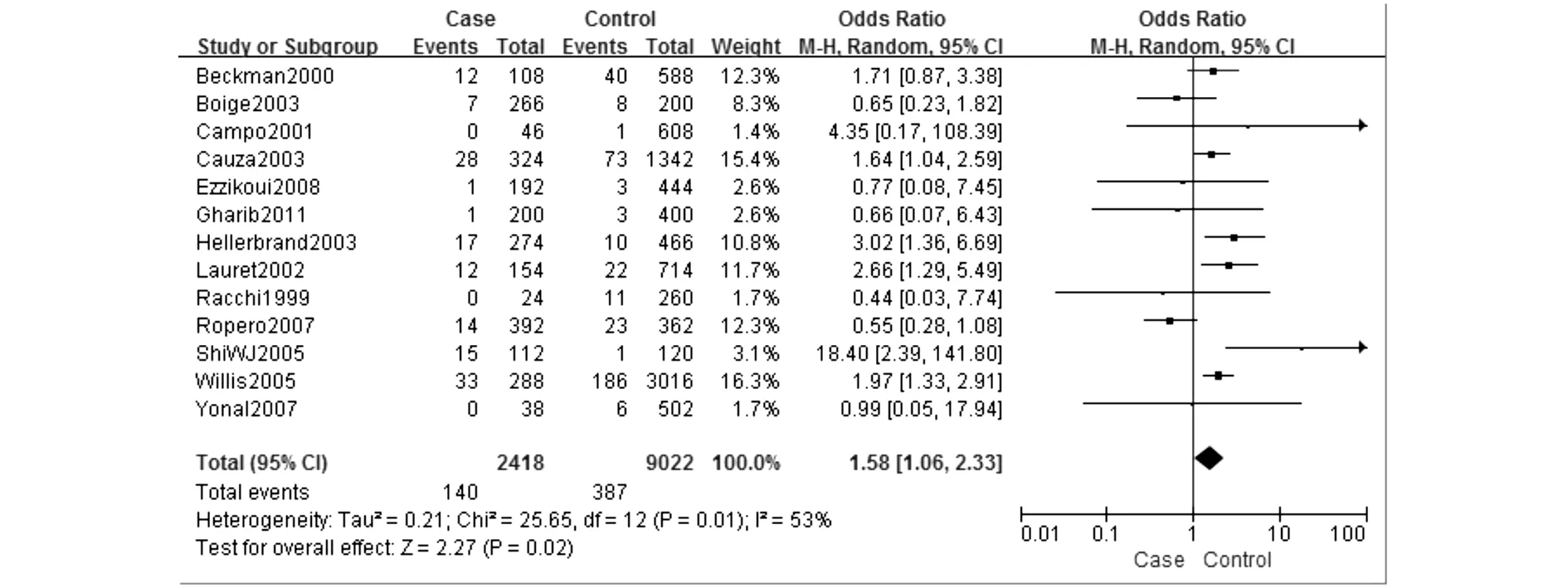
图1 C282Y 等位基因与肝癌的关联性分析(等位基因 Y vs C)
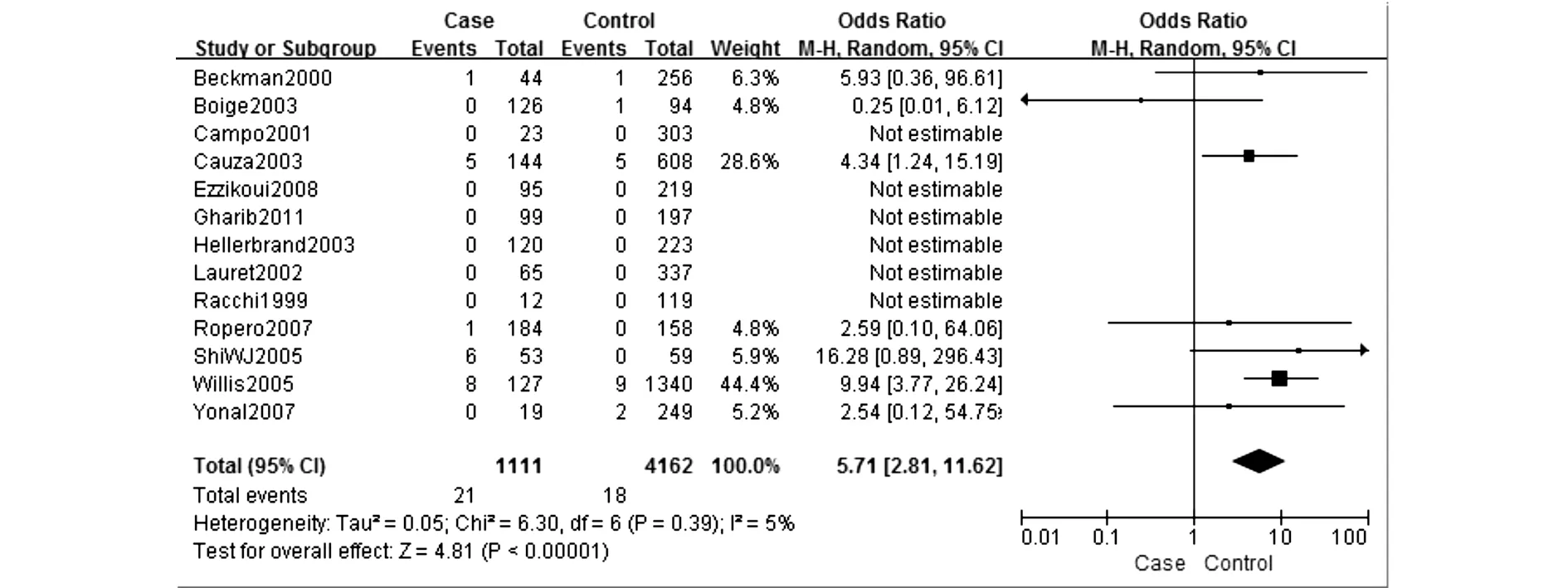
图2 C282Y 基因型与肝癌的关联性分析(纯合子基因型 YY vs CC)
2.3 发表偏移与漏斗图分析
应用RevMan 5.0软件进行漏斗图分析,各漏斗图大致对称,各对应点位于95%CI内,未见明显发表偏倚。
3 讨论
HFE主要在肝脏中表达,通过编码细胞膜蛋白调节铁蛋白与转铁蛋白受体进而调节铁的吸收,当血浆铁水平比较低的时候,HFE与转铁蛋白竞争结合转铁蛋白受体1(TfR1) ,使细胞摄取铁的水平下降 。相反,当转铁蛋白饱和度增加时,HFE竞争TfR1的能力下降,从而稳定TfR2[18-20]。此时,TfR1与血浆中转铁蛋白结合,促进铁的摄取,当转铁蛋白与TfR1结合的同时释放出的HFE与 TfR2结合,从而增加肝铁调素转录合成与分泌,负性调节小肠铁的吸收[21]。研究表明铁作为一种流行因素的致癌作用存在两种机制,一种为铁诱导氧化应激,另一种为在癌症细胞的增长过程中,铁是一个重要的辅助因子。对于HFE基因突变是否增加肝细胞癌发病风险的研究存在争议,分析原因可能是样本容量过小,因此我们通过文献检索进行Meta分析,比较全面的分析HFE基因与肝癌的关系。
本次Meta分析表明,携带C282Y纯合子基因型YY的个体患肝癌的风险是携带野生型CC的5.71倍,隐性基因Y的表达增加患肝癌的风险,而携带H63D纯合子基因型、杂合子基因型或者C282Y杂合子基因型的个体患肝癌的风险都没有明显增加。这可能与C282Y和H63D对铁吸收的调控作用不同有关。H63D可以与TfR1结合,但是对转铁蛋白和转铁蛋白受体的亲和力没有显著的影响 ,而C282Y则既可与TfR1结合,又能影响转铁蛋白和转铁蛋白受体的亲和力。综上研究结果提示,肝癌发病与HFE基因上的C282Y突变密切相关,而二者之间的关联可能是由于铁过载引起的,即可能存在这样的链式反应:C282Y突变—铁吸收增加—铁过载—肝癌。
尽管我们比较全面的分析了HFE基因突变与肝癌发病风险的关系,但是研究还是存在一定的局限性及不足。首先本次研究大多涉及的是欧洲的白种人,而包含的亚洲人较少,因此本次分析采用的人群遗传背景相对单一,其次大多数研究涉及到原始资料如吸烟、饮酒频率,居住环境等相对较少,因此我们不能评估基因与基因或基因与环境间的协同效应。所以在今后还需要更多的临床研究加以证实,以期得到更具有说服力的结果。
[1]王玉平,成建国,孙蔚明,等.遗传性血色病突变基因与糖代谢紊乱的关系研究[J].兰州大学学报(医学版),2015,41(1):29.
[2]Weinberg ED.The role of iron in cancer[J].Eur J Cancer Prev,1996,5:19.
[3]Okada S.Iron-induced tissue damage and cancer:therole of reactive oxygen species-free radicals[J].Pathol Int,1996,46:311.
[4]Racchi O,Mangerini R,Rapezzi D,et al.Mutations of the HFE gene and the risk of hepatocellular carcinoma[J].Blood Cells,Molecules,and Diseases,1999,25(5-6):350.
[5]Beckman L E,Hagerstrand I,Stenling R,et al.Interaction between haemochromatosis and transferrin receptor genes in hepatocellular carcinoma[J].Oncology,2000,59(4):317.
[6]Campo S,Restuccia T,Villari D,et al.Analysis of haemochromatosis gene mutations in a population from the Mediterranean Basin[J].Liver,2001,21(4):233.
[7]Lauret E,Rodriguez M,Gonzalez S,et al.HFE gene mutations in alcoholic and virus-related cirrhotic patients with hepatocellular carcinoma[J].American Journal of Gastroenterology,2002,97(4):1016.
[8]Cauza E,Peck-Radosavljevic M,Ulrich-Pur H,et al.Mutations of the HFE gene in patients with hepatocellular carcinoma[J].American Journal of Gastroenterology,2003,98(2):442.
[9]Boige V,Castera L,de Roux N,et al.Lack of association between HFE gene mutationsand hepatocellular carcinoma in patients with cirrhosis[J].Gut,2003,52(8):1178.
[10]Hellerbrand C,Poppl A,Hartmann A,et al.HFE C282Y heterozygosity in hepatocellular carcinoma:Evidence for an increased prevalence[J].Clinical Gastroenterology and Hepatology,2003,1(4):279.
[11]Shi W J,Chen H,Zhou B,et al.Association of mutations of HFE gene and hepatocellular carcinoma following chronic hepatitis[J].Zhonghua Gan Zang Bing Za Zhi 2005,13(9):682.
[12]Willis G,Bardsley V,Fellows I W,et al.Hepatocellular carcinoma and the penetrance of HFE C282Y mutations:A cross sectionals study[J].BMC Gastroenterology,2005,5(7):1.
[13]Ropero P,Briceno O,Lopez Alonso G,et al.The H63D mutation of the HFE gene is related to the risk of hepatocellular carcinoma[J].Revista Espanola de Enfermedades Digestivas,2007,99(7):376.
[14]Yonal O,Hatirnaz O,Akyuz F,et al.HFE gene mutation,chronic liver disease,and iron overload in Turkey[J].Digestive Diseases and Sciences,2007,52(11):3298.
[15]Ezzikouri S,El Feydi A E,El Kihal L,et al.Prevalence of Common HFE and SERPINA1 Mutations in Patients with Hepatocellular Carcinoma in a Moroccan Population[J].Archives of Medical Research,2008,39(2):236.
[16]Amal F Gharib,Rehab A Karam,Heba F Pasha,et al.Polymorphisms of hemochromatosis,and alpha-1 antitrypsin genes in Egyptian HCV patients with and without hepatocellular carcinoma[J].Gene,2011,489:98.
[17]Tarek Kamal Motawi,Olfat Gamil Shaker,Manal Fouad Ismail,et al.Genetic variants associated with the progression of hepatocellular carcinoma in hepatitis C Egyptian patients[J].Gene,2013:516.
[18]Giannetti AM,Bjorkman PJ.HFE and transferrin directly compete for transferrin receptor in solution and at the cell surface[J].Biol Chem,2004,279:25866.
[19]Johnson MB,Enns CA.Diferric transferrin regulates transferrin receptor 2 protein stability[J].Blood,2004,104:4287.
[20]Robb A,Wessling-Resnick M.Regulation of transferrin receptor 2 protein levels by transferrin[J].Blood,104:4294.
[21]Andrews N C,Schmidt P J.Iron homeostasis[J].Annu Rev Physiol,2007,69:69.
Association between C282Y and H63D Polymorphisms in HFE and liver cancer:A Meta-Analysis
LITong,LIShi-meng,LIUShuo,etal.
(China-JapanUnionHospitalofJilinUniversity,Changchun130033,China)
Objective To explore the association between C282Y and H63D Polymorphisms in HFE and liver cancer.Methods PubMed,CNKI and WanFang database were searched for all eligible studies up to January,2016.In accordance with the inclusion and exclusion criteria,we screened the articles,extracted the data and evaluated the quality.All the statistical analysis was conducted by RevMan 5.0.Results Finally 14 publications were included.There are 2,481 cases and 9,022 controls for HFE-C282Y polymorphism and 2,208 cases and 6,170 controls for HFE-H63D polymorphism .The meta-analysis showed that,An increased risk for liver cancer risk was identified in HFE-H63D polymorphism under allele contrast(C vs Y) :OR=1.58,95%CI(1.06,2.33).Then we made subgroup analyses about genotype,Comprising with wild type(CC),homozygotes led to increased tumor risk (YY vs CC):OR= 5.71,95%CI(2.81,11.62).Moreover,reccesive model is also an risk factor for liver cancer (YY vs CC+CY) :OR=5.71,95%CI(2.81,11.38).Conclusion Present study suggested that C282Y polymorphisms associated with an increased risk of liver cancer.
liver cancer;HFE;case-control study;Meta-analysis
1007-4287(2016)12-2020-05
R735.7
A
2016-04-18)

