斜带石斑鱼卷轴受体3基因的分离及表达分析研究❋
陈华谱, 李 臻, 邓思平, 朱春华, 李广丽❋❋, 钟鸿干
(1.广东海洋大学水产学院,海洋生态与养殖环境湛江市重点实验室,广东 湛江 524088;2.三亚市海洋与渔业监测中心,海南 三亚 572000)
研究简报
斜带石斑鱼卷轴受体3基因的分离及表达分析研究❋
陈华谱1, 李 臻1, 邓思平1, 朱春华1, 李广丽1❋❋, 钟鸿干2
(1.广东海洋大学水产学院,海洋生态与养殖环境湛江市重点实验室,广东 湛江 524088;2.三亚市海洋与渔业监测中心,海南 三亚 572000)
利用cDNA末端快速扩增技术(Rapid amplification of cDNA ends,RACE)克隆鉴定出斜带石斑鱼(Epinepheluscoioides)卷轴受体3(Frizzled 3,gFZD3)基因的cDNA序列全长,使用ClustalX(1.81)和MEGA4.0软件分别进行了序列同源比对和系统进化树分析;利用RT-PCR检测gFZD3在成鱼不同组织中的表达和gFZD3在胚胎发育及卵巢发育过程中的表达模式。研究显示:gFZD3 cDNA序列全长为2278bp,其中开放读码框为2079bp,编码692个氨基酸;序列同源性分析表明,gFZD3的氨基酸序列具有FZD家族保守的功能结构域;脊椎动物的FZD3系统进化树分析显示,斜带石斑鱼与大黄鱼(Larimichthyscrocea)的亲缘关系最近;在成鱼的组织分布中,只在脑区和性腺中检测到gFZD3表达信号,其中在卵巢中表达量最高;在胚胎发育过程中,在未受精卵和受精卵中gFZD3的表达量最高,随着胚胎的发育呈逐渐下降趋势;在卵巢发育过程中,gFZD3的表达在早期卵巢中相对较低,在随后的III和IV期卵巢中较高。研究结果表明,FZD3序列在脊椎动物中具有较高的保守性;斜带石斑鱼gFZD3的表达具有明显的组织特异性,并在胚胎和卵巢发育中,可能主要作用于胚胎发育的早期和卵巢发育的后期。本研究为进一步研究Wnt信号通路在斜带石斑鱼生殖调控中的作用提供了参考。
斜带石斑鱼;卷轴受体3基因;胚胎发育;卵巢发育;RT-PCR
Wnt(Wingless-type MMTV integration site family member)信号在细胞增殖、分化和凋亡等重要的生命活动过程中发挥着十分重要的调节作用[1-2]。目前,Wnt信号通路在性别分化与卵巢发育中的生理功能越来越受到关注。其中,Wnt4(Wingless-type MMTV integration site family member 4)作为Wnt家族中与性别及生殖调控最相关的成员,已被广泛研究[3-6]。研究发现,Wnt4主要通过参与调控缪勒氏管及其派生器官的形成,抑制雄性结构的发育,促进雌性性腺的正常发育,从而成为了重要的雌性调节因子[3-4]。另外,Wnt4的缺失会导致雌性到雄性的性逆转[5-6]。近年来,Wnt信号通路在鱼类性别调控与性腺发育中的研究也相继展开。研究表明,在黑鲷(Sparusmacrocephlus)中Wnt4参与了黑鲷雄到雌性逆转的调控[7],在虹鳟(Oncorhynchusmykiss)中Wnt4和哺乳类一样,在早期的性腺发育中发挥着十分重要的作用[8]。目前,Wnt信号通路已被证实在性别与生殖调控中具有十分重要的作用,但其确切的信号通路尚不清楚,可能是由于Wnt信号分子的受体—卷轴受体FZD(Frizzled)种类繁多,信号调控错综复杂,导致通路难以鉴定[4]。
Wnt信号通路发现30多年来,研究热点主要还是在配体Wnt信号分子上,而对Wnt信号通路中的真正传导与执行者—FZD受体的研究相对较少。因此,阐明Wnt信号通路的分子机制,务必要深入开展受体FZD的研究。FZD基因最早是在果蝇(Drosophilamelanogaster)中被发现。该基因的突变能破坏成年果蝇表皮细胞的极性[9-10]。目前,在哺乳动物中已发现10种FZD基因亚型[4],而在斑马鱼(Daniorerio)中,通过NCBI数据库搜索,只预测到9种FZD亚型。
哺乳类和鱼类的FZD基因序列结构差异较大,可能会导致其生理功能的差异。因此,开展鱼类FZD受体的研究,对Wnt信号通路的研究有重要的补充作用。FZD3属于FZD家族成员之一,在早期神经系统发育和色素细胞形成过程中具有十分重要的作用[11-12],同时被作为神经类疾病的标记而受到广泛的关注[13-14]。在鱼类中,研究已表明FZD3对斑马鱼端脑和眼睛等器官的发育具有重要的调节功能[15-16],但在其他组织中的生理功能尚无研究。
斜带石斑鱼(Epinepheluscoioides)是一种雌雄同体、先雌后雄鱼类,但其性别调控的机制尚未清楚。斜带石斑鱼这种特别的生殖调控及性腺发育方式使其成为了研究性别调控与雌性发育的理想模型[17]。本研究以我国南方重要的海水养殖鱼类斜带石斑鱼为研究对象,利用cDNA末端快速扩增技术(Rapid amplification of cDNA ends,RACE)的方法克隆斜带石斑鱼Frizzled 3(gFZD3)基因的cDNA序列全长,并开展了序列分析。同时,检测gFZD3基因在斜带石斑鱼成鱼中各组织、不同胚胎及卵巢发育时期的表达模式。本研究初步探讨了斜带石斑鱼gFZD3基因的表达模式,为后续研究Wnt信号通路在斜带石斑鱼生殖调控中的功能提供理论参考。
1 材料与方法
1.1 材料
1.1.1 实验鱼 斜带石斑鱼雌性成鱼活体(体长(36.00±3.00)cm;体重(1.40±0.20) kg;数量为3条)购自广东省湛江市东风市场。将嗅球、端脑、中脑、小脑、延脑、下丘脑、垂体、肝脏、卵巢、心脏、肾脏、脾脏、胃、肠、鳃和肌肉等组织器官取出后立即置于液氮中,并保存在-80℃超低温冰箱备用;卵巢发育样本取于海南陵水养殖基地。从1龄斜带石斑鱼(体长(13.00±1.50)cm)开始,到第二年4月(2龄,体长(25.00±2.00)cm)和第三年4月(3龄,体长(38.00±3.00)cm)连续跟踪取样3次。取样时,先将实验鱼置于含丁香酚(30mg/L)的海水中深度麻醉,然后取出部分卵巢,置于冻存管中,液氮保存,同时取出一小块卵巢置于波恩试液中固定过夜,然后石蜡组织超薄切片及苏木素伊红染色。每次取10条鱼样本,并根据卵巢的组织学特征进行分析与归类[15]。
1.1.2 胚胎样本 斜带石斑鱼胚胎收集于海南陵水养殖基地。首先,挑选健康和成熟度较好的斜带石斑鱼亲鱼提前一天进行人工催产,并通过人工挤卵,获得未授精卵,并取大约50粒上浮的活卵于洁净的冻存管中,置于液氮保存。然后,利用湿法人工授精的方法获得斜带石斑鱼受精卵,并置于水温25~28℃、盐度30的孵化池中进行孵化,同时在体视显微镜下连续观察与取样。根据胚胎发育不同时期的形体特征[18],分别取样,包括受精卵、细胞期、4细胞期、8细胞期、16细胞期、32细胞期、多细胞期、桑葚期、囊胚期、原肠期、胚体形成期、视囊形成期、肌节形成期、听囊形成期、脑泡形成期、心脏形成期、尾芽形成期、心脏跳动和晶体形成期和将孵期,每个时期取大约50个胚胎于冻存管,并由液氮冻存备用。胚胎发育时期的样本共取样3个批次(n=3)。
1.2 方法
1.2.1 引物 根据NCBI网站中GENBANK的鱼类与其他脊椎动物FZD3基因cDNA序列的保守部分,设计克隆斜带石斑鱼gFZD3基因的简并引物。引物见表l。

表1 斜带石斑鱼gFZD3基因克隆与定量RT-PCR分析所用引物
Note: ①Partail cDNA PCR; ②Adaptor Primers; ③ORF PCR; ④Tissue distribution PCR and quantitative RT-PCR
1.2.2 总RNA的提取 从-80℃超低温冰箱取超低温冻存的样本,采用注射器抽提或液氮研磨方法进行组织捣碎匀浆。总RNA提取参照Trizol ® reagent (Invitrogen, USA)试剂盒说明书操作。总RNA提取后,利用紫外分光光度计进行浓度和纯度检测,最后吸取1μg总RNA进行0.8%的琼脂糖凝胶电泳分析,检测RNA的完整性。
1.2.3 基因克隆与序列分析 利用卵巢和全脑的总RNA混合样本作为合成第一链cDNA的模板,根据Smart-RCAE试剂盒(Clontech Takara,Japan)说明书,合成gFZD3基因5’端和3’端的第一链cDNA,并克隆获得gFZD3的cDNA序列全长。利用DNAtools 6.0软件将获得的gFZD3序列进行预测并翻译成相应的氨基酸序列。采用DNASTAR软件对脊椎动物不同物种的FZD3序列进行同源性比较。利用SignalIP 3.0网站上预测基因的信号肽,用TMHMM Server v. 2.0预测分析蛋白的跨膜区。以Mega 4.0的邻位相邻法构建蛋白的系统进化树[19-20]。
1.2.4 组织分布 吸取各个组织1μg总RNA,经DNaseⅠ处理之后,按照First Strand cDNA Synthesis Kit ReverTra Ace-α(TOYOBO, Japan)的说明书进行cDNA第一链合成。其后利用斜带石斑鱼FZD3的特异引物(gFZD3-QF和gFZD3-QR)进行各组织的基因表达PCR检测。PCR反应体系为20μL,反应条件为预变性94℃ 3min,变性94℃ 30s,退火58℃ 30s,延伸72℃ 30s,40个循环后72℃延伸10min。18s(18s ribosome RNA)基因作为内参。吸取5μL的扩增产物进行1.5%琼脂糖凝胶电泳,用天能Tanon 2500R全自动数码凝胶成像分析系统进行半定量表达分析。
1.2.5实时荧光定量RT-PCR分析 将斜带石斑鱼gFZD3和18s特异引物克隆获得的特异基因片段,分别连接插入T载体中,构建质粒DNA标准样品,经转化、质粒提取后,再将质粒逐级稀释,构建质粒标准曲线。参照SYBR®Green Realtime PCR Master Mix(TOYOBO, Japan)试剂盒说明书准备反应体系,利用RocheLight Cycler 480 real time PCR system进行基因表达的检测。具体反应程序为:首先95℃预变性1min;95℃变性5s,57℃退火10s,72℃延伸20s,84℃收集荧光10s,共40个循环;溶解曲线:95℃ 1min,52℃ 1min,95℃继续。每个样品3次重复,每次重复均用标准曲线定量出相对应的域值(Cp)和cDNA拷贝数。目的基因相对表达量以平均值±标准差表示,数据分析采用SPSS统计分析。
2 结果与分析
2.1 斜带石斑鱼gFZD3 cDNA的克隆和序列分析
斜带石斑鱼gFZD3的cDNA全长序列长2278bp,开放阅读框编码692aa,其中前17个氨基酸残基为信号肽。经Expasy tools预测,gFZD3基因的前体蛋白分子量约为78.0 kDa。利用InterProScan对斜带石斑鱼gFZD3氨基酸序列进行分析预测,结果显示gFZD3属于G蛋白偶联型受体蛋白家族,胞外N-末端是一个富含半胱氨酸的结构域(Cysteinyl-rich Domain,CRD),含有13个保守的半胱氨酸,其后是七次跨膜螺旋,胞内部分包括了Loop1、Loop2和Loop3三个环,以及一个C-末端。2个胞外环之间形成了一个二硫键,是由第289位和第364位的半胱氨酸形成的。紧随跨膜螺旋结构后,胞内部分含有一个保守的K-T-X-X-W结构域(见图1)。通过Kyte-Doolittle疏水性分析,gFZD3前体蛋白含有七个疏水性很强的区域,是潜在的跨膜区(见图2)。斜带石斑鱼gFZD3氨基酸序列与大黄鱼的相似性最高,为76.2%,与安乐蜥、非洲爪蟾和小鼠分别为71.5%、69.8%和69.7%。
2.2 斜带石斑鱼gFZD3的系统进化树分析
利用MEGA4.0的邻位相连算法(Neighbor-joining method)构建斜带石斑鱼和其他脊椎动物FZD的系统进化树(见图3)。系统进化树的结果显示,斜带石斑鱼gFZD3与其他脊椎动物FZD3聚为一簇,成为一个独立的进化分支,区别于其他FZD亚型,同时也表明斜带石斑鱼与大黄鱼的亲缘关系最近,与爬行动物蜥蜴以及小鼠、牛、马和人类等哺乳动物的关系较远,符合动物进化地位的分类。
2.3 斜带石斑鱼gFZD3 mRNA在各组织中的表达分布
通过RT-PCR分析斜带石斑鱼gFZD3在成鱼外周组织(肝脏、性腺、心脏、肾脏、脾脏、胃、肠、鳃和肌肉)和脑中(嗅球、端脑、中脑、小脑、延脑、下丘脑、垂体)的表达情况。结果发现,gFZD3广泛表达于各脑区。在外周组织中,gFZD3只在卵巢和精巢中检测到基因的表达信号,并且卵巢中的表达量最高(见图4)。斜带石斑鱼gFZD3在不同组织中的表达显示出明显的组织表达特异性。
2.4 斜带石斑鱼gFZD3基因在胚胎发育中的表达模式分析
实时荧光定量RT-PCR分析结果显示,在斜带石斑鱼未受精卵中,gFZD3 mRNA表达量较高,且在受精后的表达量达到最高。但在随后的2-细胞期和4-细胞期中,表达量显著下降。在4-细胞时期之后,gFZD3的表达量相对较低且没有显著差异,其中在将孵期的表达量最低。纵观整个胚胎发育过程,gFZD3的表达随着胚胎发育的过程,形成一个由高到低的表达趋势(见图5)。
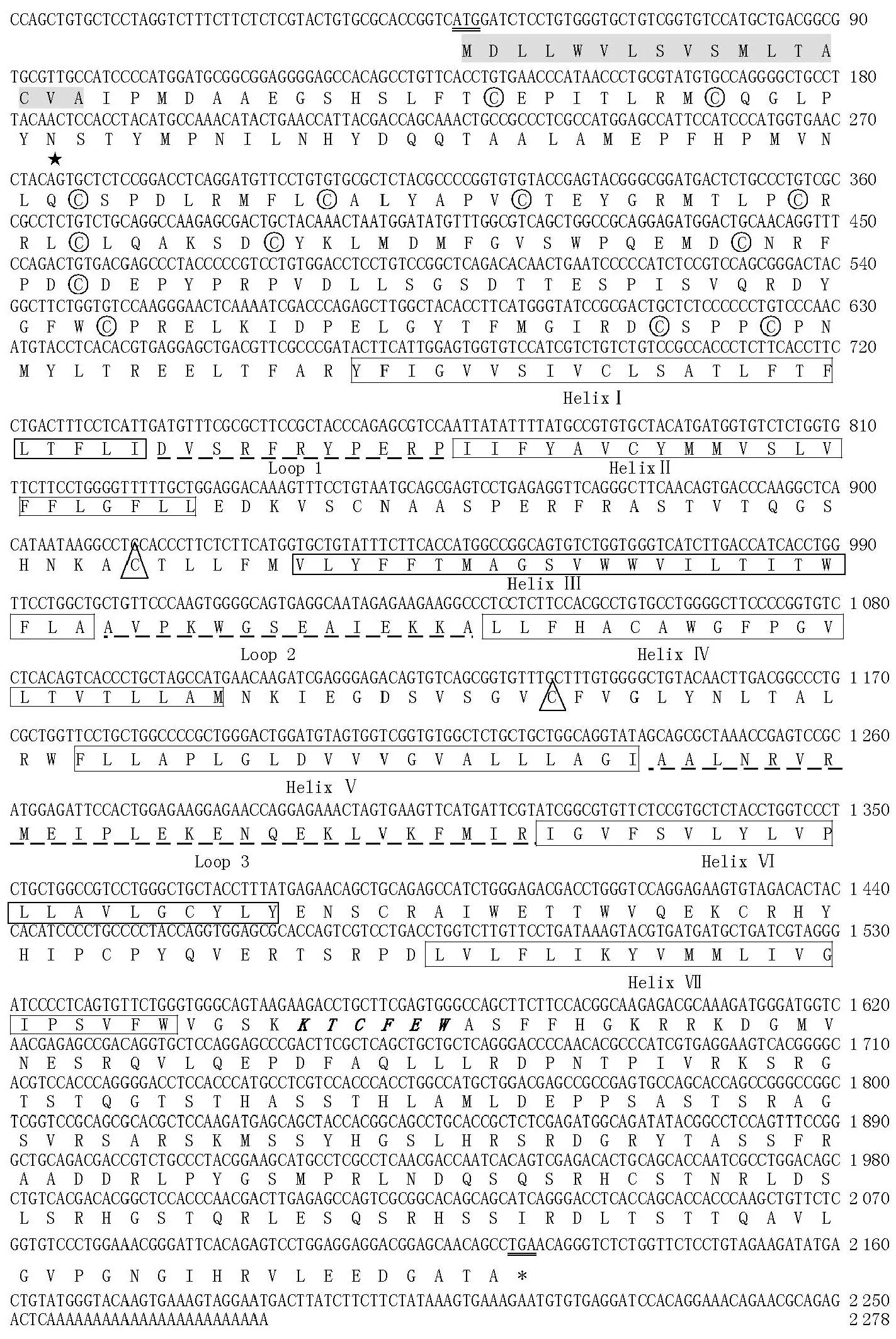
(起始和终止密码子用双下划线表示,信号肽用阴影表示,N-糖基化位点用星号★表示,半胱氨酸丰富区的13个半胱氨酸用外加圆圈表示,7个跨膜螺旋区用方框表示,在胞内环用下划线表示,二硫键的2个半胱氨酸用三角形△标注,参与经典Wnt/β-catenin信号通路的特有结构域用斜粗体表示。Start and stop codons are double underlined; putative signal peptide is shaded, potential N-glycosylation site is indicated by asterisk; thirteen conserved cysteine residues in the CRD domain are marked by circle; seven transmembrane domains are in boxes; the potential particular domain of Frizzled involved in canonical Wnt/β-catenin pathway is in bold italic.)
图1 斜带石斑鱼gFZD3基因cDNA序列及推导的氨基酸序列
Fig.1 Compiled full-lengthgFZD3 cDNA sequence and putative amino acid
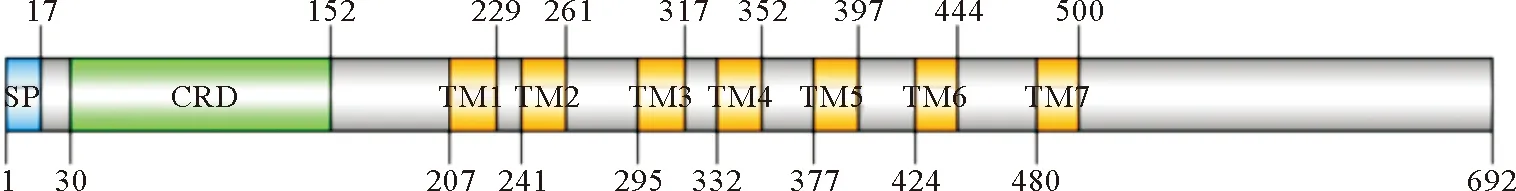
(SP:信号肽;CRD:半胱氨酸丰富区;TM1~TM7:跨膜螺旋1~7。Protein domains of gFZD3.SP: Signal peptide; CRD: Cysteine-rich domain; TM1-TM7: Transmembrane spanning segments.)
图2 斜带石斑鱼gFZD3的蛋白质结构域分析
Fig.2 Analysis of gFZD3 protein domains

(本进化树采用MEGA 4.0软件(邻位相连算法)构建,系统树中结点处数值代表10 000次评估的自举检验置信度, ▲代表斜带石斑鱼。 The phylogenetic tree was constructed by MEGA 4.0 software (the neighbor-joining method) with 10 000 bootstrap replicates. The orange-spotted grouper was marked by “▲” . 人类(Homosapiens):(HoFZD3: NP_059108.1);牛(Bosmutus):(BoFZD3: XP_005900134.1):大鼠(Rattusnorvegicus):(RaFZD3: NP_703204.1):爪蟾(Xenopuslaevis):(XeFZD3:AAI69915.1);青鱂(Oryziaslatipes):(OrFZD3:XP_004083717.1);虹鳟(Oncorhynchusmykiss):(OnFZD3:CDQ59954.1);斑马鱼(Daniorerio):(DaFZD3:NP_001036226.1;ZeFZD1: NM_001130614.1; ZeFZD2:BC056524.1; ZeFZD6: NM_200561.2; ZeFZD7:BC068322.1; ZeFZD8:AF060697.1; ZeFZD9:BC163365.1);半滑舌鳎(Cynoglossussemilaevis):(CyFZD3:XP_008335388.1);大黄鱼(Larimichthyscrocea):(LaFZD3:KKF28197.1);孔雀鱼(Poeciliaformosa):(PoFZD3:XP_007567852.1);丽鱼(Maylandiazebra):(MaFZD3:XP_004542349.1)。
图3 脊椎动物FZD3的系统进化树
Fig.3 Phylogenetic tree construction with FZD3 amino acid sequences
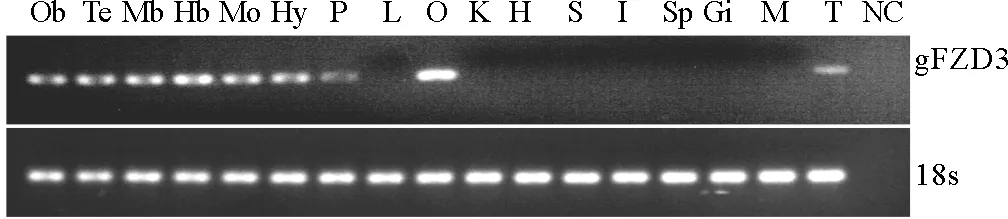
(从左到右依次为:Ob:嗅球;Te:端脑;Mb:中脑;Hb:小脑;Mo:延脑;Hy:下丘;P:垂体;L:肝脏;O:卵巢;K:肾脏;H:心脏;S:胃;I:肠;Sp:脾脏;Gi:鳃;M:肌肉;T: 精巢;NC:阴性对照。18s rRNA基因作为内部参照。n=3。From left to right, Ob: olfactory bulb ; Te: telencephalon; Mb:midbrain; Hb:hindbrain; Mo: medulla oblongata; Hy: hypothalamus; P:pituitary; L:liver; O:ovary; K:kidney; H:heart; S:stomach; I: intestine; Sp:spleen; Gi:gill; M:muscle; T:testis;NC:negative control. 18s rRNA was used as the internal control.n=3.)
图4 RT-PCR分析斜带石斑鱼gFZD3基因的mRNA在不同组织中的表达模式
Fig.4 RT-PCR analysis ofgFZD3 expression in different tissues

(目的基因相对表达量用平均值±标准差表示(n=3),柱形图上的字母的不同表示组间具有显著性差异(P<0.05)。纵坐标代表目的基因的表达量与对应18s的比值,横坐标表示不同的胚胎发育时期,数字1~20分别对应了20个不同的时期:1:未受精卵;2:受精卵;3:2细胞期;4:4细胞期;5:8细胞期;6:16细胞期;7:32细胞期;8:多细胞期;9:桑葚期;10:囊胚期;11:原肠期;12:胚体形成期;13:视囊形成期;14:肌节形成期;15:听囊形成期;16:脑泡形成期;17:心脏形成期;18:尾芽形成期;19:心脏跳动和晶体形成期;20:将孵期。Data is represented as means ± S.E.M. (n=3 pools of animals). For a given gene, groups with different letters are significantly (P<0.05) different.1: Unfertilized eggs; 2:Fertilized eggs; 3:2-cell stage; 4:4-cell stage; 5:8-cell stage; 6:16-cell stage; 7:32-cell stage; 8:Multi-cell stage; 9:Morula stage; 10:Blastula stage; 11: Gastrulation stage; 12: Embryo body stage; 13: Optic capsule appearance; 14: Muslce burl appearance; 15: Otocyst appearance; 16: Brain vesicle appearance; 17: Heart formation stage; 18: Tail-bud appearance; 19: Heart-beating and Crystal formation stage; 20: Pre-hatching stage.)
图5 斜带石斑鱼gFZD3基因在胚胎发育不同时期的表达水平变化
Fig.5 Changes ofgFZD3 mRNA levels during embryonic development.gFZD3 mRNA levels were examined by quantitative real-time RT-PCR
2.5 斜带石斑鱼gFZD3基因在卵巢发育过程中的表达模式
根据石斑鱼雌雄同体先雌后雄的卵巢发育特征,结合本次样本的卵巢切片分析,获得的斜带石斑鱼II、III和IV期卵巢样本:1.II期卵巢—初级卵母细胞(Primary-growth stage oocyte,O1)的卵巢时期;2.III期—皮层小泡形成时期(Cortical-alveolus stage oocyte,O2)的卵巢时期;3.IV期—卵黄形成(Vitellogenic stage oocyte,O3)的卵巢时期(见图6)。实时荧光定量PCR检测斜带石斑鱼gFZD3基因在卵巢发育过程的表达,结果显示斜带石斑鱼gFZD3 mRNA在卵巢发育早期表达量较低,然后随着卵巢的发育,在III期达到最高,在卵黄形成时期中的表达量有所下降,但仍维持在较高的表达水平(见图7)。
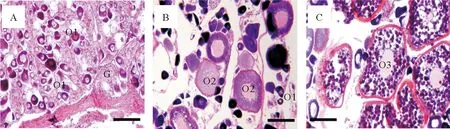
(A.II期—初级卵母细胞时期(Primary-growth stage oocyte,O1)的卵巢时期;B.III期—皮层小泡形成(Cortical-alveolus stage oocyte,O2)的卵巢时期;C.IV期—卵黄形成(Vitellogenic stage oocyte,O3)的卵巢时期。标称为200μm。A. The II ovarian stage with the primary-growth stage oocyte O1;B. The III ovarian stage with the cortical-alveolus stage oocyte O2;C.The IV ovarian stage with the vitellogenic stage oocyte O3. Scale bar=200μm.)
图6 斜带石斑鱼卵巢的发育组织切片图
Fig.6 Photomicrograph of ovarian development in orange-spotted grouper
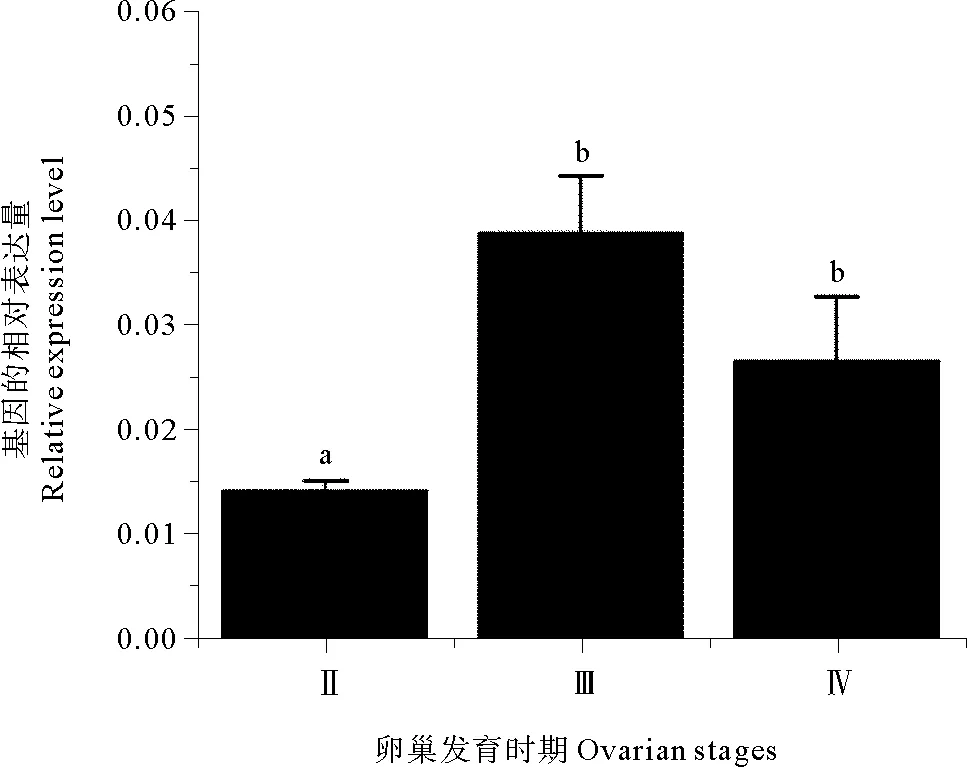
(上标不同的字母表示组间的显著性差异(P<0.05,n=5)。Data is represented as means±S.E.M. For a given gene, groups with different letters are significant different (P<0.05,n=5).)
图7 斜带石斑鱼gFZD3基因在卵巢发育过程中的表达情况
Fig.7 Changes ofgFZD3 mRNA levels during ovarian development
3 讨论
斜带石斑鱼gFZD3的氨基酸序列比对分析表明,FZD3基因在脊椎动物中具有较高的保守性。斜带石斑鱼gFZD3与其他物种的FZD一样,均属于G蛋白偶联型受体蛋白家族,并具有该家族成员保守的分子结构和功能区[4,21]。斜带石斑鱼gFZD3的氨基酸序列均含有K-T-X-X-W结构域,该胞内结构域是Frizzled蛋白参与Wnt/β-Catenin经典信号通路必需的特异结构域[21-22],因此,斜带石斑鱼gFZD3基因可能参与Wnt/β-Catenin经典信号通路转导。另外,斜带石斑鱼gFZD3在膜内侧的肽链C-末端没有S/T-X-V域,而在其他FZD亚型中含有此结构域[23]。S/T-X-V域能够与带有PDZ结构域的蛋白发生相互作用,介导Wnt非经典信号通路,比如蓬乱蛋白(Dishevelleds,Dsh)[24-25]。斜带石斑鱼gFZD3缺失该功能结构域,表明斜带石斑鱼gFZD3可能不参与Wnt非经典信号通路的传导,其信号通路的介导主要通过Wnt经典的信号通路来发挥调控作用。
斜带石斑鱼gFZD3的在不同组织中的表达结果与先前的研究报道相似[15-16]。gFZD3在神经系统中的广泛表达,表明gFZD3在神经系统中具有保守的调控生理功能。有趣的是,除了中枢神经系统组织外,gFZD3均在卵巢和精巢中均有表达。从中表明gFZD3除在神经系统中具有生理功能外,在性腺发育中同样具有潜在作用。在虹鳟和黑鲷的研究中已表明,Wnt信号通路在鱼类性腺发育及性别调控中具有十分重要的生理调节功能,但这些结果均基于Wnt信号通路的配体分子的研究来推断,对受体FZD的介导功能研究尚未清楚。已有研究报道,gFZD3在性腺中的表达具有明显的性别差异,在卵巢中的表达比在精巢中更显著。在牙鲆(Paralichthysolivaceus)、剑尾鱼(XiphophorusMaculatus)和褐菖鲉(Sebastiscusmarmoratus)等鱼类的性腺转录组分析中发现FZD3在卵巢中的表达显著高于精巢[26-28]。这预示了FZD3介导的Wnt信号通路在雌性性腺发育中的作用可能更加显著。
斜带石斑鱼gFZD3随胚胎发育呈现逐渐下降的趋势,表明斜带石斑鱼gFZD3主要作用于胚胎发育的早期。细胞极化对胚胎细胞的分化及形态建成具有十分重要的作用[7]。已有研究表明,FZD3在早期胚胎及表皮细胞的极化中具有重要的调控作用[23]。在斜带石斑鱼中,gFZD3在胚胎发育早期的高表达,也可能与细胞的极化相关。另外,斜带石斑鱼gFZD3在未受精卵中的具有较高的表达量,这可能来自母源供给,作用于受精之后的胚胎,保障胚胎的正常发育。在斜带石斑鱼卵巢发育过程中,斜带石斑鱼gFZD3基因主要在III和IV期卵巢中高表达,提示了斜带石斑鱼gFZD3可能主要作用于卵巢发育的后期。另外,结合斜带石斑鱼gFZD3基因在胚胎发育过程中的表达情况。在未受精卵中,gFZD3表达量较高,因此,gFZD3在卵巢后期的高表达,可能也是为早期的胚胎发育提供母源性的gFZD3积累。
4 结语
本研究首次从斜带石斑鱼中克隆鉴定了卷轴受体gFZD3的cDNA序列全长,并开展了斜带石斑鱼gFZD3的序列分析。结果表明,斜带石斑鱼gFZD3与其他物种的FZD类似,都属于G蛋白偶联型受体蛋白家族,并具有保守的分子结构和功能区。由于斜带石斑鱼gFZD3在膜内侧的肽链C-末端缺少S/T-X-V域,因此推测斜带石斑鱼gFZD3可能不介导Wnt/β-Catenin非经典信号通路。斜带石斑鱼gFZD3组织分布的结果表明了gFZD3具有明显的组织表达特异性,并预示了斜带石斑鱼gFZD3除在神经系统中具有传统生理功能外,可能在性腺发育中同样具有重要的生理功能,特别是在卵巢的发育。另外,检测了斜带石斑鱼gFZD3在胚胎发育过程中的表达模式,结果表明斜带石斑gFZD3可能主要作用于胚胎发育的早期,其中gFZD3 mRNA可能主要是母源性的积累。根据斜带石斑鱼gFZD3基因在卵巢发育过程的表达模式,该基因主要作用于卵巢发育的后期。但gFZD3在卵巢发育后期的高表达,是卵子本身需要还是后续早期胚胎发育的需要,目前尚未清楚。本文开展了斜带石斑鱼gFZD3基因的cDNA序列克隆鉴定及相关表达模式的研究,将对Wnt信号通路在性腺发育中的功能阐明进一步补充和完善。
[1] Cadigan K M, Nusse R. Wnt signaling: A common theme in animal development [J]. Genes Dev, 1997, 11(24): 3286-3305.
[2] Nusse R. Wnt signaling in disease and in development [J]. Cell Research, 2005, 15(1): 28-32.
[3] Katoh M. Wnt signaling pathway and stem cell signaling network [J]. Clin Cancer Res, 2007, 13(14): 4042-4045.
[4] Dijksterhuis J P, Petersen J, Schulte G. WNT/Frizzled signalling: Receptor-ligand selectivity with focus on FZD-G protein signalling and its physiological relevance: IUPHAR Review 3 [J]. Br J Pharmacol, 2014, 171(5): 1195-209.
[5] Biason-Lauber A, Konrad D, Navratil F, et al. A WNT4 mutation associated with Mullerian-duct regression and virilization in a 46 XX woman [J]. N Engl J Med, 2004, 351(8): 792-798.
[6] Vainio S, Heikkila M, Kispert A, et al. Female development in mammals is regulated by Wnt-4 signaling [J]. Nature, 1999, 397(6718): 405-409.
[7] Wu G C, Chang C F. Wnt4 Is Associated with the Development of Ovarian Tissue in the Protandrous Black Porgy,Acanthopagrusschlegeli[J]. Biol Reprod, 2009, 81(6): 1073-1082.
[8] Nicol B, Guerin A, Fostier A, et al. Ovary-Predominant wnt4 expression during gonadal differentiation is not conserved in the rainbow trout (Oncorhynchusmykiss) [J]. Mol Reprod Dev, 2012, 79(1): 51-63.
[9] Adler P. Planar signaling and morphogenesis inDrosophila[J]. Dev Cell, 2002, 2(5): 525-553.
[10] Wang Y, Macke J P, Abella B S, et al. A large family of putative transmembrane receptors homologous to the product of theDrosophilatissue polarity gene frizzled[J]. J Biol Chem, 1996, 271(8): 4468-4476.
[11] Shi O Y, Yang H Y, Shen Y M, et al. Polymorphisms in FZD3 and FZD6 genes and risk of neural tube defects in a northern Han Chinese population [J]. Neurol Sci, 2014, 35(11): 1701-1706.
[12] Chang C H, Tsai R K, Tsai M H, et al. The roles of Frizzled-3 and Wnt3a on melanocyte development: in vitro studies on neural crest cells and melanocyte precursor cell lines [J]. J Dermatol Sci, 2014, 75(2): 100-108.
[13] Kishimoto M, Ujike H, Okahisa Y, et al. The Frizzled 3 gene is associated with methamphetamine psychosis in the Japanese population [J]. Behav Brain Funct, 2008, 4(1): 1-7.
[14] Hofmeister W, Devine C A, Rothnagel J A, et al. Frizzled-3a and slit2 genetically interact to modulate midline axon crossing in the telencephalon [J]. Mech Dev, 2012, 129(5-8): 109-124.
[15] Wang Y K, Samos C H, Peoples R, et al. A novel human homologue of the Drosophila frizzled wnt receptor gene binds wingless protein and is in the Williams syndrome deletion at 7q11. 23 [J]. Hum Mol Genet, 1997(6): 465-472.
[16] Liu H, Mohamed O, Dufort D, et al. Characterization of Wnt signaling components and activation of the Wnt canonical pathway in the murine retina[J]. Dev Dyn, 2003, 227(3): 323-334.
[17] Liu M, Mitcheson Y S. Gonad development during sexual differentiation inhatchery-produced orange-spotted grouper (Epinepheluscoioides) and humpback grouper (Cromileptesaltivelis) (Pisces: Serranidae, Epinephelinae) [J]. Aquaculture, 2009, 287(1-2): 191-202.
[18] 周立斌, 邓妹芳, 张海发, 等. 斜带石斑鱼亲鱼培育和胚胎发育的研究[J]. 惠州学院学报, 2006, 26(6): 36-41. Zhou L, Deng M, Zhang H, Liyfu Y, et al. Study on brood stock culture and embryonic development ofEpinepheluscoioides[J]. Journal of Huizhou University, 2006, 26(6): 36-41.
[19] Thompson J D, Higgins D G, Gibson T J, et al. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position specific gap penalties and weight matrix choice [J]. Nucleic Acids Res, 1994, 22(22): 4673-4680.
[20] Kumar S, Tamura K, Nei M, et al. MEGA3: integrated software formolecular evolutionary genetics analysis and sequence alignment [J]. Brief Bioinform, 2004, 5(2): 150-163.
[21] Sala C F, Formenti E, Terstappen G C. Identification, gene structure, and expression of human Frizzled-3 (FZD3)[J]. Biochem Biophys Res Commun, 2000, 273(1): 27-34.
[22] Moon R T, Bowerman B, Boutros M, et al. The promise and perils of Wnt signaling through β-catenin[J]. Science, 2002, 296(5573): 1644-1646.
[23] Kohn A D, Moon R T. Wnt and calcium signaling: β-catenin -independent pathways [J]. Cell Calcium, 2005, 38(3-4): 439-446.
[24] Umbhauer M, Djiane A, Goisset C, et. al. The C-terminal cytoplasmic Lys-thr-X-X-X-Trp motif in frizzled receptors mediates Wnt/beta-catenin signaling [J]. EMBO Journal, 2000, 19(18): 4944-4954.
[25] Kay B K, Kehoe J W. PDZ Domains and Their Ligands [J]. Chem Biol, 2004, 11(4): 423-425.
[26] Fan Z, You F, Wang L, et al. Gonadal transcriptome analysis of male and female olive flounder (Paralichthysolivaceus) [J]. Biomed Res Int, 2014, 2014(2): 291067.
[27] Zhang Z, Wang Y, Wang S, et al. Transcriptome analysis of female and maleXiphophorusmaculatusJp 163 A [J]. PLoS One, 2011, 6(4): 18379.
[28] Sun L, Wang C, Huang L, et al. Transcriptome analysis of male and femaleSebastiscusmarmoratus[J]. PLoS One, 2012, 7(11): 50676.
责任编辑 朱宝象
Isolation and Expression Analysis of Frizzled 3 Gene of Orange-Spotted Grouper (Epinepheluscoioides)
CHEN Hua-Pu1, LI Zhen1, DENG Si-Ping1, ZHU Chun-Hua1, LI Guang-Li1, ZHONG Hong-Gan2
(1.Fishery Collegel, Municipal Key Laboratory of Marine Ecology and Environment of Zhanjiang, Guangdong Ocean University, Zhanjiang 524088, China; 2.Sanya Marine Environment and Fisher Monitoring Center, Sanya 572000, China)
In this study, the cDNA of orange-spotted grouper(Epinepheluscoioides) frizzled 3 (FZD3) gene was isolated with its expression analyzed. The full length cDNA sequence of grouperFZD3(gFZD3)gene was isolated by using rapid-amplification of cDNA ends (RACE) method. The amino acid alignment and phylogenetic tree construction were performed by using ClustalX (1.81) and MEGA4.0, respectively. Tissue distribution ofgFZD3 transcript was examined thorough RT-PCR. The abundance ofgFZD3 transcript during embryonic and ovarian developments was detected by qRT-PCR. The isolatedgFZD3 cDNA was 2 255 bp in length and contained a 2 079 bp ORF encoding a deduced protein of 692 amino acids. Amino acid sequence analysis revealed that gFZD3 presented all typical structural characteristics of FZD family. Phylogenetic analysis showed that gFZD3 clustered with the evident subclade of FZD3, and showed a close relationship to that ofLarimichthyscrocea. In orange-spotted grouper,gFZD3 was found to express only in brain and two gonads, ovary and testis, with the highest abundance of its transcript detected in ovary. During embryonic development,FZD3 is highly expressed in unfertilized and fertilized eggs, but such expression gradually decreased at subsequent embryonic development stages. Furthermore, the abundance of its transcriptwas low at early ovarian stage, and high at subsequent III (cortical-alveolus) and IV (vitellogenic) ovarian stages. In conclusion,gFZD3 was isolated from orange-spotted grouper and FZD3 was highly conservative among different species in structure. The specific expression ofgFDZ3 in brain and gonads suggested an evident tissues-specific distribution pattern of gFZD3. The expression ofgFZD3 during the embryonic and ovarian developments indicated that gFDZ3 may play important roles at early stages of embryonic development and late stages of ovarian developments of orange-spotted grouper. The present study supplied the preliminary information for the further evaluation of Wnt pathway in fish reproduction.
Epinepheluscoioides; Frizzled 3; embryonic development; ovarian development; RT-PCR
广东省海洋渔业科技推广专项(A201408A06);海南省科技合作专项(KJHZ2015-08)资助 Supported by Guangdong Province Marine Fishery Science and Technology Promotion Project (A201408A06); Hainan International Science and Technology Cooperation Project (KJHZ2015-08)
2015-11-06;
2016-05-20
陈华谱(1983-),男,讲师,研究方向:鱼类生理与繁殖。
❋❋ 通讯作者:E-mail:guangli211@163.com
S917.4
A
1672-5174(2017)01-068-08
10.16441/j.cnki.hdxb.20150384
陈华谱, 李臻, 邓思平, 等. 斜带石斑鱼卷轴受体3基因的分离及表达分析研究[J]. 中国海洋大学学报(自然科学版), 2017, 47(1): 68-75.
CHEN Hua-Pu, LI Zhen, DENG Si-Ping, et al. Isolation and expression analysis of frizzled 3 gene of orange-spotted grouper (Epinepheluscoioides)[J]. Periodical of Ocean University of China, 2017, 47(1): 68-75.

