红树林内生真菌来源内酯类化合物D1952抗肿瘤活性研究
黄益,于暕辰,唐戈,袁洁,高晓霞
(1.广东药科大学 药学院,广东 广州 510006; 2.中山大学 中山医学院,广东 广州 510080)
红树林内生真菌来源内酯类化合物D1952抗肿瘤活性研究
黄益1,2,于暕辰2,唐戈2,袁洁2,高晓霞1
(1.广东药科大学 药学院,广东 广州 510006; 2.中山大学 中山医学院,广东 广州 510080)
目的 探讨红树林老鼠簕内生真菌来源内酯类化合物D1952抗肿瘤作用及分子机制。方法 分子对接技术寻找D1952的潜在靶点,四甲基二氮唑蓝(MTT)比色法研究D1952抗肿瘤谱;脱氧核糖核酸末端转移酶介导的缺口末端标记法(TUNEL)、PI染色法、免疫印迹法(Western blotting)检测D1952对细胞周期和凋亡的影响及相关信号通路蛋白的变化。结果 细胞周期蛋白激酶2(CDK2)是D1952的潜在靶点;D1952能有效抑制21种肿瘤细胞的增殖,且对MDA-MB-435的半数抑制浓度(IC50)为1.11 μmol/L。TUNEL染色可见肿瘤细胞凋亡明显;流式细胞术表明其能将MDA-MB-435细胞阻滞于G1/S 期,且D1952能促进PARP的切割、导致p-RB降低和p21的表达增加。结论 红树林老鼠簕内生真菌来源化合物D1952具有较好的抗肿瘤活性,并有望成为靶向CDK2的抗肿瘤先导化合物。
红树林; 细胞周期蛋白激酶2; 小分子抑制剂; 抗肿瘤
红树林因具有陆地到海洋过度独特的特殊生态系统,蕴藏着极为丰富和多样的微生物群落,目前以红树林来源为代表的天然产物已成为海洋药物研究的热点[1-2],从中发现许多具有新颖结构和较强生物活性的化合物[3]。老鼠簕(AcanthusilicifoliusLinn)为爵床科老鼠簕属药用红树植物,收录在《全国中草药汇编》[4],主要用于淋巴结肿大、急慢性肝炎、肝脾肿大、胃痛、咳嗽、哮喘等症。Babu等[5]将鼠簕的乙醇提取物进行鼠类实验发现其具有抗肿瘤效应。Zhao等[6]从老鼠簕根中发现4个新型2-唑啉酮对肿瘤细胞具有一定的细胞毒性作用。此外,老鼠簕的次生代谢产物及其抗肿瘤活性也有相关报道[7-8]。
细胞周期蛋白激酶(CDK)一直被认为是抗肿瘤药物及其他增殖失调疾病药物研发的重要靶点,其抑制剂按作用机制不同,大致可分为ATP竞争性和非竞争性抑制剂[9],其中ATP竞争性CDK抑制剂在CDK抑制剂研发较多。ATP竞争性CDK抑制剂多为平面杂芳烃结构,由杂环家族组成或衍生而来,也可来源于天然产物[10]。
内酯类化合物D1952来源于红树林老鼠簕树皮内生真菌,具有2个苯环和1个7元环的内酯平面结构,有望成为一个新型CDK抑制剂,本文从分子水平和细胞水平对D1952化合物抗肿瘤作用进行了研究,以期为进一步探索老鼠簕药用价值,并为该化合物最终成为抗肿瘤药物先导化合物提供理论依据。
1 材料与试剂
1.1 主要试剂及仪器
胎牛血清(Hyclone);DMEM完全培养基/1640培养基(Invitrogen);四甲基偶氮唑蓝(Genview);TUNEL细胞凋亡检测试剂盒(Promega);核糖核酸酶RNAase(鼎国生物);碘化丙啶PI(凯基生物);Anti-Fade试剂(Life);人PARP抗体、人p21(Cell Signaling Technology);α-tubulin、二甲基亚砜(DMSO)、青霉素、链霉素(Sigma);兔抗、鼠抗、BCA蛋白定量分析试剂盒、ECL显色液(Pierce);PVDF膜(Millipore);CO2细胞培养箱(Thermo);倒置显微镜(Carl Zeiss);多功能酶标仪(BioTek)。
1.2 细胞系
人白血病细胞系HL-60、K562,人肺癌细胞系A549、NCI-H226、NCI-H460,人结肠癌细胞系COLO205、HCT-116、HCT-15、HT-29、KM12、SW-620、SNB-19、U251,人乳腺癌细胞系MDA-MB-435、MCF7、MDA-MB-231、BT-549、T-47D、MDA-MB-468,人肾癌细胞系SN12C,人前列腺癌细胞系PC-3为中山大学热带病防治研究教育部重点实验室保存,并在已发表的其他研究项目中使用[11-12]。
1.3 化合物D1952与CDK2蛋白晶体结构
海洋小分子化合物来源于国家海洋生物天然产物化合物库(http://mnpd.sysu.edu.cn/)。该化合物库收集管理海洋天然产物化合物信息超过13 000条,保藏化合物实物样品超过2 000个。化合物D1952由中山大学化学与化学工程学院佘志刚教授提供[13],DMSO溶解为10 mmol/L储存液。CDK2的晶体结构数据来源于蛋白质数据库(protein data bank,PDB)。
2 方法
2.1 化合物D1952和CDK2蛋白的结构域对接
采用MOE 8.0软件对目前进入临床试验和临床前研究的23个CDK小分子抑制剂构建相似度筛选模型,对国家海洋生物天然产物化合物库的小分子化合物进行筛选。把筛选获得的候选分子与CDK2(3FZ1)的蛋白晶体结构数据进行分子对接。经过预处理,去水,加氢,处理蛋白,确定活性位点,将D1952与活性位点对接。
2.2 细胞培养
人肺癌细胞系A549、NCI-H226、NCI-H460,人结肠癌细胞系COLO205、HCT-116、HCT-15、HT-29、KM12、SW-620,人胶质瘤细胞SNB-19、U251,人乳腺癌细胞系MDA-MB-435、MCF7、MDA-MB-231、BT-549、T-47D、MDA-MB-468,人肾癌细胞系SN12C,人前列腺癌细胞系PC-3分别培养于含10%(φ)胎牛血清、2 mmol/LL-谷氨酰胺、0.1 mmol/L非必需氨基酸、10 mmol/L Hepes(缓冲液)、100 IU/mL青霉素和100 μg/mL链霉素的DMEM完全培养基中。人白血病细胞系HL-60、K562,培养于含10%胎牛血清1640培养基中,置于37 ℃ 5%(φ)CO2孵箱中孵育培养。传代时用含0.02%EDTA的0.05%胰酶消化,以DMEM完全培养基终止消化。
2.3 MTT比色检测细胞增殖[14]
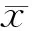
2.4 TUNEL染色检测细胞凋亡
取对数生长期的MDA-MB-435细胞,按照每孔1.0×105个细胞的密度分别接种于已铺有盖玻片的24孔细胞培养板中,置于37 ℃ 5%CO2细胞培养箱中培养。细胞孵育24 h后,用不同浓度化合物处理细胞,均以0.1%DMSO为溶剂对照,置于37 ℃ 5%CO2细胞培养箱中培养;处理24 h后,弃去原培养基,加入预冷的4%(φ)甲醛,4 ℃固定细胞30 min,PBS洗涤细胞后,用0.2%Triton X-100室温下处理5 min,加入100 μL平衡缓冲液覆盖细胞,室温下孵育5~10 min后50 μL rTdT 反应缓冲液37 ℃孵育1 h,接着加入2×SSC溶液室温作用15 min后,PBS洗涤细胞避光干燥盖玻片过夜。用含DAPI的Anti-Fade试剂于盖玻片上封片,在荧光显微镜下进行观察并拍照,TUNEL染色阳性荧光信号呈绿色,DAPI荧光信号呈蓝色。并取10个视野进行TUNEL染色阳性细胞计数。
2.5 PI染色检测细胞周期
取对数生长期的细胞2×106接种于60 mm的细胞培养皿中贴壁生长24 h后,分别给予不同浓度D1952作用一定时间后,收集细胞,用PBS洗2次,1 200 r/min离心5 min,弃上清后重悬于75%(φ)乙醇中,过夜,用PBS洗2次后,加入RNAase及PI,37 ℃避光孵育15 min,流式细胞仪检测(激发波长488 nm,吸收波长为610 nm),每个样品20 000个细胞,用ModFit软件分析。
2.6 Western blotting检测相关蛋白
收集得到不同浓度梯度处理的细胞裂解液,按BCA法进行蛋白定量,取等量蛋白质加入各电泳通道(约40 μg)。SDS-聚丙烯酰胺凝胶电泳后,转到PVDF膜上,5%脱脂牛奶室温摇床封闭1 h,TBST(pH=7.6)清洗3次,每次15 min,分别加入PARP(1∶1 000)、人p21(1∶500)、人p-RB(1∶500)以及内参α-tubulin(1∶1 000)并4 ℃过夜后,TBST清洗3次,每次15 min,再孵育相应二抗(1∶1 000)1 h,TBST清洗3次,每次15 min,最后在暗房用ECL显色液显色发光。
3 结果
3.1 化合物D1952与CDK2 PDB对接
通过对现有的23个CDKs小分子抑制剂的3D骨架结构及官能团虚拟筛选,发现D1952与flavopiridol相似性最高。因此基于现有flavopiridol的靶点研究和已有的CDK2 的晶体结构[15](PDB code:3FZ1),通过分子对接,发现D1952与水化Leu83和Glu81的侧链形成较为牢固的氢键;同时与Phe80和Val18形成叠加的π键,进而使D1952结合CDK2更加稳定(图1)。结果表明,化合物D1952与CDK2的非共价键的竞争结合方式,但是这种“紧密”的结合模式的精确解析还有待其结构生物学的深入研究。

HOOOHOOOABCD
A. D1952结构图; B.蛋白与小分子空间位置示意图; C.小分子蛋白相互作用二维平面图; D.蛋白小分子相互作用图。
图1 D1952与CDK2 活性区域的虚拟对接
Figure 1 D1952 binding with active sites of CDK2 by docking method
3.2 D1952对肿瘤细胞的体外抑制作用
本实验通过MTT的方法探究D1952对不同组织类型共21种肿瘤细胞增殖的影响,从而进行D1952抗肿瘤研究。如图2所示,D1952能抑制急性白血病细胞、非小细胞肺癌细胞、人结肠癌细胞、中枢神经肿瘤细胞、人肾癌细胞,人前列腺癌细胞、人乳腺癌细胞的增殖,具有广泛的抗肿瘤活性。此外,D1952对人乳腺癌细胞MDA-MB-435的生长抑制作用呈现明显的剂量依赖性,其作用48 h的半数生长抑制浓度为1.11 μmol/L。
3.3 D1952对MDA-MB-435细胞周期的阻滞作用
为了进一步验证D1952对人乳腺癌细胞周期的阻滞作用,本实验通过PI单染法检测不同浓度D1952对MDA-MB-435细胞周期的影响。如图3所示,D1952可引起MDA-MB-435细胞发生G1/S期阻滞现象,经过1.0 μmol/L、2.0 μmol/L的D1952化合物处理24 h后的G1/S期细胞比例与对照组37.18%,分别上升至39.38%和43.98%。D1952对MDA-MB-435细胞的G1/S期阻滞作用具有一定的浓度依赖性。
3.4 TUNEL染色检测D1952对人乳腺癌细胞的凋亡诱导作用
为了进一步确定D1952对人乳腺癌细胞的凋亡诱导作用,本研究应用TUNEL染色检测不同浓度D1952作用24 h后MDA-MB-435细胞的凋亡情况。结果显示(图4), 未经D1952作用的对照组几乎未


A. 3 μmol/L D1952的抗肿瘤谱; B. 不同浓度的D1952对人乳腺癌细胞MDA-MB-435作用48 h的抑制效果。

A. D1952诱导MDA-MB-435细胞周期变化分析; B. D1952作用于MDA-MB-435细胞的细胞周期时相分布。
A. D1952诱导MDA-MB-435细胞凋亡的结果; B. D1952作用于MDA-MB-435细胞的TUNEL阳性细胞定量。
图4 TUNEL染色检测D1952对MDA-MB-435细胞的凋亡诱导作用
Figure 4 Effect of D1952 on the apoptosis of MDA-MB-435 cells
见TUNEL染色阳性细胞;经D1952作用后,TUNEL染色阳性细胞明显增加。荧光显微镜下随机选取10个视野计数阳性细胞比例,可见随着D1952浓度的升高,TUNEL染色阳性细胞比例逐步增高,呈剂量依赖性。浓度为1.0 μmol/L的D1952作用24 h后,MDA-MB-435细胞TUNEL染色阳性率均达到20.05%;2.0 μmol/L浓度的D1952作用24 h后,MDA-MB-435细胞TUNEL染色阳性率均达到26.49%。
3.5 D1952作用后MDA-MB-435细胞中凋亡蛋白及细胞周期蛋白表达变化
为明确D1952导致人乳腺癌细胞MDA-MB-435凋亡的分子机制,本文以2个不同浓度的D1952作用于MDA-MB-435细胞24 h后,检测到相关的蛋白表达。如图5所示,随着该化合物浓度的提高,凋亡相关蛋白PARP前体降低,而剪切体升高,这指示该化合物能够促使细胞凋亡;细胞周期抑制蛋白p21表达水平比对照组有所升高,而p-RB表达水平降低,这提示该化合物可能通过阻滞细胞G1周期来促进细胞的凋亡。

123MDA-MB-435(24h)IntactPARPCleavedPARPp21p-RBα-tubulin
1. Control; 2. 1.0 μmol/L D1952; 3. 2.0 μmol/L D1952。
图5 D1952作用后MDA-MB-435细胞中的PARP、p21和p-RB的表达水平
Figure 5 Effect of D1952 on the expression of PARP,p21and p-RB in MDA-MB-435 cells
4 讨论
近年研究发现,癌细胞中大多存在细胞分裂周期基因的活化、过度表达及CDKIs(CDK inhibitor,CDKIs)功能的缺损[16],与其相对的CDKIs发挥抑制细胞周期的制动器作用。本文利用计算机辅助寻靶点的方法,首先筛选出于D1952具有相似3D空间结构的CDK小分子抑制剂Flavopiridol,在临床前研究中Flavopiridol表现出诱导细胞凋亡和肿瘤生长抑制活性,此外Flavopiridol对CDK1、2、4的抑制活性试验,以及与酶ATP 结合口袋的三维晶体结构确证了Flavopiridol与CDKs的相互作用[17]。因此,本文通过对Flavopiridol已有研究报道的靶点进行分析,将D1952与现有的蛋白晶体结构CDK2进行分子对接,预测其靶点。已有研究表明,Flavopiridol与CDK2的晶体结构显示其5-羟基和4-酮能分别与CDK2主干上Glu81的羰基氧和Leu83的氨基NH形成两条氢键作用[18],本实验对接结果发现D1952也能水化Leu83和Glu81的侧链形成较为牢固的氢键,同时,D1952还能与Phe80浅腔中Phe80共轭结合。近年来研究者发现该浅腔只能容纳体积较小的疏水性基团,对该浅腔不同程度占据表明小分子抑制剂的活性具有选择性[19]。同时本研究对D1952体外抗肿瘤活性及其机制进行了研究,通过实验发现D1952能有效抑制不同组织类型共21种肿瘤细胞增殖,具有广泛的抗肿瘤活性。TUNEL实验进一步表明D1952具有诱导MDA-MB-435细胞凋亡的作用。此外,通过细胞周期实验验证发现,D1952能诱导肿瘤细胞造成G1/S期阻滞,引起细胞凋亡。
在哺乳动物细胞中,CDK单体没有活性,只有与相应的调节亚基cyclin结合后才能变成有活性的稳定构象。CDK/cyclin的活化也受到内源性抑制子抑制、活化及抑制磷酸化的调节。其中p21 Waf1/Cip1蛋白作为一种细胞周期抑制蛋白,可以与CDK2形成复合体,限制其构象改变,抑制酶活,同时当CDK2与cyclin E结合受到抑制时,导致视网膜母细胞瘤蛋白(retinoblastoma protein,RB)磷酸化减少,从而促进RB与转录因子E2F结合并抑制其活性,造成G1/S阻滞[20]。为探讨D1952抗肿瘤的分子机制,采用Western blotting分析了细胞周期及凋亡相关蛋白变化,结果表明,D1952作用后,MDA-MB-435细胞中的凋亡效应蛋白PARP发生裂解,及细胞周期抑制蛋白p21表达量升高,同时p-RB减少,一定程度上说明D1952能够靶向CDK2诱导细胞通过p21和p-RB抑制细胞周期活动从而引起细胞凋亡而发挥抗肿瘤的活性。该结果为深入研究D1952抗肿瘤活性的分子机制提供了线索,并为进一步开发抗肿瘤新型候选药物奠定了基础。
[1] 洪葵.红树林放线菌及其天然产物研究进展[J].微生物学报,2013,53 (11):1131-1141.
[2] 康伟.海洋生物活性物质发展研究[J].亚太传统医药,2014,10(3):47-48.
[3] WU Jun,XIAO Qiang,XU Jing,et al. Natural products from true mangrove flora: source,chemistry and bioactivities[J]. Nat Prod Rep,2008,25(3):955-981.
[4] 《全国中草药汇编》编写组.全国中草药汇编[M].北京:人民卫生出版社,1978:231-232.
[5] BABU B H,SHYLESH B S,PADIKKALA J. Tumor reducing and anticarcinogenic activity of Acanthus ilicifolius in mice[J]. J Ethnopharmacol,2002,79(1):27-33.
[6] ZHAO Dan,XIE Lijun,YU Lei,et al. ChemInform abstract: new 2-Benzoxazolinone derivatives with cytotoxic activities from the roots ofAcanthusilicifolius[J]. J Cheminform,2015,63(12):1087-1090.
[7] ISLAM M A,SAIFUZZAMAN M,AHMED F,et al. Anti-nociceptive activity of methanolic extract ofAcanthusilicifoliusLinn. Leaves[J]. TUrk J Pharm Sci,2012,9(1):51-60.
[8] 孙世伟,林贞健,朱天骄,等.老鼠簕植物内生真菌Aspergillusterreus(W-8)抗肿瘤活性成分的研究[J].中国海洋大学学报(自然科学版),2011,41(S1):349-355.
[9] PEYRESSATRE M,PRÉVEL C,PELLERANO M,et al. Targeting cyclin-dependent kinases in human cancers: from small molecules to Peptide inhibitors[J]. Cancers,2015,7(1):179-237.
[10] ASGHAR U,WITKIEWICZ A K,TURNER N C,et al. The history and future of targeting cyclin-dependent kinases in cancer therapy[J]. Nat Rev Drug Discov,2015,14(2): 130-146.
[11] JIANG Lili,MAO Pu,SONG Libing,et al. miR-182 as a prognostic marker for glioma progression and patient survival[J]. Am J Pathol,2010,177(1):29-38.
[12] LIU Liping,CHEN Kun,WU Jueheng,et al. Downregulation of miR-452 promotes stem-like traits and tumorigenicity of gliomas[J]. Clin Cancer Res,2013,19(13):3429-3438.
[13] PAN Jiahui,DENG Juanjuan,CHEN Yiguan,et al. New lactone and xanthone derivatives produced by a mangrove endophytic fungus phoma sp. SK3RW1M from the south china sea[J]. Helv Chim Acta,2010,93(7):1369-1374.
[14] XIE Gue’e,ZHU Xun,LI Qing,et al. SZ-685C,a marine anthraquinone,is a potent inducer of apoptosis with anticancer activity by suppression of the Akt/FOXO pathway[J]. Br J Pharmacol,2010,159(3):689-697.
[15] DENG Yongqi,SHIPPS G W,ZHAO Lianyun,et al. Modulating the interaction between CDK2 and cyclin with a quinoline-based inhibitor[J]. ACS Med Chem Lett,2014,24(1):199-203.
[16] CICENAS J,KALYAN K,SOROKINAS A,et al. Highlights of the latest advances in research on CDK inhibitors[J]. Cancers,2014,6(4):2224-2242.
[17] SHAPIRO G I. Preclinical and clinical development of the cyclin-dependent kinase inhibitor flavopiridol[J]. Clin Cancer Res,2004,10(10):4270-4275.
[18] 白晓光,许乐幸,李祎亮,等.基于靶蛋白结构的CDK2小分子抑制剂研究进展[J].中国新药杂志,2011,20(17):1667-1672.
[19] BUGELSKI P J,KIM C. T-dependent antigen response (TDAR) tests: meta-analysis of results generated across multiple laboratories[J]. J Immunotoxicol,2007,4(2):159-164.
[20] CANAVESE M,SANTO L,RAJE N. Cyclin dependent kinases in cancer[J].Cancer Biol Ther,2014,13(7): 451-457.
(责任编辑:幸建华)
Potent antineoplastic effects of a lactone D1952 derived from mangrove microbes
HUANG Yi1,2,YU Jianchen2,TANG Ge2,YUAN Jie2,GAO Xiaoxia1
(1.SchoolofPharmacy,GuangdongPharmaceuticalUniversity,Guangzhou510006,China; 2.ZhongshanSchoolofMedicine,Sun-YatSenUniversity,Guangzhou510080,China)
Objective To investigate the antineoplastic activity and mechanism of D1952,a lactone derived from mangrove microbes,at both cellular and molecular levels. Methods The target of D1952 was predicted by molecular docking. MTT assay was utilized to study cytotoxicity of D1952 on different tumor cells. Effects of D1952 on cell cycle and apoptosis were tested by terminal deoxynucleotidyl transferase (TDT)-mediated biotinylated deoxyuridine triphosphate (dUTP)-biotin nick end labeling (TUNEL) staining,PI staining and western blotting. Results D1952 effectively inhibited the proliferation of 21 tumor cells with potentially targeting CDK2. The half maximal inhibitory concentration (IC50) of D1952 in MDA-MB-435 cells was 1.11 μmol/L. D1952 induced cell apoptosis and apoptosis protein PARP was cleaved leading increased P21 and decreased p-RB. D1952 also induced cell cycle arrest at the G1/S phase. Conclusion D1952 derived from mangrove microbes displays the antitumor activity,which is expected to be a lead compound targeting CDK2 in relevant tumors.
mangrove; CDK2; small molecule inhibitor; antitumor
2016-08-12
海洋公益性行业科研专项(201305017); 海洋经济创新发展区域示范专项(GD2012-D01-001)
黄益(1991—),女,2014级硕士研究生,Email: huanghuayu57@yahoo.com;通信作者: 高晓霞 (1972—),女,博士,教授,主要从事中药制剂质量控制研究,Email: gaoxxia91@163.com;袁洁(1978—),女,博士,副教授,主要从事海洋活性分子的药物靶点及分子机制研究,Email: yuanjie@mail.sysu.edu.cn。
时间:2016-11-29 9:37 ttp://www.cnki.net/kcms/detail/44.1413.R.20161129.0937.001.html
R965
A
1006-8783(2016)06-0737-06
10.16809/j.cnki.1006-8783.2016081202

