蚕丝蛋白对磷酸钙颗粒释药的影响
王欣宇,刘洪卓,宋立娜,李三鸣
(沈阳药科大学 药学院,辽宁 沈阳 110016)
蚕丝蛋白对磷酸钙颗粒释药的影响
王欣宇,刘洪卓,宋立娜,李三鸣*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的研究蚕丝蛋白对磷酸钙颗粒中吸附的牛血清白蛋白释放的影响。方法CaCl2法提取蚕丝蛋白;用反向微乳化法制备磷酸钙颗粒;以牛血清白蛋白(BSA)为模型药物,以蚕丝蛋白为控释材料,探索温度、BSA加入量、pH值、蚕丝蛋白质量浓度对颗粒吸附的影响,同时测定磷酸钙颗粒中BSA的释放度。结果温度对BSA的吸附量无明显影响,但随加入BSA的量增加,其吸附量先增大后减小;介质pH值增大时BSA的吸附量降低。蚕丝蛋白与BSA在颗粒表面相互作用后,吸附量明显降低,随着蚕丝蛋白质量浓度增加,BSA在磷酸钙颗粒上的吸附量也略有下降,同时释放速度减慢。结论蚕丝蛋白在特定质量浓度下可以有效控制磷酸钙颗粒中BSA的释放。
药剂学;控制释放;CaCl2法;反向微乳化法;蚕丝蛋白;磷酸钙(CaP)颗粒;牛血清白蛋白
骨缺损主要是由于先天性骨疾病及后天感染、创伤、肿瘤切除等原因导致的,严重影响人们的生活和健康,骨移植是目前临床上最常用的治疗骨缺损的方法。磷酸钙颗粒的主要成分是羟基磷灰石,与人体骨组织中最主要的无机成分相同,因此与骨组织具有良好的生物相容性,可用作骨缺损的治疗。但是作为药物载体,存在释放初期突释的问题,限制其应用。蚕丝蛋白作为一种生物可降解的天然蛋白,其独特的线团结构可以在粒子表面形成扩散的阻滞层,从而延缓药物的快速释放,故而具有优良的缓释功能[1-3];另外,蚕丝蛋白含有大量氨基酸残基,具有化学反应的潜在反应位点[4-6],因此可与许多物质发生相互作用。
本文作者使用反向微乳化法制备磷酸钙空白颗粒[7],作为模型蛋白药物的载体,以蚕丝蛋白为控释材料,以牛血清白蛋白为模型药物,考察磷酸钙颗粒吸附牛血清白蛋白的影响因素,同时研究不同质量浓度蚕丝蛋白对载牛血清白蛋白磷酸钙颗粒的体外释放的影响,从而为其作为蛋白药物缓释载体提供理论基础。
1 仪器与材料
JA2003A电子天平(上海精密电子仪器有限公司),CPA225D电子天平(德国Sartorius公司),DZF-150恒温真空干燥箱(河南省太康县教材仪器厂),SHB-III循环水式多用真空泵(郑州长城科工贸有限公司),DF-101S集热式恒温磁力搅拌器(巩义市予华仪器有限责任公司),PSH-3D pH计(上海雷磁公司),LS32激光衍射粒度分析仪(美国Beckman Coulter公司),Nano ZS激光粒度仪(英国马尔文仪器公司),LDZ4-0.8离心机(北京医用离心机厂),IX71S8F-3荧光显微镜(沈阳禾光科技有限公司Olympus辽宁总代理),Mx3000P酶标仪(美国Thermo SCIENTIFIC公司)。
Tween 85(分析纯,北京百灵威科技有限公司),环己烷、碳酸钠(分析纯,天津博迪化工股份有限公司),磷酸氢二钠、氢氧化钠(分析纯,天津瑞金特化学品有限公司),氯化钙(分析纯,天津北方天医化学试剂厂),磷酸二氢钾、磷酸氢二钾(分析纯,西陇化工股份有限公司),乙醇(分析纯,天津富宇精密化工有限公司),甲醇(分析纯,山东禹王实业有限公司化工分公司),蚕茧(桑蚕茧,广西柳城县蚕茧公司),牛血清白蛋白(bovine serum albumin, BSA)、异硫氰酸荧光素(fluorescein isothiocyanate, FITC)和异硫氰酸罗丹明-B(rhodamine B isothiocyanate, Rh-B)(西格玛奥德里奇(上海)贸易有限公司),二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(碧云天生物科技研究所)。
2 方法
2.1 蚕丝蛋白的提取及荧光标记
将去除蚕蛹的干蚕茧剪成1 cm2左右的碎片,烘干备用。取备用蚕茧1 g,置于15 mL浓度为20 mmol·L-1Na2CO3溶液中,沸水浴脱胶60 min后,抽滤,洗净,40 ℃烘干。将脱胶蚕丝置于8 mL CaCl2-水-乙醇 ( n∶n∶n = 1∶8∶2)溶液中,70 ℃下搅拌2 h后,4 000 r·min-1离心5 min,透析除去杂质,即得蚕丝蛋白溶液[8]。
用FITC对蚕丝蛋白进行荧光标记,研究蚕丝蛋白对磷酸钙的包衣过程。方法如下:避光条件下,称取FITC 1.0 mg,溶于1 mL碳酸盐缓冲溶液(pH值9.2)中,同时用pH值7.4的PBS溶液稀释蚕丝蛋白溶液至20 g·L-1,取5 mL与上述FITC碳酸盐缓冲溶液混匀,室温条件下搅拌3 h。将混合液置于4 ℃冰箱中反应12 h。透析法除去游离的FITC,冷冻干燥,即得荧光标记的蚕丝蛋白。
2.2 磷酸钙颗粒的制备与表征
采用反向微乳法制备磷酸钙颗粒。量取Tween 85 2.2 mL和环己烷12.7 mL,混匀,得油相;将油相两等分,50 ℃下、分别滴入25 mmol·L-1Na2HPO4水溶液2.5 mL、0.5 mol·L-1CaCl2水溶液2.5 mL,搅拌,形成W/O乳液。搅拌条件下合并上述乳液,20 min后,室温静置待沉淀析出,弃上清,用乙醇和水反复清洗磷酸钙颗粒,真空干燥,即得磷酸钙颗粒。
荧光显微镜下观察RhB-BSA及FITC-蚕丝蛋白在颗粒表面的吸附分布。BSA的标记方法同蚕丝蛋白的标记方法。于25 ℃下,将颗粒超声分散后,分别采用LS32激光衍射粒度分析仪和 Nano ZS激光粒度仪测定粒子粒径及zeta 电位。同法测定颗粒吸附BSA以及经蚕丝蛋白包裹后粒径和电位的变化。
2.3 磷酸钙颗粒对BSA的吸附作用
2.3.1 吸附温度及BSA的加入量对吸附的影响
取0.5 g·L-1磷酸钙颗粒混悬液1.0 mL,加入不同体积的1.0 g·L-1BSA溶液,使磷酸钙颗粒与BSA的质量比分别为1∶0.1、1∶0.2、1∶0.3、1∶0.5、1∶0.6、1∶1.0、1∶1.4和1∶1.8,用去离子水定容至5.0 mL,室温下搅拌16 h。离心,BCA法[9]测定上清液中BSA的含量,BSA加入总量减去上清液中BSA含量即为BSA的吸附量。依据下式计算颗粒中BSA的载药量和有效吸附率:
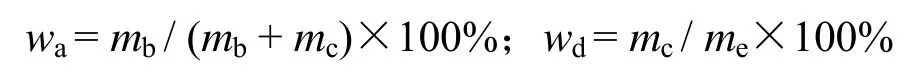
其中:wa为BSA载药量,wd为BSA有效吸附率,mb为颗粒吸附的蛋白质量,mc为加入的空白颗粒质量,me为加入蛋白总质量。
2.3.2 吸附介质pH值对吸附的影响
取0.5 g·L-1磷酸钙颗粒混悬液1.0 mL,加入1.0 g·L-1BSA溶液0.5 mL,用pH值5.8的PBS溶液、水、pH值7.4的PBS溶液和pH值8.5的PBS溶液定容至5.0 mL,余下操作同“2.3.1”条。
2.3.3 蚕丝蛋白对BSA吸附的影响
取20.0 mg磷酸钙颗粒,分散于20 mL水中,避光下加入RhB-BSA 10.0 mg,搅拌16 h,离心,水洗、真空干燥,即得载BSA的磷酸钙颗粒。
精密称定上述载BSA的磷酸钙颗粒2.0 mg,置于10 mL具塞玻璃离心管中,加入蚕丝蛋白溶液,使其质量浓度分别为0.5、1.0和2.0 g·L-1,缓慢振摇15 min,离心,取上清液作为供试液;以540 nm为激发波长、625 nm为发射波长,测定供试液的荧光强度,计算蚕丝蛋白溶液中的游离BSA质量浓度。将沉淀水洗后真空干燥,即得不同质量浓度蚕丝蛋白包裹的载BSA的磷酸钙颗粒。
2.4 磷酸钙颗粒中BSA的释放考察
精密称定经质量浓度0.5、1.0和2.0 g·L-1蚕丝蛋白包裹的载BSA的磷酸钙颗粒2.0 mg,置于具塞玻璃试管中,加入释放介质2 mL,在37 ℃、100 r·min-1下震荡,于不同时间取释放介质100 μL,测定BSA的质量浓度,并计算蛋白的累积释放度。
3 结果与讨论
3.1 颗粒的制备与表征
反向微乳法制备的磷酸钙颗粒平均粒径为13.39 μm,粒径主要分布在4~27 μm内,颗粒表面带有负电荷,zeta电位为-9.19 mV,颗粒吸附BSA后,粒径无明显变化,zeta电位降至-11.30 mV;1 g·L-1蚕丝蛋白包裹吸附BSA的颗粒后,粒径增加1.7 μm,电位无明显变化,为-11.05 mV。如图1所示,载RhB-BSA磷酸钙颗粒经FITC-蚕丝蛋白处理后,两种蛋白均匀分布在颗粒表面(图1A、B),且蚕丝蛋白起到了一定的包裹功能(图1C),有利于控制BSA的释放。
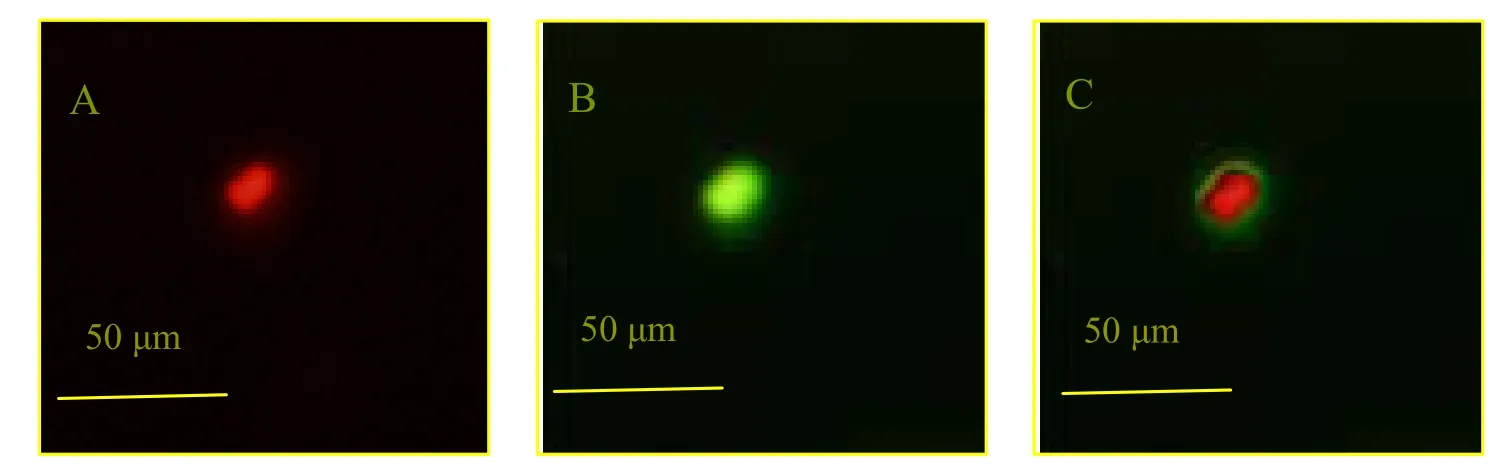
Fig. 1 The distribution of RhB-BSA(A) and FITC-silk fibroin(B) on CaP microparticles图 1 RhB-牛血清白蛋白(A) 及 FITC-蚕丝蛋白(B)在磷酸钙颗粒表面的分布
3.2 磷酸钙颗粒对BSA吸附的影响因素
3.2.1 吸附温度及BSA的加入量对磷酸钙颗粒吸附BSA总量的影响
选取20、30和40 ℃条件研究温度对磷酸钙颗粒吸附BSA总量的影响。选取磷酸钙颗粒与BSA的质量比分别为1∶0.1、1∶0.2、1∶0.3、1∶0.5、1∶0.6、1∶1.0、1∶1.4和1∶1.8的条件研究BSA加入量对磷酸钙颗粒吸附BSA总量的影响。结果表明,BSA在磷酸钙颗粒表面的吸附行为在不同温度下相似,无明显差异,40 ℃下载药量为34.69%、有效吸附率为88.52%,20 ℃下载药量为32.56%、有效吸附率为80.49%,30 ℃下载药量为33.52%、有效吸附率为84.08%(图2)。结果提示,BSA在颗粒表面的吸附主要是静电吸附,温度对其无影响。吸附量随BSA的加入量增大先增大后减小,在BSA的量为600 μg时达到最大。如图2B所示,不同温度下BSA的利用率无显著差异,但随BSA的加入(低于600 μg)药物有效吸附率先缓慢下降,后呈快速下降趋势。BSA的加入量较大时,由于分子间相互作用,形成多聚体的趋势大于吸附于颗粒表面的趋势,更能降低BSA分子的能量,因此,当BSA的加入量太高时,蛋白载入量反而降低,有效吸附率降低加快。
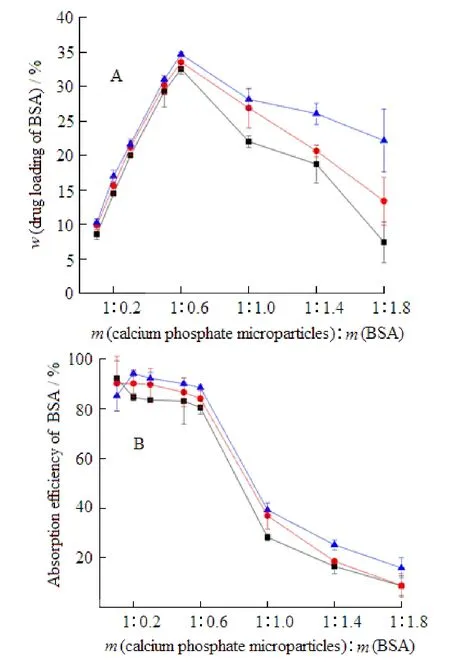
Fig. 2 The drug loading and absorption efficiency of BSA with different concentration of BSA under given temperatures (±s, n=3)图 2 BSA的加入量对磷酸钙颗粒吸附BSA的影响(±s, n=3)
3.2.2 吸附介质pH值对吸附的影响
配制一系列不同pH值的磷酸盐缓冲溶液作为吸附过程的介质,研究介质pH值对BSA吸附量的影响。从图3看出,介质的pH值影响BSA的吸附,且在考察的介质pH值范围内,pH值越高(5.8, water, 7.4, 8.5)BSA的吸附越少(分别为27.27%, 20.79%, 14.29%, 10.65%)。这是因为介质pH值越高,BSA分子带负电增多(pH>PI, PIBSA=4.6),同时,颗粒表面所带负电进一步增强,pH值为5.8、7.4和8.5磷酸盐缓冲溶液中颗粒的zeta电位分别为-12.30、-19.35和-25.35 mV;结果是蛋白和颗粒之间的排斥力增大,致使蛋白在磷酸钙颗粒表面的吸附随着pH升高而降低。
Fig. 3 The loading of BSA in CaP microparticles in various solutions with different pH (± s, n= 3)图 3 介质PH对磷酸钙颗粒吸附BSA的影响(± s, n= 3)
3.2.3 蚕丝蛋白对BSA吸附的影响
调节包裹颗粒所需蚕丝蛋白的质量浓度,研究吸附BSA的磷酸钙颗粒经过不同质量浓度蚕丝蛋白包裹的过程中,蚕丝蛋白的加入量对颗粒吸附BSA总量的影响,计算不同条件下的BSA吸附总量。由如图4可知,未加入蚕丝蛋白前吸附量为26.64%,加入蚕丝蛋白后BSA的吸附量明显降低。另外,随着蚕丝蛋白质量浓度升高,颗粒表面BSA吸附量也略有下降(分别为 18.00%、 16.65% 和15.03% )。这主要是由于两种蛋白具有同种电荷[10],吸附介质中的蚕丝蛋白以无规则线团的溶胀形式为主,侧基基团暴露在外部,部分基团吸附在磷酸钙颗粒表面,与BSA形成竞争,此过程中颗粒表面吸附的BSA发生解吸附,导致吸附量降低。蚕丝蛋白质量浓度越高,颗粒表面竞争作用越大,但是,蚕丝蛋白在颗粒表面会形成一定厚度包裹层,解吸附的BSA 在此过程中被重新带入包裹层。蚕丝蛋白包裹过程与解吸附过程动态变化,表观表现为随着蚕丝蛋白溶液质量浓度的增加,BSA吸附量略有降低。
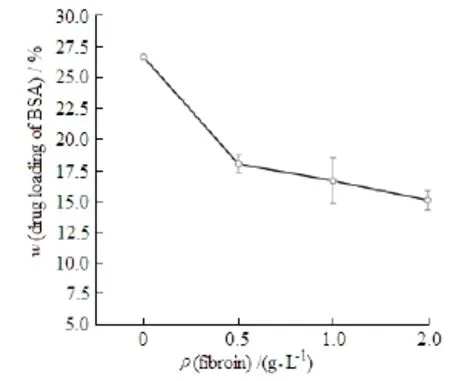
Fig. 4 The influence of silk fibroin concentration on the loading efficiency of BSA(±s, n=3)图 4 蚕丝蛋白浓度对磷酸钙颗粒吸附BSA的影响(±s, n=3)
3.3 蚕丝蛋白质量浓度对BSA的释放影响
在pH>5的条件下,蚕丝蛋白与BSA带有同种电荷,竞争吸附磷酸钙颗粒表面有限的吸附位点,因此,在BSA释放的过程中也会有所影响。
从30 d的释放曲线来看(图5 A),各组在前3天有一个快速释放的过程,后发生一个短期的迟滞现象;随后,由于各组蚕丝蛋白质量浓度增加,BSA释放速度逐渐降低。为研究前期突释过程的差异,从图5 B可以看出,0.5 g·L-1蚕丝蛋白处理的颗粒,释放速度高于未经蚕丝蛋白处理的磷酸钙颗粒,2.0 g·L-1蚕丝蛋白处理的磷酸钙颗粒释放速度最缓慢。这是因为低质量浓度的蚕丝蛋白不能有效覆盖磷酸钙颗粒表面,无法形成完整的包衣层,颗粒表面的部分吸附位点被蚕丝蛋白吸附,产生了敏化作用,导致低质量浓度蚕丝蛋白促进BSA的释放。
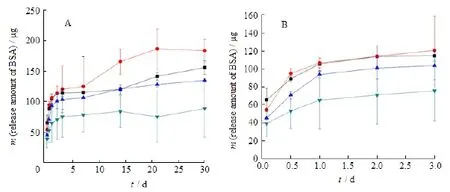
Fig. 5 The effect of silk fibroin on the release of BSA from CaP microparticle(±s, n=3)图 5 丝素蛋白质量浓度对磷酸钙颗粒释放BSA的影响(±s, n=3)
4 结论
以BSA为模型蛋白,测定了磷酸钙颗粒在不同BSA质量浓度、温度、pH值条件下的吸附量。蚕丝蛋白的加入会与BSA形成竞争,使BSA吸附量降低。
在实验范围内,控制释放的蚕丝蛋白质量浓度达到2.0 g·L-1,磷酸钙颗粒中BSA的释放减慢。
[1] WANG Xiaoqin, WENK Esther, HU Xiao, et al. Silk coating on PLGA and alginate microspheres for protein delivery[J]. Biomaterials, 2007, 28: 4161-4169.
[2] WENK E, WANDREY A J, LORENZ L, et al. Silk fibroin spheres as a platform for controlled drug delivery[J]. J Control Release, 2008, 132: 26-34.
[3] SOMVIPART S, KANOKPANONT S. Development of electrospun beaded fibers from Thai silk fibroin and gelatin for controlled release application[J]. Int J Biol Macromol, 2013, 55: 176-184.
[4] TAO Wei, LI Mingzhong, ZHAO Chunxia. Structure and properties of regenerated Antheraea pernyi silk fibroin in aqueous solution[J]. Int J Biol Macromol, 2006, 40(5): 472-478.
[5] MORI H, TSUTAKA M. New silk protein: modification of silk protein by gene engineering for production of biomaterials[J]. Reviews in Molecular Biotechnology, 2000, 74(2): 95-103.
[6] MARCELO C L, KIM Y G, KAINE J L, et al. Stratification, specialization, and proliferation of primary keratinocyte cultures. Evidence of a functioning in vitro epidermal cell system[J]. J Cell Bio, 1978, 79(2): 356-361.
[7] LI Jun, YANG Yang, HUANG Leaf. Calcium phosphate nanoparticles with an asymmetric lipid bilayer coating for siRNA delivery to the tumer[J]. J Control Release, 2012, 158: 108-114.
[8] BAYRAKTAR O, MALAY O, OZGARIP Y, et al. Silk fibroin as a novel coating material for controlled release of theophylline[J]. Eur J Pharm Biopharm, 2005, 60: 373-381.
[9] 李海玲,彭书明,李 凛. 4种常用蛋白浓度测定蛋白浓度的比较[J]. 中国生化药物杂志, 2008, 29(4): 277-282.
[10] 张光先, 鲁成. 蚕丝蛋白带电荷数的研究[J]. 蚕业科学, 2009, 01: 99-105.
The effect of silk fibroin on drug release properties of calcium phosphate particles
WANG Xinyu, LIU Hongzhuo, SONG Lina, LI San-ming*
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo study the release kinetics of calcium phosphate (CaP) microparticles, with different concentration of fibroin coatings.MethodsThe silk fibroin was extracted using CaCl2method;The CaP microparticles were prepared using reversed micro-emulsion method. With bovine serum albumin (BSA) as the model drug and silk fibroin as coating material, we studied the influence of factors (such as pH value, ionic strength, silk fibroin concentration) on the process of adsorption to the CaP microparticles and the release properties of BSA from CaP microparticles were evaluated.ResultsTemperature had no obvious effect on the adsorption quantity of BSA on calcium phosphate particles. The quality of added BSA increased, loading quantity initially increased then decreased. Adsorption amount of BSA reduced apparently as CaP microparticles interacted with silk fibroin. The loading amount was slightly lower and release ratewasslower when the silk fibroin concentration was higher.ConclusionIn the range of measurement, the release of BSA from CaP microparticles can be effectively controlled by silk fibroin at certain concentration.
pharmaceutics; controlled release; CaCl2method; reversed micro-emulsion method; silk fibroin; calcium phosphate(CaP) particles; bovine serum albumin (BSA)
(2016)04–0135–08
10.14146/j.cnki.cjp.2016.04.004
(本篇责任编辑:赵桂芝)
2015–04–30
王欣宇(1991–), 女(汉族), 山东枣庄人, 硕士研究生,E-mailwangxinyusd@163.com; *
李三鸣(1957–), 男(汉族), 辽宁开原人, 教授, 博士, 博士生导师, 主要从事药物缓控释制剂的研究,Tel.024-23896258,E–mail li_sanming@sina.com。
- 中国药剂学杂志(网络版)的其它文章
- 藤黄酸白蛋白纳米粒的制备及稳定性研究
- 帕洛诺司琼贴剂的含量测定方法
- 纳豆激酶与尿激酶的对比性研究

