黄精种子破眠技术的优化
程秋香,曹 丹,李吟平,刘 峰,席鹏洲,李军超,张跃进
(1.西北农林科技大学 生命科学学院,陕西杨凌 712100;2.陕西步长制药有限公司,西安 710075)
黄精种子破眠技术的优化
程秋香1,曹 丹1,李吟平1,刘 峰2,席鹏洲2,李军超1,张跃进1
(1.西北农林科技大学 生命科学学院,陕西杨凌 712100;2.陕西步长制药有限公司,西安 710075)
为了筛选出促进黄精种子萌发的最佳破眠技术,采用正交试验设计的方法,研究GA3质量浓度、浸种温度、浸种时间、消毒剂4个因素对黄精种子萌发的影响。结果表明: GA3质量浓度为100 mg/L,浸种温度20 ℃,浸种时间12 h,消毒剂为w=3%的过氧化氢是黄精种子萌发的最佳处理条件,萌发率可达92.36%。4种因素中,浸种温度是影响黄精种子萌发的主要因素,浸种时间和GA3质量浓度次之,消毒剂的使用可以有效控制黄精种子在萌发过程中的霉变现象。
黄精;破眠技术;正交试验
黄精(PolygonatumsibiricumRed.)为百合科黄精属多年生草本植物,集药用、食用和观赏价值于一身。其根茎入药,具有润肺滋阴、补肾益精、降血脂、降血糖、提高机体免疫力、增强心肌收缩力、抗病原微生物、提高耐缺氧能力等功效[1-2]。黄精繁殖方式为有性繁殖(种子)和无性繁殖(根茎)2种[3-4]。多年来,黄精药材的人工种植主要依靠其根茎,既浪费商品药材也导致其后代退化,病虫害加重,使黄精药材的品质受到严重影响。利用黄精种子进行繁殖既可以节约大量商品药材,发挥其杂种优势,还能防止其品种退化。然而黄精种子休眠期长,自然条件下发芽率极低,对有性繁殖造成很大的障碍。本试验在以往单因素研究的基础上,采用正交试验设计的方法,系统分析GA3质量浓度、浸种温度、浸种时间和消毒剂4个因素对黄精种子萌发的综合影响,旨在筛选出促进黄精种子萌发的最佳破眠技术,为黄精种子的有性繁殖提供技术支撑。
1 材料与方法
1.1 材 料
黄精种子来自西北农林科技大学生命学院药用植物资源圃。2013年10月采集成熟黄精果实,经发酵漂洗获得黄精种子,室外沙藏。
1.2 方 法
1.2.1 正交试验设计 采用正交试验设计,以黄精种子萌发率、萌发指数等为考核指标,以GA3质量浓度(A)、浸种温度(B)、浸种时间(C)、消毒剂(D)4个因素设计4因素3水平的正交试验L9(34),详见表1和表2。表中,消毒剂的3个水平分别指:w=3%的过氧化氢处理15 min;φ=75%的乙醇处理30 min;w=0.8%次氯酸钠处理30 min。
1.2.2 发芽试验 黄精种子经2个月沙藏后取出,用清水冲洗干净,挑选表面光滑、完整、大小适中的种子,备用。根据正交试验设计进行种子处理,每组处理选取种子50粒,每组处理设3个重复。以正交试验设计中1号为例,取挑选备用的黄精种子50粒放置在培养皿中,加入质量浓度为100 mg/L的GA3溶液10 mL,20 ℃条件下浸种12 h;然后用蒸馏水清洗3次;加入w=3%的过氧化氢10 mL浸泡15 min,蒸馏水清洗3次。
将处理后的黄精种子播种在铺有双层无菌滤纸的培养皿中,置于MGC-300A型智能光照培养箱中25 ℃避光培养,发芽期限设定60 d,每天观察记录种子萌发情况,以突破种皮的下胚轴长度超过种子自身长度视为发芽[5],统计种子萌发率、萌发指数、带菌率。试验期间,适时浇水保持滤纸湿润,发现霉烂种子及时清理并更换污染滤纸。

表1 正交试验因素水平
1.3 统计分析方法
种子萌发率=60 d内萌发的种子数/供试种子数×100%
萌发指数(Gi)=∑Gt/Dt(Gt为td的萌发数,Dt为相应的萌发时间)
处理后种子带菌率=60 d发霉的种子数/供试种子数×100%
运用SPSS 20.0统计分析软件处理试验数据。
2 结果与分析
2.1 GA3质量浓度、浸种温度、浸种时间及不同消毒剂对黄精种子萌发率的影响
极差分析法是一种直观反映试验中各因素对试验结果影响大小的方法[6]。由表2可知,不同处理条件下黄精种子萌发率之间存在一定差异,其中1号处理黄精种子的萌发率最高,为92.36%;6号处理最差,为60.6%;其余处理介于二者之间。从处理的4个因素来看,浸种温度的极差值(R)最大,GA3质量浓度次之,浸种时间和消毒剂较小。说明浸种温度对黄精种子萌发率影响最大,GA3质量浓度次之。
方差分析[7]结果见表3,与极差分析结果相吻合,其中浸种温度对黄精种子萌发率的影响达到极显著(P=0.001),GA3质量浓度对黄精种子的萌发率影响达到显著水平(P=0.027),而其余2个因素的作用效果不显著(P>0.05)。4因素A、B、C、D不同水平对黄精种子萌发率的影响见图1。由图1可以看出:A1、B1、C3、D1的效应分别最大,即GA3质量浓度为100 mg/L、浸种温度20 ℃、浸种时间24 h为最佳水平,消毒剂以过氧化氢为佳。由于因素D的3个水平为非连续变量,所以在图1、2、3中均以散点形式呈现。
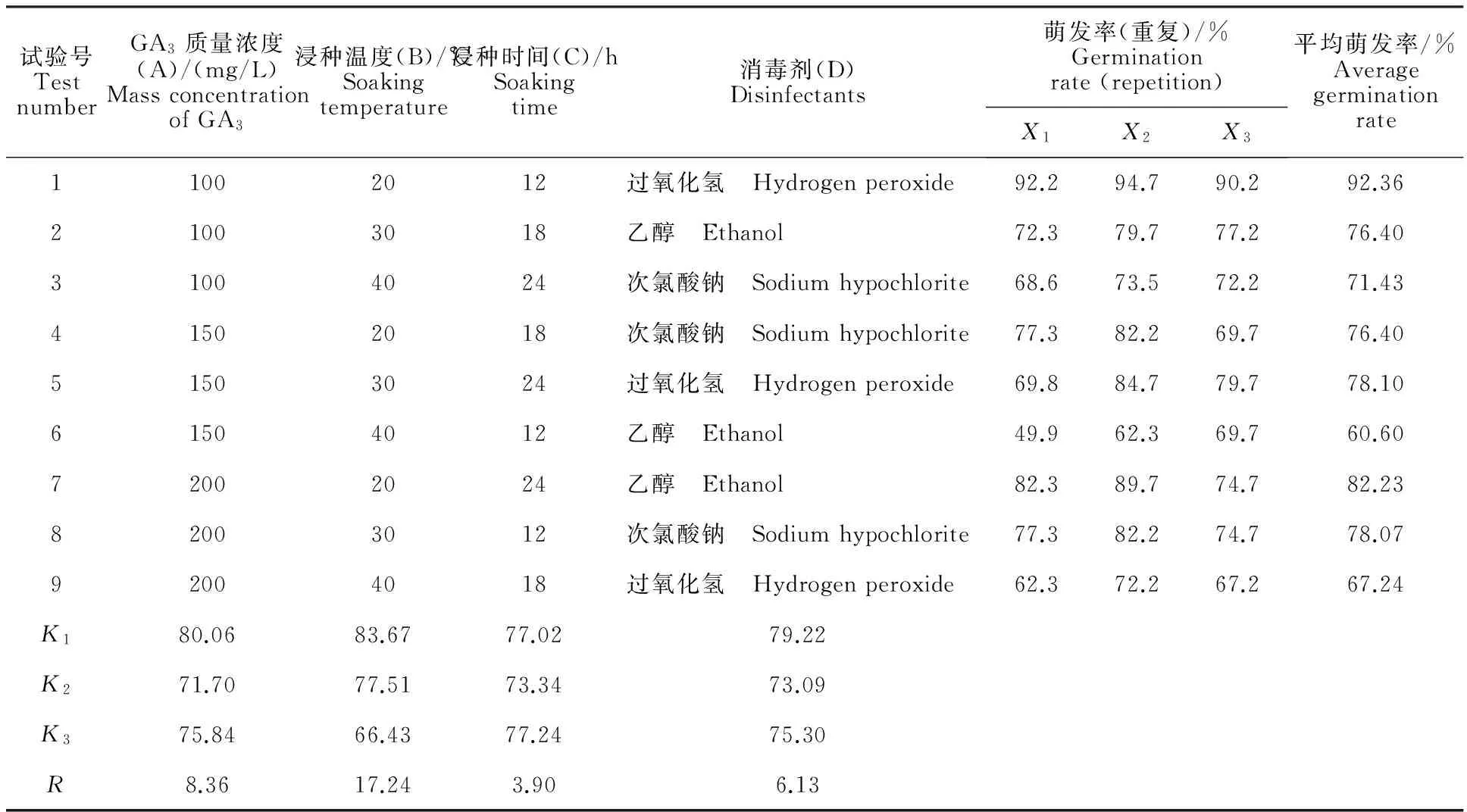
表2 不同处理下黄精种子的萌发率

表3 各因素对黄精种子萌发率影响的方差分析
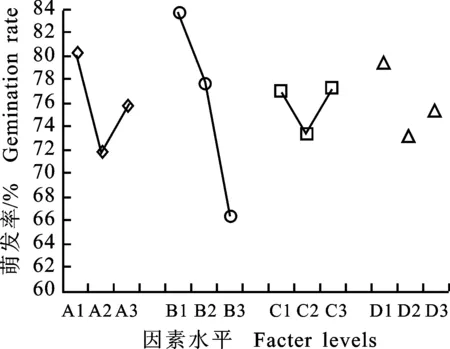
图1 4种因素对萌发率的效应曲线
2.2 GA3质量浓度、浸种温度、浸种时间及不同消毒剂对黄精种子萌发指数的影响
由表4可知,1号处理黄精种子的萌发指数最高,为1.54。GA3质量浓度、浸种温度、浸种时间、消毒剂这4个因素中,浸种温度的极差值(R)最大,浸种时间次之,GA3质量浓度和消毒剂极差值较小,说明浸种温度对黄精种子萌发指数影响最大,浸种时间次之。
表5表明,浸种温度和浸种时间对黄精种子萌发指数的影响达到极显著水平。其中,浸种温度P=0.002,浸种时间P=0.001。其余2个因素作用效果不显著(P>0.05)。结合各因素对萌发率影响的方差分析结果,浸种温度对黄精种子的萌发率和萌发指数均有极显著作用;浸种时间对黄精种子的萌发率影响作用不显著,但对萌发指数有极显著作用;GA3质量浓度对黄精种子萌发率有显著影响,对萌发指数影响不显著,消毒剂对黄精种子萌发率和萌发指数的影响均不显著。因此,实际生产中首要应考虑浸种温度,其次考虑浸种时间与GA3质量浓度。由图2可知,因素A、B、C、D对萌发指数的影响中,A3、B1,C1,D1的效应分别最大,即GA3质量浓度200 mg/L、浸种温度20 ℃、浸种时间12 h为最佳水平,消毒剂以过氧化氢为佳。

表4 不同处理下黄精种子的萌发指数
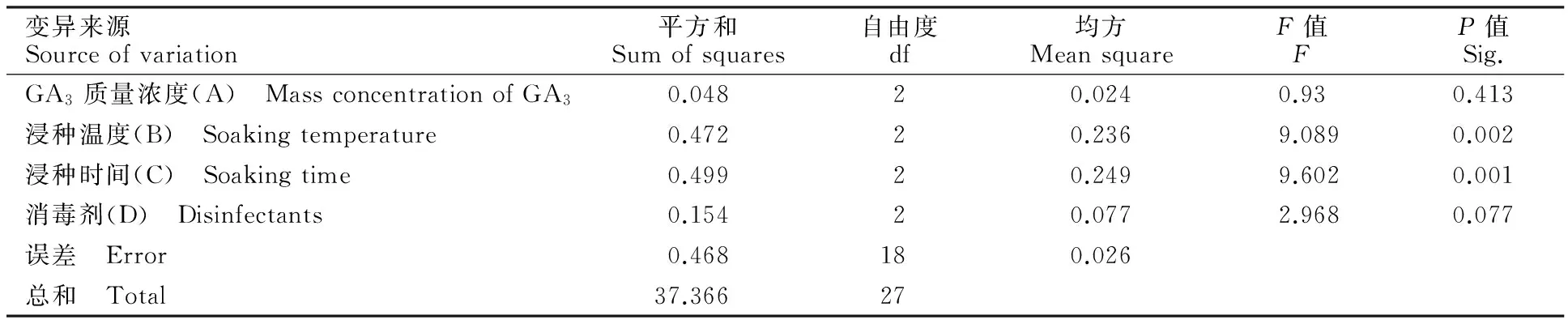
表5 各因素对黄精种子萌发指数影响的方差分析
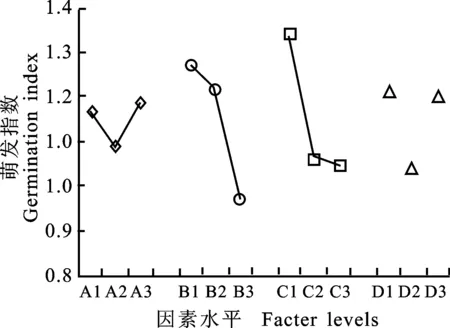
图2 4种因素对萌发指数的效应曲线
2.3 不同消毒处理的消毒效果
种子消毒处理的效果主要根据消毒后种子的带菌率来体现。带菌率高表明该消毒方法效果不佳,无法达到消毒的预期目的。黄精种子由于自身结构等原因,造成其萌发历时较长,容易引起种子霉烂。因此,消毒处理及消毒剂的选择是黄精种子萌发中非常重要的一环。各种消毒剂的消毒效果如表6及图3所示,不同消毒方法间消毒效果存在一定差异,其中D1即过氧化氢的消毒效果最好,其相应的K值最小,其他2种消毒剂效果次之,故在黄精种子繁殖中选用过氧化氢作为前期处理的消毒剂。
3 结论与讨论
4种因素对黄精种子萌发的影响程度存在较大差异,其中,浸种温度对黄精种子萌发率和萌发指数的影响极显著,且最佳效应水平为20 ℃;浸种时间对黄精种子萌发率影响不显著,对萌发指数影响极显著,且两者最佳效应水平不一致,应选择影响萌发指数最佳效应水平,即浸种时间12 h;GA3质量浓度对黄精种子萌发率影响达到显著水平,对黄精种子萌发指数影响不显著,所以应选择影响萌发率最佳效应水平,即100 mg/L;不同消毒剂对黄精种子带菌率的影响中,w=3%过氧化氢处理15 min效果最好,带菌率最低。综上分析,本试验所得到的最佳组合为A1B1C1D1,即黄精种子萌发的最佳破眠技术组合为GA3质量浓度100 mg/L,处理温度20 ℃,处理时间12 h,最后用w=3%的过氧化氢处理15 min。

表6 不同消毒剂下黄精种子的带菌率

图3 不同消毒剂处理对带菌率的效应
沙藏层积处理是一种古老而有效的破除种子休眠的方法,对因含萌发抑制物质而导致生理休眠的种子效果显著。沙藏处理可以促进胚形态发育成熟,激素含量发生变化,抑制物质降解,大分子物质转化为小分子物质,提高一些酶的活力,促进相关基因的表达,种皮透性增强,以及使胚对脱落酸的敏感降低等[8-9]。黄精种子属于综合休眠,一方面存在胚的后熟现象[10];另一方面,黄精种皮、胚乳和胚等不同部位存在一定的内源抑制物质[11],在实际生产中,新收获的黄精种子常先沙藏起来,待用时再筛出,对黄精种子而言,沙藏不仅是一种破眠方法,更是一种合理的贮藏方法,因而在黄精种子破眠方面,沙藏常作为一种必不可少的前处理方法。常用的沙藏层积有变温层积和恒温层积,变温层积通常模拟休眠种子的自然环境条件,有利于种子的胚完成生理后熟过程。王占红等[12]对黄精种子的4种不同沙藏方法进行比较,发现黄精果实经发酵漂洗获得种子室外沙藏效果最佳,因此本试验选用室外沙藏处理作为黄精种子的前处理方法。
浸种催芽是常用的催芽方法之一,通过浸种处理可以去除种子内部分抑制物,能有效提高种子发芽率,适当温度的浸种处理具有更佳的效果[13]。本研究中所得到的最适浸种温度为20 ℃,最适浸种时间为12 h,与朱伍凤等[14]的研究存在一定差异,朱伍凤等所进行的为单因素试验,而本试验为4因素3水平正交试验,这可能是引起差异的主要原因。另外,浸种效果的好坏取决于水温和浸种时间两个方面,一般情况下浸种时水温越低,需要浸种时间越长,反之水温越高,浸种时间可适当缩短。
GA3具有拮抗休眠种子内源抑制物质(包括ABA)的作用,能够促进α-淀粉酶、核酸酶、蛋白水解酶、ATP酶等的表达。GA3在促进种子萌发的过程中至少起到两种信号作用,一是软化种胚周围组织,克服种皮机械限制,二是促进种胚的生长[15]。同时,GA3对种子内ABA有一个平衡作用。黄精种子坚硬,吸水缓慢,在前期的单因素研究中发现除具有一定的机械障碍外,还存在一定的內源抑制物(包括ABA含量较高)[10], GA3浸种的应用,可以缓解或消除上述不利因素,有利于促进黄精种子萌发。本文研究表明在多因素综合作用下,100 mg/L的 GA3溶液浸种,对黄精种子萌发有较好的促进作用。
种子消毒技术在农业生产中应用较广,如草种处理、种子包衣等。本试验采用常用过氧化氢、乙醇、次氯酸钠3种消毒剂对黄精种子进行消毒,其中以过氧化氢效果最佳,该结果与李荣峰等[16]对麻疯树种子消毒处理的结果一致。
正交试验相对于单因素试验来说能更系统反应不同因素对试验结果的影响情况,能得出一个更加直观可靠的结果。本试验研究是在前期单因素研究的基础上开展的研究工作,获得的最佳破眠技术组合不仅萌发率高,而且萌发指数有较大的突破,在黄精的有性繁殖过程中,既可以节约时间,又可以增加苗子的整齐度,对实际生产具有重要的指导意义。
Reference:
[1] 中国科学院植物研究所.中国植物志:第十五卷[M].北京:科学出版社,1978:52-80.
THE CHINESE ACADAMY OF SCIENCES.Institute of Botany:Volume15.Flora Reipublicae Popularis Sinicae[M].Beijing:Science Press,1978:52-80(in Chinese).
[2] 国家药典委员会.中华人民共和国药典(一部)[S].北京:化学工业出版社,2005:215.
CHINESE PHARMACOPOEIA COMMISSION.Pharmacopoeia of the People’s Republic of China(a volume)[S].Beijing:Chemical Industry Press,2005:215(in Chinese).
[3] 黄 瑶,石 林.黄精的药理研究及其开发利用[J].华西药学杂志,2002,17(4):278-279.
HUANG Y,SHI L.Pharmacological study and exploitation ofPolygonatumsibiricumRed[J].WestChinaJournalofPharmaceuticalSciences,2002,17(4):278-279(in Chinese).
[4] 赵 致,庞玉新,袁 媛,等.药用作物黄精种子繁殖技术研究[J].种子,2005,24(3):11-13.
ZHAO ZH,PANG Y X,YUAN Y,etal.Study on the seed reproduces technology of medicinal crop rhizoma polygonati[J].Seed,2005,24(3):11-13(in Chinese with English abstract).
[5] 孙昌高,方 坚,徐秀瑛,等.百合科药用植物种子发芽的研究[J].中草药,2000(31):127-129.
SUN CH G,FANG J,XU X Y,etal.Studies on medicinal plant seed germination of lily family(Liliaceae) [J].ChineseTraditionalAndHerbalDrugs,2000(31):127-129(in Chinese with English abstract).
[6] 王钦德,杨 坚.食品试验设计与统计分析[M].北京:中国农业大学出版社,2003:349-361.
WANG Q D,YANG J.Food Experiment Design and Statistical Analysis[M].Beijing:China Agriculture Press,2003:349-361(in Chinese).
[7] 张 力.SPSS13.0在生物统计中的应用[M].厦门:厦门大学出版社,2006.
ZHANG L.SPSS13.0 In the Application of Biological Statistics[M].Xiamen:Xiamen University Publishing Company,2006(in Chinese).
[8] CHIN H L,LING Y L,MENO J T.The effect of stratification and thidiazuron treatmenton germination and protein ynthesis ofPyrusserotinaRehdcv.Niauli[J].AnnalsofBotany,1994,73:515-523.
[9] SUSAN E M ,ROSEMARY L P.Genetic regulation of seed dormancy inPurshiatridentate(Rosaceae)[J].AnnalsofBotany,2000,85:521-529.
[10] 张玉翠,李永刚,王占红,等.黄精种子休眠原因的研究[J].种子,2011,30(4):58-61.
ZHANG Y C,LI Y G,WANG ZH H,etal.Study on dormancy of reason ofPolygonatumsibiricumRed.seeds[J].Seed,2011,30(4):58-61(in Chinese with English abstract).
[11] 张跃进,张玉翠,王占红,等.黄精种子内源抑制物质的初步研究[J].西北农业学报,2011,20(7):50-55.
ZHANG Y J,ZHANG Y C,WANG ZH H,etal.Study on endogenesis inhibitor inside seed ofPolygonatumsibiricum[J].ActaAgriculturaeBoreali-OccidentalisSinica,2011,20(7):50-55(in Chinese with English abstract).
[12] 王占红,蒋 花,王 瑾,等.不同沙藏处理对黄精种子内贮藏物质及萌发的影响[J].种子,2012,31(2):91-93.
WANG ZH H,JIANG H,WAGN J,etal.Effect of sand storage on storage substance content and germination ofPolygonatumsibiricumRed.seeds[J].Seed,2012,31(2):91-93(in Chinese with English abstract).
[13] 韩 健,周广柱,李智辉,等.高速公路护坡植物种子催芽技术研究[J].山东林业科技,2008(5):28-29.
HAN J,ZHOU G ZH,LI ZH H,etal.Methods of seed accelerating germination to highway slop-protecting plants[J].JournalofShandongForestryScienceandTechnology,2008(5):28-29(in Chinese with English abstract).
[14] 朱伍凤,王剑龙,常 辉,等.黄精种子破眠技术研究[J].种子,2013,32(4):13-16,19.
ZHU W F,WANG J L,CHANG H,etal.A study on technology for breaking dormancy ofPolygonatumsibiricumRed.seeds[J].Seed,2013,32(4):13-16,19(in Chinese with English abstract).
[15] 江 玲,万建民.植物激素ABA和GA调控种子休眠和萌发的研究进展[J].江苏农业学报,2007,23(4):360-365.
JIANG L,WANG J M.Advances on seed dormancy and germination regulated by plant hormones ABA and GA[J].JiangsuJournalofAgriculturalSciences,2007,23(4):360-365(in Chinese with English abstract).
[16] 李荣峰,蓝业琳,曾小飚,等.不同消毒方法及铝浸种对麻疯树种子萌发的影响[J].种子,2013(2):5-8.
LI R F,LAN Y L,ZENG X B,etal.Effect of different disinfection methods and soaking with aluminum on seeds germination of jatrophaCurcasL.[J].Seed,2013(2):5-8(in Chinese with English abstract).
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
Optimization Technology for Breaking Dormancy ofPolygonatumsibiricumRed. Seed
CHENG Qiuxiang1,CAO Dan1,LI Yingping1,LIU Feng2, XI Pengzhou2,LI Junchao1and ZHANG Yuejin1
(1.College of Life Science,Northwest A&F University,Yangling Shanxi 712100 China; 2.Shaanxi Buchang Pharmaceutical Co.,Ltd.,Xi’an 710075,China)
In order to select the optimum technology for breaking dormancy. which could promote the seed germination ofPolygonatumsibiricum,studied we studied the effect of mass concentration of GA3,soaking temperature,soaking time and disinfectants four factors on seed germination ofPolygonatumsibiricumby the method of orthogonal experiment.The results showed that the best treatment conditions on seed germination ofPolygonatumsibiricumwas 100 mg/L GA3, 20 ℃ soaking for 12 hours,disinfectant with hydrogen peroxide(w=3%),and the germination rate could reach up to 92.36%. Among them ,the soaking temperature was the major influence factor ofPolygonatumsibiricumRed.seeds germination, soaking time and the mass concentration of GA3were the second to it, the use of disinfectant could control the contamination ofPolygonatumsibiricumeffectively during the seed germination process.
PolygonatumsibiricumRed;Dormancy-broken technology;Orthogonal experiment
ZHANG Yuejin,male,professor. Research area:mainly engaged in standardization production of medicinal plant.E-mail:qxzhang@126.com
2016-02-29
2016-04-07
陕西省科技攻关(S2014SF3834);陕西省科技攻关(2015SF2-32);杨凌示范区农业科技示范推广基地项目(A289021601)。
程秋香,女,硕士研究生,从事药用植物规范化生产技术研究。E-mail:chengqiuxiang000@sina.com
张跃进,男,教授,从事药用植物规范化生产研究。E-mail:qxzhang@126.com
日期:2016-12-12
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161212.1117.036.html
Q945
A
1004-1389(2016)12-1870-06
Received 2016-02-29 Returned 2016-04-07
Foundation item Shaanxi Province Program for Tackling Agricultural Technology(No.S2014SF3834);Shaanxi Province Program for Tackling Agricultural Technology(No.2015SF2-32);Yangling Demonstration Area Program for Agricultural Technology and Base Extensive(No.A289021601).First author CHENG Qiuxiang,female,master student.Research area:mainly engaged in standardization production technology in medicinal plant . E-mail:chengqiuxiang000@sina.com

