巧析化学平衡状态的判断
杨 娅●
贵州省遵义市第四中学(563000)
巧析化学平衡状态的判断
杨 娅●
贵州省遵义市第四中学(563000)
化学平衡状态的判断是一个难点、易错点.化学平衡指在一定条件下,当可逆反应正、逆两个方向反应速率相等,反应体系中所有参加反应的物质的质量或浓度保持恒定.可逆反应达到化学平衡状态的本质是“等”,即V正(A)=V逆(A),表现出来的结果是“定”,即某些变量一定,不再发生改变.笔者以这两点为切入点,提出判断化学平衡状态的两种方法:“v正(A)=v逆(A)”法和“变量不变”法.
化学平衡状态的判断;变量不变
一、用“v正(A)=v逆(A)”判断
“v正(A)=v逆(A)”表达的意思有两点:“正”和“逆”表示方向,即同时要有关于“正”和“逆”方向的描述;“=”表示同种物质速率相等,若为不同种物质,速率折算成同一种物质在数值上相等.综上,用“v正(A)=v逆(A)”判断化学反应是否达到平衡状态的方法要注意以下两点: 要有正和逆方向的描述, 同种物质正、逆速率相等,不同种物质正、逆速率比值等于方程式计量数比.

①单位时间内生成2nmol NH3的同时生成3nmol H2
②单位时间内生成nmol N2的同时生成3nmol H2
③用N2、H2、NH3表示的反应速率比为1:3:2的状态
④ 3v(H2)正=2v(NH3)逆
⑤3 mol H-H键断裂的同时断裂6 mol N-H键
解析 ①“生成2nmol NH3”表示正速率,“生成3nmol H2”表示逆速率,有“正”和“逆”方向的描述,用“NH3和H2”表示速率比值为2n∶3n=2∶3,等于计量数比,①说明达平衡;
②“生成nmol N2”表示逆速率,“生成3nmol H2”表示逆速率,无“正”和“逆”方向的描述,②不能说明达平衡;
③无“正”和“逆”方向的描述,③不能说明达平衡;
④有“正”和“逆”方向的描述,把3v(H2)正=2v(NH3)逆变化形式为:v(H2)正∶v(NH3)逆=2∶3,不等于计量数比,④不能说明达平衡;
⑤“3 mol H-H键断裂”表示正速率, “断裂 6 molN-H键”表示逆速率,有“正”和“逆”方向的描述,v(H2)正∶v(NH3)逆=3∶6=1∶2,等于计量数比,⑤说明达平衡.
二、用“变量不变”判断
化学反应在进行中,有些量一直不变,“不变量”不能作为判断是否达平衡的标志.有些量一直在变,当“变量”不变,则说明达到化学平衡,即“变量不变”法.
例2 在两个绝热、恒容的密闭容器中进行下列两个可逆反应:
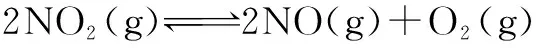

现有下列状态,其中能表明(甲)达到化学平衡状态的是( ).
能表明(乙)达到化学平衡状态的是( ).
①混合气体的颜色不再改变
②混合气体总的物质的量不再改变
③混合气体的压强不再改变
④反应物浓度不再改变
⑤混合气体的密度不再改变
⑥混合气体的平均相对分子质量不再改变
⑦绝热体系温度不再改变的状态
⑧反应物或生成物的百分含量不再改变的状态
⑨ΔH不变
解析 ①、用极端假设法判断量是否为变量,如甲方程式中,NO2有颜色,其他无色,若全为反应物,体系为红棕色,若全为生成物体系为无色,所以反应过程中,“颜色”为变量,变量不变,①可作为甲判断标志,同理①也可作为乙的判断标志;②甲方程式中,若2mol反应物完全转化得3mol生成物,该反应为气体的物质的量变化的体系,“气体总的物质的量”为变量,变量不变,②可作为甲判断标志,乙为等物质的量变化的反应,“气体总的物质的量”为不变量,则②不可作为乙的判断标志;③其它条件相同时,压强大小是由气体多少决定的,甲方程式为气体的物质的量变化的体系,即压强变化的体系,“压强”为变量,变量不变,③可作为甲判断标志.乙为等物质的量变化的反应,即“压强”为不变量,③不可作为乙的判断标志;④对于甲和乙来讲,“反应物浓度”为变量,变量不变,④可作为甲、乙判断标志;⑤公式ρ=m/V中,根据质量守恒,对于甲和乙m为不变量,由题V为不变量,所以ρ为不变量,⑤不可作为甲、乙判断标志.⑥公式M=m/n中,对于甲和乙m为不变量,甲的n为变量,乙的n为不变量,所以,甲的“M”为变量,乙的“M”为不变量.⑥可作为甲判断标志,不能作为乙判断标志.⑦由题,任何反应都有热效应,绝热下,“体系温度”为变量,⑦可作甲、乙判断标志.⑧反应物或生成物的百分含量对于甲乙都为可变量,⑧可作甲、乙判断标志.⑨ΔH为不变量,⑨不可作甲、乙判断标志.
综上所述,无论题目条件如何变化,都可转化为下列两种判断方法:“v正(A)=v逆(A)”法和“变量不变”法,用“v正(A)=v逆(A)”法判断化学平衡状态的核心是判断是否有v正和v逆;用“变量不变”法判断化学平衡状态的核心是判断给的“量”是否为变量.抓住这两点,所有平衡问题都能迎刃而解.
G632
B
1008-0333(2016)28-0087-01

