A型肉毒杆菌神经毒素重链干预大鼠脊髓损伤后蛋白表达的初步研究*
兰 婧, 王 红, 白 娟, 王亚芳, 李夏青
(山西医科大学病理生理教研室, 山西 太原 030001)
A型肉毒杆菌神经毒素重链干预大鼠脊髓损伤后蛋白表达的初步研究*
兰 婧, 王 红, 白 娟, 王亚芳, 李夏青△
(山西医科大学病理生理教研室, 山西 太原 030001)
目的: 初步观察大鼠脊髓损伤模型基础上局部注射小剂量A型肉毒杆菌神经毒素重链(BoNT/A HC)后对局部蛋白表达谱的影响,为探讨BoNT/A HC干预在体神经损伤后相关蛋白表达及其干预神经再生机制提供实验基础。方法:复制大鼠单侧腰段脊髓损伤模型;采用SDS-PAGE及双向电泳观察不同剂量BoNT/A HC(2 μg、4 μg、6 μg和8 μg)对脊髓损伤后局部(包括损伤部位及其近头端部分脊髓组织)蛋白表达谱的干预作用。结果:大鼠单侧腰段脊髓损伤2 d时局部脊髓组织结构明显破坏崩解,损伤波及左侧脊髓灰质及白质;脊髓损伤局部SDS-PAGE及考马斯亮蓝染色显示,于损伤同时局部一次性注射不同剂量BoNT/A HC后,某些蛋白表达与单纯损伤组相比明显不同,而与正常组基本一致;双向电泳结果进一步显示,损伤局部注射6 μg BoNT/A HC后2 d和20 d时,在不同等电点及不同蛋白分子量水平上,有10余种蛋白表达与单纯损伤组明显不同,呈向正常转化的趋势。结论:大鼠脊髓损伤局部注射BoNT/A HC一定时间可影响损伤局部蛋白表达谱的变化,这种变化呈现由损伤造成的蛋白表达变化被转向正常的趋势。
脊髓损伤; A型肉毒杆菌神经毒素重链; 神经损伤; 神经再生
脊髓损伤(spinal cord injury,SCI)是由于创伤性或非创伤性因素导致的脊髓结构破坏,譬如创伤、炎症、肿瘤及缺血等。严重的脊髓损伤可导致损伤相应节段所支配的躯体运动及感觉功能障碍。由于脊髓损伤局部的神经细胞及白质纤维缺乏再生能力,因此脊髓损伤是一种致残率极高的疾病,严重影响人们的正常生活,同时给家庭和社会带来沉重的负担。长期以来,探讨促进脊髓损伤后修复的各种手段成为神经科学领域的研究热点。
A型肉毒杆菌神经毒素(botulinum neurotoxin type A, BoNT/A)是迄今研究最为广泛且早已用于临床实践的肉毒杆菌毒素。BoNT/A的毒性机制主要是通过其分子结构中的重链与运动终板神经突起前膜上相应受体结合介导其分子结构中的轻链入胞、并通过轻链的Zn2+依赖性蛋白水解酶作用导致突触小体相关蛋白25(synaptosomal-associated protein 25, SNAP-25)裂解,使突触囊泡内神经递质(乙酰胆碱)释放受阻,骨骼肌收缩障碍发生麻痹[1-2]。除影响乙酰胆碱外,BoNT/A对不同神经细胞突触囊泡内的其它递质或多肽如P物质、钙调素相关基因多肽等也具有抑制释放作用[1]。根据其致病机理,临床上BoNT/A主要用于面肌痉挛、斜颈、多汗症、慢性神经性痛、美容除皱等[3]。一些在体动物实验发现BoNT/A局部注射引起肌肉麻痹的后期局部出现运动终板样结构形成[4]。除此外,体外实验也观察到培养液内加入BoNT/A可以直接刺激原代运动神经元突起生长[5-6]。基于上述研究,本实验采用大鼠脊髓损伤半离断模型局部注射人工重组的BoNT/A重链(heavy chain, HC),以期观察BoNT/A对脊髓损伤后局部蛋白表达谱的影响,为探讨BoNT/A重链干预在体神经损伤后相关蛋白表达及其干预神经再生机制提供实验基础。
材 料 和 方 法
1 实验动物和分组
雄性SD大鼠,6~7周龄,体重200~220 g,由北京海淀兴旺实验动物养殖场提供,许可证号为SCXK(京)2014-0013。实验分为4组(每组4只):(1)单纯损伤组(一侧腰段脊髓离断性损伤);(2)脊髓损伤+BoNT/A HC干预 2 d组,BoNT/A HC剂量分别采用2 μg、4 μg、 6 μg和8 μg,于损伤当时由注射器注入脊髓腔内;(3)脊髓损伤+BoNT/A HC 干预20 d组,剂量及方法同 (2);(4)正常对照组,只行皮肤切开、暴露背部脊椎,不进行脊髓损伤。
2 方法
2.1 单侧腰段脊髓损伤模型复制 脊髓损伤模型的方法及步骤参照文献进行并略作改动[7]。大致损伤步骤如下:用1%戊巴比妥钠腹腔注射(0.3~0.4 mL/kg)麻醉大鼠后将其背位固定于手术台上。腰段脊髓定位:大鼠俯卧位时根据髂后上棘首先定位腰3~腰4(L3~L4)椎间隙,以此向头端依次确定6节脊椎,第6和第7节为胸9~胸10(T9~T10)椎间隙,以T9~T10紧靠后棘突间左侧插入改良的直形注射器针头直至椎板,垂直提拉针头十数次并做背腹部抽动,抽出直形针头后再用弯形针头在同一位置进行背腹部提拉数十次。损伤过程中大鼠出现脊椎向腹侧弯曲、损伤侧后肢短暂抽搐,表明损伤成功,缝合筋膜及皮肤,模型复制完毕。待动物麻醉苏醒后呈现一侧后肢拖地行走,表明造模成功。
2.2 HE染色确定损伤部位及范围 于大鼠腰段脊髓损伤模型复制后1 d,经4%多聚甲醛溶液(新鲜配置,4 ℃)灌注固定后,由背部打开脊髓腔,暴露损伤部位脊髓,分别于损伤处上一脊髓及下一脊髓段切取脊髓组织置于4%多聚甲醛进行后固定(1 h),标本置于30%蔗糖溶液4 ℃冰箱内过夜,经梯度乙醇脱水、二甲苯透明、石蜡包埋、行脊髓额状纵形切片(切片厚度5 μm),经苏木素-伊红(HE)染色后,对损伤的范围及程度进行观察。
2.3 BoNT/A 重链髓腔内注射 脊髓损伤模型同时由改良的损伤器针头连接微量注射器注入人工重组的BoNT/A重链(List Biological Laboratories)溶液,总量为20 μL。每只大鼠给药量分别为 2 μg、4 μg、6 μg及8 μg,将所需剂量的BoNT/A重链溶于20 μL生理盐水内进行注射。
2.4 脊髓蛋白表达的检测
2.4.1 单向凝胶电泳及考马斯亮蓝染色 于模型复制+不同剂量BoNT/A重链干预后2 d、20 d时在深度麻醉状态下,沿原手术切口打开背部皮肤,用咬骨钳经腰椎第3~4椎间隙依次而上打开椎板至脊髓损伤部位,充分暴露脊髓,用剃须刀片在距损伤上下2~3 mm处分别切断,取出脊髓,将损伤侧脊髓分离作为测定标本。将标本用剪刀剪碎,置入玻璃管研磨器中,加入预冷的蛋白裂解液内(蛋白裂解液配置方法:尿素 21 g、硫脲 7.9 g、DTE 0.5 g和Tris 0.5 g,纯水定容至50 mL)。每3 mm脊髓组织加500 μL裂解液,每个脊髓标本共加入裂解液1 000 μL,标本置于玻璃研磨器内于冰上研磨成为组织悬液。并将组织悬液进行超声间断粉碎3 min,进一步充分裂解蛋白。组织蛋白悬液内加入5倍体积的预冷丙酮震荡混合,-20 ℃沉淀2 h或过夜;次日将组织混悬液进行离心(4 ℃,12 000×g30 min),弃去上清,收集沉淀;加入蛋白裂解液(500 μL)再次悬浮沉淀,充分混匀后采用ABC法进行蛋白含量测定。
将20 μg样本蛋白溶于凝胶电泳样本溶解液内,水浴中煮沸10 min。分别上样于15%的聚丙烯酰胺凝胶中进行电泳(电压 80~100 mV,时间 1.5 h)。凝胶置于0.025% 考马斯亮蓝溶液中(考马斯亮蓝 0.025 g、甲醇 400 mL,冰乙酸 70 mL,纯水定容至1 000 mL)漂染2 h,用洗脱液(甲醇 400 mL和冰乙酸 70 mL,纯水定容至1 000 mL)对凝胶进行漂洗3~4 h,染色后的凝胶条带经Bio-Rad图像处理系统进行成像分析。
2.4.2 双向电泳及银染色 蛋白提取方法同4.1,蛋白上样量为150 mg。选用pH 3~10 NL IPG预制干胶条,进行第一向等电聚焦; 将聚焦完成的胶条用 2D equilibration buffer [6 mol/L 尿素,50 mmol/L Tris-HCl (pH 8.8), 30%甘油, 2%SDS, 1% DTT,痕量溴酚蓝] 进行清洗和平衡;将平衡后的胶条放入凝胶板中,加入低熔点琼脂糖封胶液(0.5%低熔点琼脂糖+电泳缓冲液),室温静置20 min后进行第二向电泳。第二向聚丙烯酰胺凝胶浓度为12.5%,电泳参数设定为100 mV,45 min,随后改为200 mV直至溴酚蓝离胶下沿0.5 cm处停止;冷循环设定温度为15 ℃。
对完成电泳后的凝胶进行硝酸银染色。大致染色步骤为凝胶水化、10%乙醇漂洗及敏化、0.1%硝酸银染色20 min、充分水洗后加入银染色显影液(0.25%碳酸钠、0.04%甲醛溶液)显影3~5 min、充分水洗;采用Bio-Rad凝胶成像系统对银染色后的凝胶进行成像及分析处理。
3 统计学处理
采用GraphPad Prism 5.0统计软件进行统计学处理。实验数据用均数±标准误(mean±SEM)表示,多组间均数差异用单因素方差分析(one-way ANOVA),组间两两比较用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 大鼠腰段脊髓半离断损伤及HE染色
模型复制2 d后,由L3~L4椎间隙依次向上打开椎板充分暴露腰段脊髓。肉眼可见损伤部位位于腰膨大下部,局部充血肿胀,与周围组织较易辨别。低倍镜可见损伤部位主要位于脊髓左侧(损伤侧)。损伤侧脊髓正常结构破坏、组织断断续续,脊髓前后角及灰白质不可辨认,损伤侧外侧面脊髓组织缺失。高倍镜下可见损伤处神经组织呈现液化性坏死、损伤灶内部分神经细胞呈现典型坏死形态学特征(核浓缩、碎裂)、小血管明显扩张、损伤区域炎性细胞浸润不十分明显。除此外,镜下可见损伤灶越过中央管略向对侧延伸,脊髓中央管不易辨认,见图1。
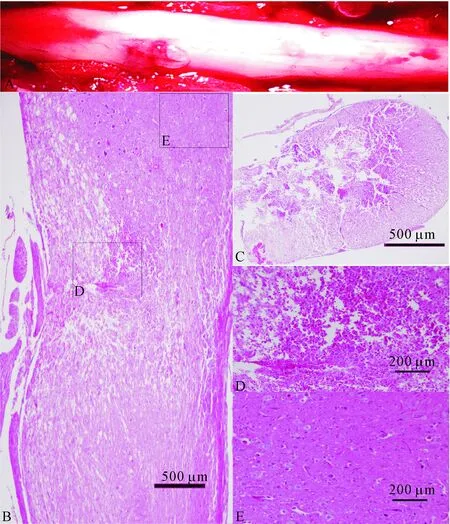
Figure 1.Gross and histological views of unilateral lumbar spinal cord injury. A: one-side damage was observed on the dorsum of the lumbar spinal cord; B: the longitudinal section of spinal cord including the injury site; C: the cross section of spinal cord injury location; D: the gray matter which surrounded the injury site with clear normal histological features (magnification); E: the center of the damage location with obvious destruction in structures and micro-foci of liquefaction, the gray and white matter couldn’t be recognized.
图1 单侧腰椎脊髓损伤的大体观和组织学形态
2 脊髓损伤局部注射BoNT/A重链对局部蛋白表达谱的影响
损伤后2 d脊髓局部的蛋白表达与正常对照组相比,损伤局部的蛋白表达谱发生明显变化,其中主要表现在分子量为180 kD、120 kD、40 kD及30 kD附近的蛋白表达量明显增加,而分子量约在65 kD的蛋白质降解成数条蛋白带,分子量约在75 kD的蛋白表达减少。BoNT/A重链注射后2 d及20 d,上述相应部位的蛋白表达不同程度地趋向于正常对照组的表达谱特征;更值得注意的是,在6 μg BoNT/A HC注射后20 d左右,分子量约在75 kD、65 kD及20 kD部位的蛋白表达量甚至超过正常对照组。凝胶电泳的考马斯亮蓝染色的初步结果提示BoNT/A HC可能干预脊髓损伤后损伤局部蛋白的表达,见图2。

Figure 2.The comparison of protein expression in spinal cord tissue after unilateral spinal cord injury with different doses of BoNT/A heavy chain injection. *: the protein bands displayed various changes after injury of spinal cord, most of which increased and some degraded; #: the obvious reversal effect of BoNT/A heavy chain on the proteins with decreased expression after spinal cord injury; !: BoNT/A heavy chain reduced the protein expression which appeared increased after injury.
图2 单侧脊髓损伤并注射不同剂量的BoNT/A HC后损伤脊髓组织中蛋白表达的比较
3 BoNT/A 重链干预脊髓损伤局部蛋白表达
双向电泳结果显示脊髓损伤后局部蛋白整体表达谱发生明显变化,一些蛋白表达明显增多,而另一些蛋白的表达则减少或消失。这些蛋白表达的变化有些呈集中趋势,表现为蛋白组群整体变化,而大部分则为一些散在的蛋白表达点的变化。总体上看,可以将这些蛋白表达发生变化的区域按照等电点(isoelectronic point,pI)及分子量(molecular weight,MW)的交叉分成4个亚区: a区: pI在8~9, MW为60~110 kD; b区: pI在5~6, MW为25 kD左右; c区: pI在6~7, MW为20 kD左右; d区: pI接近8, MW为45 kD左右,见图3。
将上述部位进一步放大可以看到,单纯损伤后a区的蛋白表达呈点群表达量增多,主要集中于MW接近60 kD水平上有多组蛋白表达水平较正常对照组显著增多(P<0.01);除此外,MW在110 kD水平位置的蛋白表达也明显增强。BoNT/A 重链注射后2 d,上述2个部位的蛋白表达即表现明显下降,注射后20 d时,上述部位蛋白表达特征与正常对照组极相似,差异无统计学显著性,见图4。 单纯损伤时c区的突出变化是在分子量为18.4 kD及20 kD的水平上分别出现2个新的蛋白表达点。BoNT/A 重链用药2 d时18 kD水平的蛋白表达明显降低,而对20 kD位置的蛋白表达未显示干预作用;用药20 d时,上述2个位点的蛋白表达与正常对照组基本接近,差异无统计学显著性,见图5。

Figure 3.Analysis of the protein expression in the spinal cord tissue after unilateral spinal cord injury with different doses of BoNT/A heavy chain injection by 2-demensional SDS-PAGE. a, b, c and d pointed the location where the protein expression altered after injury and intervention with BoNT/A heavy chain. MW: molecular weight; pI: isoelectronic point.
图3 单侧脊髓损伤并注射BoNT/A HC不同时间后脊髓组织蛋白表达的双向电泳分析
单纯脊髓损伤时b区和d区2个部位分别有数个蛋白点呈现表达降低,第1个蛋白点出现在b区,分子量约为50 kD左右,损伤后表达基本消失;第2个及第3个出现在d区,分子量基本接近,在25 kD左右,二者损伤时皆表达减少。采用BoNT/A 重链后2 d,b区的蛋白表达有所回升,用药达20 d时,蛋白表达水平基本达到正常对照组水平,而d区的2个蛋白点在BoNT/A 重链用药2 d时,表达呈现回升,用药达20 d时又表现减少,差异有统计学意义(P<0.01),见图6。
总之,在体脊髓损伤时脊髓局部组织蛋白质表达变化非常显著,一些蛋白质组群表达增强,甚至出现新的蛋白质,而另外一些蛋白表达则明显降低。BoNT/A重链的给予可以使这些由于损伤发生变化的蛋白质出现向正常转化的趋势,使损伤后表达增强的蛋白质趋于降低,表达减少的蛋白质趋于增多,且随着给药后时间的延长这种逆转作用表现更为突出。

Figure 4.Comparison of the protein expression at the selective location from Figure 3a (MW range: 45~116.2 kD). →: the protein located at 100 kD level;: the protein located at 60 kD. Mean±SEM.n=4.**P<0.01vscontrol;##P<0.01vsinjury group.
图4 图3中a区域蛋白表达的比较

Figure 5.The comparison of the protein expression at the selective location from Figure 3c (MW range: 14~20 kD). →: the protein located at 20 kD level;: the protein located at 18 kD. Mean±SEM.n=4.**P<0.01vscontrol;#P<0.05,##P<0.01vsinjury group.
图5 图3中c区域蛋白表达的比较

Figure 6.The comparison of the protein expression at the selective location from Figure 3d (A; MW range: 45~60 kD) and Figure 3b (B; MW range: 20~30 kD). →: MW was around 50 kD;: MW was around 23 kD;: MW was around 25 kD. Mean±SEM.n=4.**P<0.01vscontrol;##P<0.01vsinjury group.
图6 图3中d和b区域蛋白表达的比较
讨 论
脊髓损伤后的修复是临床医学的难题之一,探索能够促进脊髓损伤后修复或寻找能刺激局部存活神经细胞恢复再生能力的新药/制剂是神经科学领域重要研究方向。迄今,很多研究者对此进行了多种尝试,譬如:在椎管内注入神经营养因子;将神经干细胞植入损伤局部;按照中医的方法进行针灸、按摩、电针或中药离子导入,促进患者脊髓功能的康复[8-10]。然而,由于上述各种治疗的局限或不确定性,目前仍未找到治疗脊髓损伤后再生的有效药物及疗法。
BoNT/A与神经再生之间的关系起源于对肉毒毒素局部注射后期出现新的运动终板样结构的形成及体外实验BoNT/A可刺激原代运动神经元神经突起生长[4]。BoNT/A的化学结构为蛋白多肽,分为重链和轻链,两者借二硫键相互连接。毒素重链主要与宿主细胞膜上的特异受体结合介导毒素入胞;进入胞浆的轻链是毒素发挥毒性的催化单位[11]。采用商品化的人工重组的BoNT/A重链仅保留毒素的入胞结构域而排除了毒素的毒性结构。因此,这种人工重组的BoNT/A重链体内应用不会引起肉毒毒素中毒反应,而且毒素重链与宿主细胞膜上相应受体的结合及随后的受体-配体内吞入胞势必会引起细胞内某些信号系统的激活。我们前期的体外实验已经证实人工重组的BoNT/A重链可促进Neuro-2a细胞突起增长并可促进某些再生相关信号分子,譬如ERK1/2及Akt的磷酸化[5-6]。
脊髓损伤后采用BoNT/A重链干预是否可促进局部的损伤修复目前尚无报道。在本实验中当损伤同时给予BoNT/A重链后一定时间,可使损伤后某些增加或减少的蛋白质表达量趋于正常化,SDS-PAGE+考马斯亮蓝及2-D胶电泳的结果提示BoNT/A 重链对脊髓损伤后蛋白产生干预作用的位点分布相对较广,较为明显的变化出现在分子量为60~110 kD、45 kD及18~25 kD的蛋白点或组群。在单纯损伤时,这些部位的蛋白表达有些增高,有些降低,甚至损伤后出现个别新的蛋白表达点,当采用不同剂量BoNT/A重链注射后,这些损伤后的蛋白表达谱呈现逆转性变化、与正常对照组的脊髓蛋白表达谱接近,尤以用药后20 d时表现明显;多数观察到的蛋白变化在损伤后给药2 d与给药20 d呈现逐步恢复到正常的趋势,与单纯损伤时相比差异有统计学意义,总体上体现了BoNT/A重链逆转损伤所带来的脊髓蛋白表达异常的作用。
发育成熟的中枢神经细胞基本丧失其再生能力,即使神经元仍然存活,其上行突起也不能再生,不能与上一级神经细胞的轴突形成突触;另外中枢神经系统损伤时伴有的髓鞘崩解破坏而产生的髓磷脂抑制因子,通过与神经细胞膜上相应受体结合而发挥其对轴突生长的抑制作用,与此同时,髓鞘崩解产物刺激胶质细胞增生形成的胶质瘢痕也对神经细胞的再生修复产生阻碍。因此,不论是脑还是脊髓损伤后,这些髓磷脂相关抑制因子及其胶质瘢痕蛋白的表达增加。据文献报道,可溶性髓磷脂相关糖蛋白(myelin-associated glycoprotein,MAG)和少突细胞髓磷脂糖蛋白(oligodendrocyte myelin glycoprotein,OMgp)分子量皆在110 kD左右,这些蛋白皆属于髓磷脂抑制因子[12]。本实验中发现单纯脊髓损伤时MW在110 kD、pI为8左右的蛋白点或蛋白组群数量表达明显增多,当采用BoNT/A重链后2 d时这些分子量水平的蛋白组群数量及蛋白表达均有所下降,到20 d时呈现与正常对照组类似的水平。另外,双向电泳结果显示MW在60 kD左右、pI为8~9的碱性蛋白质在损伤后也明显增多,当采用BoNT/A重链后2 d这些分子量水平的蛋白组群数量及蛋白表达均也有所下降,到20 d时也呈现与正常对照组类似的水平。研究结果已经证实,Nogo-66(来源于髓磷脂的另一种生长抑制蛋白)以及髓磷脂抑制因子受体的分子量分别为66 kD和65 kD[13]。中枢神经系统损伤后局部所产生的大量髓磷脂抑制因子与神经轴突膜上相应受体结合、激活细胞内抑制信号通路(譬如RhoA-ROCK-MLC)最终导致成熟中枢神经系统神经元轴突再生抑制。从上述2个位点的蛋白表达谱变化可以推测,BoNT/A 重链局部注射可能一方面通过干预髓磷脂抑制因子的产生或降解而削弱其抑制作用;另一方面可能通过减少神经轴突膜上神经抑制因子相应受体的表达而减少髓磷脂抑制因子的作用。因此,BoNT/A 重链促神经再生的现象有可能通过降低髓磷脂抑制因子的抑制作用而实现。
除此之外,实验中还观察到单纯脊髓损伤时MW在45 kD、pI为碱性的一些蛋白表达点较正常对照组明显减少,而在BoNT/A重链注射后2 d就显示其表达灰度值有所恢复,甚至较正常对照组略偏高。 就目前所知,体内一些再生相关蛋白或再生相关信号蛋白,譬如ERK1/2、Akt、GAP-43、Wnt/β-catenin、Eph-Ephrin、JNK等蛋白分子量多在40~55 kD之间[5-6, 14-15]。ERK1/2、Akt是目前公认的参与组织细胞再生的重要信号蛋白;生长相关蛋白43是一种胞膜磷酸蛋白质,与神经再生关系密切。损伤后再生能力越强,再生的轴突末梢生长相关蛋白-43的表达也就越明显[16]。有文献报道增加Wnt/β-catenin、Eph-Ephrin及JNK的表达或促进激活可以促进中枢神经系统的再生。因此本实验结果提示,BoNT/A重链可能在抑制髓磷脂抑制因子及其受体的同时,促进神经突起或细胞内一些参与再生的信号蛋白分子的表达。事实上,我们前期的体外实验结果已经证实BoNT/A重链可促进ERK1/2和Akt/PKB的磷酸化[5]。
在本实验中还观察到,MW约在25 kD、pI为5~6的一些小分子蛋白在单纯损伤时表达减少,而在BoNT/A重链用药2 d时表达明显增多,但用药达20 d时则变化不明显。小鸟嘌呤核苷三磷酸酶的Rho家族成员——RhoA、Rac1、Cdc42等皆属于小分子蛋白[17]。如前所述,RhoA是细胞内生长抑制信号通路中的重要启动蛋白,RhoA的表达减少或抑制则标志着下游信号通路不能被激活,神经生长抑制作用被削弱。然而,由于只是在BoNT/A重链注射后2 d时小分子水平的蛋白表达较单纯损伤组减少,而用药时间达到20 d时这种现象消失,因此考虑这种变化可能属于BoNT/A重链对某些蛋白表达的短效作用。
总之,上述多个位点的蛋白表达变化特征提示,脊髓损伤后给予BoNT/A重链可以干预局部蛋白的表达、促进损伤后局部蛋白代谢趋向正常化; BoNT/A重链可能通过多种机制促进神经损伤后修复再生,譬如削弱神经生长抑制因子的抑制作用,增强再生相关蛋白的表达等。
由于本实验所得结果仅仅是脊髓损局部的整体蛋白表达谱的变化,就目前的结果也还不能解释BoNT/A重链干预脊髓损伤后蛋白的具体机制。然而蛋白表达谱的变化对于阐明BoNT/A重链在脊髓损伤后再生修复中的作用至关重要,因此,有待于今后在此基础上进行蛋白质谱并结合蛋白生物信息学技术对BoNT/A重链所引起的脊髓损伤后蛋白表达的逆转进行更进一步的分析,以期最终能够阐明BoNT/A重链干预神经损伤后再生的确切机制。
[1] Blasi J, Chapman ER, Link E, et al. Botulinum neuroto-xin A selectively cleaves the synaptic protein SNAP-25[J]. Nature, 1993, 365(6442):160-163.
[2] Whitemarsh RC, Tepp WH, Johnson EA, et al. Persis-tence of botulinum neurotoxin A subtypes 1-5 in primary rat spinal cord cells[J]. PLoS One, 2014, 9(2):e90252.
[3] Dressler D. Clinical applications of botulinum toxin[J]. Curr Opin Microbiol, 2012, 15(3):325-336.
[4] Coffield JA, Miletic V, Zimmermann E, et al. Demonstration of thyrotropin-releasing hormone immunoreactivity in neurons of the mouse spinal dorsal horn[J]. J Neurosci, 1986, 6(4):1194-1197.
[5] 高美玲, 王 红, 张彩云, 等.血清型A 肉毒杆菌神经毒素重链对Neuro-2a 细胞的促神经突起再生作用[J]. 中国病理生理杂志, 2015, 31(12):2221-2227.
[6] 王 红, 高美玲, 兰 婧, 等. 小鼠神经母细胞瘤细胞株用于A型肉毒毒素重链体外实验的可行性研究[J]. 中华细胞与干细胞杂志, 2015, 5(4):241-249.
[7] Peng WS, Qi C, Zhang H, et al. Distribution of paired immunoglobulin-like receptor B in the nervous system related to regeneration difficulties after unilateral lumbar spinal cord injury[J]. Neural Regen Res, 2015, 10(7):1139-1146.
[8] Ansorena E, De Berdt P, Ucakar B, et al. Injectable alginate hydrogel loaded with GDNF promotes functional recovery in a hemisection model of spinal cord injury [J]. Int J Pharm, 2013, 455(1-2):148-158.
[9] Lu P, Woodruff G, Wang Y, et al. Long-distance axonal growth from human induced pluripotent stem cells after spinal cord injury[J]. Neuron, 2014, 83(4):789-796.
[10]施海燕, 郝又国, 陆伟伟. 脊髓损伤的康复治疗进展[J]. 中国康复, 2012, 27(1):44-46.
[11]李夏青.肉毒杆菌毒素的临床应用及其前景[M]. 第1版.北京:知识产权出版社, 2012: 13-32.
[12]Lee JK, Geoffroy CG, Chan AF, et al. Assessing spinal axon regeneration and sprouting in Nogo-, MAG-, and OMgp-deficient mice[J]. Neuron, 2010, 66(5):663-670.
[13]Rolando C, Parolisi R, Boda E, et al. Distinct roles of Nogo-A and Nogo receptor 1 in the homeostatic regulation of adult neural stem cell function and neuroblast migration[J]. J Neurosci, 2012, 32(49):17788-17799.
[14]Gwak YS, Unabia GC, Hulsebosch CE. Activation of p-38α MAPK contributes to neuronal hyperexcitability in caudal regions remote from spinal cord injury[J]. Exp Neurol, 2009, 220 (1):154-161.
[15]Vaz AR, Silva SL, Barateiro A, et al. Pro-inflammatory cytokines intensify the activation of NO/NOS, JNK1/2 and caspase cascades in immature neurons exposed to elevated levels of unconjugated bilirubin[J]. Exp Neurol, 2011, 229(2):381-390.
[16]Yuan Q, Hu B, Chu TH, et al. Co-expression of GAP-43 and nNOS in avulsed motoneurons and their potential role for motoneuron regeneration[J]. Nitric Oxide, 2010, 23(4):258-263.
[17]Guo XD, Zahir T, Mothe A, et al. The effect of growth factors and soluble Nogo-66 receptor protein on transplanted neural stem/progenitor survival and axonal regeneration after complete transection of rat spinal cord [J]. Cell Transplantation, 2012, 21(6):1177-1197.
(责任编辑: 林白霜, 罗 森)
Botulinum neurotoxin type A heavy chain intervenes in expression of ge-neral proteins in spinal cord after unilateral spinal cord injury in rats
LAN Jing, WANG Hong, BAI Juan, WANG Ya-fang, LI Xia-qing
(DepartmentofPathophysiology,ShanxiMedicalUniversity,Taiyuan030001,China.E-mail:xqli2013@126.com)
AIM: To observe the effect of botulinum neurotoxin type A heavy chain (BoNT/A HC) on the pattern of spinal protein expression by intrathecal injection after spinal cord injury in rats, and to explore the role of BoNT/A HC intervention in spinal protein expression and some of its mechanisms in nerve regeneration after injury. METHODS: The model of unilateral lumbar spinal cord injury was established. The effects of BoNT/A HC intervention at different doses (2 μg, 4 μg, 6 μg and 8 μg) on the general pattern of protein expression in the spinal cord tissues at the injury site and the cranial part adjacent to the injury site was measured and evaluated by SDS-PAGE and Coomassie brilliant blue staining first, and then by two-dimensional SDS-PAGE. RESULTS: The histological structure of the ipsilateral side of lumbar spinal cord showed obvious destruction and degradation, mainly affecting both gray and white matter of the left side of the cord. The result of SDS-PAGE with Coomassie brilliant blue staining from injured spinal cord tissue displayed that the expression of some proteins after one-time BoNT/A HC treatment appeared obviously different from that without BoNT/A HC treatment. Moreover, the pattern of the protein expression affected by BoNT/A HC was similar to that of the normal spinal cord. The more detail information from two-dimensional SDS-PAGE indicated that more than 10 proteins with different molecular weight and isoelectronic points were differentially expressed at day 2 and day 20 after local injection of 6 μg BoNT/A HC. This altered expression actually appeared a tendency toward the pattern shown in normal group. CONCLUSION: The immediate application of BoNT/A HC at the injury site after unilateral lumbar spinal cord injury is able to affect the pattern of local protein expression. The altered protein expression by injury could be reversed back to normal or approximately normal by local BoNT/A HC administration.
Spinal cord injury; Botulinum neurotoxin type A heavy chain; Nerve injury; Nerve regeneration
1000- 4718(2016)12- 2125- 08
2016- 07- 08
2016- 09- 09
国家自然科学基金资助项目(No. 81171178);山西省回国留学人员科研资助项目(No. 2012046)
R363.2+1
A
10.3969/j.issn.1000- 4718.2016.12.002
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0351-4135067; E-mail: xqli2013@126.com

