小麦穗突变体 Sda1与其野生型叶片总蛋白双向电泳体系的建立
周丽敏,马文洁,武炳瑾,张德强,杨智全,孙道杰
(西北农林科技大学农学院,陕西杨凌 712100)
小麦穗突变体 Sda1与其野生型叶片总蛋白双向电泳体系的建立
周丽敏,马文洁,武炳瑾,张德强,杨智全,孙道杰
(西北农林科技大学农学院,陕西杨凌 712100)
为探索适合小麦穗突变体 Sda1叶片蛋白的双向电泳体系,寻找Sda1与其野生型叶片的差异蛋白,以Sda1与其野生型的抽穗期叶片为材料,从蛋白质提取、双向电泳条件等方面对适合 Sda1及其野生型叶片蛋白的双向电泳体系进行探索。分析试验得到的双向电泳图谱,发现利用TCA/丙酮提取叶片总蛋白,用pH 4~7的17 cm线性胶条,采用13%浓度的分离胶,上样量为900 μg,利用改良的等电聚焦程序,能够得到背景清晰、分辨率高的电泳图谱;电泳图谱在低分子区蛋白点分布均匀,并且重复性好。利用PDQuest 8.0.1 软件分析图谱,得到27个差异点蛋白,相比于野生型植株, Sda1突变体表现为蛋白表达量下调与缺失,发现6个缺失蛋白,21个表达下调蛋白。
小麦;穗突变体;叶片;双向电泳;2-DE图谱
小麦是中国的主要粮食作物之一,产量性状的改良是目前小麦遗传改良的重要方面[1]。对小麦产量性状影响较大的是穗部性状,包括穗粒数、小穗数、千粒重等[2]。旗叶是籽粒干物质积累的重要来源[3],研究小麦穗突变体 Sda1及其野生型叶片的蛋白质组学,对提升小麦穗粒数与叶片的“源-库”关系的认识具有重要意义。
蛋白质组技术是后基因组时代的重要工具,它是在基因表达水平上对生命活动的本质进行研究,常利用高分辨蛋白质双向电泳技术对蛋白质进行分离。双向电泳技术(two-dimensional electrophoresis, 2-DE)作为蛋白质分离的重要手段,是目前蛋白质组学研究中应用最广泛的一种蛋白分析方法[4-6]。蛋白样品的成功制备是双向电泳实验成功的前提,双向电泳技术的难点在于蛋白样品的提取、等电聚焦(IEF)条件的选择。关于小麦幼穗[7]、籽粒谷蛋白[8]、叶片[9]、花药[10]等蛋白质组学的研究,在蛋白质提取、双向电泳条件的探索等方面已有大量报道。TCA/丙酮沉淀法是传统的蛋白制备方法,但存在蛋白沉淀不完全、复溶较为困难、无法完全去除盐离子等缺陷[9]。而TCA/丙酮沉淀-酚/SDS联合抽提法能够使沉淀中残留的酚类、脂质、色素等次级代谢物极大的去除[11]。小麦叶片蛋白质的提取、分离、鉴定等受小麦叶片中的次级代谢产物如酚类、多糖、脂质、核酸、盐离子影响,不同品系小麦叶片中的次级代谢物含量不同。虽然利用TCA/丙酮沉淀法[9]、酚提取-甲醇/醋酸铵沉淀[12]、尿素/硫脲法[12]、TCA/丙酮沉淀-酚/SDS联合抽提法[11],都得到了清晰的双向电泳图谱,但由于次级代谢物的影响,还需根据不同的小麦品系选择合适的提取方法。
双向电泳中的等电聚焦程序是双向电泳成功与否的另一重要影响因子。前人对等电聚焦条件的选择多参照O′Farrell[13]的方法,大多只有主动水化(主动水化是在低电压条件下除去样品中的盐分,使大分子量蛋白质进入胶条的过程,但容易使小分子蛋白部分损失[14];被动水化是在没有电压条件下通过胶条的吸附使小分子蛋白进入胶条,可以有效减少蛋白沉淀,但容易使小分子蛋白到达等电点而堵塞胶条上的胶孔,大分子的蛋白难以进入胶条)。齐婷婷等[15]提出了小麦叶片蛋白的被动水化研究,但由于受提取方法的影响,图谱结果不是很理想。
小麦叶片双向电泳第二向SDS-PAGE中的胶浓度多为12%[9-12],由于蛋白质种类以及分子量的不同需要选择不同的胶浓度,但目前关于小麦突变体 Sda1的双向电泳体系还未见报道。
为了得到蛋白质点清晰、分辨率高的Sda1突变体叶片蛋白2-DE图谱,本研究从样品制备、电泳条件中等电聚焦程序、第二向分离胶浓度等方面进行改进和优化,以期找到适合该穗突变体叶片的双向电泳体系,为双向电泳体系条件的改进和优化提供新的方向。
1 材料与方法
1.1 材 料
2009年5月在本课题组育种材料中发现小麦穗部发育异常的突变体Sda1,该突变体由隐性单基因控制,并且突变性状只能通过杂合体自交遗传[16]。该突变体整体表现为穗小,雄蕊败育,雌蕊发育不良且形态不完整,植株矮,叶片短小细窄,不易产生种子。 2014年6月份随机收获没有发生突变的植株上的小麦籽粒,当年10月份种植于杨凌实验田中,2015年4月在突变性状发生的抽穗期,取穗伸出旗叶叶鞘2 cm的Sda1突变体与其野生型叶片,存放于-80 ℃冰箱备用。
1.2 仪器和试剂
PROTEAN IEF cell等电聚焦系统(美国Bio-Rad公司),PROTEAN Ⅱ xi Cell垂直电泳系统(美国Bio-Rad公司),Power Look 2100XL扫描仪(美国UMAX公司)。pH 4~7线性17 cm IPG干胶条、载体两性电解质(pH4~7)、矿物油均购自美国Bio-Rad公司;Sigma公司的二硫苏糖醇(DTT)、尿素、硫脲,Sigma公司进口分装的CHAPS、碘乙酰胺;Tris饱和酚、SDS、蔗糖、 β-巯基乙醇、盐酸、TEMED、丙烯酰胺、N,N′-2甲叉双丙烯酰胺、甘氨酸、过硫酸铵(AP)等均为国产分析纯。
1.3 蛋白提取方法
1.3.1 TCA/丙酮沉淀法
蛋白样品提取参照刘 卫等[10]的TCA/丙酮沉淀法,蛋白提取液用2 mL无酶离心管分装于-80 ℃保存备用。
1.3.2 酚/SDS抽提法
参照李红兵等[11]的方法,每研磨1 g叶片加入10 mL TCA/丙酮提取液(10% TCA,0.2% DTT),反复颠倒混合,-20 ℃沉淀过夜提取蛋白质,4 ℃下16 000 r·min-1离心10 min,弃上清;沉淀用含100 mmol·L-1醋酸铵的80%甲醇溶液洗1次,80%丙酮洗1次,通风橱内室温干燥10 min;加入10 mL酚/SDS抽提液[pH 8.0的Tris饱和酚与SDS(十二烷基硫酸钠)缓冲液1∶1混合,其中SDS缓冲液成份为:30%蔗糖、 2%SDS、 5%β-巯基乙醇]、0.1 mol·L-1醋酸铵的甲醇溶液,-20 ℃沉淀4 h;4 ℃下16 000 r·min-1离心10 min,弃上清液,沉淀用甲醇洗1次,80%丙酮洗1次,通风橱内自然风干,按1 mg加入30 μL蛋白质裂解液(7 mol·L-1尿素,2 mol·L-1硫脲,4% CHAPS,65 mmol·L-1DTT, 2% pH 4~7 载体两性电解质)通风橱内室温裂解蛋白样品,至沉淀不再生成为止。16 000 r·min-1离心20 min,取上清液于无酶离心管中,即为蛋白提取液,用2 mL无酶离心管分装于-80 ℃保存备用。
1.4 等电聚焦电泳
用Bio-Rad 公司的IPGphor 电泳仪进行第一向等电聚焦电泳,其中蛋白质上样量约为900 μg,总上样量体积为 350 μL(pH 4~7,17 cm线性 IPG 预制胶条),水化和聚焦的温度为 20 ℃,聚焦完毕后,胶条先在 5 mL 胶条平衡缓冲液Ⅰ(0.375 mol·L-1的Tris-HCl,pH 8.8,7 mol·L-1尿素,30%甘油,5% SDS,2% DTT)中平衡15 min,再于5 mL胶条平衡缓冲液Ⅱ(2.5%碘乙酰胺替代2% DTT,其余组分同平衡缓冲液Ⅰ)中平衡 15 min,然后进行第二向 SDS-聚丙烯酰胺凝胶电泳,采用12%和13%两种浓度的SDS-PAGE分离胶进行试验,本研究的改良程序见表1,比经典的等电聚焦程序增加了一步被动水化和500 V、线性的除盐过程。
1.5 2-DE图谱分析
用Power Look 2100XL扫描仪对染色、脱色后双向电泳的凝胶进行扫描,分辨率为300 dpi。用PDQuest 8.0.1凝胶图谱分析软件对凝胶中蛋白质斑点的大小、数目等进行配比分析。
2 结果与分析
2.1 蛋白提取方法的比较
采用TCA/丙酮沉淀法和酚/SDS抽提法两种方法提取的蛋白样品,在相同的电泳条件下经多次试验均获得了清晰的双向电泳图谱。通过比较发现,不同的蛋白提取方法获得的图谱之间,无论在质量还是蛋白点数上都存在显著差异。
TCA/丙酮沉淀法提取的蛋白电泳图谱(图1-A)蛋白质点数多且蛋白形状规则、清晰。酚/SDS抽提法得到的电泳图谱(图1-B)较TCA丙酮沉淀法蛋白质点明显变少,尤其在酸性端,蛋白丢失严重,不符合获得叶片总蛋白这一要求。虽然酚/SDS抽提法在上部高丰度蛋白处能明显消除干扰的影响,但是蛋白丢失严重,所以后续实验采用TCA/丙酮沉淀法提取蛋白质。
表1 本实验改良的等电聚焦电泳程序
Table 1 Procedures of improved isoelectric focusing electrophoresis
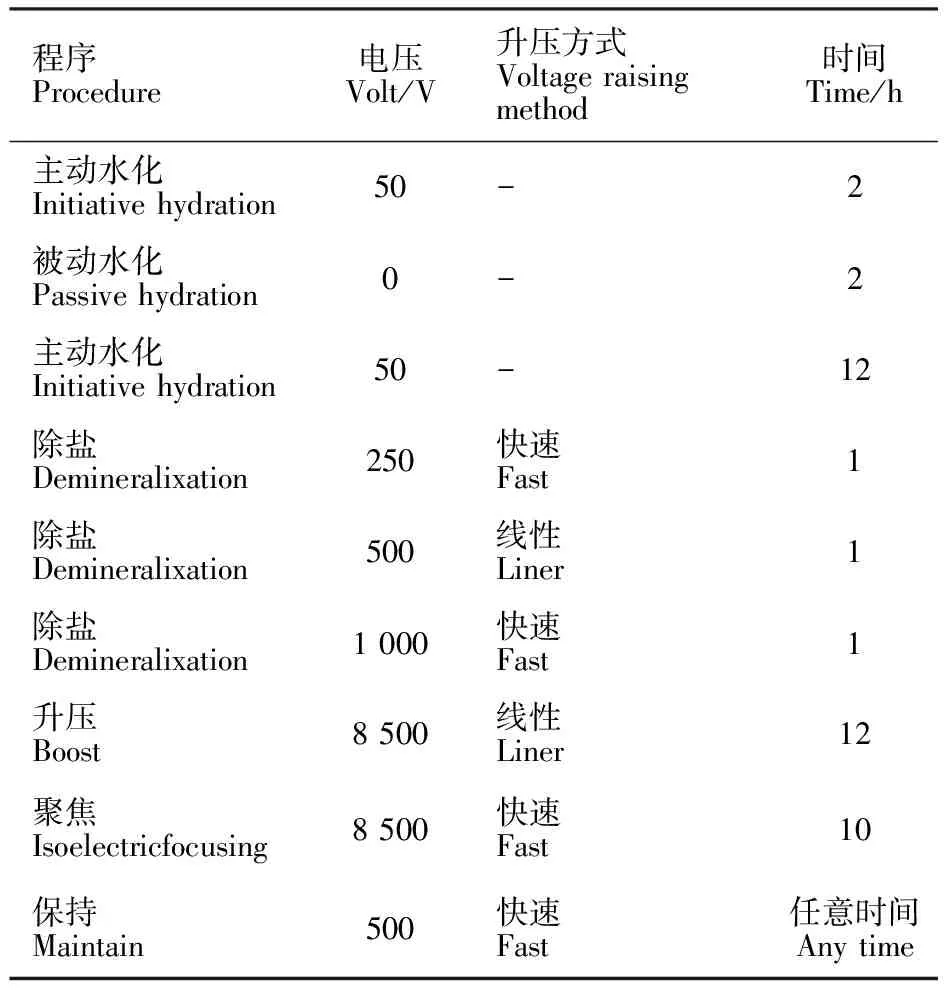
程序Procedure电压Volt/V升压方式Voltageraisingmethod时间Time/h主动水化Initiativehydration50-2被动水化Passivehydration0-2主动水化Initiativehydration50-12除盐Demineralixation250快速Fast1除盐Demineralixation500线性Liner1除盐Demineralixation1000快速Fast1升压Boost8500线性Liner12聚焦Isoelectricfocusing8500快速Fast10保持Maintain500快速Fast任意时间Anytime
2.2 第二向电泳SDS-PAGE胶浓度的选择
利用前人的研究结果[ 9-12],第二向凝胶电泳采用浓度为12%的凝胶(图2-A),起始时用低电流(10 mA·gel-1),待样品完全走出 IPG胶条,浓缩成一条线后,再加大电流至恒直流电20 mA·gel-1,待溴酚蓝指示剂达到底部边缘时停止电泳。从图2中发现12%的分离胶中小分子蛋白未能得到较好的分离,且整体来看条带在胶下方;在相同电泳条件下用13%的凝胶进行电泳,观察胶浓度对蛋白质分离效果的影响,发现在13%的分离胶中, 蛋白条带清晰且分布均匀(图2-B)。
2.3 等电聚焦电泳程序的比较
将TCA/丙酮沉淀法提取的 Sda1穗突变体叶片蛋白用17 cm、pH 4~10的线性胶条进行双向电泳,图3-A为参照Görg等[17]的方法,同时添加500 V,线性,1 h的盐离子去除步骤进行的。图3-B是按表1程序(本实验改良的等电聚焦电泳程序)进行的凝胶电泳图像。图3-A虽然得到了清晰的蛋白质点,但是蛋白分点较少,图3-B则得到了较多的小分子量蛋白点,且分离效果较好。
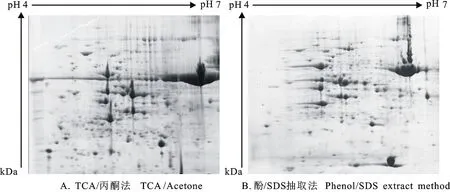
图1 不同提取方法的凝胶图

图2 不同浓度凝胶的2-DE图谱
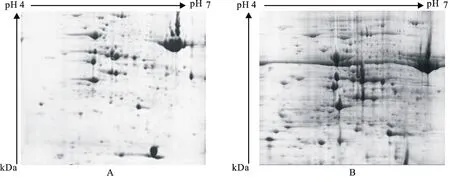
图3 经典等电聚焦电泳程序(A)及本研究改良电泳程序(B)的2-DE图谱
2.4 Sda1突变体与其野生型叶片总蛋白的差异
利用以上得到的适合该突变体的双向电泳条件,得到 Sda1突变体和野生型的差异蛋白结果(图4),利用PDQuest 8.0.1 软件分析得到27个差异点蛋白,其中有21个蛋白在 Sda1中表达下调,6个表现为缺失。
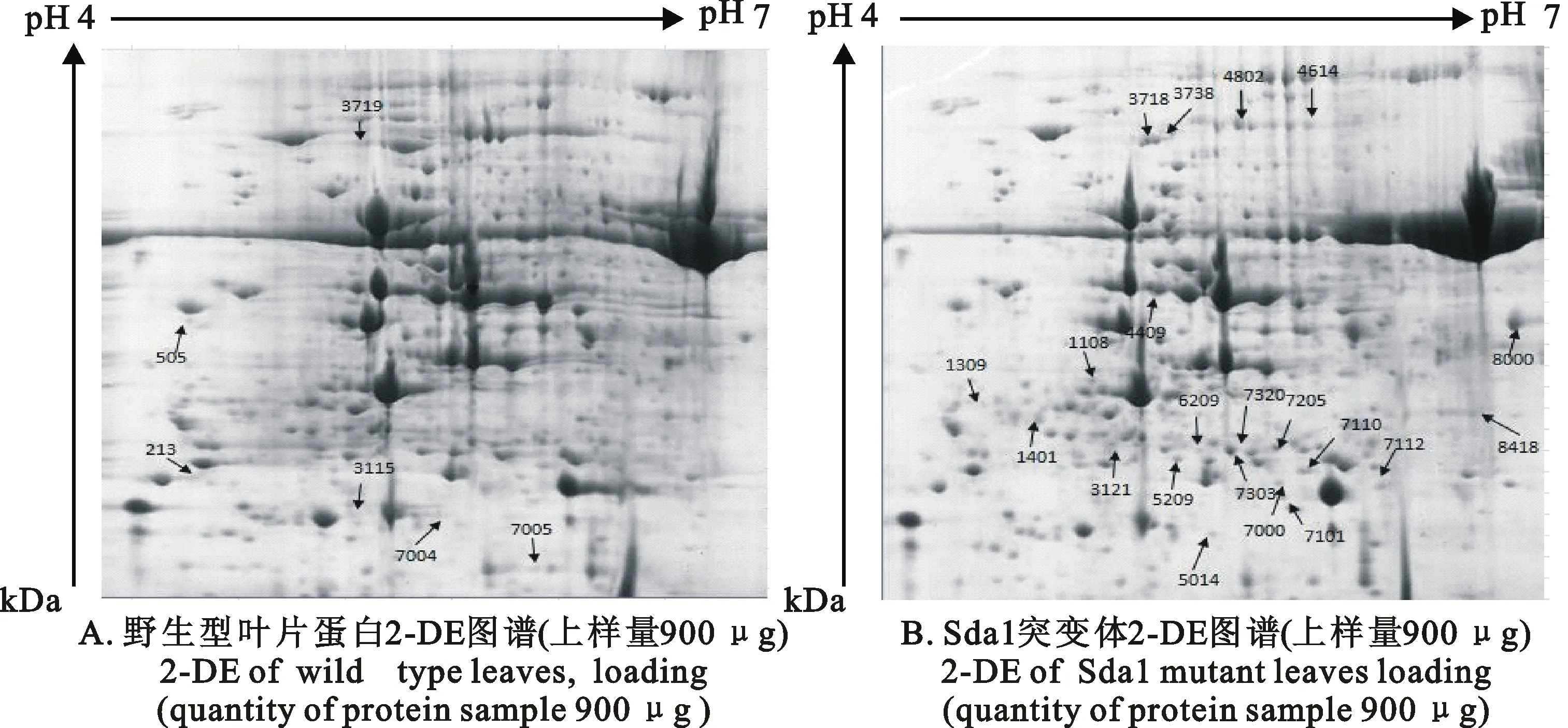
图4 Sda1突变体与野生型抽穗期叶片总蛋白2-DE图谱
3 讨 论
3.1 蛋白提取方法的选择
本研究利用TCA/丙酮沉淀法结合酚/SDS抽提法制备叶片蛋白样品,试验结果蛋白质点清晰、背景清楚、蛋白质点分布均匀。但是利用此方法电泳图谱蛋白质点总数少,尤其在胶图下端低分子量区域的蛋白质点明显较少。笔者还同时利用传统的TCA/丙酮沉淀法制备蛋白进行双向电泳,图谱结果(图1-A)得到的胶图点分布均匀、清晰、且横纹较少。我们分析酚/SDS联合抽提法可能在抽提过程中导致一些小分子蛋白丢失或者一些水溶性蛋白转移到水相中导致蛋白缺失。本研究结果与刘伟霞等[12]利用酚提取-甲醇/醋酸铵沉淀法得到的小麦叶片图谱结果一致。本研究利用传统TCA/丙酮沉淀法制备蛋白样品时,针对该方法复溶较为困难,在蛋白样品制备后立即进行浓度测定定量、上样进行电泳。对无法完全去除盐离子的问题,通过双向电泳等电聚焦时第一向增加500 V,线性,1 h的盐离子去除步骤来解决,得到比较好的胶图,蛋白质点分布均匀、清晰、且横纹较少。
3.2 电泳条件的优化
3.2.1 等电聚焦(IEF)电泳程序的选择
适宜的等电聚焦程序能够使蛋白质有效进入胶条,进而获得理想的凝胶图谱。等电聚焦的好坏会直接影响双向电泳图谱的质量[12]。等电聚焦过程是在电泳槽中放有两性电解质并通以直流电,两性电解质形成一个由阳极到阴极逐步增加的pH梯度,蛋白质在电流作用下聚焦于与该蛋白质点相等等电点和相等pH点 的IPG胶条上。Westermeier[18]发现蛋白质与上样缓冲液混合后,在室温条件下被动水化容易使蛋白降解,在蛋白溶胀过程中施加低电压可以使大分子蛋白进入胶条。因此合适的等电聚焦程序需根据组织蛋白特性使主动水化与被动水化相结合,使蛋白质点在 IPG胶条上被较好的吸收。
本研究首先在低电压条件50 V, 2 h,使得蛋白样品移动到对应的等电点,再利用0 V,2 h的被动水化过程,使得小分子蛋白得到充分吸收,再在50 V,12 h的主动水化条件下使大分子蛋白进入胶条。等电聚焦结果在SDS-PAGE胶上均匀分离,得到较好的电泳图谱,方便筛选蛋白差异点并进行鉴定[12-18]。另外,盐离子影响蛋白质电泳图谱质量[6]。本实验通过利用比其他实验[12,15,18]多一步的除盐程序并且采取逐步升压的方式,所得到的两张胶图中的竖条纹干扰较少,分辨率高。并且图3B较图3A的蛋白质点多,证明被动水化使得蛋白分子能够被充分吸收。
3.2.2 双向电泳不同胶浓度的选择
分离胶把经过第一向等电聚焦到IPG胶条中的蛋白在SDS-PAGE胶中按蛋白分子大小分离出来,实验中要根据不同的植物组织选择不同的胶浓度。本试验先采用前人小麦叶片蛋白双向电泳[11,19]采用的12%分离胶,因胶分子之间孔隙较大,小分子蛋白容易透过胶之间的孔隙,不易分离。本实验后又采用13%的SDS-PAGE胶,增加了低分子量区的分离效果,2-DE图谱效果较好,可以避免蛋白丢失导致的结果不准确。因此,针对不同的蛋白样品应选择不同的分离胶浓度。
3.3 小麦穗突变体 Sda1与其野生型的差异
Sda1突变体较其野生型整体表现雄蕊败育,穗小、雌蕊发育不良并且形态不完整,植株矮、叶片窄小、不易产生种子,这些性状表现可能与相关蛋白的表达下调或缺失有关。
[1] 何中虎,夏先春,陈新民.中国小麦育种进展与展望[J].作物学报,2011,37(2):202.
HE Z H,XIAN X C,CHEN X M.Progress of wheat breeding in China and the future perspective [J].ActaAgronomicaSinica,2011,37(2):202.
[2] 郭天财,冯 伟,赵会杰,等.两种穗型冬小麦品种旗叶光合特性及氮素调控效应[J].作物学报,2001,30(2):115.
GUO T C,FENG W,ZHAO H J,etal.Phptosynthetic characteristics of flag leaves and nitrogen effects in two winter wheat cultivars with different spike type [J].ActaAgronomicaSinica,2001,30(2):115.
[3] 郭天财,王之杰,胡廷积,等.不同穗型小麦品种群体光合特性及产量性状的研究[J].作物学报,2001,27(5):633.
GUO T C,WANG Z J,HU T J,etal.Study on canopy apparent photosynthesis characteristics and grain yield traits of two winter wheat cultivaters with different spike type [J].ActaAgronomicaSinica,2001,27(5):633.
[4]GREMER F,VAN DE WALLE C.Method for extraction of proteins from green plant tissues for two-dimensional polyacrylamide gel eleetrophoresis[J].AnalyticalBiochemistry,1985,147:22.
[5] 任丽萍,范海延,宋铁峰,等.基于双向电泳技术的植物差异蛋白质组学研究进展[J].中国农学通报,2011,27(5):53.
REN L P,FAN H Y,SONG T F,etal.Advances in differential proteomics based on 2-DE in botany[J].ChineseAgriculturalScienceBulletin,2011,27(5):53.
[6]GOVONRUN V M,ARCHAKOV A I.Proteomic technologies in modern biomedical science [J].Biochemistry,2002,67:1109.
[7] 于 松,高庆荣,袁 凯,等.小麦幼穗蛋白质双向电泳条件的优化[J].基因组学与应用生物学,2012,31(1):84.
YU S,GAO Q R,YUAN K,etal.Optimization of two-dimensional gel electrophoresis for proteins from wheat young panicle [J].GenomicsandAppliedBiology,2012,31(1):84.
[8] 高 璇,高利艳,晏月明.小麦籽粒谷蛋白提取方法的优化与双向电泳分析[J].麦类作物学报,2008,28(6):971.
GAO X,GAO L Y,YAN Y M.Optimization of extraction method of wheat grain glutenins and two-dimensional electrophoretic analysis[J].JournalofTriticeaeCrops,2008,28(6):971.
[9] 金 艳,许海霞,徐圆圆,等.几种不同提取方法对小麦叶片总蛋白双向电泳的影响[J].麦类作物学报,2009,29(6):1083.
JIN Y,XU H X,XU Y Y,etal.Effect of different extraction protein methods on two-dimensional electrophoresis of wheat leaf protein[J].JournalofTriticeaeCrops,2009,29(6):1083.
[10] 刘 卫,陈蕊红,张改生,等.小麦遗传型与生理型雄性不育花药蛋白质双向电泳分析[J].遗传学报,2008,30(8):1063.
LIU W,CHEN R H,ZHANG G S,etal.Two-dimensional electrophoresis on anther total proteins of male sterility induced by chemical hybridizing agent and heredity type in wheat [J].Hereditas,2008,30(8):1063.
[11] 李红兵,康振生.适于小麦叶片蛋白质组分析的样品提取方法研究[J].西北植物学报,2011,31(3):632
LI H B,KANG Z S.Sample preparation methods suitable for wheat leaf proteome analysis [J].ActaBotanicaBoreali-Occidentalia,2011,31(3):632.
[12] 刘伟霞,潘映红.适用于小麦叶片蛋白质组分析的样品制备方法[J].中国农业科学,2007,40(10):2169.
LIU W X,PAN Y H.Sample preparation methods suitable for wheat leaf P roteome analysis[J].ScientiaAgriculturaSinica,2007,40(10):2169.
[13]O′Farrell P H.High resolution two-dimensional eleetrophoresis of proteins [J].JournalofBiologicalChemistry,1975,250:4007.
[14]VALCU C M.SCHLINK K.Efficient extraction of proteins from woody plant samples for two-dimensional eleetrophoresis [J].Proteomics,2006,6(14):4166.
[15] 齐婷婷,段江燕.适用于小麦叶片总蛋白分析的双向电泳技术[J].山西师范大学学报(自然科学版)2012,26(4):50.
QI T T,DUAN J Y.Analysis of total protein in wheat leaf using two-dimensional electrophoresis [J].JournalofShanxiNormalUniversityNaturalScienceEdition,2012,26(4):50.
[16] 宋全昊,刘路平,李法计,等.小麦穗部发育多效基因的遗传分析与基因定位[J].西北植物学报,2013,33(4):643.
SONG Q H,LIU L P,LI F J,etal.Genitic analysis and gene mapping of spike development pleiotropic gene in wheat [J].ActaBotanicaBoreali-OccidentaliaSinica,2013,33(4):643.
[17]GÖRG A,OBERMAIER C,BOGUTH G,etal.Recent de-velopments in two-dimensional gel electrophoresis with immobilized pH gradients:wide pH gradients up to pH 12,longer separation distances and simplified procedures [J].Electrophoresis,1999,20(4-5):712.
[18]WESTERMEIER R,NAVEN T.Proteomics in Practice A Laboratory Manual of Proteome Analysis [M].Weinheim:Wiley-VCH,2002:11.
[19] 朱 宏,张中恒,王同昌,等.小麦叶片蛋白质双向电泳的改良方法[J].东北林业大学学报,2004,32(4):68.
ZHU H,ZHANG Z H,WANG T C,etal.An improving method of two-D gel electrophoresis for analyzing the protein in wheat[J].JournalofNortheastForestryUniversity,2004,32(4):68.
Establishment of Two-Dimensional Electrophoresis System for the Total Leaf Proteins Separation in the Spike Mutant Sda1 and Its Wild-Type
ZHOU Limin,MA Wenjie,WU Bingjin,ZHANG Deqiang,YANG Zhiquan,SUN Daojie
(Agronomy College,Northwest A&F University,Yangling,Shaanxi 712100,China)
In order to explore suitable 2-DE(two-dimensional electrophoresis) system for Sda1(spike development atrophy 1) leaf protein to screen differential protein expression between Sda1 and its wildlife type in wheat(Triticum).The protein extraction method and two-dimensional electrophoresis conditions were studied. A clear background, well distributed protein spots and reproducible 2-DE maps can be obtained by using the TCA/acetone protein extraction method, with 13% separation gel, a sample amount of 900 μg, the linear strip 17 cm immobilized pH gradient(IPG) strip pH 4 to 7, modified isoelectric focusing(IEF) process, and modified Coomassie Brilliant Blue for staining. Using this optimized 2-DE system, some differential protein spots between Sda1 and its wildlife-type were found. Compared with its wildlife-type,21 spots were down-expressed, and six spots were not expressed in Sda1.
Wheat;Spike mutants;Leaf;Two-dimensional electrophoresis; 2-DE map

麦类作物学报 2016,36(12):1629⁃1634JournalofTriticeaeCropsdoi:10.7606/j.issn.1009⁃1041.2016.12.12
时间:2016-12-07
2016-06-12
2016-07-25
国家重点基础研究计划项目(2014CB138100);陕西省自然科学基金项目(2015JM3094);陕西省重点科技创新团队项目(2014KCT-25) 第一作者E-mail:mizhouzai8866@126.com
孙道杰(E-mail:chinawheat@hotmail.com)
S512.1;S330
A
1009-1041(2016)12-1623-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20161207.1751.022.html

