在线光纤传感同步吸收—荧光光谱检测仪测定阿司匹林片中游离水杨酸
喀日耶姆·艾海提+艾尔肯·依不拉音
[摘要] 目的 建立在线光纤传感同步吸收-荧光光谱法测定阿司匹林中游离水杨酸的方法。 方法 采用在线光纤传感同步吸收-荧光光谱法测定不同厂家阿司匹林片中水杨酸,1% 冰醋酸-甲醇溶液作为溶剂,20%甲醇作为载液,泵流速1.00 mL/min,进样体积50 μL时,300 nm为吸收波长,303 nm为激发波长,430 nm为发射波长进行检测。 结果 游离水杨酸在0.5~5.0 μg/mL(r=0.9994)范围内线性良好。拜阿司匹林、阿司匹林肠溶片、阿司匹林泡腾片中游离水杨酸的平均加样回收率分别为98.01%、98.32%、98.40%;精密度、稳定性、重复性的RSD均<1.60%。 结论 该方法灵敏度高、重复性好,适用于阿司匹林中游离水杨酸的检测。
[关键词] 在线光纤传感;同步吸收-荧光光谱检测仪;阿司匹林游离水杨酸;微量检测
[中图分类号] R927.2 [文献标识码] A [文章编号] 1673-7210(2016)10(c)-0126-04
[Abstract] Objective To establish an online optical fiber sensing synchronous absorption-fluorescence spectrometer for detection of free salicylic acid in aspirin. Methods Free salicylic acid in aspirin from different manufacturer was measured by online optical fiber sensing synchronous absorption - fluorescence spectrometry, as soon as solvent was 1% glacial acetic acid - methanol solution, carrying fluid was 20% methanol, pump flow rate was 1.00 mL/min, sample volume was 50 μL, 300 nm was selected absorption wavelength, 303 nm was selected fluorescence excitation wavelength, 430 nm was selected emission wavelength to be proceeded. Results The linear ranges of free salicylic acid was 0.5-5.0 μg/mL (r=0.9994). The average recovery of free salicylic acid in aspirin, aspirin enteric tablets and aspirin effervescent tablets were 98.00%, 98.32%, 98.40%; the RSD of precision, stability, repeatability were less than 1.60%. Conclusion The method is high sensitivity and good repeatability for the residue analysis of free salicylic acid in aspirin.
[Key words] Online optical fiber sensing; Synchronous absorption-fluorescence spectrum detector; Free salicylic acid in aspirin; T race detection
阿司匹林(Aspirin,ASP)是常用的解热镇痛药,用于各种原因引起的[1-2] 感冒、发热、头痛、关节痛、风湿病,还能抑制血小板聚集。阿司匹林是有机物中的酯类物质,易发生水解反应[3],产物游离水杨酸易被氧化形成醌类物质,使阿司匹林变质,从而降低产品质量,且对人体有极大的毒副作用[4]。阿司匹林含量测定方法主要有高效液相色谱法[5-8]、反相液相色谱法[9]、酸碱滴定法、气相色谱法[10]、紫外可见分光光度法[11-12]、荧光分光光度法和自动电位滴定法[13]等。
1970年代发展起来的新技术是光纤化学传感技术,也是光纤、六通阀、流通池、检测器、光谱、材料和计算机结合起来的技术[14-16]。在线光纤传感同步吸收-荧光光谱检测法在射光90°方位下可以检测出吸收光谱和荧光光谱。目前初步假设入射光在流通池内,产生漫反射,改变了光的传播路线,经过几次漫反射转移方向与入射光90°方向产生吸收光谱[17]。在入射光垂直点能检测荧光光谱,但使用的数据分析软件是测定吸光度数据模型原因,检测出来倒立的荧光图谱其值为负。该测定法重复性好、灵敏度高、基线稳定、样品检测下限低,可观察200~800 nm范围内的吸收光谱、发射光谱、吸收点及荧光点按时序图的变化[18-19]。
1 仪器与试药
1.1 仪器
光谱仪(美国海洋公司,QE65000);光纤(美国海洋公司,FIA-P400-SR);光源(美国海洋公司,DH-2000);柱塞泵(日本精密科学株式会社,SP-D320U);UV-2550紫外分光光度计(日本,岛津)。
1.2 试药
拜阿司匹林(Bayer Schering Pharmacy,批号:BJ05662);阿司匹林肠溶片(石家庄市华新药公司,批号:018110930);阿司匹林泡腾片(阿斯利康制药公司,批号:1108081);游离水杨酸(中国食品药品检定研究院,0106-9508),实验用水为二次蒸馏水,这些试药均为分析纯。
1.3 实验原理
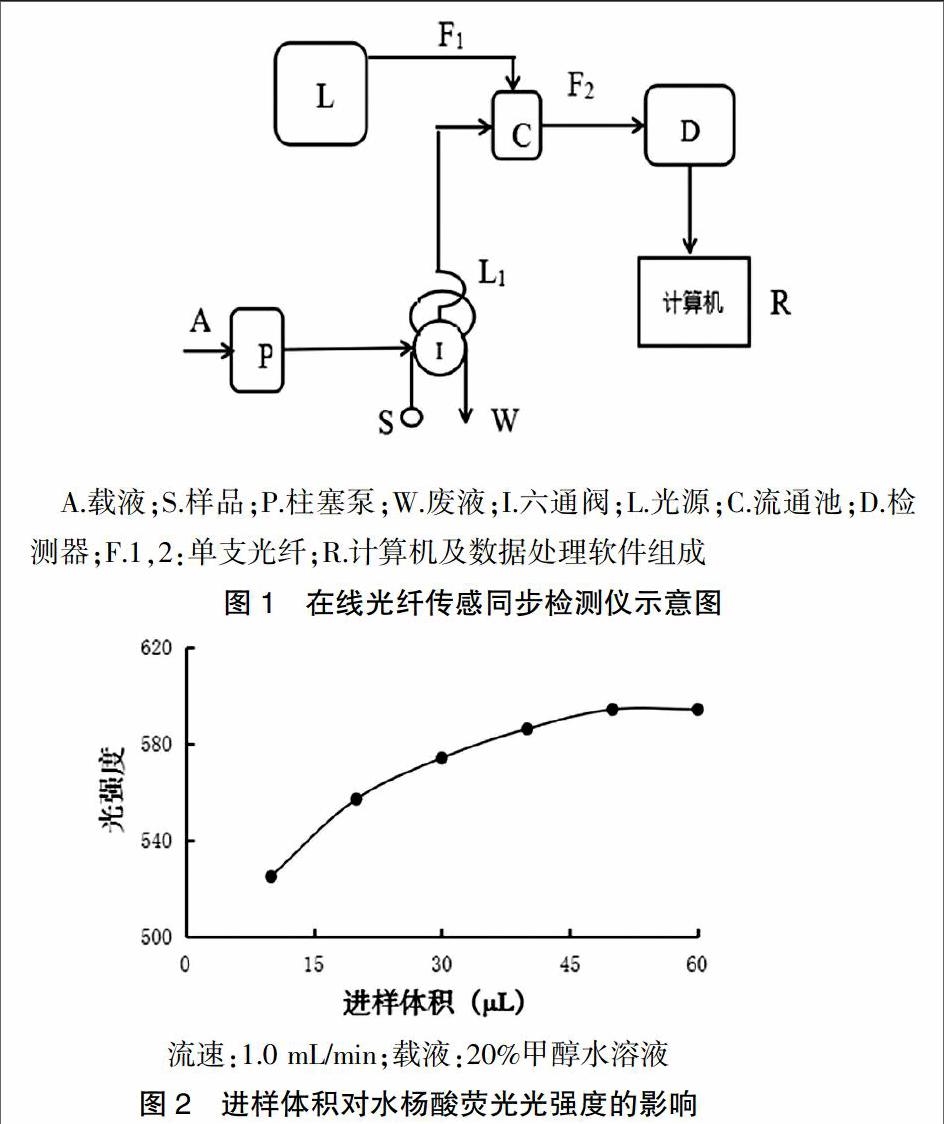
在光谱测定工作中经常需要同时检测吸收光谱和荧光发射光谱。为了实现两种光谱同时检测出一种检测器,经多次设计并通过多种样品吸收光谱和荧光发射光谱的检测验证了两种光谱同时检测的可能,并得到了较好的实验数据及结果。见图1。
2 方法与结果
2.1 影响因素考察
2.1.1 检测波长的选择 精密量取浓度为5 μg/mL的100 mL游离水杨酸标准溶液,用紫外可见分光光度计、荧光分光光度计和在线光纤传感同步吸收-荧光光谱检测仪分别扫描吸收光谱和荧光光谱,测得游离水杨酸的吸收波长300 nm,荧光激发波长303 nm,荧光发射波长430 nm。
2.1.2 载液浓度的影响 考察20%、40%、60%、80%、100 %甲醇-水溶液五个浓度,浓度越大,出峰时间越快,但因甲醇-水比例较大时易在流路中产生气泡,影响检测结果,20%甲醇-水溶液作为载液时,峰形成及出峰时间跟其他比例的甲醇液相差很小,且无溶剂峰干扰。故选择20%甲醇溶液作为最佳载液。
2.1.3 载液流速的影响 从0.5~4.0 mL/min范围内考察洗脱载液流速。载液流速0.5 mL/min时出峰时间很慢。载液流速从2~4 mL/min时,出峰时间随流速的增加而加快,但同时,脉冲对基线稳定性的影响也增加。泵流速为1 mL/min时,脉冲影响极小,出峰时间也快,每秒中的进样次数可达到3次。所以1 mL/min的流速作为最佳载液流速。
2.1.4 在线光纤传感同步吸收-荧光光谱法进样体积的影响 调节在线光纤传感同步吸收-荧光光谱检测仪的进样环长度,精密吸取5 μg/mL水杨酸标准溶液,依次进样10、20、30、40、50、60 μL,通过水杨酸溶液的吸光强度变化,确定进样体积。进样体积在10~40 μL时,溶液荧光强度不断增大,大于50 μL后,荧光强度基本不变,但此时,在线时序图中游离水杨酸峰有拖尾现象,因此选择进样体积为50 μL。结果见图2。
2.2 水杨酸标曲光谱及时序图
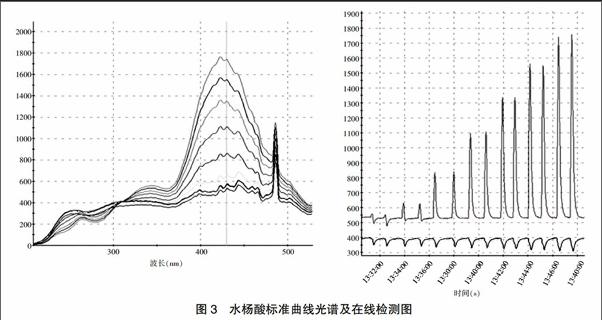
20%甲醇为载液,流速为1 mL/min,进样体积为50 μL。水杨酸浓度依次为0.5、1.0、2.0、3.0、4.0、5.0 μg/mL。按信噪比(S/N=3),得到的最低检测限为0.1 μg/mL。图3左图为紫外-荧光光谱浓度梯度变化图,300 nm左右处成凹状,是水杨酸在不同浓度时的紫外吸收波长,430 nm左右显示凸状,为不同浓度时的荧光波长;右图向上峰为荧光强度实时变化图(λ=430 nm),倒挂形状峰为紫外吸收强度实时变化图(λ=300 nm)。以对照品进样量(μg)为横坐标,光强度为纵坐标,绘制标准曲线,在线光纤传感荧光光谱法测时线性方程Y=138.16 X+25.31 (r=0.9994),荧光分光光度法测时线性方程Y=37.36 X+3.44 (r=0.9990)。水杨酸标准曲线光谱及时序图见图3。
2.3 方法学考察
2.3.1 精密度试验 准确吸取5 μg/mL水杨酸标准液0.5、1.0、5.0 mL各3份于25 mL量瓶,加1%冰乙酸-甲醇至刻度,配制成浓度为1、2、5 μg/mL的溶液,依照对照品测定法,测6次,得RSD为1.23%、1.05%、0.76%。
2.3.2 重复性试验 取拜阿司匹林及其肠溶片、泡腾片,各配成6份溶液,测得RSD为0.98%、1.14%、1.06%。
2.3.3 稳定性试验 同一份样品,于制备后0~8 h内每隔2 h取样50 μL检测,水杨酸峰强度基本不变,RSD为1.52 %。表明水杨酸8 h内稳定性良好。
2.3.4 回收率试验 精密称取约含阿司匹林50 mg的拜阿司匹林及其肠溶片、泡腾片,置500 mL的容量瓶中,定量加入水杨酸对照品溶液,用1%冰醋酸-甲醇溶液稀释至刻度,摇匀,过0.45 μm滤膜。每份样品平行测定三次,结果见表1~2。
2.4 样品含量检测
精密称取拜阿司匹林69.25 mg、阿司匹林肠溶片149.55 mg、阿司匹林泡腾片79.65 mg(均含有阿司匹林50 mg)于500 mL量瓶,加1%冰醋酸-甲醇定容,摇匀,0.45 μm滤膜过滤,在线光纤传感同步吸收-荧光光谱法、荧光分光光度法检测,结果表明三种阿司匹林类药片中的水杨酸含量符合限量规定,在线光纤传感荧光光谱法测定出来的水杨酸含量比荧光分光光度法测定出来的水杨酸含量高。结果见表3。
2.5 线光纤传感荧光光谱法和荧光分光光度法含量测定差异比较
经统计学验证,在线光纤传感荧光光谱法和荧光分光光度法测出来的差值均数为0.08,差值标准差为0.03,得P = 0.04(直接概率法),按α=0.05,认为两种方法数据总体结果有显著差异。这说明在线光纤传感荧光光谱法的检测灵明度高,可检测微量物质。
3 讨论
3.1 样品溶剂
乙酰水杨酸是弱酸性化合物,微溶于水,溶于乙醇、乙醚,也溶于较强的碱性溶液,其水溶液水解强度受酸碱影响最大,选用1%冰醋酸-甲醇溶液溶解样品,可有效抑制其水解。
3.2 检测波长
紫外分光光度法检测时,浓度3 μg/mL以下的水杨酸在300 nm处的吸光度值较小,线性关系差。荧光分光光度计检测时,300 nm处测得的线性关系良好,并且与阿司匹林在275 nm处的紫外吸收重合,故选300 nm作为水杨酸含量的检测波长。
[参考文献]
[1] 熊晓丹,孙丹,吴雪亭,等.阿司匹林中乙酰水杨酸含量测定的问题探讨[J].化学教学,2015(10):91-93.
[2] Ortega Algar S,Ramos Martos N,Molina Diaz A. Fast and single Solid phase fluorescence spectroscopic batch procedure for (acetyl) salicylic acid determination in drug formulations [J]. Pharm Biomed Anal,2003,31(3):439-446.
[3] 李玉贤,张云封,张俊利,等.阿司匹林制备方法的比较研究[J].中国医药指南,2014,12(31):67-69.
[4] Leehsin S,Tunghu T. Simultaneous determination and pharmacokinetics of protein unbound aspirin and salicylic acid in rat blood and brain by microdialysis:An application to herbal-drug interaction [J]. Journal of Chromatography B,2012,895-896(3):31-38.
[5] Tian J,Chen XS,Wang RD. Determination of free salicylic acid in chewing aspirin tablets by HPLC [J]. Di Yi Jun Yi Da Xue Xue Bao,2003,23(7):744-747.
[6] 孙瑛,何春龙,成业,等.HPLC法测定阿司匹林肠溶片中阿司匹林的含量[J].北方药学,2014,11(11):12-14.
[7] Dong YI,Zhao YZ,Zhang YN. Determination of aspirin and free salicylic acid in lysinipirine injection by high performance liquid chromatography [J]. Journal of Chromatography,2002,20(3):277-280.
[8] 游秋屏,马逊娜.阿司匹林和游离水杨酸高效液相色谱检定新方法的研究[J].中国现代药物应用,2013,7(22):234-235.
[9] 翟登奎,崔红,刘宾娜.RP-HPLC测定阿司匹林搽剂的含量[J].中国实验方剂学杂志,2011,17(2):89-90.
[10] 李祖光,国明,聂晶,等.直接进样杆在线衍生GC-MS测定阿司匹林中的水杨酸[J].浙江工业大学学报,2014, 42(1):67-70.
[11] 张祖栋,孙阔,孙浩,等.紫外多波长光谱法监测阿司匹林合成过程的水杨酸和阿司匹林[J].化学分析计量,2016, 25(1):30-34.
[12] 王晨霞,舒余琪.紫外分光光度法阿司匹林肠溶片中阿司匹林的含量测定[J].广东化工,2014,23(41):200-202.
[13] 杨孝容,向清祥,涂婷,等.自动电位滴定法测定阿司匹林肠溶片中总羧酸和阿司匹林的含量[J].化学研究与应用,2015,27(12):1891-1895.
[14] Marie Pospí[s] ilová,Gabriela Kuncová, Josef Tr [o]gl. Fiber-Optic Chemical Sensors and Fiber-Optic Bio-Sensors [J]. Sensors,2015,15(10):25208-25259.
[15] Susin C,Abdul Aziz AR,Sulaiman W. Harun Fiber Optic Sensors for Selected Waste water Characteristics [J]. Sensors,2013,13(7):8640-8668.
[16] Hummad Habib Qazi,Abu Bakar bin Mohammad,Muhammad Akram. Recent Progress in Optical Chemical Sensors [J]. Sensors,2012,12(12):16522-16556.
[17] 艾尔肯.依不拉音,白娟娟,李新霞,等.在线光纤传感同步吸收-荧光光谱仪及食品、药品残留量检测的应用(第四届中国在线分析仪器应用及发展国际论坛论文集),2011:139-148.
[18] 章立华,艾尼娃尔·艾克木,艾尔肯·依不拉音.流动注射-光纤化学传感荧光法测定维生素B2的含量[J],应用化工,2014,43(11):2104-2106.
[19] 章立华,艾尔肯·依不拉音.光纤化学传感同步吸收-荧光法的建立[J].光谱学与光谱分析,2016,36(2):1-4.
(收稿日期:2016-07-20 本文编辑:赵鲁枫)

