蛋白质内含子介导蛛丝功能化平台的建立
林森珠,陈格飞,2,孟清
1 东华大学 生物科学与技术研究所,上海 201620
2 卡罗林斯卡学院老年痴呆症研究中心,瑞典 斯德哥尔摩 14157
蛋白质内含子介导蛛丝功能化平台的建立
林森珠1,陈格飞1,2,孟清1
1 东华大学 生物科学与技术研究所,上海 201620
2 卡罗林斯卡学院老年痴呆症研究中心,瑞典 斯德哥尔摩 14157
林森珠, 陈格飞, 孟清. 蛋白质内含子介导蛛丝功能化平台的建立. 生物工程学报, 2016, 32(12): 1704-1714.
Lin SZ,Chen GF, Meng Q. Construction of spider silk functional platform via intein trans-splicing. Chin J Biotech, 2016, 32(12): 1704-1714.
为建立高效快捷的蛛丝功能化修饰平台,蛋白质内含子的反式剪接技术被首次应用于重组蛛丝的功能化修饰。在体外通过Ssp DnaB的反式剪接作用,在蛋白质水平上将12 kDa泛素相关修饰蛋白(SUMO) 与蛛丝蛋白 (W2CT) 连接形成功能化蛛丝蛋白SUMOW2CT。修饰后SUMOW2CT与W2CT均能形成纳米至微米级的丝纤维,但SUMOW2CT自动成丝速度明显下降且产量约为W2CT的一半。与W2CT丝纤维 (W) 相似,SUMOW2CT丝纤维 (UW) 不具有超收缩能力和对2%SDS不耐受,但机械性能低于W2CT丝纤维。功能化蛋白SUMOW2CT形成的丝纤维中SUMO蛋白仍保持着正确三维结构,可被SUMO蛋白酶酶切。外源功能化蛋白质虽在一定程度上降低了丝的形成速度和机械性能,但修饰上的功能化蛋白仍保持着生物活性,表明断裂蛋白质内含子介导的蛛丝修饰平台成功建立,也为蛛丝的功能化修饰和应用奠定了坚实的技术基础。
重组蜘蛛丝,断裂蛋白质内含子,功能化修饰,重组葡萄状腺丝蛋白,小分子泛素相关修饰蛋白
上海市科委攻关项目 (No. 14521100700),上海市科委国际合作项目 (No. 14520720200),国家外专局“高端外国专家项目”(No. GDW20143100071),国家自然科学基金 (No. 31570721),教育部直属高校学校特色项目 (No. TS2011DHDX025) 资助。
生物材料在生物医学领域具有着重要的作用,可以作为伤口的缝合线、药物载体和组织工程中的支架等。生物材料表面的化学特性极其重要,例如影响表面细胞的吸附能力,活化调节细胞繁殖、分化和存活的通路等[1-3]。作为生物材料的一种,丝纤维由于比表面积相对大、材质柔和、吸附能力好以及容易加工改造成各种材料等特性而备受欢迎。天然的丝纤维材料,是大分子蛋白质聚合物,由于具有良好的生物兼容性、不致毒性和潜在的生物活性等特性而被认为是目前最具有潜能的生物材料[4]。目前最受研究者关注的蛋白质来源天然丝纤维有蚕丝和蜘蛛丝两种。蛛丝因为具有比蚕丝更好的机械性能和生物兼容性而备受研究者关注。但是由于蜘蛛的同类相食和蛛丝的难以收集,以及圈养获得的蛛丝存在着性能的差异使得对蛛丝的研究比蚕丝缓慢许多[5]。
蚕丝来源的丝纤维在生物医学领域被应用了几十年,为了提高蚕丝纤维的表面化学特性,研究者们通过化学交联法或者基因工程融合表达的方法在蚕丝纤维中引入具有结合功能或者催化功能的多肽,如引入细胞结合多肽[3,6]、生长因子[4,7]、亲和结构[8]、增强绿色荧光蛋白[9]和碱性成纤维细胞生长因子[10]等。最近,又新发现的一种比化学交联法更有效的方法,即通过控制蚕丝的膜的形成过程来载入功能性抗体[11]。由于蛛丝的研究相对蚕丝落后,蛛丝来源的丝纤维,还未商业化应用。目前,国内外科学家已经尝试在细菌、酵母、植物、昆虫、哺乳类细胞以及转基因动物中制备重组蛋白[4,12-13]。异源制备的重组蛛丝蛋白质在体外能够加工成为各种各样的类丝结构,如纤维、膜和泡沫等[4,14-19]。为了进一步提高重组蛛丝纤维的生物活性,已经有研究者通过基因重组技术,将短的细胞结合多肽修饰重组蛛丝蛋白上,并被证实能够提高重组丝纤维的生物亲和性[20-21]。此外,更大蛋白,如诱导矿物质化蛋白以及抗菌肽,也已用来和蛛丝蛋白融合表达,最终形成的丝状复合物不仅具有了丝纤维的特性而且拥有外源蛋白的特性[22-27]。近期研究者还将蛛丝蛋白和生物素结合结构域融合表达,形成的丝纤维能够捕捉带有生物素修饰的复合物[28]。
圆网蜘蛛能够制备6种丝纤维和1种类胶物质,其中包裹丝因为它强度和弹性的完美结合,是几种丝中韧性最好的丝,也是近几年来除了拖丝之外备受研究者关注的蛛丝。我们实验室前期研究的三带金蛛Argiope trifasciata来源的含有两个重组模块以及C端非重复区的重组葡萄状丝蛋白 (W2CT) 可以在大肠杆菌中高效表达,并且能够在体外生理环境下手动拉成丝[17]。
基于前期实验基础,我们设想这种简单易表达的,并且在生理条件下容易成丝的丝纤维能否像蚕丝或者拖丝那样在丝纤维表面展示功能性蛋白,从而对该丝进行功能化修饰。以往的功能化修饰的方法中,化学交联法具有一定的随机性,效率相对较低,蛋白质融合表达,虽然可以将蛋白质特意修饰在N端或者C端,但由于蛛丝蛋白的特殊性 (高度重复性),在构建重组克隆的过程中,容易导致额外的同源重组,致使构建克隆和蛋白质表达失败的风险性比较高。另外当需要对多个蛛丝进行多个活性蛋白分别修饰的时候,就涉及到构建多个克隆,增加了实验的工作量。因而,在本实验中,我们引入了蛋白质内含子。将酿酒酵母来源的12 kDa小分子泛素相关修饰蛋白 (Small ubiquitin-related modifier,SUMO) 作为模式功能性的蛋白来修饰蛛丝蛋白。实验结果显示,Ssp DnaB S0断裂蛋白质介导的反式剪接,可以成功地将一个12 kDa的蛋白质在体外蛋白质水平上连接到重组蛛丝蛋白的N端,形成的融合蛋白不仅具有自动成丝的特性,而且维持了SUMO蛋白的正确折叠,本实验证实了断裂蛋白质内含子介导的蛛丝功能化修饰的可行性,为蛛丝的高效快捷功能化修饰提供技术平台。
1 材料与方法
1.1 克隆的构建、表达以及断裂蛋白质内含子介导的反式剪接
将两端引入BSaⅠ和BfuAⅠ限制性内切酶酶切位点的模式蛋白SUMO以及蛛丝蛋白W2CT的编码基因,分别经BSaⅠ和BfuAⅠ限制性内切酶 (Fermentas公司) 酶切,再由T4DNA连接酶 (Fermentas公司) 分别连入经过改造的表达载体pERBnH和pEHRBc (表达载体带有2个限制性内切酶酶切位点BSaⅠ和BfuAⅠ;6个His的纯化标签 (用H表示);Ssp DnaB S0断裂蛋白质内含子的N端片段或者C端片段) 获得重组质粒pEURBnH和pEHRBcW2CT,预表达的重组融合蛋白为SUMORBnH和HRBcW2CT (图1)。
重组质粒转化进入BL21 DE3 (Novagen)细胞中,37 ℃培养至A600约为0.8时,分别加入终浓度为0.8 mmol/L的IPTG,25 ℃过夜诱导表达。室温7 500 r/min离心 5 min收集细胞,缓冲液 (50 mmol/L NaH2PO4,pH 8.0,300 mmol/L NaCl) 重悬细胞后,在冰上超声破碎90次,每次5 s (JY92-Ⅱ超声破碎仪器,宁波新芝生物科技股份有限公司,中国)。通过预实验发现C端前体蛋白HRBcW2CT形成包涵体,N端前体蛋白SUMORBnH是可溶性的。HRBcW2CT包涵体通过用8 mol/L尿素以及超声波破碎来协助溶解,溶解的混合物在室温下10 000 r/min,离心30 min,保留上清液,将上清液梯度透析到4 mol/L的尿素,然后透析液转入预处理的Ni-NTA柱(Qiagen,Germany),并梯度冲洗来降低尿素的浓度 (从4 mol/L到0 mol/L),C端前体最后被平衡在50 mmol/L K3PO4缓冲液 (pH 7.5) 中并被保留在柱子上备用。可溶性蛋白SUMORBnH根据Ni-NTA柱 (Qiagen,Germany) 纯化手册直接进行非变性纯化,但是在最后一步N端前体被保留在柱子上,并且用50 mmol/L K3PO4缓冲液 (pH 7.5) 平衡。
蛋白质的剪接反应是将保留在柱子上的N前体 (SUMORBnH-Beads) 和C前体 (Beads-HRBcW2CT) 进行摩尔比2∶1混合后加入终浓度1 mmol/L的DTT (二硫苏糖醇),在4 ℃过夜剪接。所得的穿柱液就是我们所需要的修饰的融合蛋白SUM0W2CT。蛛丝蛋白W2CT的获得方法,参见我们前期的实验[17]。
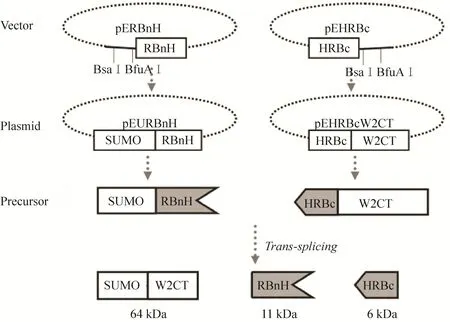
图1 质粒构建、蛋白表达和反式剪接流程图Fig. 1 Flow chart for plasmid construction, protein expression and split intein trans-splicing.
1.2 重组蜘蛛丝的制备及其定量
750 μL相同浓度 (1 mg/mL) 的蛋白质溶液SUMOW2CT和W2CT在与200 μL的Ni-NTA柱子混合后,固定在旋转仪器上的同一个圆周的位置,转速20 r/min、25 ℃。分别在0、2、4、6、24 h,挑出丝放于缓冲液中拍照记录丝的形成速度。24 h后,将所成的丝挑出,用足量的磷酸钾缓冲液冲洗后,平铺在光学显微镜下拍照观察丝的形态。随后两组丝分别被溶解在含有10%的SDS溶液中,通过SDS-PAGE胶,对比形成丝的蛋白质的量。
1.3 杂合蛛丝上修饰蛋白的活性检测
SUMOW2CT在旋转仪上所形成的丝被挑出,用1 mL的50 mmol/L K3PO4缓冲液 (pH 7.5)充分冲洗后分为两组。第1组用于检测SUMO的活性,在第1组中加入100 μL缓冲液,SUMO酶以及终浓度1 mmol/L的DTT,25 ℃反应4 h。将丝取出溶解于10%的SDS溶液中,再混合回溶液中,加入上样缓冲液,SDS-PAGE胶检测样品。第2组作为对照,是为了检测丝中是否吸附游离的SUMOW2CT,第2组的处理方法与第1组一样除了没有加SUMO蛋白酶。浸泡上清取出,加入上样缓冲液,通过SDS-PAGE胶,检查是否具有游离的SUMOW2CT。
1.4 重组蛛丝性能测试
来自蛋白质溶液W2CT的重组丝 (W) 和来自蛋白质溶液SUMOW2CT的重组丝 (UW)被手动拉出,并固定在C形卡上[17]。
固定在C型卡上的丝分别取10根用于超收缩和化学抵抗性检测。即将C型卡中间的桥折叠,然后在丝上加入50 μL的去离子水或者2% SDS溶液,光学显微镜下放大倍数1 000倍拍照检测。
每种丝取10根用于在温度为 (22.0±2) ℃,湿度约为40%的条件下测定丝的力学性能(Agilent T150 UTM,Agilent technologies,美国)。
2 结果与讨论
蜘蛛丝纤维经过长久的自然进化,综合品质远远优于现阶段的人工合成材料,被认为是最具有潜力的生物材料,在医学尤其是组织工程方面具有十分诱人的应用前景。蜘蛛丝主要由高分子量的丝素蛋白组成,丝素蛋白由于N端非重复区、中间占90%含量的重复区和C端非重复区组成,其中中间的重复区对蛛丝的性能具有决定性的作用[16]。在本实验中,两个重复模块的三带金蛛Argiope trifasciata来源的包裹丝再加上C端非重复区重组包裹丝丝蛋白(W2CT) 和实验室比较容易获得的模式蛋白SUMO被用来进行试验。只有具有正确三维结构的SUMO蛋白才能够被SUMO蛋白酶识别并且酶切下来,因而我们通过检测丝纤维上SUMO是否可以被SUMO蛋白酶酶切来判断重组包裹丝可否展示活性的蛋白。从而来验证通过蛋白质内含子介导的蛛丝的功能化修饰是否具有可行性。
2.1 功能化蛛丝蛋白的制备
蛋白质内含子是一类介导它两端的蛋白质外显子通过肽键进行连接,然后自身从前体蛋白质中剪切出来的蛋白质。其中S0断裂蛋白质内含子是在微小蛋白质内含子的基础上,将蛋白质内含子断裂成10 kDa左右的N端前体和6 kDa左右的C端前体,N端前体和C端前体在体外仍能够识别对方,进行高效剪接,因而具有很高的通用性。最近Hauptmann和他的合作伙伴利用蛋白质内含子随机性剪接获得了含有天然蛛丝蛋白大小的重组鞭毛状腺丝蛋白的混合物,解决了大分子量的蛛丝难以表达的难题,为蜘蛛丝的人工合成开拓了新的方法[29]。在本实验中的蛋白质内含子Ssp DnaB S0在外显子是W2或者C8CT的时候具有约80%−90%的剪接活性因而被用在本实验中作为修饰的媒介[17]。构建含有N端蛋白质内含子和C端蛋白质内含子表达载体后 (图1,Vector),只要将功能蛋白质基因以及蛛丝蛋白的基因酶切连接进入载体中(图1,Plasmid),表达产物体外剪接后即可以实现蛛丝蛋白在蛋白水平上的修饰 (图1,Splicing product)。蛋白质内含子的引入,不仅能够使得蛛丝的修饰高效快捷而且解决蜘蛛丝蛋白与不同蛋白质融合表达有可能导致不表达的风险。例如当对于3种不同来源的蜘蛛丝,需要分别被3种不同的功能蛋白进行修饰时 (图2),如果通过基因工程的手段在基因水平上构建融合克隆的话,需要构建9个克隆随后表达9个蛋白质,每个蛋白都有可能因为蛛丝重复片段的特点导致难以构建克隆或者难以表达 (图2A)。蛋白质内含子的引入后,却只需要6个克隆表达6个前体蛋白。其中3个表达N端前体蛋白 (功能蛋白基因与N端蛋白质内含子基因融合表达后的前体蛋白),另外3个是C端前体蛋白 (C端蛋白质内含子分别与3种丝纤维蛋白进行融合表达)。蛋白质内含子分子量相对较小,与外显子融合的时候,降低了克隆和表达的难度。此外6 kDa的C端蛋白质内含子前体与丝纤维基因融合表达的时候,融合蛋白难以表达的风险明显小于大分子功能蛋白与蛛丝融合表达。再者在蛋白质内含子介导的修饰系统中,只有3个融合蛋白质需要考虑到可能由于蛛丝的重复片段的存在会导致难以克隆与表达的问题,即3个C端蛋白质前体,一旦这3个都能表达,那么在体外混合,通过蛋白质水平的反式剪接,就可以获得我们想要的9个功能性蛋白 (图2B)。总体说来,蛋白质内含子介导的蛛丝功能化,能够有效减少克隆构建和蛋白质表达的数目,降低克隆构建和蛋白质表达的风险,减少了实验研究的难度,缩短了时间,从而能有效加快实验进程和降低实验成本。
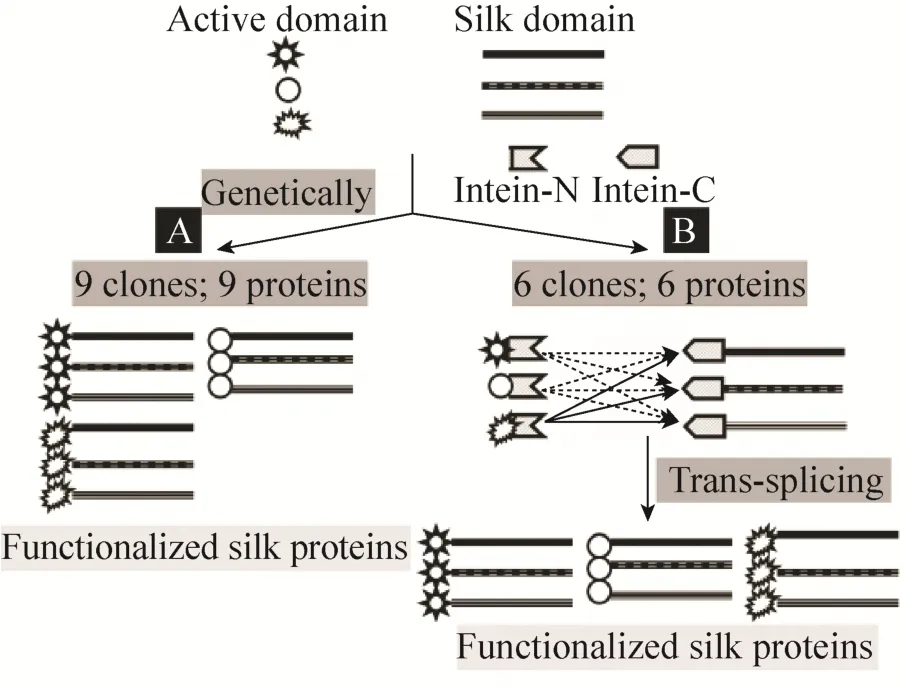
图2 蛛丝蛋白功能化修饰方法比较Fig. 2 Comparison Analysis on different silk protein functionalized methods. (A) Silk protein fused with active protein by genetical method. (B) Silk protein functionalized via S0 split intein trans-splicing.
此外,实验的设计过程中,6个组氨酸的纯化标签被融合在N端蛋白质内含子的C末端和C端蛋白质内含子的N末端,当反式剪接反应发生后,前体和剪接副产物因为都有蛋白质内含子所以都具有6个组氨酸纯化标签,而剪接产物(SUMOW2CT) 没有,这给蛋白质纯化提供了便利。将剪接反应直接在Ni-NTA纯化柱上进行,这种纯化柱上剪接,节省掉了传统的剪接方法的4个步骤:1) 前体蛋白质从柱上洗脱;2) 透析掉咪唑;3) 反式剪接反应;4) 再过柱子获得穿柱液 (图3A)。柱上剪接反应结束后,所得到的穿柱液就是我们所需要的目的蛋白质 (图3B)。
实验中N端前体蛋白SUMORBnH和C端前体蛋白HRBcW2CT在1 L LB溶液中的表达量约为60 mg/L,经过剪接反应,获得的剪接产物约30 mg/L (图4),和融合表达获得的6×His-sumo-W2CT相比,产量并没有太多的变化[17]。高效率剪接活性的S0蛋白质内含子的引入,以及柱上剪接的可行性 (80%的柱上剪接效率) (图4,泳道2),使得剪接后蛋白质的获得量并没有减少。高剪接效率的断裂蛋白质内含子的柱上剪接,不仅降低了由于这些步骤所带来的蛋白质产量的损失,而且也给修饰蛋白质纯化节省了时间和成本。并且剪接产物中没有任何额外的纯化标签的污染 (图4,泳道3)。
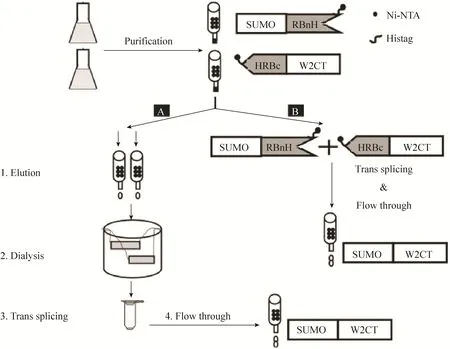
图3 柱上剪接流程图Fig. 3 Comparison analysis on different silk protein functionalized methods. (A) Silk protein fused with active protein by genetical method. (B) Silk protein functionalized via S0 split intein trans-splicing.
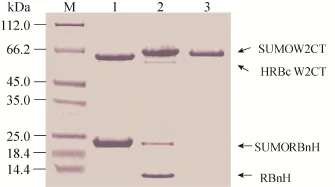
图4 重组丝蛋白的功能化的修饰-反式剪接Fig. 4 Recombinant spider silk functionalized by SUMO via intein trans splicing. M: marker; 1: mixture contains N-precursor protein (SUMORBnH-Beads) and C-precursor protein (Beads-HRBcW2CT); 2: splicing product from trans-splicing reaction; 3: flow though from Ni-NTA beads (SUMOW2CT).
2.2 功能化蛛丝的形成,产量的检测以及功能蛋白的生物活性的检测
在蛋白质自动成丝实验过程中,为了使得实验结果更具有可比性,两种相同浓度的蛋白质溶液被用于做平行试验。一种蛋白质溶液是只含有W2CT,另外一种蛋白质溶液修饰的融合蛋白即SUMOW2CT。在自发成丝的过程中,由于丝的形成需要一定的剪切力,所以200 μL的Ni-NTA被加入到旋转仪上的溶液中。在我们的预实验过程中,Ni-NTA的加入能够有效加快自动成丝的速度。在成丝的过程中,我们发现,W2CT (图5,A-E)的成丝速度明显快于SUMOW2CT (图5,F-J),W2CT在旋转仪上2 h (图5B) 就已经明显有丝的形成,而SUMOW2CT (图5G) 却还没有明显地成丝。4 h的时候 (图5,C和H) 也是一样。只有在6 h的时候SUMOW2CT才明显出现丝纤维(图3I),这说明在丝的形成过程中,蛋白质的N末端的灵活性对于丝的形成起着至关重要的作用。这与之前研究中发现的重组包裹丝单个重复模块的N端的结构具有一定的活动性是一致的[30]。相同时间24 h后所成的丝的蛋白质含量进行对比 (图6,泳道1和2),发现W丝的蛋白质含量是UW的1.8倍。进一步说明在相同的条件下,修饰后的蛛丝蛋白虽然仍能够自发形成丝纤维,但是成丝的能力有所下降。
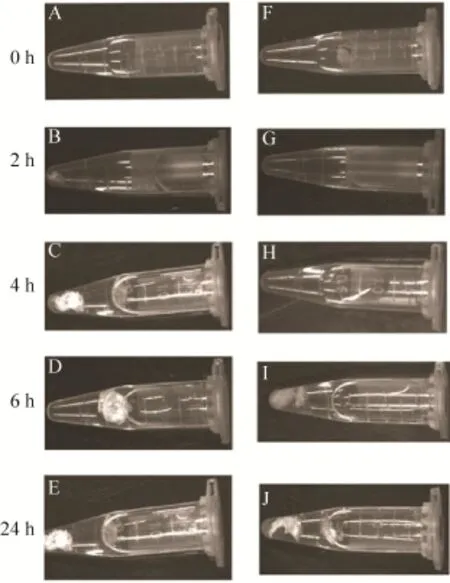
图5 重组丝成丝能力分析Fig. 5 Fiber assembling ability analysis. (A-E) W fibers formed from protein W2CT. (F-Z) UW fibers formed from protein SUMOW2CT. Protein was added to the 1 mL centrifuge tube and fixed on rotor with a speed of 20 r/min for 0 h (A, F); 2 h (B, G); 4 h (C, H); 6 h (D, I); 24 h (E, J).
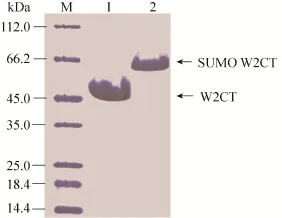
图6 通过SDS-PAGE胶对所成的丝定量Fig. 6 Quantity analysis by SDS-PAGE gel. M: marker; lane 1 and lane 2 are samples from W and UW fibers receptivity.
将所形成的丝浸泡在生理环境下,加入SUMO蛋白酶,室温酶切结果显示,相对于酶切前 (图7,泳道1),50%的丝纤维上的SUMO蛋白被酶切下来 (图7,泳道2)。相对于游离的丝纤维蛋白来说,在同等条件下100%酶切效率(图7,泳道4和5)。导致丝纤维上SUMO蛋白酶切下来效率降低的原因可能为:1) 由于丝纤维蛋白质是混聚集体,导致了分子的流动性降低,从而使得局部的蛋白酶浓度低于对照组;2) 展示的SUMO蛋白只有50%展示在表面,蛋白酶没有办法进入到丝纤维里面去酶切纤维内部的SUMO蛋白,所以酶切效率降低;3) 只有50%的SUMO蛋白维持着正确的三维结构。但是不管哪种原因导致酶切活性降低,对旋转仪上自发形成的丝上的功能蛋白的活性检测显示,重组包裹丝W2CT能够展示具有活性的功能蛋白,也说明了蛋白质内含子介导的蛛丝功能化修饰的成功。
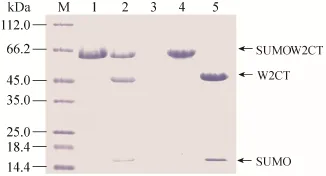
图7 SDS-PAGE胶检测SUMO酶酶切Fig. 7 SUMO protease digestion result was analyzed by SDS-PAGE gel. M: marker; 1: fibers before mixing with SUMO protease; 2: fibers mixed with SUMO protease for 4 h; 3: buffer extracting from fibers' leaching; 4: protein solution SUMO-W2CT before mixing with SUMO protease; 5: protein solution SUMO-W2CT mixed with SUMO protease for 4 h.
2.3 功能化蛛丝的性能检测
虽然丝的成丝速度受到了影响,但是研究发现,两种蛋白溶液旋转仪上旋转4 h后,都形成了丝的聚集物,该丝的聚集物在1 000倍显微镜下都可以清楚地看到纳米级到微米级左右的丝纤维 (图8A和C)。随后,为进一步研究修饰后丝的性能是否有影响,丝从蛋白溶液中被拉出和固定在C型卡上。并且进行了超收缩和化学抵抗性测试。和W2CT形成的丝一样,SUMOW2CT形成的丝不具有超收缩能力,并且在2%的SDS溶液中1 s内就被溶解 (图8B和D)。这说明外源蛋白的引入,并没有对丝的超收缩、化学抵抗性产生以及表面结构并产生影响。但是进一步的机械性能检查发现,修饰后的丝的性能即弹性有所下降 (表1,图9),从而导致了丝的整体性能的下降。所以通过剪接修饰的丝,虽然并没有影响丝的超收缩和化学抵抗性,但是却对丝的机械性能产生一定程度的影响,使得丝的弹性降低。蛋白修饰的引入使得丝的机械性能的降低这一缺陷,可以通过制备杂合丝来改善丝的性能。我们的杂合丝研究发现,通过在包裹丝中引入拖丝成分,能够有效提高丝的机械性能,因而后期如果功能性修饰包裹丝所形成的丝性能如果达不到实验的要求可以采用修饰杂合丝的方法来克服这一困难。
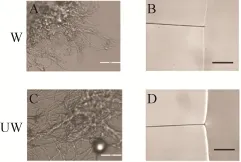
图8 光学显微镜观察自动形成的丝以及手动拉的丝的超收缩和化学抵抗性Fig. 8 Observation under light microscope (scare bar=50 μm). A,C are fibers self- assemble in centrifuge tube, while B and D are fiber drawn by hand, the shadow is 2% SDS solution.
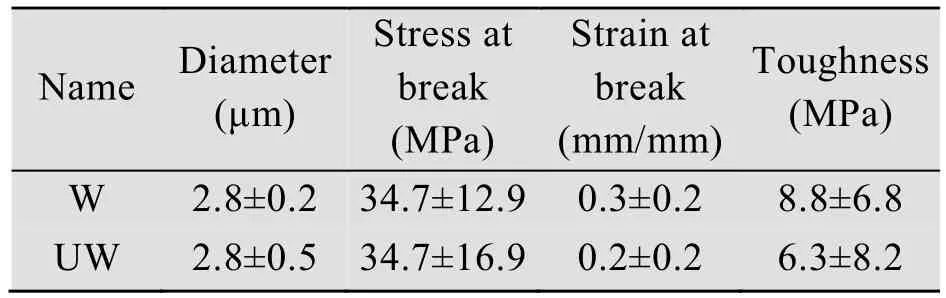
表1 重组丝的机械性能Table 1 Mechanical property
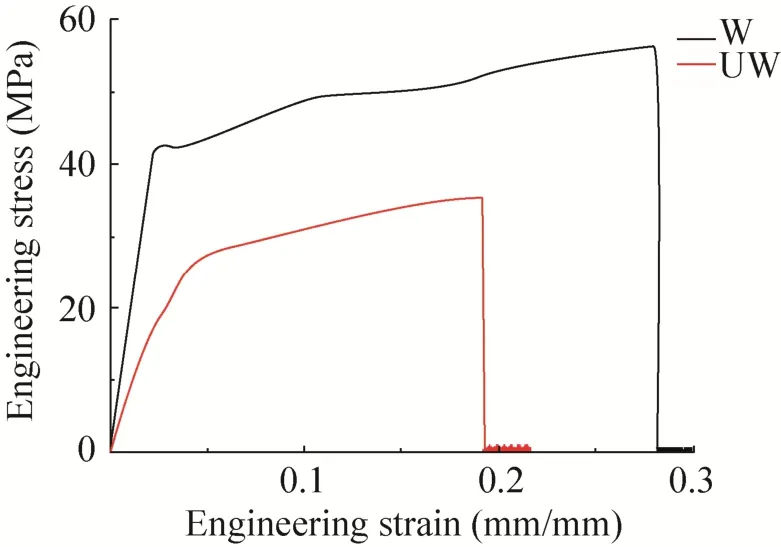
图9 重组丝的机械性能Fig. 9 Mechanical property of represent fibers.
3 总结
实验研究构建了含有蛋白质内含子的载体,为后续的丝蛋白的蛋白质功能化修饰提供了便利,并且纯化标签的设计,S0高剪接效率的断裂蛋白质内含子的应用再加上柱上剪接的高效进行,使得获取修饰蛋白的步骤简单、方便。最终获得的功能化蛛丝蛋白不带有任何额外的纯化标签,避免给功能化的蛛丝带来额外的污染。
自动旋转仪成丝速度快、方法简便,该方法用于预实验中制备后续实验所需要的材料,方法简单、方便。自动成丝实验结果表明,活性蛋白对蛛丝的蛋白W2CT的N端功能化修饰确实会影响丝的形成速度和产量,但是并不影响丝的形成。丝的超收缩和化学抵抗性显示,丝的这些性能没有得到太大的改变,虽然修饰后的丝纤维的性能有所下降。此外,丝的表面蛋白的展示活性检测,结果表明形成的丝纤维中的外源性蛋白,仍然保持着本身的活性。即被活性蛋白修饰的包裹丝不仅具有了包裹丝本身的特性还具有了活性蛋白的特性,说明了修饰的成功,也说明了修饰平台的确立,为蛛丝蛋白质的功能化提供了高效快捷的技术手段。
[1] Kim HJ, Kim UJ, Vunjak-Novakovic G, et al. Influence of macroporous protein scaffolds on bone tissue engineering from bone marrow stem cells. Biomaterials, 2005, 26(21): 4442-4452.
[2] Zhao CH, Yao JM, Masuda H, et al. Structural characterization and artificial fiber formation of Bombyx mori silk fibroin in hexafluoro-isopropanol solvent system. Biopolymers, 2003, 69(2): 253-259.
[3] Sofia S, McCarthy MB, Gronowicz G, et al. Functionalized silk-based biomaterials for bone formation. J Biomed Mater Res, 2001, 54(1): 139-148.
[4] Widhe M, Johansson J, Hedhammar M, et al. Invited review current progress and limitations of spider silk for biomedical applications. Biopolymers, 2012, 97(6): 468-478.
[5] Altman GH, Diaz F, Jakuba C, et al. Silk-based biomaterials. Biomaterials, 2003, 24(3): 401-416.
[6] Chen JS, Altman GH, Karageorgiou V, et al. Human bone marrow stromal cell and ligament fibroblast responses on RGD-modified silk fibers. J Biomed Mater Res A, 2003, 67A(2): 559-570.
[7] Karageorgiou V, Meinel L, Hofmann S, et al. Bone morphogenetic protein-2 decorated silk fibroin films induce osteogenic differentiation of human bone marrow stromal cells. J Biomed Mater Res A, 2004, 71A(3): 528-537.
[8] Wang XQ, Kaplan DL. Functionalization of silk fibroin with NeutrAvidin and biotin. Macromol Biosci, 2011, 11(1): 100-110.
[9] Inoue S, Kanda T, Imamura M, et al. A fibroin secretion-deficient silkworm mutant, Nd-sD, provides an efficient system for producing recombinant proteins. Insect Biochem Mol Biol, 2005, 35(1): 51-59.
[10] Hino R, Tomita M, Yoshizato K. The generation of germline transgenic silkworms for the production of biologically active recombinant fusion proteins of fibroin and human basic fibroblast growth factor. Biomaterials, 2006, 27(33): 5715-5724.
[11] Lu Q, Wang XQ, Zhu HS, et al. Surface immobilization of antibody on silk fibroin through conformational transition. Acta Biomater, 2011, 7(7): 2782-2786.
[12] Tokareva O, Michalczechen-Lacerda VA, Rech EL, et al. Recombinant DNA production of spider silk proteins. Microb Biotechnol, 2013, 6(6): 651-663.
[13] Murphy AR, Kaplan DL. Biomedical applications of chemically-modified silk fibroin. J Mater Chem,2009, 19(36): 6443-6450.
[14] Hedhammar M, Bramfeldt H, Baris T, et al. Sterilized recombinant spider silk fibers of low pyrogenicity. Biomacromolecules, 2010, 11(4): 953-959.
[15] Widhe M, Bysell H, Nystedt S, et al. Recombinant spider silk as matrices for cell culture. Biomaterials, 2010, 31(36): 9575-9585.
[16] Rising A, Widhe M, Johansson J, et al. Spider silk proteins: recent advances in recombinant production, structure-function relationships and biomedical applications. Cell Mol Life Sci, 2011, 68(2): 169-184.
[17] Lin SZ, Chen GF, Liu XQ, et al. Chimeric spider silk proteins mediated by intein result in artificial hybrid silks. Biopolymers, 2016, 105(7): 385-392.
[18] Hedhammar M, Rising A, Grip S, et al. Structural properties of recombinant nonrepetitive and repetitive parts of major ampullate spidroin 1 from Euprosthenops australis: implications for fiber formation. Biochemistry, 2008, 47(11): 3407-3417.
[19] Stark M, Grip S, Rising A, et al. Macroscopic fibers self-assembled from recombinant miniature spider silk proteins. Biomacromolecules, 2007, 8(5): 1695-1701.
[20] Wohlrab S, Müller S, Schmidt A, et al. Cell adhesion and proliferation on RGD-modified recombinant spider silk proteins. Biomaterials, 2012, 33(28): 6650-6659.
[21] Bini E, Foo CWP, Huang J, et al. RGD-functionalized bioengineered spider dragline silk biomaterial. Biomacromolecules, 2006, 7(11): 3139-3145.
[22] Huang J, Wong C, George A, et al. The effect of genetically engineered spider silk-dentin matrix protein 1 chimeric protein on hydroxyapatite nucleation. Biomaterials, 2007, 28(14): 2358-2367.
[23] Mieszawska AJ, Fourligas N, Georgakoudi I, et al. Osteoinductive silk-silica composite biomaterials for bone regeneration. Biomaterials, 2010, 31(34): 8902-8910.
[24] Mieszawska AJ, Nadkarni LD, Perry CC, et al. Nanoscale control of silica particle formation via silk-silica fusion proteins for bone regeneration. Chem Mater, 2010, 22(20): 5780-5785.
[25] Gomes S, Numata K, Leonor IB, et al. AFM study of morphology and mechanical properties of a chimeric spider silk and bone sialoprotein protein for bone regeneration. Biomacromolecules, 2011, 12(5): 1675-1685.
[26] Wong Po Foo C, Patwardhan SV, Belton DJ, et al. Novel nanocomposites from spider silk-silica fusion (chimeric) proteins. Proc Natl Acad Sci USA, 2006, 103(25): 9428-9433.
[27] Gomes SC, Leonor IB, Mano JF, et al. Antimicrobial functionalized genetically engineered spider silk. Biomaterials, 2011, 32(18): 4255-4266.
[28] Jansson R, Thatikonda N, Lindberg D, et al. Recombinant spider silk genetically functionalized with affinity domains. Biomacromolecules, 2014, 15(5): 1696-1706.
[29] Hauptmann V, Weichert N, Menzel M, et al. Native-sized spider silk proteins synthesized in planta via intein-based multimerization. Transgenic Res, 2013, 22(2): 369-377.
[30] Tremblay ML, Xu LL, Lefèvre T, et al. Spider wrapping silk fibre architecture arising from its modular soluble protein precursor. Sci Rep, 2015, 5: 11502.
(本文责编 陈宏宇)
Qing Meng. Tel: +86-21-67792651; Fax: +86-21-67792647; E-mail: mengqing@dhu.edu.cn
Construction of spider silk functional platform via intein trans-splicing
Senzhu Lin1, Gefei Chen1,2, and Qing Meng1
1 Institute of Biological Sciences and Biotechnology, Donghua University, Shanghai 201620, China
2 Center for Alzheimer Research, Karolinska Institute, Stockholm 14157, Sweden
To provide technical support for spider silk functional modification, we developed a simple and efficient functional platform via intein trans-splicing. Small ubiquitin-related modifier protein (SUMO) was fused to the recombinant spider silk protein (W2CT) by peptide bond via S0 split intein Ssp DnaB trans-splicing, resulting in a protein SUMOW2CT. However, incorporation of exogenous protein led to mechanical property defect and lower fiber yield, and also slowed down the fiber assembly velocity but no obvious differences in supercontraction and chemical resistance when compared with fibers from W2CT (W). SUMO protease digestion showed positive results on the fibers, indicating that the SUMO protein kept its native conformation and bioactive. Above all, this work provides a technical support for spider silk high simply and efficient functionalized modification.
recombinant spider silk, split intein, functionalized modification, recombinant aciniform silk protein, small ubiquitin-related modifier
Supported by:Shanghai Science and Technology Research Projects (No. 14521100700), International Cooperation Project of Shanghai Science and Technology Committee (No. 14520720200), International Experts' Project of the State Administration of Foreign Experts Affairs in China (No. GDW20143100071), National Nature Science Foundation of China Research (No. 31570721), Universities Characteristic Project of the Ministry of Education of China (No. TS2011DHDX025).
Received:April 17, 2016;Accepted:June 12, 2016

