臭氧氧化猪场处理尾水对苦草(Vallisneria spiralis)抗氧化系统的影响
王俊力,陈桂发,刘福兴,宋祥甫,邹国燕
(上海市农业科学院,上海 201403)
臭氧氧化猪场处理尾水对苦草(Vallisneria spiralis)抗氧化系统的影响
王俊力,陈桂发,刘福兴*,宋祥甫,邹国燕
(上海市农业科学院,上海 201403)
为了探索臭氧氧化技术应用于畜禽养殖废水排放前的预处理对环境可持续发展的影响,用不同浓度臭氧氧化处理经生化工艺处理后的猪场尾水,以苦草为试验材料,从活性氧代谢和抗氧化系统的角度,探讨了沉水植物在臭氧氧化猪场处理尾水中的适应性以及臭氧氧化技术的应用对水生植物的影响。结果表明:与未经臭氧氧化处理相比,臭氧氧化后(AO1 10 mg·L-1、AO2 30 mg·L-1、AO3 50 mg·L-1)猪场处理尾水中苦草的过氧化氢(H2O2)含量有升高趋势;AO2处理中苦草的抗坏血酸(AsA)-谷胱甘肽(GSH)循环对H2O2调节起重要作用,苦草的抗坏血酸过氧化物酶(APX)活性、AsA和GSH含量增加,从而使生物量增加;AO3处理中苦草AsA含量降低,H2O2与抗氧化物质之间没有达到平衡,从而使生物量降低。结果显示,试验条件下,30 mg·L-1的臭氧氧化应用于猪场处理尾水,能增强沉水植物的抗氧化系统,促进生长,从而对水生生态系统有调节作用。
臭氧氧化;猪场尾水;沉水植物;苦草;抗氧化系统
我国是世界上畜牧业资源丰富和历史悠久的国家之一[1]。近年来,我国规模化畜禽养殖业迅速发展,随之产生的废物量快速增加[2-3]。猪场废水排放量大,传统的生化方法虽然能使猪场废水达到我国现行畜禽养殖业的排放标准,但已远远达不到环境可持续发展的要求,这使人们越来越关注畜禽养殖废水的深度处理方法。
臭氧氧化可以用于地表水、地下水以及生活和工业废水的处理和净化[4-6],臭氧氧化技术在畜禽养殖废水方面的应用近几年也逐渐被重视[3,7-9]。研究表明,臭氧氧化能去除猪场废水的不良气味、颜色和无机营养盐,提高透光率和藻类生物量等[8-9],还能降低抗生素耐药菌的生物活性[10]并使残留细菌引起的微藻小球藻生长量下降[7]。然而,目前国内外对臭氧氧化水处理技术的研究多注重水质的改善,但水处理技术应用的最终目的应该是恢复水体的生态功能[11],提高水体的自净能力,因而水处理技术应用后水体的排放对水生生态系统中生物组分的影响研究尤为重要。
臭氧氧化后的猪场废水中依然存在一些残留微生物[7],而且使水体中的溶解氧(DO)[12]、有机物和无机物含量发生变化[9],造成水体环境的改变。由于环境变化会刺激植物体内产生各种类型的活性氧(ROS),如果抗氧化系统抵御不了ROS的积累,就会使植物受到伤害,那么了解植物的抗氧化代谢特征可能有助于对水处理技术后续影响的研究[13]。水生植物尤其沉水植物在生态系统中具有不可替代的地位和作用,是水质评估和后续风险评价的指示生物[14]。从沉水植物生理水平上探求水环境对植物的影响更能准确地反映植物体的代谢水平和对环境的响应。对沉水植物生理影响的研究,目前多见水体富营养化或重金属胁迫的报道[15-16],而臭氧氧化技术的后续影响研究还未见报道,所以用沉水植物抗氧化系统的响应来研究畜禽养殖废水经臭氧氧化处理后对水生植物的影响具有重要意义。
苦草是一种多年生沉水克隆植物,广泛分布于我国的各种淡水栖息地[17],具有良好的实验特性[18]。本研究以苦草为材料,从其活性氧代谢和抗氧化系统的角度出发,研究经臭氧氧化深度处理后的猪场尾水对苦草生长的影响,探讨苦草在猪场处理尾水中的适应性和臭氧氧化技术应用于畜禽养殖废水对水生生态系统的影响,为臭氧氧化技术在环境可持续发展方面的应用研究提供理论依据。
1 材料和方法
1.1 试验地点与材料
本试验在上海市农业科学院庄行综合试验基地(121°23′E、30°53′N)进行。水样采集于上海市农业科学院畜牧试验场猪场的排放水池。该场以养殖生猪为主,占地面积3.33hm2,年出栏数3000余头。猪场废水主要包括尿、粪和猪舍冲洗水。日产废水量约5t,排放间隔时间为7d。猪场废水经生化处理后到达排放水池。本试验于2015年9—10月进行,每隔7d在排放水池中采水1次,共采集4次,采样后尽快进行臭氧氧化处理。
臭氧氧化装置由臭氧发生器(WG-S10,上海威固)、臭氧浓度检测仪(IDEAL-2000,美国)、不锈钢增压泵(JETB-0.37)、文丘里射流器(A25152)和气液反应器(不锈钢材质,D 50 cm,H 90 cm)组成。通过臭氧发生器制备臭氧,调节臭氧流量为2.5 L·min-1,由臭氧检测仪在线检测臭氧浓度,每次处理的水量固定,设置3个臭氧投加浓度,分别约为10、30、50 mg·L-1,反应时间为30 min,处理时的猪场尾水温度约为20℃。处理后的水在通风环境中放置24 h,保证无剩余臭氧,然后用于苦草试验。
苦草(Vallisneria spiralis,常绿品种,购自上海海洋大学)的培育过程在普通池塘中完成,采集长势和生长量相对一致的幼苗(长度40±5 cm)在圆锥形塑料桶(上口直径40 cm,下口直径32 cm,高56 cm)中进行前培育,桶中底泥(采自附近河道)高约15 cm,每个塑料桶中种植苦草7簇,每簇2株,并放入池塘水至淹没叶片止,每个塑料桶下方20 cm处装有排水口。待植物苗进入正常的生长阶段并有外扩能力后,分别加入未处理和不同臭氧浓度处理的水样,之后每7 d换一次水,在换水之前采集水样和植物样(苦草叶片),进行生理生化指标测定,共采集4次。
本试验设4个处理,包括3个不同浓度臭氧氧化处理和1个对照,即:BO(Before O3,对照,未经处理的猪场处理尾水)、AO1(AfterO3,臭氧投加浓度为10 mg· L-1)、AO2(After O3,臭氧投加浓度为30 mg·L-1)、AO3(After O3,臭氧投加浓度为50 mg·L-1),分别用于苦草培养,每个处理设3个重复。
加入苦草中的处理水和试验后水质情况见表1。
1.2 测定指标与方法
超氧阴离子(O-2·)产生速率采用羟胺法测定[19];过氧化氢(H2O2)含量采用分光光度计法测定[20];丙二醛(MDA)含量的测定采用硫代巴比妥酸比色法,消光系数为0.155 μmol·L-1·cm-1[21]。
超氧化物歧化酶(SOD,EC 1.15.1.1)活性采用四唑氮蓝(NBT)光氧化还原法测定,以每分钟每克植物组织(鲜重)的反应体系对NBT光化还原抑制50%为一个SOD活性单位(U)。过氧化氢酶(CAT,EC 1.11.1.6)活性采用紫外吸收法测定,以1 min内A240减少0.1的酶量为一个酶活单位(U)。过氧化物酶(POD,EC 1.11.1.7)活性采用愈创木酚法测定,将每分钟1个单位的吸光度变化定义为一个POD活性单位(U)[20]。抗坏血酸过氧化物酶(APX,EC 1.11.1.11)活性采用紫外分光光度计测定,消光系数为2.8 mmol·L-1·cm-1)[22]。酶活性(比活)以可溶性蛋白为基础来表示。可溶性蛋白含量根据Bradford[23]的方法检测,以牛血清白蛋白(BSA)为标准。抗坏血酸(AsA)含量参照邹琦[24]的方法测定。谷胱甘肽(GSH)含量参照Griffith[25]的方法测定。
1.3 数据统计与分析
采用SPSS 13.0(SPSS Inc.,Chicago,IL,USA)软件进行统计分析,Sigmaplot 12.0软件完成制图工作。

表1 加入苦草中和苦草试验后水质情况Table 1 Water quality before and after Vallisneria spiralis test
2 结果与分析
2.1 臭氧氧化猪场处理尾水对苦草生物量的影响
第4次采样时,以每个处理3簇统计了苦草叶片干重,4个处理生物量分别为BO 1.63 gDW、AO1 1.83 gDW、AO2 2.44 gDW、AO3 1.15 gDW。从图1可以看出,AO1、AO2与BO相比,苦草长势良好,生物量分别增加了12.3%和49.7%,AO3的苦草长势最弱,生物量与BO相比降低了29.4%。

图1 苦草形态照片(每处理3簇)Figure 1 The morphology of Vallisneriaspiralis
2.2 臭氧氧化猪场处理尾水对苦草活性氧含量的影响
臭氧氧化猪场处理尾水对苦草O-2·和H2O2的影响如图2所示。与BO相比,AO2处理的苦草O-2·含量有降低趋势,但并未达到显著水平(P>0.05);在第1次采样时,AO1处理的苦草O-2·含量有升高趋势,并与AO2处理之间达差异显著水平(P<0.05,图2A)。与BO相比,臭氧氧化处理有增加苦草H2O2含量的趋势,并在第1次采样中,AO3处理与BO处理之间达差异显著水平(P<0.05,图2B)。臭氧氧化猪场尾水处理对苦草O-2·(P=0.010)和H2O2(P=0.017)含量都有显著影响(表2)。
2.3 臭氧氧化猪场处理尾水对苦草抗氧化酶防御系统的影响
如图3A所示,第1次采样中,与BO相比,AO1和AO2处理中的苦草SOD活性有升高趋势,但未达到显著水平(P>0.05);在之后的采样中,臭氧氧化处理有降低苦草SOD活性的趋势,AO2处理中的苦草SOD活性在第2次采样中明显降低,与BO之间达到差异显著水平(P<0.05)。与BO相比,臭氧氧化处理中的苦草CAT活性在第1次采样中有降低趋势,并且AO3与BO之间达差异显著水平(图3B);而在之后的采样中,臭氧氧化处理的苦草CAT活性与BO相比有增加趋势,并且AO3处理与BO之间都达到显著差异水平(P<0.05)。
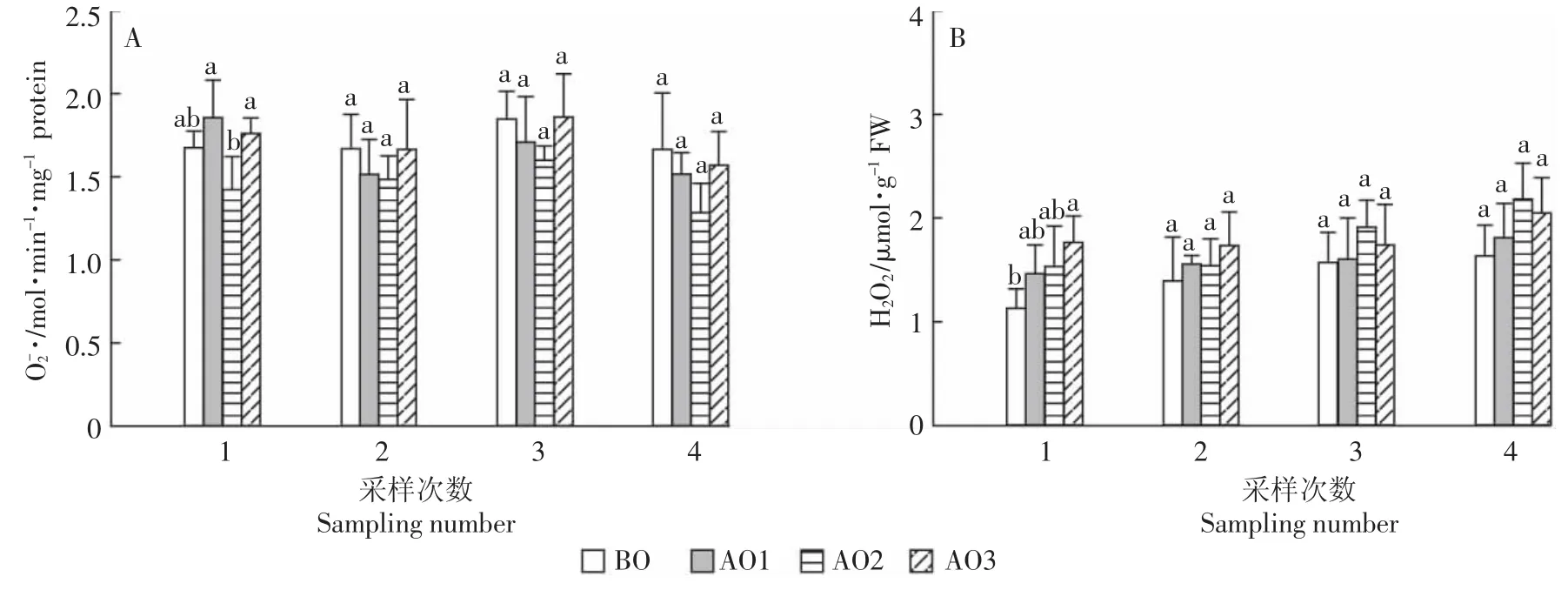
图2 臭氧氧化猪场处理尾水对苦草活性氧含量的影响Figure 2 Superoxide(,A)production and hydrogen peroxide(H2O2,B)content in Vallisneriaspiralis under piggery tail water of ozonation in four sampling numbers

表2 采样批次、臭氧氧化处理以及交互作用对苦草生理指标影响的显著性分析Table 2 P-values for the effects of sampling number,ozonation treatment and their interaction on physiological parameters in Vallisneria spiralis
结合4次采样来看(图3C),与BO相比,臭氧氧化处理有降低苦草POD活性的趋势,且在第2次采样中,AO2处理的苦草POD活性与BO之间差异显著(P<0.05);第3次采样中,AO3处理与AO1处理相比POD活性降低明显(P<0.05)。臭氧氧化处理有增加苦草APX活性的趋势(图3D),且AO2处理增加相对明显,与BO之间在第3次采样中达差异显著水平(P<0.05)。臭氧氧化猪场尾水处理对苦草CAT(P= 0.007)、POD(P=0.022)和APX(P=0.003)活性有显著影响(表2)。
2.4 臭氧氧化猪场处理尾水对苦草抗氧化物质的影响处理之间苦草AsA的变化趋势在4次采样中不尽相同(图4A),与BO相比,臭氧氧化处理在第1和第2次采样中有增加苦草AsA含量的趋势,且在第1次采样中,AO3处理增加相对明显(P<0.05),第2次采样中,AO2处理增加相对明显(P<0.05);在第3和第4次采样中,AO2处理中苦草AsA含量有增加趋势,而AO1和AO3处理中苦草AsA含量降低,AO2处理(升高)与AO3处理(降低)之间差异显著(P<0.05)。
除第4次采样外,与BO相比,臭氧氧化处理有增加苦草GSH含量的趋势。在第1次采样中,AO1和AO2处理与BO之间达差异显著水平(P<0.05);在第3次采样中,AO2和AO3处理与BO相比增加明显(P<0.05)。从4次采样样品平均值来看,AO2处理的苦草AsA和GSH含量与BO处理相比增加明显,平均分别增加33.3%和14.9%。臭氧氧化猪场尾水处理对苦草AsA(P=0.001)和GSH(P=0.017)含量都有显著影响(表2)。
3 讨论
活性氧(ROS)是植物体内正常代谢的产物。在适宜的浓度下,ROS被认为是信号转导级联反应中的第二信使,调节细胞内的几种植物响应,包括气孔关闭、程序性细胞死亡及对生物或非生物胁迫的耐性等[26]。高浓度的ROS会对植物产生伤害,使植物过早衰老,而ROS信号的强度、寿命和大小取决于氧化剂的产生和被抗氧化剂清除之间的平衡[13]。·是最重要的氧自由基,也是其他ROS的前体物。本试验结果表明,臭氧氧化猪场尾水处理并没有使苦草产生·积累(图2A),且AO2处理中苦草·含量在4个处理中最低,说明苦草较为适应AO2的环境。相对于H2O2来说·是一个非常不稳定的ROS,可迅速通过歧化作用转化为H2O2[27]。可以看出(图2B),臭氧氧化处理中苦草H2O2含量与BO相比有升高趋势,结合苦草的生物量和长势(图1)可以说明,AO1和AO2处理中苦草H2O2含量增加可能起到信号转导作用,激发体内抗氧化系统发生反应[28],使其在生长过程中产生独特的代谢和保护机制[29],从而维持苦草生长;AO3处理中苦草H2O2含量增加可能使其体内产生了ROS积累,从而影响了苦草生长。
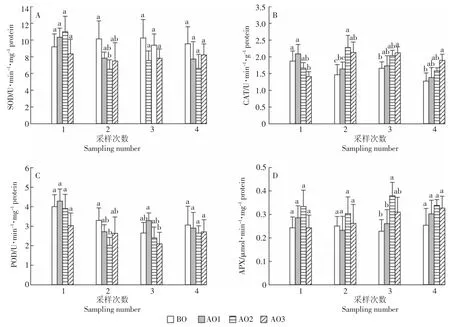
图3 臭氧氧化猪场处理尾水对苦草抗氧化防御酶活性的影响Figure 3 Superoxide dismutase(SOD,A),catalase(CAT,B),peroxidase(POD,C)and ascorbate peroxidase(APX,D)activities in Vallisneriaspiralis under piggery tail water of ozonation in four sampling numbers
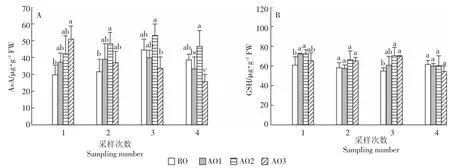
图4 臭氧氧化猪场处理尾水对苦草抗氧化物质含量的影响Figure 4 Ascorbic acid(AsA,A)and glutathione(GSH,B)content in Vallisneriaspiralis under piggery tail water of ozonation in four sampling numbers
在本试验中,与BO相比,除第1次采样外,臭氧氧化处理有降低苦草SOD活性的趋势(图3A),且AO2处理降低明显,这与AO2处理中的O-2·含量低有关(图2A);而苦草SOD活性的降低可能是因为SOD发挥了歧化作用,从而使自身活性降低。与BO相比,臭氧氧化处理使苦草CAT活性在第1次采样中有降低趋势(图3B),在之后的采样中又逐渐升高,说明在试验初始,苦草对环境产生了不适反应,而在不适条件下苦草会调节自身的内源保护机制,以促进抗氧化酶活性的表达[33]。综合4次采样来看,与BO相比,臭氧氧化处理有降低苦草POD活性的趋势(图3C),说明臭氧氧化猪场处理尾水环境下,苦草H2O2含量的增加并没有激发POD活性,POD对苦草的调节没有起到主要作用,苦草是通过另外的抗氧化途径来进行ROS调节的。APX是AsA-GSH循环中的关键酶[32],臭氧氧化处理有增加苦草APX活性的趋势(图3D),且AO2处理中增加相对明显,而AO2处理中苦草的生物量也最大,说明与POD相比,可能AsA-GSH循环在本试验条件下对苦草的ROS调节更有效。
AsA-GSH循环负责清除H2O2,AsA和GSH是AsA-GSH循环中两个重要的抗氧化物质,它们往往通过相互耦合而起作用。叶片AsA水平被认为是衡量植物耐受性的一个指标[34]。如图4A所示,在第1次采样中,AO3处理中苦草AsA含量显著增加,在之后的采样中又显著降低,说明短期处于逆境中时,植物会激发体内的抗氧化物质来抵御不适条件,而之后苦草不能将体内的AsA含量维持在正常水平,可能是在此环境下时间过长对AsA再生系统产生了不利影响[35],植物体抗氧化胁迫的能力减弱[36]。AO2中苦草的AsA含量较高,说明AsA在调节苦草的适应性和体内的生理平衡上发挥重要作用。GSH是再生AsA的重要物质,是植物代谢过程中生理变化的潜在标记物。臭氧氧化处理有增加苦草GSH含量的趋势(图4B),对AsA的再生起到重要作用。在AO2处理中,苦草的APX活性、AsA含量和GSH含量都有增加趋势,说明AsA-GSH循环在该环境中对苦草的ROS调节和维持生物量具有重要作用。
4 结论
(1)除SOD活性以外,臭氧氧化处理对苦草的活性氧和抗氧化指标均有显著影响(P<0.05)。
(2)AO1和AO2处理与BO处理相比,苦草的生理指标调节功能相对较好,AO2处理中苦草的生物量最高,AsA-GSH循环对ROS的调节起重要作用,其中的APX活性、AsA和GSH含量增加明显。
(3)AO3处理中,苦草的H2O2含量增加,AsA含量降低,活性氧和抗氧化指标之间没有达到平衡,限制了苦草的生长,使苦草生物量降低。
(4)在合适的臭氧氧化浓度条件下,臭氧氧化技术应用于畜禽养殖废水处理对沉水植物的生长具有促进作用,从而对水生生态系统的调节具有重要意义。
[1]翁伯琦,雷锦桂,江枝和,等.集约化畜牧业污染现状分析及资源化循环利用对策思考[J].农业环境科学学报,2010,29(增刊):294-299.
WENG Bo-qi,LEI Jin-gui,JIANG Zhi-he,et al.Present situation analysis of intensive livestock pollution and countermeasures consideration of resource recycling[J].Journal of Agro-Environment Science,2010, 29(Suppl):294-299.
[2]Macauley J J,Qiang Z,Adams C D,et al.Disinfection of swine wastewater using chlorine,ultraviolet light and ozone[J].Water Research,2006, 40(10):2017-2026.
[3]曾鑫,呼世斌,屈广周,等.臭氧氧化处理养猪场厌氧沼液[J].环境工程学报,2015,9(7):3332-3338.
ZENG Xin,HU Shi-bin,QU Guang-zhou,et al.Treatment of swine farm anaerobic biogas slurry by ozone oxidation[J].Chinese Journal of Environmental Engineering,2015,9(7):3332-3338.
[4]Tay K S,Madehi N.Ozonation of ofloxacin in water:By-products, degradation pathway and ecotoxicity assessment[J].Science of the Total Environment,2015,520:23-31.
[5]Jennifer G A,Marc W B,Douglas R C,et al.Effects of oxygenation on ammonia oxidation potential and microbial diversity in sediment from surfaceflow wetland mesocosms[J].Bioresource Technology,2010,101(4):1389-1392.
[6]Tripathi S,Pathak V,Tripathi D M,et al.Application of ozone based treatments of secondary effluents in the tropical cities[J].Bioresource Technology,2011,102(3):2481-2486.
[7]Gan K,Mou X,Xu Y,et al.Application of ozonated piggery wastewater for cultivation of oil-rich Chlorella pyrenoidosa[J].Bioresource Technology,2014,171:285-290.
[8]Kim H C,Choi W J,Maeng S K,et al.Ozonation of piggery wastewater for enhanced removal of contaminants by S.quadricauda and the impact on organic characteristics[J].Bioresource Technology,2014,159:128-135.
[9]Silva G H R,Daniel L A,Bruning H,et al.Anaerobic effluent disinfectionusingozone:Byproductsformation[J].BioresourceTechnology,2010, 101(18):6981-6986.
[10]Carbajo J B,Petre A L,Rosal R,et al.Continuous ozonation treatment of ofloxacin:Transformation products,water matrix effect and aquatic toxicity[J].Journal of Hazardous Materials,2015,292:34-43.
[11]刘娅琴,刘福兴,宋祥甫,等.农村污染河道生态修复中浮游植物的群落特征[J].农业环境科学学报,2015,34(1):162-169.
LIU Ya-qin,LIU Fu-xing,SONG Xiang-fu,et al.Characteristics of phytoplankton community in country contaminated ditches during ecological restoration[J].Journal of Agro-Environment Science,2015,34(1):162-169.
[12]于衍真,谭娟,冯岩.臭氧组合工艺在水处理中的应用[J].工业用水与废水,2008,39(3):8-16.
YU Yan-zhen,TAN Juan,FENG Yan.Application of ozone-combined process in water treatment[J].Industrial Water and Wastewater,2008, 39(3):8-16.
[13]Sharma P,Jha A B,Dubey R S,et al.Reactive oxygen species,oxidative damage,and antioxidative defense mechanism in plants under stressful conditions[J].Journal of Botany,2012,Article ID 217037, 1-26.doi:10.1155/2012/217037
[14]Zhang L,Wang S,Jiao L,et al.Physiological response of a submerged plant(Myriophyllum spicatum)to different NH4Cl concentrations in sediments[J].Ecological Engineering,2013,58:91-98.
[15]刘燕,王圣瑞,金相灿,等.水体营养水平对3种沉水植物生长及抗氧化酶活性的影响[J].生态环境学报,2009,18(1):57-63.
LIU Yan,WANG Sheng-rui,JIN Xiang-can,et al.Effects of different nutritional condition on the growth and antioxidant enzyme activity of three submerged macrophytes[J].Ecology and Envrionment,2009,18(1):57-63.
[16]Delmail D,Labrousse P,Hourdin P,et al.Physiological,anatomical and phenotypical effects of a cadmium stress in different-aged chlorophyllian organs of Myriophyllu malterniflorum DC(Haloragaceae)[J]. Environmental and Experimental Botany,2011,72(2):174-181.
[17]Wang C,Zhang S H,Wang P F,et al.Metabolic adaptations to ammonia-induced oxidative stress in leaves of the submerged macrophyte Vallisneria spiralis(Lour.)Hara[J].Aquatic Toxicology,2008,87(2):88-98.
[18]Jiang J,Gu X,Song R,et al.Microcystin-LR induced oxidative stress and ultrastructural alterations inmesophyll cells of submerged macrophyte Vallisneria spiralis(Lour.)Hara[J].Journal of Hazardous Materials,2011,190(1):188-196.
[19]王爱国,罗广华.植物超氧化物自由基与羟胺反应的定量关系[J].植物生理学通讯,1990,26(6):55-57.
WANG Ai-guo,LUO Guang-hua.Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants[J]. Plant Physiology Communications,1990,26(6):55-57.
[20]李玲.植物生理学模块实验指导[M].北京:科学出版社,2009:84-100.
LI Ling.Experimental instruction of plant physiology module[M].Beijing:The Science Publishing Company,2009:84-100.
[21]李合生,孙群,赵世杰,等.植物生理生化原理和实验技术[M].北京:高等教育出版社,2004:260-261.
LI He-sheng,SUN Qun,ZHAO Shi-jie,et al.Principles and experimental techniques of plant physiology and biochemistry[M].Beijing:Higher Education Press,2004:260-261.
[22]Nakano Y,Asada K.Purification of ascorbate peroxidase in spinach chloroplasts:Its inactivation in ascorbate-depleted medium and reactivation by monodehydroascorbate radical[J].Plant Cell Physiology,1987, 28(1):131-140.
[23]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.
[24]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000, 159-170.
[25]Griffith O W.Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vivylpyridine[J].Analytical Biochemistry,1980,106(1):207-212.
[26]Miller G,Shulaev V,Mittler R.Reactive oxygen signaling and abiotic stress[J].Physiologia Plantarum,2008,133(3):481-489.
[27]Sgherri C,Quartacci M F,Navari-Izzo F.Early production of activated oxygen species in root apoplast of wheat following copper excess[J]. Journal of Plant Physiology,2007,164(9):1152-1160.
[28]Rai R,Agrawal M.Evaluation of physiological and biochemical responses of two rice(Oryza sativa L.)cultivars to ambient air pollution using open top chambers at a rural site in India[J].Science of the Total Environment,2008,407(1):679-691.
[29]Liu Y G,Wang X,Zeng G M,et al.Cadmium-induced oxidative stress and response of the ascorbate-glutathione cycle in Bechmeria nivea(L.)Gaud[J].Chemosphere,2007,69(1):99-107.
[30]Tasgin E,Atici O,Nalbantoglu B,et al.Effects of salicylic acid and cold treatments on protein levels and on the activities of antioxidant enzymes in the apoplast of winter wheat leaves[J].Phytochemistry,2006, 67(1):710-715.
[31]Barcelo A R,Pomar F,Lopez-Serrano M,et al.Peroxidase:A multifunctional enzyme in grapevines[J].Functional Plant Biology,2003,30(6):577-591.
[32]Wang J,Zhang H,Allen R D.Overexpression of an Arabidopsis peroxisomal ascorbate peroxidase gene in tobacco increases protection against oxidative stress[J].Plant and Cell Physiology,1999,40(7):725-732.
[33]Bowler C,Montagu M V,Inze D.Superoxide dismutase and stress tolerance[J].Annual Review of Plant Physiology and Plant Molecular Biology,1992,43(1):83-116.
[34]Frei M,Wissuwa M,Pariasca-Tanaka J,et al.Leaf ascorbic acid level: Is it really important for ozone tolerance in rice?[J].Plant Physiology and Biochemistry,2012,59:63-70.
[35]Mahalingam R,Jambunathan N,Gunjan S K,et al.Analysis of oxidative signaling induced by ozone in Arabidopsis thaliana[J].Plant,Cell and Environment,2006,29(7):1357-1371.
[36]宋玉芝,孔繁璠,王敏,等.光照强度及附植藻类对狐尾藻生理指标的影响[J].农业环境科学学报,2015,34(2):233-239.
SONG Yu-zhi,KONG Fan-fan,WANG Min,et al.Effects of light intensity and epiphytic algae on physiological parameters of Myriophyllum spicatum[J].Journal of Agro-Environment Science,2015,34(2):233-239.
Effects of ozonation of piggery tail water on the antioxidant system in Vallisneria spiralis
WANG Jun-li,CHEN Gui-fa,LIU Fu-xing*,SONG Xiang-fu,ZOU Guo-yan(Shanghai Academy of Agricultural Science,Shanghai 201403,China)
Ozonation is becoming more prevalent as a pretreatment in the dispose of livestock wastewater,there are growing concerns on the effects of ozonation technology on sustainable development of environment.In this research,after the piggery tail water from biological pond system was further treated by ozonation,the effects of ozonized piggery tail water on the health of aquatic ecosystems were investigated in the terms of reactive oxygen species and antioxidant system of Vallisneria spiralis.The results showed that compared with the un-ozonized tail water,ozonation(AO1 10 mg·L-1,AO2 30 mg·L-1,AO3 50 mg·L-1)increased hydrogen peroxide(H2O2)content in Vallisneria spiralis.AO2 treatment increased ascorbate peroxidase(APX)activity,ascorbic acid(AsA)and glutathione(GSH)content and the biomass,indicating the important role of AsA-GSH cycle in regulating H2O2levels.However,AO3 treatment decreased AsA content,broke the balance between H2O2and antioxidants and resulted in the decreased biomass of Vallisneria spiralis.Our results suggested that,30 mg·L-1is the optimum ozone concentration to treat piggery tail water,by which it could promote the antioxidant system and growth of submerged macrophytes,and very helpful for the maintenance of healthy aquatic ecosystem.
ozonation;piggery tail water;submerged macrophytes;Vallisneria spiralis;antioxidant system
X713
A
1672-2043(2016)12-2299-07
10.11654/jaes.2016-0743
王俊力,陈桂发,刘福兴,等.臭氧氧化猪场处理尾水对苦草(Vallisneria spiralis)抗氧化系统的影响[J].农业环境科学学报,2016,35(12):2299-2305.
WANG Jun-li,CHEN Gui-fa,LIU Fu-xing,et al.Effects of ozonation of piggery tail water on the antioxidant system in Vallisneria spiralis[J].Journal of Agro-Environment Science,2016,35(12):2299-2305.
2016-05-31
国家水体污染控制与治理科技重大专项(2012ZX07101-004)
王俊力(1985—),女,辽宁丹东人,博士,从事植物生理生态研究。E-mail:jlwang2014@yeah.net
*通信作者:刘福兴E-mail:liufuxing@126.com

