反胶束体系对花生蛋白功能性与结构的影响研究
赵晓燕 朱海涛 张炳文 汤卫东 张立金 何 磊
(济南大学酒店管理学院食品科学与营养系,济南 250022)
反胶束体系对花生蛋白功能性与结构的影响研究
赵晓燕 朱海涛 张炳文 汤卫东 张立金 何 磊
(济南大学酒店管理学院食品科学与营养系,济南 250022)
研究了反胶束体系对花生蛋白功能特性、氨基酸组成和二级结构的影响。与水相法所提花生蛋白相比,2种方法制备的蛋白氮溶解指数与吸水性相近;反胶束法所提花生蛋白的颜色白亮,吸油性较差,但乳化特性与起泡性特性明显优于水相法所提花生蛋白。此外,反胶束萃取法有利于提高花生蛋白中某些氨基酸含量,如鲜味氨基酸天门冬氨酸、谷氨酸;反胶束萃取花生蛋白酰胺带Ι的二级结构光谱发生了移动,无规则卷曲和β-转角含量有一定程度的增加,β-折叠含量稍微减少,新出现α-螺旋结构含量。
反胶束 萃取 花生蛋白 功能性 结构
花生蛋白是一种优质的植物蛋白,与大豆蛋白、棉籽蛋白、菜籽蛋白等植物蛋白相比,具有独特的风味物质,更易消化,所含毒性物质少,是一种理想的食品基础原料。国家粮油信息中心提供的数据显示,2013年我国花生种植面积471万hm2,花生总产量1 700万t,位居世界第一[1]。我国花生原料资源丰富,应该充分利用这一优势对花生进行精深加工,开发出更多的高活性花生蛋白产品,将改性后具有优良的功能特性的花生蛋白添加到食品中,拓宽花生蛋白利用领域,提高花生蛋白的利用率。
蛋白的功能特性主要包括溶解性、吸水性、吸油性、乳化性及乳化稳定性,起泡性及泡沫稳定性等[2]。蛋白质的这些功能性质不仅与本身的氨基酸组成、分子大小、分子结构有关系,还受所处环境的温度、pH、电离强度等的影响[3]。前人对花生蛋白粉溶液的各项功能特性进行了研究,从试验结果可知,外界环境因素对花生蛋白的功能特性有较大的影响[4-5]。反胶束对大豆与核桃蛋白的结构与功能特性的影响已有相关研究,而反胶束对花生蛋白结构与功能性的影响研究鲜有报道[6-8]。
本试验研究了利用AOT/正己烷反胶束体系萃取的花生蛋白的功能特性,利用氨基酸分析仪(AAA)、傅里叶红外光谱(FTIR)等对花生蛋白进行了研究,并与传统方法制备的花生蛋白的结构及特性进行了对照试验。
1 材料与方法
1.1 原料
低温花生粕:山东省高唐蓝山集团。
1.2 药品和试剂
AOT(丁二酸二异辛酯磺酸钠):上海益民化工厂;正己烷、磷酸氢二钠、磷酸二氢钾、氯化钾均为北京化学试剂公司。花生油:山东鲁花集团生产的5S一级压榨花生油。
1.3 仪器和设备
FJ200-S高速分散均质机:上海索映仪器设备有限公司;LXJ-ⅡB离心机:上海安亭科学仪器厂;PHSJ-3F PH计:上海精密科学仪器有限公司;SHY-2A水浴恒温振荡器:江苏金坛市金城国胜实验仪器厂;SH-3磁力搅拌器:北京金紫光科技发展有限公司;L8900氨基酸分析仪(AAA):日本日立公司;Pekin-Elmer Model GX傅里叶红外光谱(FTIR):英国Pekin-Elmer公司。
1.4 试验方法
1.4.1 花生蛋白制备
1.4.1.1 反胶束法提取花生蛋白[9-10]
取浓度0.08 g/mL AOT/正己烷的反胶束溶液150 mL,加入0.05 mol/L的KCL缓冲液9 mL,摇匀,稍待片刻至溶液变澄清,加入3.75 g的100目的低温花生粕,在40 ℃恒温水浴中,180 r/min的速度震荡1 h,3 000 r/min的条件下离心15 min,取上层清液得蛋白前萃液;取蛋白前萃液加入等体积的1 mol/L的KCL缓冲溶液,在40 ℃恒温水浴中,250 r/min以上的速度震荡1.5 h,4 500 r/min的条件下离心15 min,收集下层清液即蛋白后萃液;将后萃液放入分子质量7 000 u的透析袋中,4 ℃条件下透析16~24 h,除去其中的电解质离子,冷冻干燥即得花生蛋白。含水量为4.12%,粗脂肪质量分数为0.37%,蛋白质的质量分数为86.17%(凯氏定氮法检测)。
1.4.1.2 水相法提取花生蛋白[10]
取300 mL KH2PO4+Na2HPO4缓冲液(调节pH 7.0)加入15 g 100目的低温花生粕,在40 ℃恒温水浴中,250 r/min以上的速度震荡2 h,4 500 r/min的条件下离心15 min,取上层清液;将上层清液在12 000 r/min的条件下高速离心20 min,所得清夜即为蛋白提取液;将上层清液放入分子质量7 000 u的透析袋中,4 ℃条件下透析16~24 h,除去其中的电解质离子,冷冻干燥即得花生蛋白。含水量为3.95%,粗脂肪质量数为8.92%,蛋白质的质量分数为80.65%(凯氏定氮法检测)。
1.4.2 花生蛋白功能特性研究
1.4.2.1 花生蛋白氮溶解指数(NSI)的测定
花生蛋白氮溶解指数(NSI)测定参照GB 5511—1985。
1.4.2.2 花生蛋白吸水性的测定[2]
花生蛋白的吸水性是指每克花生蛋白结合水的克数,测定方法:称取0.5 g(精确到0.000 1 g)花生蛋白粉,放入已称重的50 mL离心管中,加入10 mL蒸馏水,同时搅拌,至花生蛋白完全润湿,室温下放置30 min,在3 000 r/min的条件下离心15 min,弃掉上层清液后称重。吸水性的计算如式(1)所示。
吸水性=(吸水后样品质量-吸水前样品质量)/吸水前样品质量
(1)
1.4.2.3 花生蛋白吸油性的测定[12]
准确称取0.5 g(精确到0.000 1 g)花生蛋白粉,放入已称重的15 mL离心管中,加入3 mL花生油,用玻璃棒搅拌5 min至混合均匀,室温下静置30 min,在3 000 r/min的条件下离心15 min,吸去上层未吸附的花生油,称重。吸油性的计算如式(2)。
吸油性=(吸油后样品质量-吸油前样品质量)/吸油前样品质量
(2)
1.4.2.4 花生蛋白乳化性及乳化稳定性的测定[13]
准确称取2.5 g(精确到0.000 1 g)花生蛋白粉,分散于50 mL蒸馏水中,再加入50 mL花生油,均质2 min(10 000 r/min),离心(3 000 r/min)10 min,取出离心管,观察乳化情况,记录乳化层高度及管中液体总高度,计算乳化能力EA,计算方法如式(3)所示。
EA=(H0/H)×100%
(3)
式中:H0为离心管中乳化层高度/ m;H为离心管中液体总高度/cm。
将离心管置于80 ℃水浴中加热30 min后,用自来水冷却至室温,再次离心10 min,记录乳化层高度及管中液体总高度,计算如花稳定性ES,计算方法如式(4)所示。
ES=(H1/H2)×100%
(4)
式中:H1为加热冷却后离心管中乳化层高度/ cm;H2为加热冷却后离心管中液体总高度/cm。
1.4.2.5 花生蛋白起泡性及起泡稳定性的测定[14]
精确称取1 g 蛋白粉试样置于装料杯中,加入100 mL蒸馏水,均质(12 000 r/ min) 2 min ,记录均质停止时的泡沫体积,起泡能力计算方法如式(5)所示。
起泡能力=(均质停止时泡沫体积/100) ×100%
(5)
均质停止后,室温下静置30 min ,记录此时泡沫体积,泡沫稳定性计算方法如式(6)所示。
泡沫稳定性=(30 min 后泡沫体积/均质停止时泡沫体积)×100%
(6)
1.4.3 花生蛋白氨基酸分析[15]
采用氨基酸分析仪测定2种方法所提取的花生蛋白中氨基酸的含量。
1.4.4 红外光谱研究花生蛋白的二级结构[6]
用傅里叶红外光谱(FTIR)测定花生蛋白的二级结构。样品制备采用KBr压片法,取花生蛋白样品约3 mg 与溴化钾200 mg 混合, 研磨均匀压片。用Pekin-Elmer Model GX傅里叶红外光谱仪测量在20 ℃测定样品,检测器DTGS。试验条件为:分辩率4 cm-1,测量范围4 000~400 cm-1,扫描信号累加32次,信噪比>500。图谱处理:选择酰胺Ⅰ带光谱,作去卷积变换和二阶导数数值处理,求出去卷积谱和二阶导数谱,确定子峰峰位并作曲线拟合处理求出各子峰面积,找出结构与谱带的对应关系,并对不同方法制备花生蛋白进行比较。
2 结果与分析
2.1 花生蛋白的外观评定与功能特性的研究
利用反胶束法提取的花生蛋白与利用水相法提取的花生蛋白相比,两者在感官上有明显差别:前者颜色亮白,呈现粉末状;后者颜色为暗淡无光的白色,呈现絮状。两者功能特性测定结果如表1所示。
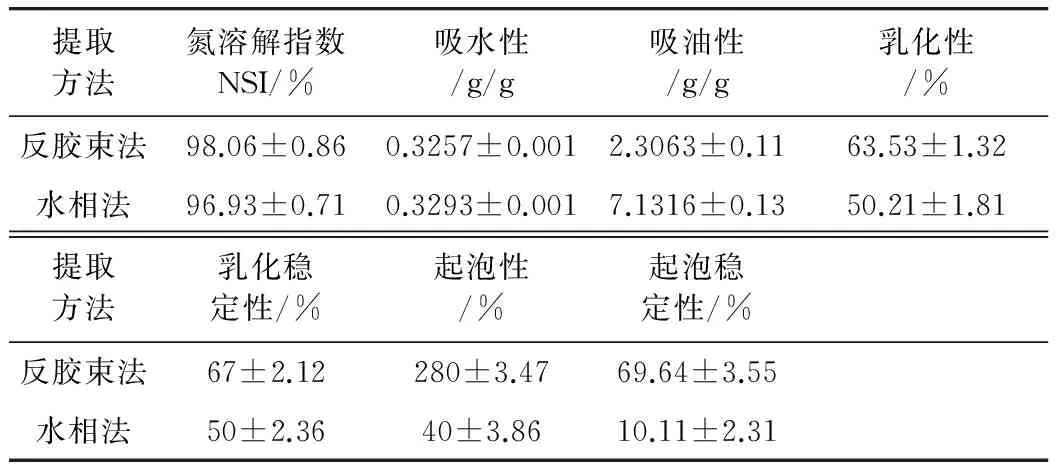
表1 花生蛋白产品的功能特性
由表1可以看出,2种方法所提的花生蛋白的功能特性有所差别。两者的氮溶解指数相近,都比较高,因为2种方法所提取的蛋白都是溶于水的蛋白,所以制得的产品都能很好的复溶于水,所以两者的氮溶解指数都很高。两者的吸水性能相差不大,但水相法所提蛋白的吸油性明显由于反胶束法所提蛋白。从两者形态结构上来看,水相法所提絮状蛋白比反胶束法所提粉末状蛋白能更好地“包藏”油脂,可能使其吸油显著增多。另外,蛋白产品的吸油性还与其氨基酸组成等有关系。乳化性方面,反胶束法所提花生蛋白的乳化性与乳化稳定性优于水相法所提花生蛋白。起泡性方面,反胶束法所提花生蛋白的起泡性明显优于水相法所提花生蛋白,而且稳定性也相对较好。
2.2 花生蛋白氨基酸分析
采用氨基酸分析仪测定花生蛋白中氨基酸含量如表2所示。
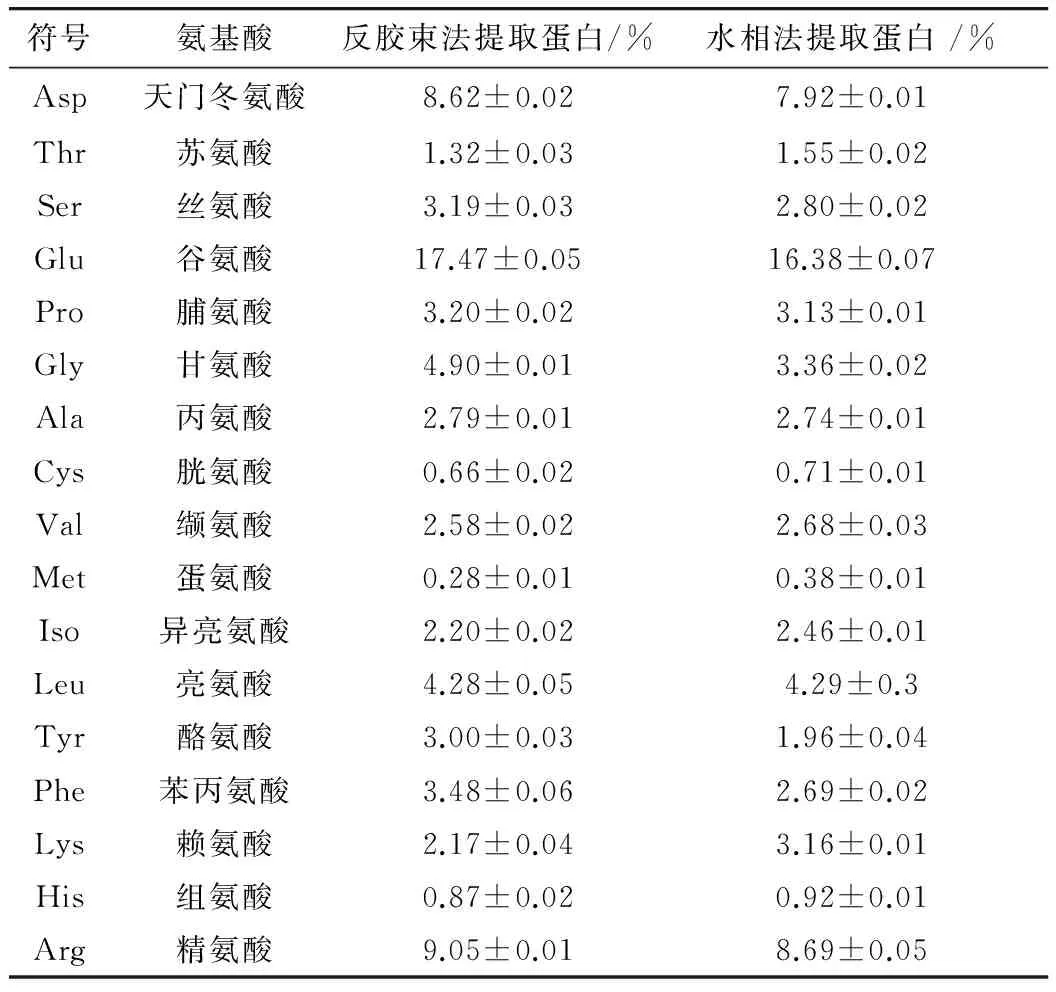
表2 氨基酸成分分析
花生蛋白的氨基酸氨基酸组成比较丰富,含有18种氨基酸(因为采用酸水解法,色氨酸未检出)。
由表2中可以看出,2种方法所提花生蛋白在氨基酸的种类上没有差别,但在氨基酸总量和含量组成上有所不同。反胶束法所提花生蛋白氨基酸总量为70.16%,其中7种必需氨基酸含量为16.41%;水相法所提花生蛋白的氨基酸总量为65.82%,其中7种必需氨基酸含量为17.21%。2种方法所提氨基酸的主要氨基酸谷氨酸、精氨酸、天门冬氨酸、甘氨酸、亮氨酸、苯丙氨酸等在含量上相比,反胶束法所提的含量均高于水相法所提的含量。谷氨酸和天门冬氨酸这2种鲜味氨基酸在反胶束法所提花生蛋白中的含量明显高于在水相法所提花生蛋白中的含量。
反胶束法所提花生蛋白中各种氨基酸含量的变化原因有可能是,由于反胶束溶液具有独特的组成成分,在其疏水相互作用、静电作用以及界面作用等的作用下,引起蛋白质在制备过程中发生部分水解,或者部分氨基酸发生的转化而导致。
2.3 花生蛋白的二级结构分析
红外光谱技术应用于蛋白的结构分析大致经历了定性研究、半定量研究和定量研究3个发展阶段,其中定量研究始于20世纪80年代。本研究采用了傅里叶变换红外光谱仪测定蛋白的二级结构,与常规的色散型红外光谱仪相比,傅里叶变换红外光谱仪具有灵敏度高、分辨率高、频率精度高和信噪比高的优势。
反胶束相制备的花生蛋白的酰胺Ⅰ带光谱及去卷积谱如图1所示,从去卷积谱可以分离出7个子峰分别列于表3中;水相制备花生蛋白的酰胺Ⅰ光谱及去卷积谱如图2所示,在去卷积光谱中可以观察到的5个子峰别列于表3中。
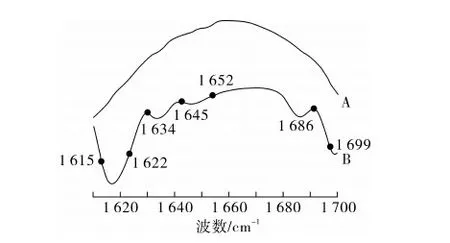
图1 反胶束制备花生蛋白的原始光谱(A)和去卷积光谱(B)

图2 水相制备花生蛋白的原始光谱(A)和去卷积光谱(B)
由图1、图2和表3中可以看出,反胶束制备的花生蛋白的二级结构在酰胺Ⅰ有7个子峰,水相制备的花生蛋白的二级结构在酰胺Ⅰ有5个子峰,两者相比频率基本没有变化,但是反胶束制备的花生蛋白的二级结构的红外特征中出现了新的频率。
反胶束制备的花生蛋白的二级结构发生位移的可能原因:一是反胶束制备花生蛋白过程中,原料与有机溶剂接触,引起了蛋白结构的变化;二是反胶束相中的表面活性剂与花生蛋白之间相互作用,引起了蛋白结构的变化。关于这一方面,Chang等[16-17]做过相关试验,但具体机理尚需研究。

表3 水相和反胶束制备的花生蛋白酰胺Ⅰ带频率(cm-1)
2.3.1 花生蛋白在酰胺Ⅰ带中的二级结构分布
α-螺旋结构在酰胺Ⅰ带中所在范围为1 650~1 660 cm-1。反胶束制备的花生蛋白的α-螺旋结构谱带则在1 652 cm-1;而水相制备的花生蛋白在酰胺Ⅰ带中没有发现α-螺旋结构。
β-折叠结构在酰胺Ⅰ带的波段有2个,通常为1 615~1 640 cm-1和1 670~1 690 cm-1附近[17]。由图1和表3中可知,反胶束制备的花生蛋白的β-螺旋结构对应的谱带分别为1 615,1 622,1 634,1 686 cm-1;由图2和表3中可知,水相制备的花生蛋白的β-螺旋结构对应的谱带分别为1 615,1 622,1 686 cm-1。两者相比,水相制备的花生蛋白1 634 cm-1附近的β-折叠结构消失。
蛋白的无序结构的谱带在约在1 645 cm-1左右,β-转角结构谱带约在1 660 cm-1和1 700 cm-1附近。2种方法所制备的花生蛋白在酰胺Ⅰ带中的无序结构和β-转角结构没有明显差别,无序结构均在1 645 cm-1附近,β-转角结构均在1 699 cm-1附近。
2.3.2 花生蛋白在酰胺Ⅰ带中的二级结构定量分析
利用红外光谱的二阶导数可以直接对蛋白二级结构的成分进行定量分析。在二阶导数谱中,确定子峰峰位,作出曲线拟合,求出各子峰面积,所得到的子峰面积对应于蛋白质二级结构成分的面积的比值即该二级结构所占比例。表4是对花生蛋白在酰胺Ⅰ带中的二级结构定量分析结果。
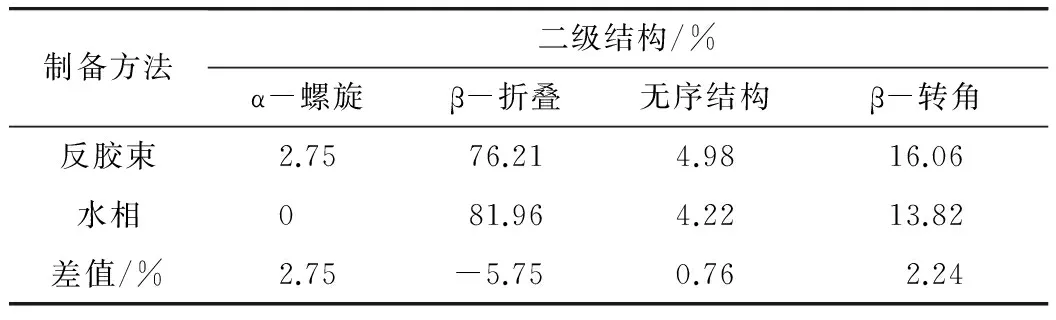
表4 花生蛋白在酰胺Ⅰ带的二级结构定量分析
由表4可知,与水相制备的相比,反胶束制备的花生蛋白的二级结构中β-折叠的百分含量有所下降,降低了5.75%;无序结构差别不大;β-转角结构的含量高出2.24%。另外,反胶束制备蛋白的二级结构还含有2.75%α-螺旋结构,这是水相法所提花生蛋白中所没有的。
3 结论
3.1 2种方法所提花生蛋白在外观上有所差异。反胶束法所提花生蛋白为亮白细腻的粉末状;水相法所提花生蛋白为絮状且颜色暗淡。
3.2 在功能特性方面,2种方法所提花生蛋白的氮溶解指数、吸水性相近;水相法所提花生蛋白的吸油性要比反胶束法所提花生蛋白的好;反胶束法所提花生蛋白的乳化性与稳定性要比水相法所提花生蛋白的好;在起泡性和起泡稳定性上,反胶束法所提花生蛋白要明显优于水相法所提花生蛋白。
3.3 2种方法所提花生蛋白的氨基酸种类没有差别,但是在含量上有所差异。反胶束制备有利于提高花生蛋白中某些氨基酸的含量,如2种鲜味氨基酸天门冬氨酸、谷氨酸。
3.4 通过傅里叶红外光谱(FTIR)测定花生蛋白的二级结构可知,反胶束法提取花生蛋白会对花生蛋白的二级结构产生作用。与水相法所提花生蛋白相比,反胶束制备的花生蛋白的二级结构中β-折叠的百分含量降低了5.75%,无序结构差别不大,β-转角结构的含量高出2.24%,2.75%,α-螺旋结构是水相法所提花生蛋白中所没有的。
[1]FAS-USDA web [EB/OL]. www.fas.usda.gov
[2]American Association of Cereal Chemists (AACC), Approved Methods of the AACC[S]. Method 44-19, 10th ed., AACC, St. Paul, MN, USA, 2000
[3]李晓刚,张永丹.花生粕的酶解新工艺研究[J].食品工业科技,2004, 25(2):102-103
[4]董贝森,朱海涛,于跃芹. 花生蛋白粉溶液流变学特性及功能性的研究[J]. 农业工程学报,1999,15(1):251-252
[5]徐维艳,王卫东,秦卫东. 花生蛋白的制备、功能性质及应用[J]. 食品科学,2010,31(17):476-479
[6]Chen X Y, Ru Y, Chen F L, et al. FTIR spectroscopic characterization of soy proteins obtained through AOT reverse micelles [J]. Food Hydrocolloids, 2013, 31: 435-437
[7]Zhao X Y, Chen F S, Chen J Q, et al. Effects of AOT reverse micelle on properties of soy globulins[J]. Food Chemistry, 2008, 111: 599-605
[8]Liu F L, Wang X C, Zhao X Y, et al. Surface properties of walnut protein from AOT reverse micelles[J]. International Journal of Food Science and Technology, 2014, 49: 626-633
[9]赵晓燕,盖国胜,薛文通, 等.二次通用旋转组合设计法优化AOT 反胶束体系萃取大豆蛋白质的研究[J].中国粮油学报,2008,23 (6): 56-63
[10]王宪昌,虎海防,赵晓燕等.反胶束法提取核桃粕中蛋白的前萃工艺研究[J]. 中国粮油学报,2014, 29 (1):91-94
[11]Nagano T, Hirotsuka M, Mori H, et al. Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J]. Journal of Agricultural and Food Chemistry, 1992, 40: 941-944
[12]张立伟. 富硒菜籽蛋白产品的制备、功能特性及应用研究[D].武汉:武汉食品工业学院,1995
[13]周瑞宝. 植物蛋白功能原理与工艺[M]. 北京: 化学工业出版社, 2007
[14]刘大川. 植物蛋白工艺学[M]. 北京:中国商业出版社,1993
[15]Zhao X Y., Chen J, Lu Z F., et al. Analysis of the Amino Acids of Soy Globulins by AOT Reverse Micelles and Aqueous Buffer[J]. Applied Biochemistry and Biotechnology, 2011, 165: 802-813
[16]Chang Q, Chen J, Zhang X, et al. Effect of the Cosolvent Type on the Extraction of α-Amylase with Reversed Miceles: Circular Dichroism Study[J]. Enzyme and Microbial Technology, 1997, 20: 87-92
[17]Chang Q L, Liu H Z, Chen J Y. Fourier Transform Infrared Spectra Studies of Protein in Reverse Micelles: Effect of AOT/Isooctance on the Secondary Structure of α-Chymotrypsin[J]. Biochimica et Biophysica Acta,1994, 1206: 247-25.
Effect of Reverse Micelles on the Functional Properties and Structure of Peanut Protein
Zhao Xiaoyan Zhu Haitao Zhang Bingwen Tang Weidong Zhang Lijin He Lei
(Department of Food Science and Nutrition, School of Hotel Management, University of Jinan, Jinan 250022)
The review studies the effect of reverse micelles on functional properties, amino acid composition and the secondary structure of peanut protein. The results show that similar nitrogen solubility index and water absorption of protein using AOT reverse micelles and aqueous buffer extraction are found. Color of peanut protein obtained through reverse micelles is bright and white with poor oil absorbency, while the emulsifying properties and foaming properties are significantly better than that of aqueous buffer phase. In addition, the reverse micelles could improve certain amino acids in peanut protein, for example the flavor amino acid, asparaginic acid and glutamic acid; The second derivative spectra of proteins in amide Ι bands from reverse micelles has been shifted compared with their spectra with aqueous buffer extraction method, random coil and β-corner content increase, while β-sheet reduces in a certain extent, and new α-helix content appears.
reverse micelles, extraction, peanut protein, functional properties, structure
TS201.4
A
1003-0174(2016)06-0063-05
国家自然科学基金(21406133)
2014-10-19
赵晓燕,女, 1975 年出生,副教授,食品理论与加工应用及生物粉体技术

