星形胶质细胞的缝隙连接蛋白43参与冷冻伤后脑水肿的形成*
章科娜, 丁悦敏, 杜月光, 龚 婉, 张 雄
(1浙江中医药大学基础医学院,浙江 杭州 310053; 2浙江大学城市学院医学院,浙江 杭州 310015; 3浙江大学医学院基础医学系,浙江 杭州 310058)
星形胶质细胞的缝隙连接蛋白43参与冷冻伤后脑水肿的形成*
章科娜1, 丁悦敏2, 杜月光1, 龚 婉1, 张 雄3△
(1浙江中医药大学基础医学院,浙江 杭州 310053;2浙江大学城市学院医学院,浙江 杭州 310015;3浙江大学医学院基础医学系,浙江 杭州 310058)
目的: 探讨脑水肿后星形胶质细胞缝隙连接蛋白43(Cx43)的表达及其在脑水肿的发生发展过程中所起的作用。方法:采用颅骨外液氮冷冻法建立大鼠右侧顶叶皮层脑水肿模型。实验分为假手术组、脑水肿模型组和脑水肿模型+缝隙连接阻断剂(carbenoxolone或octanol)干预组。干湿重法测定冷冻伤后的脑含水量;甲酰胺法测定大鼠血脑屏障通透性的改变;HE染色观察冷冻伤脑组织的病理变化;Western blot法和免疫组化检测Cx43蛋白的表达情况。结果:冷冻伤可引起大鼠损伤脑皮层区的含水量增加,在冷冻伤后24 h脑水肿发展到高峰。冷冻伤引起损伤脑皮层区域的血脑屏障通透性增加,范围大于直接冷冻损伤区。HE染色观察显示冷冻伤中心区细胞坏死明显,而冷冻伤周围区域出现水肿。脑冷冻伤引起冷冻伤周围皮层区域的Cx43蛋白表达增加,但冷冻伤中心区的Cx43蛋白表达降低。Carbenoxolone或octanol阻断Cx43的功能,降低了冷冻伤皮层区的含水量和血屏障通透性。结论:脑水肿时星形胶质细胞上的Cx43表达上调,功能增强;阻断Cx43的功能可在一定程度上减轻脑水肿。
缝隙连接蛋白43; 星形胶质细胞; 脑水肿; 缝隙连接; 冷冻伤
脑水肿是各种颅脑疾病及损伤最常见的并发症,会导致颅内压增高,脑疝形成,危害严重[1]。据统计结果显示,在所有创伤性颅脑损伤患者中,脑水肿约占死亡率的50%[2]。因此,研究脑水肿的形成机制和治疗策略具有非常重要的临床意义。此外,创伤后脑水肿的范围往往不仅仅局限在损伤部位,通常会向损伤周围区域扩散进而导致脑水肿范围的扩大。
在中枢神经系统中,胶质细胞的数量远多于神经元,其中大部分由星形胶质细胞组成。已有研究显示脑水肿早期主要表现为星形胶质细胞胞体和突起肿胀,内质网肿大,线粒体改变,细胞核、细胞膜破坏[3]。因此,星形胶质细胞肿胀可能是脑水肿发生发展过程中的一个重要因素。缝隙连接蛋白43(connexin 43,Cx43)是构成星形胶质细胞间缝隙连接的主要蛋白质,具有特殊结构和重要功能,已有许多研究表明它与多种中枢神经系统疾病有着密不可分的关系,如脑缺血[4-6]、脑创伤[7]、Alzheimer’s病[8-10]、脑肿瘤[11-12]等。有关Cx43在脑水肿中变化及其相关机制至今尚未明确,因此本研究的主要目的是探讨脑水肿后Cx43的表达和功能的变化,并初步阐述Cx43在脑水肿发生发展中的作用。
材 料 和 方 法
1 实验动物及分组
健康清洁级成年SD大鼠,雌雄不限,体重为(230±30)g,购自上海斯莱克实验动物中心。随机分为假手术组、脑水肿模型组、Cx43阻断剂carbenoxolone(CBX)组和Cx43阻断剂octanol组。
2 主要试剂
Carbenoxolone(CBX)、octanol、伊文氏蓝(Evans blue,EB)、Tris-base和TTC购自Sigma;羊抗兔connexin 43多克隆抗体购自Bioworld Technology;羊抗兔GAPDH多克隆抗体购自北京博奥森生物技术有限公司;羊抗兔荧光 II抗和羊抗小鼠荧光 II 抗购自LI-COR;预染蛋白质分子量Marker购自MBI Fermentas;PVDF膜购自Millipore;SDS 购自Sangon Biotech;RIPA裂解液、BCA蛋白定量试剂盒、多聚赖氨酸、30%Arc-Bis(29∶1)、SDS-PAGE及蛋白上样缓冲液均购自碧云天。
3 主要方法
3.1 大鼠脑水肿模型的建立 参照Kawai等[13]的方法加以改进。4%水合氯醛腹腔注射麻醉大鼠后,将其俯卧位固定于脑立体定位仪上,备皮,沿正中切开头皮,分离骨膜,暴露颅骨表面。以前囟向后3 mm,右旁开矢状缝4 mm为圆心,以直径5 mm的圆形区域为冷冻区。将内盛定量液氮的自制冷冻杯的铜管(外径为5 mm,内径为3 mm)置于该区域,持续冷冻80 s,造成右侧顶叶脑皮层水肿。手术过程中将立体定位仪接通水浴加热,维持肛温为37~37.5 ℃。冷冻伤结束后,立即将头皮缝合,自由饮食饮水。假手术组(sham组)与冷冻伤模型组(cryoinjury组)同样进行麻醉、切开头皮和暴露颅骨,但是不进行冷冻。
3.2 脑含水量的测定 为观察冷冻伤后不同时点的脑含水量,本实验于冷冻伤后6 h、24 h和72 h,将大鼠断头取脑,取损伤侧半球的全部脑皮层,同时在对侧半球取全部皮层,剥离血管膜,用滤纸吸去表面的水分和血,称量脑湿重。然后于100 ℃烘箱中烘24 h至恒重,称量此时的脑组织干重。用Elliot公式计算得到脑组织含水量:脑含水量(%)=(脑湿重-脑干重)/脑湿重×100%。为比较假手术组、脑水肿模型组、CBX阻断剂组和octanol阻断剂组之间的脑含水量,本实验在冷冻伤后24 h,将大鼠断头取脑,切取脑水肿的主要病变区域,即冷冻伤中心和周围2 mm区域的所有脑皮层,同样采用干湿重法测定脑含水量。
3.3 血脑屏障(blood-brain barrier,BBB)通透性的测定 采用甲酰胺法测定BBB通透性的改变。首先制定标准曲线,然后于冷冻伤后10 min,经尾静脉注射已过滤的2% EB(1 mL/kg),24 h后再次麻醉,经左心室灌注生理盐水至右心房流出无色液体为止,断头取脑,选取冷冻伤部位呈蓝染的皮层以及左侧半球相应区域的脑皮层,称湿重。然后将脑皮层剪成小块置于甲酰胺中,37 ℃孵育48 h。孵育结束后,低速离心,取上清液,在632 nm处测定吸光度。根据标准曲线计算出EB浓度。
3.4 TTC与EB双染 大鼠在冷冻伤后10 min,经尾静脉注射已过滤的2% EB生理盐水溶液,于冷冻伤后24 h经左心室灌注生理盐水,至右心房流出清亮液体为止,然后断头取脑,切成2 mm厚的冠状切片,浸泡于2% TTC溶液中,37 ℃避光孵育20 min,中间过程翻动脑组织以保证其能够充分与TTC溶液反应。染色结果拍照后保存。
3.5 脑组织石蜡切片样本的采集 于冷冻伤后各时点麻醉大鼠,经左心室灌注生理盐水,剪开右心耳放血,至右心房流出清亮液体,再用4%多聚甲醛灌注固定至大鼠肢体变硬。然后断头取脑,4%多聚甲醛继续固定48 h。常规脱水、透明、浸蜡,包埋成蜡块,用于HE染色和免疫组化染色。
3.6 Cx43免疫组化染色 采用免疫组化EnVision法检测:石蜡切片4 μm,60 ℃烤片后常规脱蜡、水化;置于3% H2O2中10 min以封闭内源性过氧化物酶,蒸馏水洗3次;将切片于0.01 mol/L的柠檬酸钠缓冲液中煮沸20 min进行抗原修复,自然冷却至室温。0.01 mol/L PBS洗3遍;Cx43 Ⅰ抗(1∶50)4℃孵育过夜;次日,用0.01 mol/L PBS洗3次;II抗37 ℃孵育30 min;0.01 mol/L PBS洗3次;DAB显色,苏木素染液复染细胞核,常规脱水、透明、中性树胶封片。光镜下观察,胞浆或胞膜内出现棕色颗粒为阳性。用Image-Pro Plus 6.0图像分析软件进行分析,用平均吸光度表示Cx43的相对表达量。
3.7 Western blot法检测Cx43的蛋白水平 将大鼠麻醉,经左心室生理盐水灌注后取脑,分别取冷冻伤中心区域及冷冻伤周围2 mm的皮层,加入RIPA裂解液,提取总蛋白,用BCA法测定总蛋白浓度。用裂解液将各组蛋白调至等浓度后,加入上样缓冲液后充分混匀,于沸水中变性5 min,将制备好的蛋白样本置于-20 ℃保存,待用。将蛋白样品按照每泳道30 μg总蛋白上样,5%浓缩胶部份采用50 V进行电泳,待蛋白进入12%分离胶后采用110 V继续电泳。电泳结束后,250 mA恒流转膜2 h。5%脱脂牛奶室温封闭2 h后,分别用Cx43(1∶1 000)抗体或GAPDH(1∶1 000)抗体孵育,4 ℃过夜。次日,TBST洗3次,用荧光素标记的羊抗兔 II 抗(1∶5 000)、羊抗小鼠II抗(1∶5 000)室温下避光孵育2 h。TBST洗3次。用Odyssey红外激光双色图像分析系统扫膜。ImageJ图像分析软件测定光密度值,进行定量分析。
4 统计学处理
所有结果用均数±标准差(mean±SD)表示,多组数据的组间差异比较采用单因素方差分析(one-way ANOVA)法,各组均数间两两比较采用Bonferroni方法;以P<0.05为差异有统计学意义。
结 果
1 冷冻伤引起脑含水量增加
用干湿重法测定大鼠在冷冻伤后6 h、24 h和72 h的脑含水量。从图1可知,冷冻伤后6 h和24 h,损伤区域的含水量逐渐增加,与sham组相比差异有统计学显著性(P<0.01)。在冷冻伤后72 h脑含水量降低,与sham组相比差异无统计学显著性。上述结果说明脑冷冻伤后24 h内,脑含水量逐渐增加,约在24 h是脑水肿较严重的时期,所以本研究后续实验采用冷冻伤后24 h作为主要观察阶段。

Figure 1.Brain water content at 6 h, 24 h and 72 h after cryo-injury.Mean±SD.n=4.**P<0.01vssham group.
图1 冷冻伤后6 h、24 h和72 h脑含水量的变化
2 冷冻伤引起血脑屏障通透性增加
冷冻伤后10 min经尾静脉注射2% EB溶液,通过观察脑组织的蓝染现象,可以用于评价冷冻伤后血脑屏障的受损情况。正常情况下,血脑屏障完整,EB不能通过;当血脑屏障受损时,其通透性增加,EB能够通过血脑屏障,组织被染成蓝色。因此蓝染程度越深则表明血脑屏障的受损程度越大。实验结果发现,血脑屏障受损区域并不仅仅存在于冷冻伤的位置(相当于铜管直径5 mm的圆形区域),而是扩散至周围区域。在冷冻伤中心直径约5 mm的圆形皮层区呈现深蓝色,我们定义为冷冻伤中心区,在冷冻伤周围2 mm范围内的皮层区域呈浅蓝色,我们定义为冷冻伤周围区。
经EB蓝染的脑组织切成2 mm厚的脑片后再进行TTC染色,结果如图2所示。红色着色区域表示的正常脑组织,蓝染区域是血脑屏障被破坏的区域。从TTC和EB双染的结果中,我们发现损伤主要存在于脑皮层部位,且坏死区也主要存在于冷冻伤中心区域。
3 HE染色观察
HE染色结果显示sham组大鼠脑皮层的细胞结构清晰,未见异常。而冷冻伤后24 h,冷冻伤中心区的细胞核固缩,细胞坏死明显;在冷冻伤周围区主要表现为神经细胞周围出现水肿,神经细胞和胶质细胞的细胞间隙扩大,而多数细胞核较为正常。HE染色结果提示冷冻伤周围区域大脑皮层出现明显的水肿病变,见图3。

Figure 2. TTC and Evans blue double staining of the rat brain at 24 h after cryoinjury.
图2 冷冻伤后24 h大鼠脑组织的TTC与EB双染
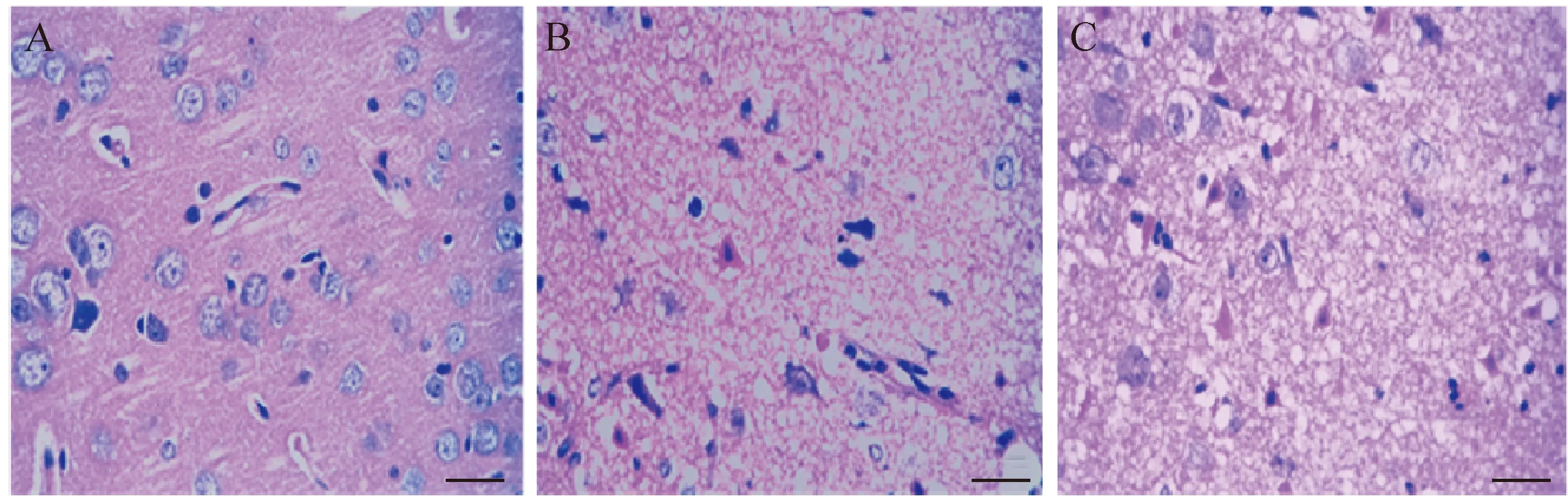
Figure 3. HE staining in the different areas of brain cortex from sham group and cryoinjury group at 24 h after cryoinjury. The scale bar=50 μm. A: the cortex of sham rats; B: the central area of cortex at 24 h after cryoinjury; C: the surrounding area of cortex at 24 h after cryoinjury.
图3 冷冻伤后24 h不同损伤皮层区的HE染色
4 冷冻伤区域Cx43表达量降低
用ImageJ软件分析Cx43和GAPDH的吸光度,用GAPDH为标准,得到各组Cx43蛋白的相对表达量。以sham组的Cx43表达量为标准,与冷冻伤后各时点的Cx43蛋白表达量进行比较,计算得出图4的结果。统计结果显示,损伤后2 h、6 h、12 h、24 h和72 h损伤中心皮层区域的Cx43表达均降低,推测是由于多数细胞坏死导致蛋白表达量降低。

Figure 4. Cx43 expression in sham group and in the central area of injured brain cortex at 2 h, 6 h, 12 h, 24 h and 72 h after cryoinjury. Mean±SD.n=5.*P<0.05,**P<0.01vssham group.
图4 冷冻伤后不同时点损伤中心皮层区域Cx43的表达情况
5 冷冻伤周围区域Cx43表达量增加
图5统计结果表明,与sham组相比,损伤周围皮层区域Cx43的表达量增加。并且随着冷冻伤后时间的延长,即损伤后2 h、6 h、12 h、24 h和72 h,Cx43表达量逐渐增加。
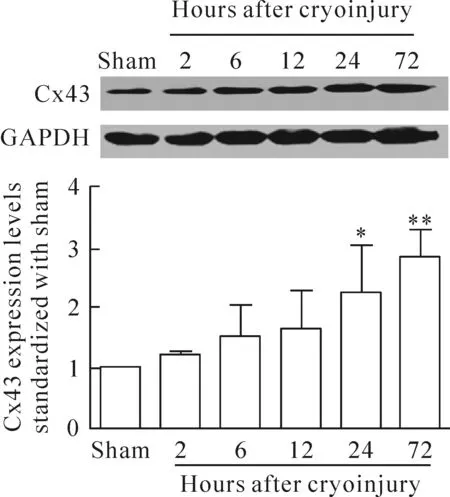
Figure 5. The protein expression of Cx43 in sham group and in the surrounding area of injured brain cortex at 2 h, 6 h, 12 h, 24 h and 72 h after cryoinjury. Mean±SD.n=5.*P<0.05,**P<0.01vssham group.
图5 冷冻伤后不同时点损伤周围皮层区域Cx43的表达情况
6 脑水肿不同时期Cx43的免疫组化染色结果
图6中棕色着色区域显示的是Cx43的阳性表达区域,棕色颗粒越多,说明Cx43表达量越多。与sham组相比,冷冻伤后2 h、6 h、24 h和72 h的脑组织切片中,损伤周围区出现了明显的Cx43阳性表达区域,这与Western blot实验结果相符合,更加充分地证明了脑水肿时Cx43蛋白的表达增加。
7 阻断星形胶质细胞的Cx43降低了脑含水量
从图7可知,腹腔注射50 mg/kg CBX或5 mmol/L octanol后,冷冻伤后脑组织的含水量比注射生理盐水组降低。经过统计学检验,与冷冻伤模型组相比,CBX和octanol阻断剂组能显著降低脑含水量(P<0.01)。虽然CBX和octanol能在一定程度上降低脑水肿后脑含水量,但是与sham组相比,脑含水量值还是高于sham组,不能使其降低到正常水平。
Figure 6.The distribution of immunoreactivity of Cx43 in the cortex. The scale bar=150 μm.Mean±SD.n=4.*P<0.05,**P<0.01vssham group.
图6 冷冻伤周围脑皮层中Cx43表达增加
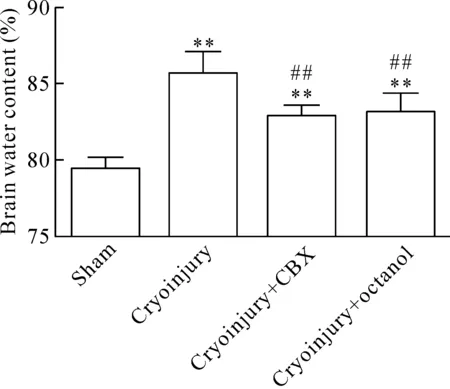
Figure 7.Brain water content at 24 h after cryoinjury. Octanol and carbenoxolone were injected intraperitoneally.Mean±SD.n=4.**P<0.01vssham group;##P<0.01vscryoinjury group.
图7 CBX和octanol阻断缝隙连接蛋白43降低了脑含水量
8 阻断星形胶质细胞的Cx43减少了BBB的开放
从图8中可知,腹腔注射50 mg/kg CBX和5 mmol/L octanol均能够降低损伤区脑组织的BBB通透性。经过统计学检验,与注射生理盐水组相比,CBX阻断剂组能显著降低BBB的通透性(P<0.01),而octanol阻断剂组的效果则不明显。
讨 论
Cx43是形成星形胶质细胞间缝隙连接的主要蛋白质,它允许离子和分子量小于1 kD的小分子物质(cAMP、IP3、H2O等)自由扩散进入相邻的细胞,实现细胞间的物质扩散和信息传递。本实验发现冷冻伤引起脑水肿的过程中Cx43蛋白表达量增加,并采用腹腔注射CBX和octanol来阻断缝隙连接,使Cx43功能降低,进一步使细胞间通过缝隙连接的跨膜转运降低。由于冷冻伤引起血脑屏障通透性增加,这有助于CBX和辛醇通过受损的血脑屏障到达大脑皮层发挥缝隙连接阻断剂的作用。实验结果显示,注射阻断剂CBX和octanol后,脑含水量比生理盐水组降低;并且采用CBX后,BBB通透性也较生理盐水组降低。
Figure 8. BBB permeability at 24 h after cryoinjury. Octanol and carbenoxolone were injected intraperitoneally.Mean±SD.n=5.**P<0.01vssham group;##P<0.01vscryoinjury group.
图8 CBX和octanol阻断缝隙连接蛋白43降低了BBB通透性
以上结果提示星形胶质细胞Cx43参与了冷冻伤后脑水肿的形成过程,并且阻断Cx43的功能可以改善冷冻伤后脑水肿程度,可能机制如下:
①本实验采用颅骨外冷冻伤致使的脑水肿模型是血管源性和细胞毒性混合型脑水肿,即细胞内、外水肿同步发展而形成。目前认为血脑屏障的功能与结构损坏是血管源性脑水肿的病理基础,而星形胶质细胞终足上的Cx43参与血脑屏障的形成。Hayashi等[14]将星形胶质细胞与脑内皮细胞在体外共同培养,诱导出血脑屏障的特性。Simard等[15]在实验中证实了Cx43在星形胶质细胞的终足上广泛存在。Ezan等[16]在出生后2 d 的小鼠脑组织血管周围的终足上检测到有星形胶质细胞Cx43的表达,且在出生后15 d血管系统完全成熟。并且在GFAP阳性细胞的Cx43基因敲除小鼠上,发现星形胶质细胞的终足出现水肿,部分水通道蛋白4缺失,胶质细胞终足上用于锚定在血管周围基膜的跨膜受体表达减少。这些结果表明Cx43对于维持血脑屏障的完整性具有重要的作用,且Cx43缺失会引起细胞水肿。此外,韩东等[17]的研究也表明octanol可以降低脑缺血再灌注后血脑屏障的通透性增加程度。本实验采用CBX治疗冷冻伤脑水肿的同时,由于CBX阻断了细胞间缝隙连接,改善了由于损伤引起的BBB通透性的改变。其中可能的机制一是阻断缝隙连接后抑制了星形胶质细胞与内皮细胞之间的双向钙信号传递。星形胶质细胞的钙波可以传递给内皮细胞并对细胞内的钙离子变化产生影响。而内皮细胞钙离子的变化被认为是内皮细胞间紧密连接破坏和血脑屏障开放的关键原因[18-20]。第二,抑制缝隙连接可以阻止血管内皮细胞间的有害物质及信号的传递过程,最终导致BBB通透性的改变。
②星形胶质细胞间由Cx43组成的缝隙连接参与水分和代谢应激信号的传递。缝隙连接允许分子量小于1 kD或直径小于1.5 nm的分子通过,是细胞间物质和信息跨膜传递的重要通道[21]。颅脑创伤后释放兴奋性氨基酸,如谷氨酸→激活NMDA受体→神经细胞对K+、Ca2+和Na+的通透性增加,胞内离子浓度增加→胞内渗透压增加→出现细胞毒性脑水肿。在体外培养星形胶质细胞中发现,与野生型大鼠细胞相比,Cx43基因敲除大鼠释放谷氨酸减少,这提示谷氨酸可能通过Cx43构成的缝隙连接扩散至相邻细胞或细胞外基质[22]。另有研究表明当细胞外K+浓度升高时,引起Cx43表达增加,细胞间隙连接的偶联程度增强[23],而神经元兴奋释放到胞外的K+主要通过胶质细胞膜上的内向整流钾离子通道被稀释,进一步介导了脑内的水转运过程[24]。在本实验中,冷冻伤引起水肿,导致水分和谷氨酸等参与脑水肿形成的代谢物质在胞浆中积聚。这些有害代谢物质通过损伤后增加的Cx43及其构成的缝隙连接进入到相邻的未受损伤的细胞中,进一步扩大了脑水肿的范围并加重水肿的程度。本实验通过加入CBX和octanol阻断缝隙连接,在一定程度了阻止了这些有毒物质在细胞间的传递,阻止了脑水肿向周围组织扩散,从而改善了脑水肿程度。
综上所述,脑水肿引起Cx43表达上调,可能通过改变血脑屏障通透性或通过形成更多的缝隙连接或者半通道,促使水肿细胞的水分和其它有害物质扩散到周围的细胞或者外环境中,导致水肿范围扩大,加重脑水肿。
[1] Donkin JJ, Vink R. Mechanisms of cerebral edema in traumatic brain injury: therapeutic developments[J]. Curr Opin Neurol, 2010, 23(3):293-299.
[2] Marmarou A. Pathophysiology of traumatic brain edema: current concepts[J]. Acta Neurochir Suppl, 2003, 86:7-10.
[3] 张新宇, 孙晓川. 星形胶质细胞与脑水肿[J]. 创伤外科杂志, 2008, 10(1):85-87.
[4] Schulz R, Gorge PM, Gorbe A, et al. Connexin 43 is an emerging therapeutic target in ischemia/reperfusion injury, cardioprotection and neuroprotection [J]. Pharmacol Ther, 2015, 153:90-106.
[5] Li WE, Nagy JI. Connexin43 phosphorylation state and intercellular communication in cultured astrocytes following hypoxia and protein phosphatase inhibition[J]. Eur J Neurosci, 2000, 12(7):2644-2650.
[6] Haupt C, Witte OW, Frahm C. Temporal profile of connexin 43 expression after photothrombotic lesion in rat brain[J]. Neuroscience, 2007, 144(2):562-570.
[7] Ohsumi A, Nawashiro H, Otani N, et al. Alteration of gap junction proteins (connexins) following lateral fluid percussion injury in rats[J]. Acta Neurochir Suppl, 2006, 96:148-150.
[8] Nagy JI, Li W, Hertzberg EL, et al. Elevated connexin43 immunoreactivity at sites of amyloid plaques in Alzheimer’s disease[J]. Brain Res, 1996, 717(1-2):173-178.
[9] Ye B, Shen H, Zhang J, et al. Dual pathyways mediate β-amyloid stimulated glutathione release from astrocytes[J]. Glia, 2015, 63(12):2208-2219.
[10]Orellana JA, Shoji KF, Abudara V, et al. Amyloid β-induced death in neurons involves glial and neuronal hemichannels[J]. J Neurosci, 2011, 31(13):4962-4977.
[11]Sin WC, Aftab Q, Bechberger JF, et al. Astrocytes promote glioma invasion via the gap junction protein connexin43[J]. Oncogene, 2016, 35(12):1504-1516.
[12]Moinfar Z, Dambach H, Schoenebeck B, et al. Estradiol receptors regulate differential conexin 43 expression in F98 and C6 Glioma cell lines[J]. PLoS One, 2016, 11(2):e0150007.
[13]Kawai N, Kawanishi M, Okada M, et al. Treatment of cold injury-induced brain edema with a nonspecific matrix metalloproteinase inhibitor MMI270 in rats[J]. J Neurotrauma, 2003, 20(7):649-657.
[14]Hayashi Y, Nomura M, Yamagishi S, et al. Induction of various blood-brain barrier properties in non-neural endothelial cells by close apposition to co-cultured astrocytes[J]. Glia, 1997, 19(1):13-26.
[15]Simard M, Arcuino G, Takano T, et al. Signaling at the gliovascular interface[J]. J Neurosci, 2003, 23(27):9254-9262.
[16]Ezan P, André P, Cisternino S, et al. Deletion of astro-glial connexins weakens the blood-brain barrier[J]. J Cereb Blood Flow Metab, 2012, 32(8):1457-1467.
[17]韩 冬, 冯加纯, 邓 方, 等. 缝隙连接对大鼠脑缺血再灌注后血脑屏障通透性的影响[J]. 中华神经科杂志, 2007, 40(7):447-451.
[18]Revest PA, Abbott NJ, Gillespie JI. Receptor-mediated changes in intracellular [Ca2+] in cultured rat brain ca-pillary endothelial cells[J]. Brain Res, 1991, 549(1):159-161.
[19]Tiruppathi C, Minshall RD, Paria BC, et al. Role of Ca2+signaling in the regulation of endothelial permeability[J]. Vascul Pharmacol, 2002, 39(4-5):173-185.
[20]Ahmmed GU, Malik AB. Functional role of TRPC channels in the regulation of endothelial permeability[J]. Pflugers Arch, 2005, 451(1):131-142.
[21]Naff NJ, Carhuapoma JR, Williams MA, et al. Treatment of intraventricular hemorrhage with urokinase: effects on 30-day survival[J]. Stroke, 2000, 31(4):841-847.
[22]Ahmad Waza A, Andrabi K, UI Hussain M. Adenosine-triphosphate-sensitive K+channel (Kir6.1): a novel phosphospecific interaction partner of connexin 43 (Cx43) [J].Exp Cell Res, 2012, 318(20):2559-2566.
[23]Spray DC, Ye ZC, Ransom BR. Functional connexin“hemichannels”: a critical appraisal[J]. Glia, 2006, 54(2):758-773.
[24]雷公文, 代大伟. 脑内水转运的研究进展[J]. 医学综述, 2016, 22(1):30-33.
(责任编辑: 陈妙玲, 罗 森)
Astrocytic connexin 43 is involved in development of cryoinjury-induced cerebral edema
ZHANG Ke-na1, DING Yue-min2, DU Yue-guang1, GONG Wan1, ZHANG Xiong3
(1DepartmentofBasicMedicine,ZhejiangChineseMedicalUniversity,Hangzhou310053,China;2SchoolofMedicine,ZhejiangUniversityCityCollege,Hangzhou310015,China;3DepartmentofBasicMedicine,CollegeofMedicine,ZhejiangUniversity,Hangzhou310058,China.E-mail:xiongzhang@zju.edu.cn)
AIM: To discuss the change of astrocytic connexin 43 (Cx43) expression in cerebral edema and the potential roles of Cx43 in the development of cerebral edema. METHODS: Cryoinjury-induced cerebral edema model was established in the right parietal lobe cortex in the rats. The animals were divided into sham group, cryoinjury-induced cerebral edema model group, and cryoinjury-induced cerebral edema model injected with carbenoxolone (or octanol) group. Dry and wet weight method was used to measure the content of brain water. Methanamide method was used to evaluate the permeability of blood-brain barrier (BBB) after cryoinjury. HE staining showed the physiological changes in injured brain cortex. The protein expression of Cx43 was detected by Western blot and immunohistochemical staining. RESULTS: The brain water content in the injured cortex of rats was increased and cerebral edema developed to the peak at 24 h after cryoinjury. The permeability of BBB was increased in the injured cortex of the rats, and the area where BBB was damaged was larger than injured area. HE staining showed that many cells were dead in the central area of cryoinjury, and at the same time cerebral edema was appeared obviously in the surrounding area of injured brain cortex. The protein expression of Cx43 was up-regulated in the surrounding area of injured brain cortex, while Cx43 expression decreased in the injured cortex at different periods after cryoinjury. Both the content of brain water in the injured cortex and the permeability of BBB at 24 h after cryoinjury were reduced after injecting carbenoxolone or octanol intraperitoneally to block Cx43. CONCLUSION: The cerebral edema up-regulates the expression of Cx43 and also strengthens its function. Once Cx43 is blocked, the degree of cerebral edema in rats is attenuated.
Connexin 43; Astrocytes; Cerebral edema; Gap junction; Cryoinjury
1000- 4718(2016)11- 1996- 07
2016- 05- 30
2016- 09- 01
浙江省教育厅科研项目(No. Y201120080);浙江中医药大学校级科研基金(No. 2014ZY02)
R338.2; R363.1+2
A
10.3969/j.issn.1000- 4718.2016.11.013
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0571-88208292; E-mail: xiongzhang@zju.edu.cn

