Aurora-A表达与胰腺癌吉西他滨耐药关系的实验研究
何永礼 施福田 严秋亮 朱锦辉
Aurora-A表达与胰腺癌吉西他滨耐药关系的实验研究
何永礼 施福田 严秋亮 朱锦辉
目的 探讨Aurora-A的表达与胰腺癌吉西他滨耐药之间的关系。方法 40只裸鼠采用随机数字表法分为两组,分别采用人胰腺癌细胞株PANC-1和吉西他滨耐药株PANC-1/R2皮下移植再原位移植的方法构建动物模型(PANC-1组、PANC-1/R2组)。采用实时定量基因扩增(qPCR)法测定PANC-1和PANC-1/R2中Aurora-AmRNA的表达。建模后第5周处死裸鼠,测定并比较两组裸鼠体重、肿瘤转移情况、肿瘤质量;采用免疫组化方法测定并比较两组瘤体Aurora-A蛋白的表达。结果PANC-1组、PANC-1/R2组第5周裸鼠体重、肿瘤重量及肿瘤转移率分别为(23.2±1.41)g、(0.453±0.110)g、36.8%及(22.91± 1.13)g、(0.564±0.203)g、50.0%,两组比较差异均有统计学意义(均P<0.05),两组Aurora-A mRNA表达分别为1.002±0.040及1.845±0.069,差异有统计学意义(P<0.05);两组Aurora-A蛋白阳性表达率分别为83.3%及57.9%,差异有统计学意义(P<0.05)。结论 Aurora-A高表达与胰腺癌细胞株的吉西他滨耐药有关,新方法构建的PANC-1/R2耐药株Aurora-A高表达,可用于胰腺癌吉西他滨耐药研究的载体。
Aurora-A 胰腺癌 多药耐药 吉西他滨
【 Abstract】 Objective To assess the relationship of Aurora-A expression with gemcitabine-resistance in pancreatic cancer cells. Methods Pancreatic cancer model was established by inoculation in nude mice with human pancreatic cancer PANC-1 cells and drug resistant pancreatic cancer PANC-1/R2 cells,respectively(n=20 in each group).The expression of Aurora-A mRNA in PANC-1 and PANC-1/R2 cells were tested by qPCR technique.Animals were sacrificed after 35d and the tumor tissue samples were collected.The expression of Aurora-A protein in tumor tissues of two groups was detected by immunohistochemistry. Results In PANC-1 and PANC-1/R2 groups,the metastatic rate in 5 ws was 36.8%(7/19)and 50.0% (9/18)(χ2=4.21,P<0.05),the mean weight of tumor was 0.453±0.110g and 0.564±0.203g(t=9.35,P<0.05),the weight of mice was 23.2±1.41 g and 22.91±1.13g(t=20.36, P<0.05).The expression of Aurora-A mRNA in PANC-1 cells and in PANC-1/R2 cells was 1.002± 0.040 and 1.845± 0.069,respectively(t=35.02,P<0.05).Positive expression of Aurora-A protein was detected in 15 out 18 mice of PANC-1/R2 group,while it was in 11 out 19 mice of PANC-1 group(χ2=5.023,P<0.05). Conclusion High expression of Aurora-A gene is associated with gemcitabine-resistance in pancreatic cancer cells.
胰腺癌是常见的病死率很高的恶性肿瘤,化疗效果不理想。作为治疗胰腺癌的首选药物吉西他滨,其化疗有效率也仅为25%[1],多药耐药是导致化疗效果欠佳的重要原因。Aurora-A蛋白作为DNA修复功能的蛋白,具有参与修复DNA的作用。目前发现,在食管癌、前列腺癌、乳腺癌、胃癌、肺癌等的化疗中,抑制Aurora-A的表达能增强肿瘤的化疗敏感度[2-4]。本文采用人胰腺癌细胞株PANC-1和吉西他滨耐药株PANC-1/R2细胞株皮下移植再原位移植的方法构建动物模型,以此研究Aurora-A差异表达与吉西他滨的耐药关系,现将结果报道如下。
1 材料和方法
1.1 材料 (1)实验动物:40只雄性BALB/c裸小鼠由浙江中医药大学动物实验中心提供,鼠龄42~56(47± 12)d;质量18~20(19.2±0.7)g;饲养于恒温(25~27℃)、恒湿(45%~50%),且符合无特定病原体条件的裸鼠室内;饮用水及标准食疗均经灭菌后供动物自由食用。(2)细胞株:PANC-1由浙江大学医学院附属第二医院外科研究所提供。PANC-1/R2为体外培养体内诱导循环筛选的新方法获得的PANC-1的吉西他滨耐药株。(3)主要仪器和试剂:实时定量基因扩增(qPCR)仪购自Biorad公司,IS1000凝胶成像系统购自美国法莫西亚公司,Beckman Coul ter Avanti J-20低温离心机购自德国Heraeus公司,鼠抗人Aurora-A单克隆抗体购自美国Santa Crus Biotechnology公司,Taq DNA聚合酶购自日本Takara公司,RNA酶抑制剂购自美国Promega公司,ABC免疫组化检测试剂盒购自华美生物工程公司。
1.2 方法
1.2.1 分组方法 将40只裸小鼠采用随机数字表法分成两组,每组20只,分别用PANC-1和PANC-1/R2两种细胞株皮下移植再原位移植的方法建模(即PANC-1组及PANC-1/R2组)。两组裸鼠每天检查、每周称重,于建模后第5周称重后处死。实验过程中,PANC-1组术后1周因腹腔感染死亡1只,故PANC-1组19只进入后续实验,PANC-1/R2组术后10d及2周时因腹腔感染各死亡1只,故18只进入后续实验。收集两组裸鼠肿瘤病灶及淋巴结和内脏等标本组织。胰腺肿瘤组织在拭干表面水分后立即在电子称上称重并记录。标记取下后的标本,用预冷的0.9%氯化钠溶液冲洗,并取肿瘤组织1块(用于免疫组化染色)立即置入液氮罐中,后转入-80℃冰箱保存。其余肿瘤组织石蜡包埋切片进行HE染色。所有肿瘤组织均作病理切片证实。记录两组裸鼠重量、肿瘤组织重量,以及胰腺外淋巴、远处转移发生率,并进行组间比较。
1.2.2 Aurora-A mRNA测定 PANC-1和PANC-1/R2两种细胞株作体外培养,细胞裂解提取RNA,以提取的RNA进行扩增。其引物序列及目的片段的长度Aurora-A-R为CGGTTCAGAATCAGAAGCAGAAGC(5′-3′);Aurora-A-F为CCAGAGGGCGACCAATTTCAAAG(5′-3′)。qPCR程序:将提取的RNA反转录制备cDNA,设定程序为两步法real-time PCR,预变性95℃,1min;之后每一步变性95℃,5s;退火延伸60℃,20s;共进行40个循环。PCR产物经2%琼脂糖凝胶电泳,选择明亮条带的产物进行正反向测序,电压设定120V,电流60mA,然后在自动凝胶成像系统上成像观察扩增结果。记录两组qPCR测定的mRNA的结果,并进行组间比较。
1.2.3 Aurora-A蛋白表达测定 采用二步法免疫组化测定Aurora-A蛋白表达。免疫组化染色程序按试剂盒说明书进行,PBS代替一抗作阴性对照。Aurora-A蛋白阳性表达定位于细胞质,呈棕黄色颗粒。在光学显微镜下观察全片,对切片染色阳性情况进行评估,结果判定参照文献[3]进行。显微镜下取不同放大倍数,选取5个高倍视野,拍照、保存结果。根据阳性细胞数量、百分率及表达强度分为4级:0级为无明显阳性反应细胞,Ⅰ级为阳性细胞<25%、弱染色,Ⅱ级为阳性细胞25%~75%;Ⅲ级为阳性细胞>75%、强染色。0~Ⅰ级判为阴性表达;Ⅱ~Ⅲ级判为阳性表达。分别记录两组免疫组化Aurora-A蛋白表达的阳性率,并进行比较。
1.3 统计学处理 应用SPSS 14.0统计软件,计量资料以表示,组间比较采用t检验。计数资料以百分率表示,组间比较采用χ2检验。
2 结果
2.1 两组裸鼠第5周体重、肿瘤质量及胰腺外淋巴、远处转移发生率比较 见表1。

表1 两组第5周裸鼠体重、肿瘤质量及胰腺外淋巴、远处转移发生率比较
2.2 两种细胞株Aurora-A mRNA表达水平的比较PANC-1、PANC-1/R2细胞株Aurora-A mRNA的表达水平分别为1.002±0.040及1.845±0.069,两者比较,差异有统计学意义(t=35.02,P<0.05)。其电泳图见图1。
2.3 两组裸鼠标本中Aurora-A蛋白表达情况 PANC-1、PANC-1/R2标本中Aurora-A蛋白表达阳性率分别为57.9%(11/19)、83.3%(15/18),两组比较差异有统计学意义(χ2=5.023,P<0.05)。光学显微镜下可见Aurora-A蛋白阳性表达呈棕黄色颗粒,主要分布在肿瘤细胞和血管内皮细胞的细胞质中(图2)。
3 讨论
Aurora-A是新近发现的调节中心体、微管功能的丝氨酸/苏氨酸蛋白激酶,在中心体成熟、纺锤体形成、染色体分离,即有丝分裂的正常进行中发挥至关重要的作用。目前,Aurora-A已被认为是一个与多种恶性肿瘤发生相关的癌基因。当前众多研究发现,Aurora-A在乳腺癌、胰腺癌、食管癌、胃癌、肺癌、膀胱癌等多种恶性肿瘤中高表达[5-6],其表达水平与肿瘤的组织学分级、临床分期和患者预后具有相关性[7]。抑制Aurora-A活性,可有效地阻碍细胞的生长、增殖,并引起肿瘤细胞的凋亡[8]。当肿瘤细胞面对化疗药物的作用下出现DNA的损伤时,Aurora-A恰能对损伤的DNA进行修复,从而出现耐药。很多研究表明,Aurora-A的高表达是产生肿瘤耐药的重要因素[9-10]。既往的研究着重于Aurora-A的表达与肿瘤及预后的关系,如Sakakura等[11]报道存在Aurora-A基因扩增的原发性胃癌患者比未发现Aurora-A基因扩增的患者预后更差。Warner等[12]比较了Aurora-A和Aurora-B作为胰腺癌抗癌治疗的分子靶点,发现以Aurora-A为靶点治疗可能在有丝分裂停滞和快速诱导程序性死亡方面,优于针对Aurora-B为靶点的治疗,但鲜有Aurora-A蛋白表达与胰腺癌吉西他滨耐药关系的研究,因此本研究通过构建耐药细胞株及耐药动物模型,并通过该研究平台探讨Aurora-A蛋白表达与胰腺癌吉西他滨耐药的关系。

图1 两种细胞株Aurora-A电泳图[a:标记物(Marker)电泳图,b:分组及对应的目标条带]
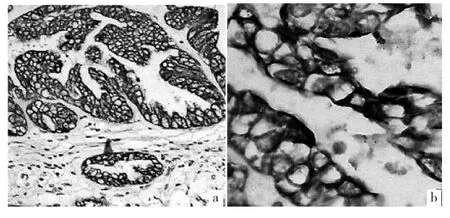
图2 Aurora-A蛋白表达免疫组化检测所见(a:苏木精染色,× 100;b:苏木精染色,×400)
PANC-1/R2细胞株是通过体外培养体内诱导方式,循环2轮后获得的耐药细胞株。用PANC-1、PANC-1/R2细胞株构建胰腺癌模型,发现PANC-1/R2恶性程度更高,表现为该组的瘤体质量更重,裸鼠体重相对较轻且胰腺癌的转移率明显较高,提示耐药的胰腺癌细胞的生物学恶性程度也相应提高。
通过qPCR技术检测两组Aurora-A mRNA的表达,两组结果比较差异有统计学意义。免疫组化测定蛋白水平的表达,两组表达情况比较,差异有统计学意义。可见蛋白水平和基因水平均证实Aurora-A的表达与胰腺癌吉西他滨的耐药有关,具体为耐药细胞Aurora-A高表达,敏感细胞Aurora-A低表达,证实Aurora-A的表达与胰腺癌吉西他滨耐药有关,这与文献报道的情况相符合。
Aurora-A如何参与肿瘤的发生和耐药产生,目前有很多观点。大体上认为Aurora-A过表达能够在Cdc20-BubR1相互作用的水平上,通过干扰有丝分裂检测点复合物的恰当组装导致基因不稳定和肿瘤生长[1]。目前多药耐药的机制尚不明确,宏观上讲与肿瘤细胞的自我吞噬增强自身抵抗力以及减少凋亡有关。Aurora-A参与自噬调节的研究不多,但已报道的研究结果表明Aurora-A可以通过自噬的途径诱导肿瘤的耐药。Zou等[13]研究发现Aurora-A阳性表达的乳腺肿瘤组织中自噬相关蛋白SQSTM1呈现高表达,该研究通过小分子VX-680或sRNA干扰抑制Aurora-A的表达,发现微管相关蛋白1轻链3-Ⅱ(LC3-Ⅱ)和自噬体明显增加,而SQSTM1明显降低;而过度表达Aurora-A则抑制自噬。Aurora-A通过负向调节自噬的途径发挥诱导乳腺细胞自噬性的凋亡。该研究结果提示Aurora-A的高表达抑制自噬,低表达诱导自噬产生对药物的耐药,这与本研究结果不符合,推测自噬在耐药产生中并非主导作用。Hamidi等[14]研究表明Nupr1通过调节Aurora-A对抗因缺氧及糖饥饿引起的自噬性的细胞程序性死亡,提示非DNA损伤性的抗癌药物耐药可能与Aurora-A有关。p53、PP1、Cy clin B1-cdc2、BRCA1、RasGA P、Survivin、c-myc与Aurora-A的相互作用是导致胰腺癌发生耐药的可能原因。可见,Aurora-A参与肿瘤形成及多药耐药的机制研究很多,机制复杂,但目前与自噬相关的较少,而其作用逐步得到认识,具有广阔的研究前景。
综上所述,Aurora-A被认为与肿瘤预后密切相关,本研究结果显示PANC-1组免疫组化Aurora-A的阳性表达与转移率有关,PANC-1/R2组Aurora-A的阳性表达与转移率无关。但两组间Aurora-A蛋白表达差异有统计学意义。提示对于敏感的肿瘤(如PANC-1细胞株),Aurora-A蛋白表达与胰腺癌的转移率有关,但随着Aurora-A的高表达产生对吉西他滨的耐药(如PANC-1/R2细胞株),其表达与转移率无关。Aurora-A在PANC-1/R2组高表达,同样转移率高于PANC-1组,这些提示Aurora-A的表达与胰腺癌吉西他滨耐药及肿瘤转移率有关,均提示高表达Aurora-A的胰腺癌预后差。
[1] Huynh A S,Abrahams D F,Torres M S,et al.Development of an orthotopic human pancreatic cancer xenograft modelusing ultrasound guided injection ofcells[J].PLoS One,2011,6(5):e20330.
[2] Menke C,Goncharov T,Qamar L,et al.TRAIL Receptor Signaling Regulation of Chemosensitivity In Vivo but Not In Vitro[J].PLoS One,2011,6(1):e14527.
[3] El-Sheikh A,Fan R,Birks D,et al.Inhibition of Aurora Kinase A Enhances Chemosensitivity of Medulloblastoma CellLines[J].Pediatr Blood Cancer,2010,55:35-41.
[4] Kumano M,Miyake H,Terakawa T,et al.Suppressed tumour growth and enhanced chemosensitivity by RNA interference targeting Aurora-A in the PC3 human prostate cancer model[J].BJU Int,2010,106(1):121-127.
[5] Wang XX,Liu R,Jin S Q,et al.Overex pres sion ofAurora-Akinase promotes tumor cell proliferati on and inhibits apoptos is in esophagealsquamous cellcarcinoma cellline[J].CellRes,2006,16 (4):356-366.
[6] Tanaka E,Hashimoto Y,Ito T,et al.The clinical significance of Aurora-A/STK15/BTAK expression in human esophageal squamous cellcarcinoma[J].Clin Cancer Res,2005,11(5):1827-1834.
[7] Reznikoff C A,Belair C D,Yeager T R,et al.A molecular g enetic model of human bladder cancer pathogenesis[J].Semin Oncol, 1996,23(5):571-584.
[8] Borges K S,Castro-Gamero A M,Moreno D A,et al.Inhibition of Aurorakinases enhances chemosensitivity to temozolomide and causes radiosensitization in glioblastoma Cells[J].J Cancer Res Clin Oncol,2012,138(3):405-414.
[9] Tanaka E,Hashimoto Y,Ito T,et al.The Suppression of Aurora-A/STK15/BTAKExpression Enhances Chemosensitivity to Docetaxel in Human Esophageal Squamous Cell Carcinoma[J].Clin Cancer Res,2007,13(4):1331-1340.
[10] El-Sheikh A,Fan R,Birks D,et al.Inhibition of Aurora Kinase A Enhances Chemosensitivity of Medulloblastoma Cell Lines[J]. Pediatr Blood Cancer,2010,55(1):35-41.
[11] Sakaku ra C,H agiw ara A,Yas uoka R,et al.Tumour-amplif iedbkinas eBTAK is amplified and overex pres sed in gast ric cancers with possible involvem ent in aneu ploid formation[J].Br J Cancer,2001,84(6):824-831.
[12] Warner S L,Mun oz R M,Stafford P,et al.Comparing Aurora-A and Aurora-B as molecul ar t arget s f or growth in hibit ion of pancreaticcancercells[J].MolCancerTher,2006,5(10):2450-2458.
[13] Zou Z,Yuan Z,Zhang Q,et al.Aurora kinase Ainhibition-induced autophagy triggers drug resistance in breast cancer cells[J]. Autophagy,2012,8(12):1798-1810.
[14] Hamidi T,Cano C E,Grasso D,et al.Nupr1-aurora kinase A pathway provides protection against metabolic stress-mediated autophagic-associated celldeath[J].ClinCancerRes,2012,18(19): 5234-5246.
(本文编辑:杨丽)
《浙江医学》对作者署名的一般要求
同时具备以下3项条件者方可署名为作者:(1)参与选题和设计或资料的分析与解释者;(2)起草或修改论文中关键性理论或其他主要内容者;(3)能对编辑部的修改意见进行核修,在学术界进行答辩,并最终同意该文发表者。仅参与研究项目资金的获得或收集资料者不能列为作者,仅对科研小组进行一般管理者也不宜列为作者。对文章中的各主要结论,均必须至少有1位作者负责。作者中如有外籍作者,应征得其同意,并在投稿时向编辑部提供相应证明材料。集体署名的文稿,在题名下列出署名单位,于文末列出整理者姓名,并须明确该文的主要负责人,在论文首页脚注通信作者姓名、单位、邮政编码及E-mail地址。通信作者一般只列1位,由投稿者确定。如需注明协作组成员,则于文末参考文献前列出协作组成员的单位及姓名。作者的具体排序应在投稿前即确定,在编排过程中不应再改动,确需改动时必须出示单位证明。
本刊编辑部
Association between expression of Aurora-A and gemcitabine-resistance in pancreatic cancer cells
HE Yongli,SHI Futian,YAN Qiuliang,et al.Department of General Surgery,the Second Affiliated Hospital Zhejiang University School of Medicine,Hangzhou 310009,China
Aurora-Akinase Pancreatic carcinoma Multiple drug resistance Gemcitabine
2014-07-09)
浙江省医药卫生科技计划(2012KYB018),浙江省中医药优秀青年人才基金(2013ZQ021)
310009 杭州,浙江大学医学院附属第二医院外科(何永礼、朱锦辉,何永礼系在职研究生,现在金华文荣医院普外科工作);金华文荣医院普外科(施福田),金华市人民医院普外科(严秋亮)
朱锦辉,E-mail:steversson@126.com

