右美托咪定预处理对单肺通气后肺损伤的保护作用
,,,*,
(1.南华大学附属第二医院麻醉科,湖南 衡阳,4210012;南华大学附属第二医院重症医学科)
·临床医学·
右美托咪定预处理对单肺通气后肺损伤的保护作用
陈莹1,王德明1,吴昆鹏2,黄治家2*,言彩红2
(1.南华大学附属第二医院麻醉科,湖南 衡阳,4210012;南华大学附属第二医院重症医学科)
目的探讨右美托咪定预先给药对单肺通气后肺损伤的保护作用。方法选择择期行全麻单肺通气的食管癌病人56例,随机分为右美托咪定组和对照组各28例,分别于麻醉诱导后单肺通气前(T1)、单肺通气6Omin(T2)、120min(T3)、单肺通气结束前(T4)、出室前(T5)及术后24h(T6)时间点记录患者平均动脉压、心率、氧合指数、气道峰压和脑电双频指数值,并测定血清超氧化物歧化酶(SOD)、白介素(IL)-6、丙二醛(MDA)浓度。
结果两组术中监测氧合指数在T2~T4时间点,右美托咪定组低于对照组(P<0.05);除T1时间点外,T2~T6时间点血清IL-6、MDA浓度,右美托咪定组明显低于对照组(P<0.05),而SOD右美托咪定组明显高于对照组(P<0.05);其余指标两组无差异。结论右美托咪定可显著减低单肺通气期间的炎症因子表达,改善术中的氧合指数,对单肺通气肺损伤有保护作用。
右美托咪定; 单肺通气; 肺损伤
单肺通气(one-lung ventilation,OLV)常用于胸外科手术,可为术者创造良好的操作条件,还可避免术侧分泌物流入健侧肺,减少肺部并发症。但单肺通气亦可导致肺内分流、通气/血流比例失调而诱发炎症细胞因子释放,降低动脉氧合、低氧性肺血管收缩、结束单肺通气后手术侧肺复张对肺组织造成损伤[1-2]。研究表明,高选择性肾上腺素α2受体激动药右美托咪定(Dexmedetomidine,Dex)可抑制单肺通气炎症反应,减轻单肺通气肺损伤[3-4],可以降低全身炎症反应从而延长生存时间[5-7]。研究发现,右美托咪定具有潜在的多种器官保护效应(包括心、脑、肾与小肠等)[8-11]。本研究拟探讨右美托咪定预处理对开胸手术单肺通气术后肺损伤的影响,为肺通气围术期肺保护的防治提供临床证据。
1 资料与方法
1.1病例资料选择2012年1月~2014年12月在南华大学附属第二医院行择期手术的ASAI、Ⅱ食管中段癌患者56例,男31例,女25例。随机分为两组:右美托咪定组(Dex组)和对照组(NS组)各28例。平均年龄(43±8.5)岁、体重(61±2)kg、身高(161±2.2)cm,术中均以右肺通气。入选标准:1)术前肺功能测试结果正常;2)无基础疾病,临床各项生化检查无明显异常;3)术前无其他药物治疗。排除标准:1)术中出现大出血(出血量>500 mL)者;2)围术期出现呕吐误吸者;3)术中无低氧血症及血流动力学异常。研究经院伦理委员会批准,所有患者或其家属均签署了知情同意书。
1.2方法患者均无术前麻醉用药,入手术室后测平均动脉压(MAP)、心率(HR)、动脉血氧饱和度(SPO2)和脑电双频指数(BIS),建立上肢静脉通路,左侧桡动脉穿刺行持续有创动脉血压监测后取动脉MAP。Dex组于麻醉诱导前10min,用微量泵给予右美托咪定负荷量1.000μg·kg-1,静脉泵注10min,随后以0.600μg·kg-1·h-1的速度持续泵入直至手术结束,NS组用等量生理盐水代替右美托咪定。诱导麻醉两组均采用静脉注射咪达唑仑0.050 mg/kg、盐酸戊乙奎醚0.010mg/kg,芬太尼0.005mg/kg、异丙酚1.500mg/kg、顺阿曲库铵0.150mg/kg行快速诱导插入35~39号双腔支气管导管(驼人集团),所有患者喉镜暴露分级为Ⅰ~Ⅱ级,听诊法确定导管定位良好,且隔离效果满意后,接Smart Vent 7900型麻醉机(Datex Ohmeda公司,美国)行机械通气。单肺通气期间设潮气量为5mL/kg,通气频率14~16次/分钟,吸呼比(I:E)1:2,氧流量1.5L/min,维持呼气末CO2(PetCO2)分压35~45mmHg。麻醉以吸入1.0%~2.0%七氟醚和靶控输注瑞芬太尼(血浆靶浓度3~4ng/mL)维持,间断静脉注射顺阿曲库铵维持肌松,术中BIS值维持45~60,平均动脉压(MAP)、心率(HR)波动幅度不超过基础值的20%。监测血气分析、气道压峰值(Peak)、氧合指数(Oxygenation inDex,OI)。期间两组患者均为持续单肺通气联合4cmH02呼吸末正压(PEEP)至关胸,关胸清理气道后均恢复双肺通气,术毕适度膨肺,送复苏室待患者清醒且通气指标满意后拔出双腔气管导管。
1.3试剂盐酸右美托咪定(江苏恒瑞医药股份有限公司,规格2 mL∶200 μg);血清超氧化物歧化酶(SOD)EL1SA试剂盒(美国Sigma公司),白介素-6(IL-6)、脂质氧化产物丙二醛(MDA)ELISA试剂盒(美国CST公司) 。
1.4观察指标两组均在麻醉诱导后OLV前(T1)、OLV6Omin(T2)、120 min(T3)、OLV结束前(T4)、出室前(T5)及术后24 h (T6)时间点记录患者MAP、HR、PO2,取颈内静脉血5 mL,测定血清SOD、IL-6、MDA浓度。同时在T1、T2、T3、T4、T5及T6时间点记录患者OI、Peak和BIS值,取桡动脉血2 mL监测血气分析。
2 结 果
2.1两组患者一般情况ASA分级构成、病种构成、OLV时间、液体入量及手术时间差异均无统计学意义(P>0.05),见表1。
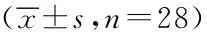
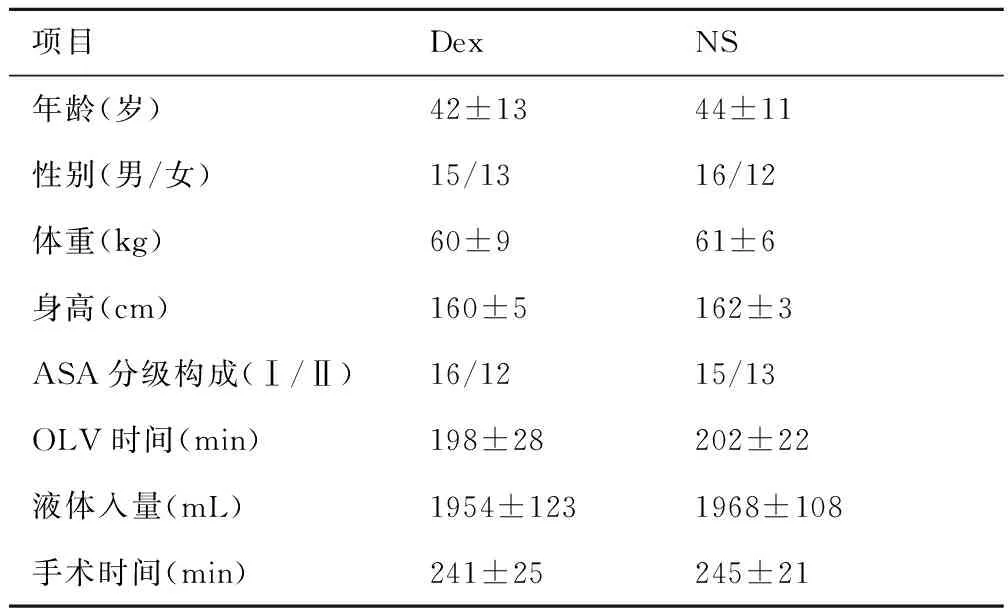
项目DexNS年龄(岁)42±1344±11性别(男/女)15/1316/12体重(kg)60±961±6身高(cm)160±5162±3ASA分级构成(Ⅰ/Ⅱ)16/1215/13OLV时间(min)198±28202±22液体入量(mL)1954±1231968±108手术时间(min)241±25245±21
2.2两组患者各时间点氧合情况比较两组OI于T2开始下降,T4时降至最低,NS组在T2~T6时低于Dex组(P
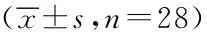
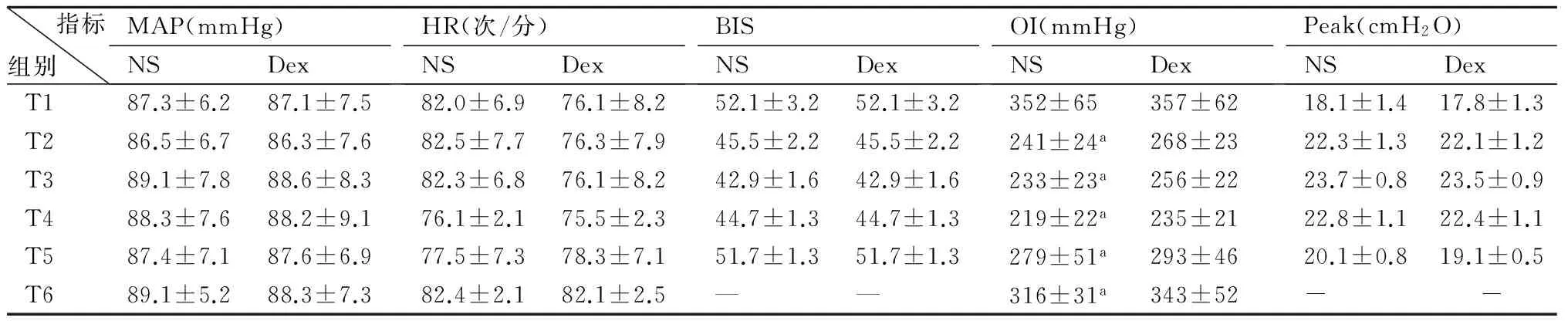
指标组别MAP(mmHg)NSDexHR(次/分)NSDexBISNSDexOI(mmHg)NSDexPeak(cmH2O)NSDexT187.3±6.287.1±7.582.0±6.976.1±8.252.1±3.252.1±3.2352±65357±6218.1±1.417.8±1.3T286.5±6.786.3±7.682.5±7.776.3±7.945.5±2.245.5±2.2241±24a268±2322.3±1.322.1±1.2T389.1±7.888.6±8.382.3±6.876.1±8.242.9±1.642.9±1.6233±23a256±2223.7±0.823.5±0.9T488.3±7.688.2±9.176.1±2.175.5±2.344.7±1.344.7±1.3219±22a235±2122.8±1.122.4±1.1T587.4±7.187.6±6.977.5±7.378.3±7.151.7±1.351.7±1.3279±51a293±4620.1±0.819.1±0.5T689.1±5.288.3±7.382.4±2.182.1±2.5——316±31a343±52--
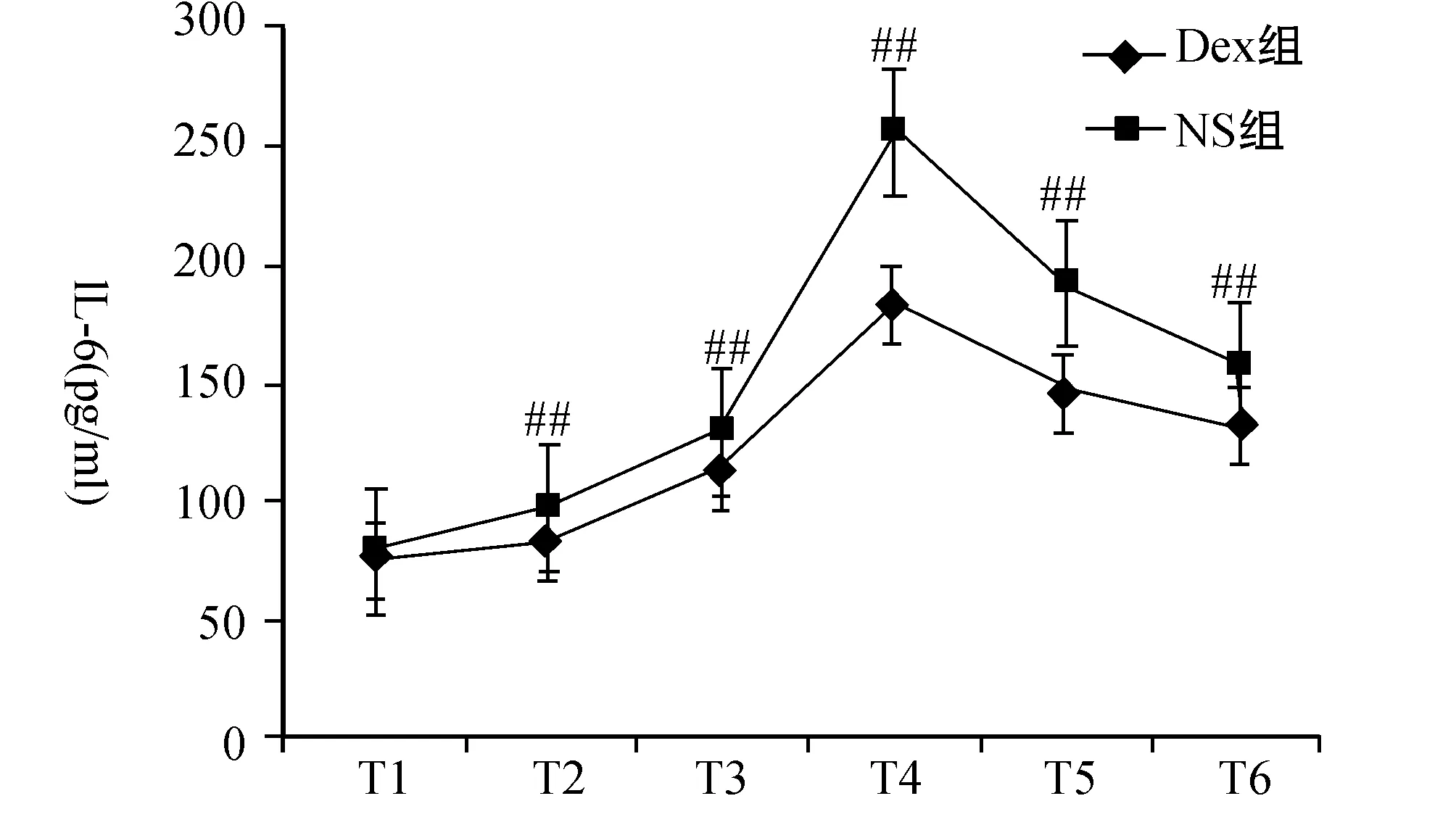
与Dex组比较,a:P 2.3两组患者各时间点炎症指标变化比较在T1时间点血清SOD、IL-6、MDA基础值含量比较无差异。Dex组SOD在T1~T4时间点逐渐升高,T4达到高峰,T4~T6逐渐下降,NS组SOD在T1~T4时间点逐渐降低,T4~T6逐渐回升,两组SOD在T2~T6时间点差异有统计学意义(P<0.05);两组IL-6、MDA在T2~T6各时间点升高,Dex组与NS组相比,T2~T6各时间点的IL-6及MDA明显降低,差异有统计学意义(P<0.05)。见图1~3。 图1 两组T1~T6各时点血清MDA浓度变化 与Dex比较,##:P<0.05 图2 两组T1~T6各时点血清IL-6浓度变化 与Dex比较,##:P<0.05 图3 两组T1~T6各时点血清SOD浓度变化 与NS比较,##:P<0.05 围手术期急性肺损伤一直被视为一个潜在复杂病理生理过程的术后并发症,致死率很高,严重影响病人恢复[12-13]。单肺通气易导致氧自由基和炎性因子的产生和释放,诱发全身炎性反应和氧化应激反应,较双肺通气更易造成急性肺损伤[14-15]。 机械通气时可引起肺泡上皮细胞细胞因子如TNF-a与 IL-l等生成和释放,加重炎性反应,引起肺血管痉挛、毛细血管通透性增强,甚至肺泡水肿,最终导致肺损伤[16]。而单肺通气过程中往往会导致肺内分流增加,低氧血症,缺氧性肺血管收缩,随后在单肺通气的结束和肺复张后,术侧肺恢复通气,大量的氧分子进入组织释放大量氧自由基并造成组织损伤。且一旦患侧肺通气复苏和低血流灌注肺/缺氧改善,过多的氧分子在组织中会释放大量的氧自由基,造成组织损伤。IL-6作为前炎性因子,既可启动早期炎性反应,又可加重炎性反应,在上述过程中大量释放,还能上调TNF-a的表达[17]。研究发现[8-11],右美托咪定可以抑制中性粒细胞的浸润,降低炎性细胞因子IL-6 、TNF-a和增加抗炎细胞因子的表达,实现对心、脑、肺、肾等器官的保护作用。本研究也发现,单肺通气开始后IL-6在两组均明显升高,但是右美托咪定预处理组血清IL-6浓度明显低于对照组。 有研究显示,肺细胞氧化应激损伤是单肺通气造成围手术期肺损伤的重要机制之一[4]。氧化应激在急性肺损伤的发生、发展中发挥重要的作用,其不仅氧化蛋白质,导致蛋白酶释放,使抗氧化剂和抗蛋白酶失活,而且直接损伤DNA导致断裂和点突变,导致脂质过氧化及前炎性物质基因表达增强,最终导致肺微血管完整性和肺泡屏障破坏,并且损伤Ⅱ型肺泡上皮细胞,引起肺表面活性物质减少、功能下降,从而导致急性肺损伤的发生[18]。术中高浓度氧的长时间吸入也会造成“氧化压力”,产生氧化应激,导致大量氧自由基产生[19],其中毒性最大的是MDA。MDA是自由基与细胞的膜性结构发生脂质过氧化反应的产物,它反映体内氧自由基量及活性,其含量的多少可直接反映机体内脂质过氧化反应的强弱,间接反映细胞损伤的程度[20]。对于血清MDA,其产生的主要机制是非酶系统与酶系统,对生物膜中的多不饱和脂肪酸进行攻击,并因此诱发过氧化作用,最终形成了脂质过氧化物,在这种脂质过氧化的作用下,可以将活性氧最终转化为具有活性的非自由基性质的分解产物,且经链式或者这种链式的支链反应来讲活性氧进行放大,在分解产物中就会出现一些引发细胞代谢功能障碍的物质,对血清MDA进行检测能够清晰地反映出机体内的脂质过氧化状况,进一步体现出机体细胞的受损情况[21]。本研究结果表明,血清MDA浓度在单肺通气后显著升高,单肺通气结束后快速下降,表明氧化应激损伤主要发生在单肺通气过程中。SOD是重要的抗氧化酶,其参与清除超氧阴离子、减少还原型亚硝酸盐的形成及所致的损伤,对肺具有保护作用[22],SOD可与氧自由基发生反应,减少细胞损伤,血清SOD的表达水平与肺损伤的程度呈明显负相关,而氧化应激产物可降低该酶活性[23]。本研究中,在单肺通气开始后直至术后24h,右美托咪定组MDA低于对照组,而SOD明显高于对照组,表明右美托咪定能增加体内抗氧化因子的产生,增强机体抗氧化能力。氧合指数(OI)是围术期肺功能监测的重要指标,在研究中,右美托咪定组的氧合指数在单肺通气期间较对照组明显升高,这表明右美托咪定预处理有利于术中肺功能的保护及术后肺部功能的恢复。 本研究结果显示,右美托咪定预处理组肺损伤明显减轻,而血清促炎因子降低,表明其肺保护作用可能与减轻炎症应激反应有关;血清MDA含量减少而SOD活性增加,氧合指数升高提示右美托咪定肺保护作用可能与肺部氧化应激水平的减弱及抗氧化能力的增强有关。 总之,右美托咪定预处理能够明显减轻单肺通气术后的肺损伤,右美托咪定的抗炎、抗氧化作用可能在其肺保护作用中起着重要作用,但是其作用的具体环节及信号转导通路岂待进一步研究。 [1] Pinhu L,Whitehead T,Evans T,et a1.Ventilator-associated lung injury [J].Lancet,2003,36 1(9354):332-340. [2] Fuller BM,Mohr NM,Dettmer M,et a1.Mechanial Ventilation and acute lung injury in emergency department patients with severe sepsis and septic shock:an observation study[J].Acad Emerg Med,2013,20(7):659 -669. [3] 张荣智,石翊飒,张亚敏,等.不同剂量右美托咪定对单肺通气患者围术期炎性反应的影响[J].中华麻醉学杂志,2011,31(12):1443-1445. [4] Li XQ,Tan WF,Wang J,et al.The effects of thoracic epidural analgesia on oxygenation and pulmonary shunt fraction during one-lung ventilation:an meta-analysis[J].BMC Anesthesiol,2015,15(1):166. [5] Hofer S,Steppan J,Wagner T,et a1.Central symp-tholytics prolong survival in experimental sepsis[J].Crit Care,2009,3:R11. [6] Qiao H,Sanders RD,Ma D,et a1.Sedation improves early out come in severely septic Spragne Dawley rats[J].Crit Care,2009,13(4):136-140. [7] Calver L,Isbister GK.Dexmedetomidine in the emergency department:assessing safety and effectiveness in difficult-to-sedate acute behavioural disturbancer[J].Emerg Med J,2012,29(11)915-918. [8] Hoffman WE,Kochs E,Wemer C,et a1.Dexmedetomedine improve neurologic outcome from incomplete ischemia in the rat.Reversal by the α2-Adrenogic antagonist atipamezole[J].Anesthesiology,1991,75(4):328-332. [9] Gu J,Sun P,Zhao H,et a1.Dexmedetomidine provides renoprote ction agaiNst ischemia-reperfusion injury in mice[J].Crit Care,2011,15(3):R153. [10] Zhang XY,Liu ZM,Wen SH,et a1.Dexmedetomidine administration before,but not after,ischemia attenuates intestinal injury induced by intestinal ischemia- reperfusion in rats[J].Anesthesiology,2012,116(5):1035-1046. [11] Kilic K,Hanci V,Selek S,et a1.The effects of Dexmedetomidine on mesenteric arterial occlusion-associated gut ischemia and reperfusion-induced gut and kidney injury in rabbits[J].J Surg Res,2012,178 (1):223-232. [12] Yu S,Shi M,Liu C,et al.Time course changes of oxidative stress and inflammation in hyperoxia-induced acute lung injury in rats[J].Iran J Basic Med Sci,2015,18(1):93-103. [13] McDonald CI,Fung YL,Shekar K,et al.The impact of acute lung injury,ECMO and transfusion on oxidative stress and plasma selenium levels in an ovine model[J].J Trace Elem Med Biol,2015,30:4-10. [14] Ferreira HC,Mazzoli-Rocha F,Momesso DP,et al.On the crucial ventilatory setting adjustment from two- to one-lung ventilation[J].Respir Physiol Neurobiol,2011,178(2-3):198-204. [15] Jorgenson A,Jaeger JM,de Souza DG,et al.Acute intraoperative pulmonary embolism:an unusual cause of hypoxemia during one-lung ventilation[J].J Cardiothorac Vasc Anesth,2011,25(6):1113-1115. [16] Wrigge H,Uhlig U,Zinserling J,et a1.The effects of different ventilatory settings on pulmonary and systemic inflammatory responses during major surgery[J].Anesth Analg,2004,98 (7):775-781. [17] 胡婧,都鹏飞,贝丹丹.外周血IL-6对新生儿脓毒症诊断价值的Meta分析 [J].中国当代儿科杂志,2015,17(11):1176-1182. [18] Hybertson BM,Lee YM,Cho HG,et a1.Alveolar type II cell abnormalities and peroxide formation in Lungs ofrats given IL-1 intratracheally[J].Inflammation,2000,24 (4):289-303. [19] Demir M,Amanvermez R,Kamali Polat A,et a1.The effect of silymarin on mescnteric ischemia-reperfusion injury[J].Med Princ Pract,2014,23(2):140-144. [20] Wang C,Wang HY,Liu ZW,et al.Effect of endogenous hydrogen sulfide on oxidative stress in oleic acid-induced acute lung injury in rats[J].Chin Med J(Engl),2011,124(21):3476-3480. [21] Kikuchi K,Kawahara KI,Uehikado H,et a1.Potential of edaravone for neuroprotection in neurologic diseases that do not involve cerebral infarction[J].Exp Ther Med,2011,2(5):77I-775. [22] Kinnula VL,Crapo JD.Superoxide dismutases in the lung and human lung diseases [J].Am J Respir Crit Care Med,2003,167(12):1600-1619. [23] Yen CC,Lai YW,Chen HL,et a1.Aerosolized human extracellular superoxide dismutase prevents hyperoxia induced lung injury[J].PLoS One,2011,6 (10):26870. ProtectionEffectofPretreatmentofDexmedetomidineonLungInjuryafterOne-LungVentilation CHEN Ying,WANG Deming,WU Kunpeng,et al (DepartmentofIntensiveCareMedicineandDepartmentofAnesthesia,theAffiliatedSecondHospital,UniversityofSouthChina,Hengyang,Hunan421001,China) ObjectiveTo investigate the effects of dexmedetomidine pretreatment on lung injury after one-lung ventilation(OLV).Methods56 cases of esophageal cancer patients undergoing elective single lung ventilation for general anesthesia,were randomly divided into two groups of Dexmedetomidine(Dex group)and control(NS group) with 28 cases in each group.Mean arterial pressure,heart rate,oxygenation index,airway peak pressure and BIS value were recorded in patients before OLV after anesthesia induction(T1),OLV after 60 min(T2),OLV after 120 min(T3),before the end of OLV(T4), before leaving the operating room(T5),and postoperative 24h(T6).The serum levels of SOD,IL-6 and MDA were measured.ResultsFor intraoperative monitoring oxygenation index in T2~T4 time points,Dex group is lower than the NS group (P<0.05); IL-6 and MDA in Dex group significantly decreased at time point T2~T6 (P<0.05 ),SOD in Dex group significantly increased(P<0.05);the rest of the two groups have no difference.ConclusionDexmedetomidine can significantly decrease inflammatory factor during OLV and improve the technique of oxygenation index,protective lung injury after one lung ventilation. Dexmedetomidine; one-lung ventilation; lung injury 10.15972/j.cnki.43-1509/r.2016.03.023 2015-12-18; 2016-01-13 *通讯作者,E-mail:35675205@qq.com. R655.3 A 秦旭平)

3 讨 论

