儿科住院患者下呼吸道病原菌分布及耐药性分析
李淑欢陈小群叶美仪薛碧华陈定强
1 广东省佛山市顺德区第一人民医院儿科(佛山 528300)2 广东省广州医科大学附属第一医院检验科(广州 510120)
儿科住院患者下呼吸道病原菌分布及耐药性分析
李淑欢1陈小群1叶美仪1薛碧华1陈定强2
1 广东省佛山市顺德区第一人民医院儿科(佛山 528300)2 广东省广州医科大学附属第一医院检验科(广州 510120)
目的 分析我院2011—2015年我院儿科住院患者下呼吸道病原菌分布及其耐药性。方法 采用全自动生化鉴定仪对痰标本分离株进行鉴定,用全自动微生物药敏系统和纸片扩散法对病原菌的耐药性进行检测,并用头孢硝噻吩纸片法对β-内酰胺酶进行检测。结果 2011—2015年共分离得到下呼吸道病原菌518株,包括肺炎链球菌(21.62%)、金黄色葡萄球菌(16.99%)、流感嗜血杆菌(14.48%)、肺炎克雷伯菌(11.97%)、大肠埃希菌(8.11%)、卡他莫拉菌(5.41%)、鲍曼不动杆菌(3.86%)和铜绿假单胞菌(3.86%)等。药敏结果显示,肺炎链球菌对克林霉素(90.18%)、红霉素(92.86%)和复方新诺明(87.50%)的耐药率较高,金黄色葡萄球菌则对青霉素G(90.91%)和红霉素(68.18%)有较强耐药性,未发现对万古霉素或利奈唑胺耐药的革兰阳性球菌。流感嗜血杆菌对氨苄西林耐药率为32%,与其β-内酰胺酶阳性率较一致,肺炎克雷伯菌和大肠埃希菌对头孢类药物(17.33%~45.33%)和喹诺酮类药物(34.67%~50.67%)耐药性较高,并发现1株碳青霉烯耐药的肺炎克雷伯菌。结论 本院下呼吸道感染病原菌谱较广,主要包括多种革兰阳性球菌和革兰阴性杆菌,并对多种抗菌药物表现出较强耐药性,临床应注重合理应用相关抗生素,严格防控病原菌的医院感染及传播。
儿科住院患者 病原菌 耐药性
下呼吸道感染是儿科住院患者常见疾病,严重威胁儿童健康和生命,积极采取措施降低发病率非常有必要。下呼吸道感染常由细菌感染引起,尤其是严重肺炎中细菌感染的可能性更大,常见的细菌病原体有肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌杆菌等[1]。近年来细菌耐药性日趋严重,给相关疾病的治疗带来更大困难。本研究通过回顾性分析2011—2015年我院儿科患者518例痰培养阳性分离株,总结下呼吸道感染细菌谱、耐药性和流行规律,为临床进行相关患者的诊断和合理治疗提供实验室参考依据,减少和减缓细菌耐药的发生。
1 资料与方法
1.1 菌株来源 选择2011年8月—2015年8月我院因下呼吸道感染住院并行痰培养检查的儿科患者,收集患者痰培养细菌分离株518株,剔除一年内同一患者的重复分离株。
1.2 痰标本的采集和培养 对入院的患儿在使用抗生素前进行痰液采集,年长儿童采用生理盐水漱口后自行咳痰,婴幼儿则采用一次性无菌吸痰器抽吸咽喉部痰液,采集后在两小时内送达微生物实验室。痰标本涂片镜检,以鳞状上皮细胞<10个/低倍镜视野,白细胞>25个/低倍镜视野为合格标本。将痰标本接种在哥伦比亚血平板和巧克力平板上,置于35℃含5%CO2的培养箱孵育24~48小时。
1.3 细菌鉴定和药敏试验 根据培养基上细菌的特点,进行菌落选择和革兰染色镜检,并采用VITEK2全自动微生物生化鉴定仪(生物梅里埃)对细菌进行鉴定,同时采用VITEK Compact微生物药敏仪和纸片扩散法检测细菌对多种抗生素的耐药性。药敏试验以大肠埃希菌ATCC25922、ATCC35218、肺炎克雷伯菌ATCC700603,铜绿假单胞菌ATCC27853、金黄色葡萄球菌ATCC25923为质控菌株,其结果根据美国临床实验室标准化协会(CLSI)相关指南进行判读,以S(敏感)、I(中介)和R(耐药)表示[2]。
1.4 β-内酰胺酶的测定 使用头孢硝噻吩纸片(生物梅里埃)检测金黄色葡萄球菌和流感嗜血杆菌中的β-内酰胺酶,并按照产品说明书进行判读。
1.5 统计学处理分析 采用WHONET 5.6软件对菌株信息进行统计分析。
2 结 果
2.1 细菌分离株总体分布情况 在本院2011—2015年下呼吸道标本分离出的518株病原菌中,革兰阳性球菌占比约39%,革兰阴性杆菌占比约50%,其它细菌占比约11%。分离菌株中比重最高的前五种细菌分别为肺炎链球菌(21.62%)、金黄色葡萄球菌(16.99%)、流感嗜血杆菌(14.48%)、肺炎克雷伯菌(11.97%)和大肠埃希菌(8.11%)。其它菌株包括卡他莫拉菌、鲍曼不动杆菌和铜绿假单胞菌等,见表1。
2.2 革兰阳性球菌的耐药性分析 两种主要革兰阳性球菌对临床常用抗生素的耐药率见表2。肺炎链球菌和金黄色葡萄球菌是分离率最高的两种细菌,其对青霉素G、红霉素和克林霉素均有很高的耐药率。肺炎链球菌对红霉素的耐药性最严重,耐药率达 92.86%,对克林霉素的耐药率稍低,但也在90%以上;其对左氧氟沙星的敏感性较高,未发现对利奈唑胺和万古霉素耐药的肺炎链球菌。金黄色葡萄球菌则对青霉素G的耐药性最高,为90.91%,对其它测试的β-内酰胺类抗生素(苯唑西林、头孢唑林和头孢西丁)则显示中度的耐药性(>35%),对利奈唑胺、万古霉素和替考拉宁则显示高度的敏感性,未发现对这三种药物耐药的金黄色葡萄球菌菌株。
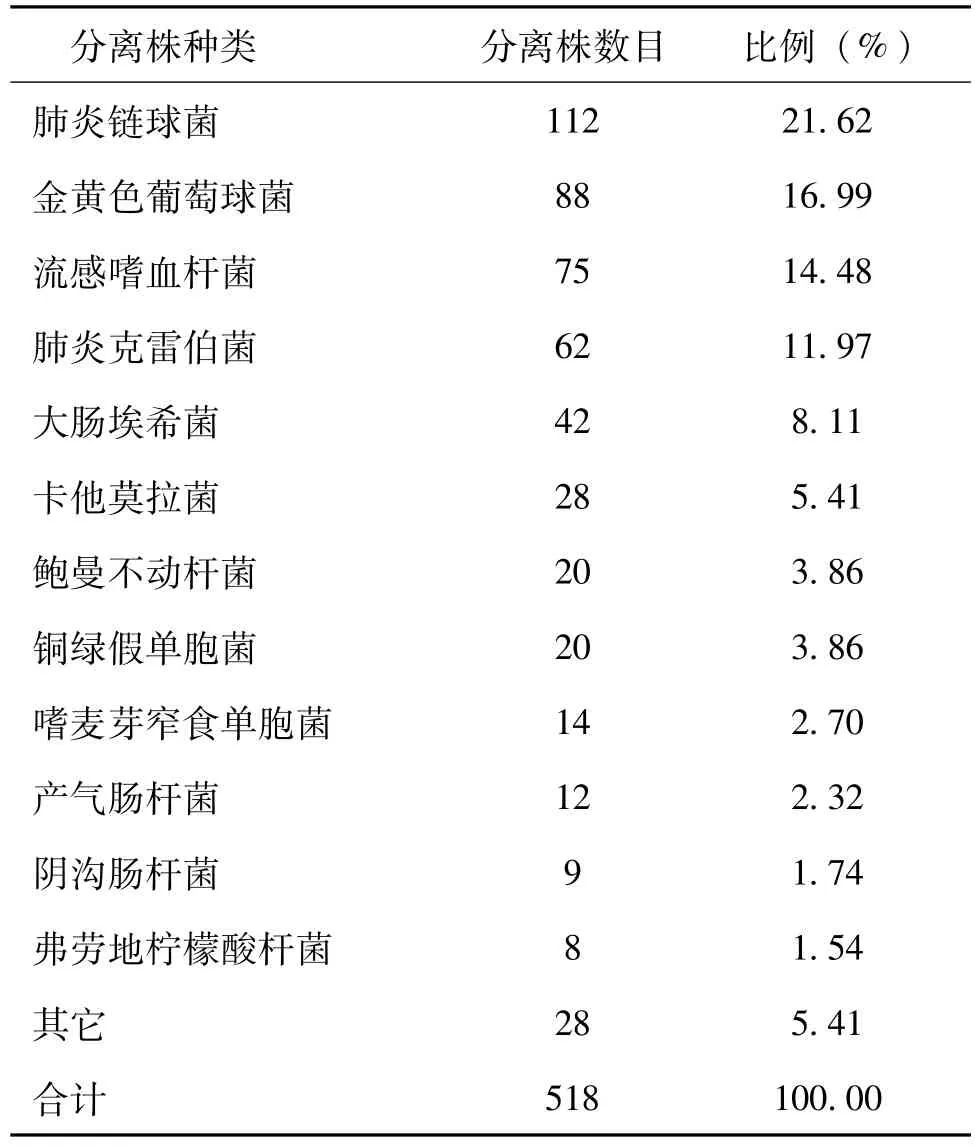
表1 518株下呼吸道病原菌分布情况

表2 主要革兰阳性球菌分离株的耐药率
2.3 革兰阴性杆菌的耐药性分析 三种比例最高的格兰阴性杆菌对临床常用抗生素的耐药率见表3。在75株流感嗜血杆菌分离中,对氨苄西林耐药率为32%(24/75),对复方新诺明耐药率达72%(54/75),对氨苄西林/舒巴坦、头孢呋辛、四环素、氯霉素和阿奇霉素的耐药率为4%~18.67%,对三代头孢菌素、环丙沙星和美罗培南则全部敏感。肺炎克雷伯菌和大肠埃希菌是最常见的肠杆菌科病原菌,对头孢菌素类药物头孢他啶、头孢曲松和头孢吡肟的耐药率为17.33%~45.33%,对喹诺酮类药物的耐药率较高(34.67%~50.67%),对阿米卡星则较敏感(耐药率20%和10.67%)。大肠埃希菌对亚胺培南和美罗培南全部敏感,肺炎克雷伯菌对这两种抗生素的耐药率均为1.61%(1/62)。

表3 主要革兰阴性杆菌分离株的耐药率
2.4 β-内酰胺酶检测结果 对金黄色葡萄球菌和流感嗜血杆菌中进行β-内酰胺酶的测定,结果表明金黄色葡萄球菌和流感嗜血杆菌β-内酰胺酶阳性率较高,分别为85.23%(75/88)和26.67%(20/75),该比率与这两种细菌对青霉素类的耐药率一致性较高。
3 讨 论
来自不同国家和地区的研究发现,引起儿童下呼吸道感染的病原菌组成有明显的地域差异性。来自美国和英国等发达国家的报道表明,引起下呼吸道感染的最常见细菌为肺炎链球菌和流感嗜血杆菌[3]。国内多个地区报道结果显示,常见的病原菌还包括金黄色葡萄球菌、肺炎克雷伯菌和大肠埃希菌等,不同地区的病原菌比例差异较大[4-6]。本研究发现,我院儿科患者下呼吸道标本细菌分离比例由高到低依次为肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌、肺炎克雷伯菌、大肠埃希菌和卡他莫拉菌等,与一部分国内外的文献报道较一致,但与另外一些研究有差异[3,7-8]。由于下呼吸道感染病程较复杂,病原体与患儿年龄、肺炎类型和季节等因素均有关系,另外肺炎链球菌、流感嗜血杆菌和卡他莫拉菌等均为苛养菌,不同实验室的分离效率可能也有不同,这可能是不同地区的病原体谱有较大差异的原因。
多重耐药肺炎链球菌的出现和流行,已经成为世界范围儿科患者下呼吸道感染治疗面临的重大难题,曾经非常有效的青霉素类和大环内酯类药物已经出现严重的耐药性[9]。本研究中分离得到的112株肺炎链球菌中,青霉素G的耐药率达50%以上,红霉素的耐药率更超过了90%。同时,分离株对克林霉素、复方新诺明和四环素等抗生素的耐药率也在70%以上,为抗菌治疗带来了很大的困难。金黄色葡萄球菌为导致儿童肺炎的重要病原体,在本研究中分离比例仅低于肺炎链球菌,也呈现较高的耐药率,其中青霉素G的耐药率达90.91%,耐甲氧西林金黄色葡萄球菌(MRSA)的比例为 37.5%,较与之前的研究报道更高[10]。万古霉素、利奈唑胺和替考拉宁对金黄色葡萄球菌非常有效,分离株中未发现耐药株,但国内外已有报道万古霉素耐药的病例[11],应引起临床的重视,合理应用这些抗生素。
流感嗜血杆菌是儿童社区获得性肺炎的重要病原菌之一,最近的报道显示其对氨苄西林的耐药性不断提高,且与β-内酰胺酶的产生密切相关。一项对苏州地区儿科患者流感嗜血杆菌分离株的研究发现,耐药性较强的抗生素为复方新诺明(76.7%)、氨苄西林(32.7%)、和四环素(14.3%),与本研究的结果较一致[12]。流感嗜血杆菌对二代和三代头孢菌素、喹诺酮和美罗培南敏感,但本院的分离株中已出现对头孢呋辛的耐药株,用纸片扩散法检测耐药性时也观察到对头孢曲松和环丙沙星纸片抑菌圈缩小的现象,说明流感嗜血杆菌已经开始对这些抗生素出现耐药性,这将使抗菌治疗方案的选择更加困难。
本研究分离株中包括多种革兰阴性杆菌,其中以肺炎克雷伯菌和大肠埃希菌数量为最多。由于超广谱β-内酰胺酶(ESBL)的广泛流行传播,肺炎克雷伯菌和大肠埃希菌对头孢菌素类药物的耐药性不断增加,且存在与喹诺酮类和氨基糖苷类等其他药物的交叉耐药情况,碳青霉烯类药物已经成为治疗产ESBL菌株的最有效药物,但近年来国内已出现耐碳青霉烯的肺炎克雷伯菌和大肠埃希菌,并有流行传播的趋势[13]。本研究也发现1株肺炎克雷伯菌对亚胺培南和美诺培南耐药,该菌株对绝大部分其他抗生素也呈现高度的耐药性,这在儿科患者的分离株中是较少见的,应引起临床的重视,合理使用相关抗生素,严格做好院感防控工作,防止耐药株的产生和流行。
[1]杨永弘,马香.小儿呼吸道感染的细菌病原[J].实用儿科临床杂志,2011,26(4):229-232.
[2]Clinical and Laboratory Standards Institute(CLSI). Performance standards for antimicrobial susceptibility testing[S].Nineteenth Informational Supplement,M100-S22,2012.
[3]PRAYLE A,ATKINSON M,SMYTH A.Pneumonia in the developed world[J].Paediatr Respir Rev,2011,12(1):60-69.
[4]宋培红,芦惠,董晓勤.儿童急性下呼吸道感染细菌病原学分析[J].医学研究杂志,2008,37(4): 98-99.
[5]高成菊,曹美珍.儿童下呼吸道感染细菌病原及耐药分析[J].安徽医药,2009,13(5):543-544.
[6]刘虹,谢辉,张继永,等.小儿急性下呼吸道感染细菌病原及耐药性分析[J].中国卫生检验杂志,2008,18(11):2333-2334,2390.
[7]TSANG KW,FILE TM JR.Respiratory infections unique to Asia[J].Respirology,2008,13(7):937-949.
[8]陆权.呼吸道感染常见细菌病原的变迁及对策[J].临床儿科杂志,2008,26(6):455-458.
[9]VASOO S,SINGH K,HSU LY,et al.Increasing antibiotic resistance in Streptococcus pneumoniae colonizing children attending day-care centres in Singapore[J]. Respirology,2011,16(8):1241-1248.
[10]史梦,保勇,尹亚非,等.儿科患者呼吸道感染常见病原菌及耐药性分析[J].中国医学创新,2014,11(23):112-115.
[11]APPELBAUM PC.The emergence of vancomycin-intermediate and vancomycin-resistant Staphyloccus aureus[J].Clin Microbiol Infect,2006,12(Suppl 1):16-23.
[12]陶云珍,王运中,吾金彪,等.苏州地区2011-2012年儿童感染流感嗜血杆菌耐药新特征[J].临床儿科杂志,2013,31(9):845-849.
[13]汪明,孙自镛,陈中举,等.碳氢酶烯类耐药的肠杆菌科细菌耐药机制研究[J].中华检验医学杂志,2012,35(4):339-344.
Analysis of antimicrobial resistance and the profile of pathogens from lower respiratory tract infections in pediatric inpatients
Li Shuhuan,Chen Xiaoqun,Ye Meiyi,et al.The First General Hospital of Shunde,Foshan 528300,China
Objective To analyze the antimicrobial resistance and the profile of pathogens from lower respiratory tract infections in pediatric in patients. Methods Sputum bacterial isolates were identified by an automated biochemical identification system.Antimicrobial resistance was detected by an automated drug susceptibility detection system and the disc diffusion method.The β-lactamases was tested by the nitrocefin disc detection method. Results Five hundred and eighteen bacterial pathogens were isolated from sputum samples during 2011-2015,including streptococcus pneumoniae(21.62%),staphylococcus aureus(16.99%),haemophillus influenzae(14.48%),klebsiella pneumoniae(11.97%),escherichia coli(8.11%),moraxelle catarrhalis(3.8%),acinetobacter baumanii(3.86%)and pseudomonas aeruginosa(3.86%).High resistant rates were detected for S.pneumoniae to clindamycin(90.18%),erythromycin(92.86%)and sulfamethoxazole(85.50%),while S.aureus was highly resistant to penicillin G(90.91%)and erythromycin(68.18%).Resistance to vancomycin and linezolid was not detected for gram positive cocci.The resistant rate to ampicillin was 32%for H.influenzae,which was in concordance with the production of β-lactamases.Relatively high resistance was detected for K.pneumoniae and E.coli to cephalosporins and quinolones.A carbapenem-resistant K.pneumoniae isolate was also detected. Conclusion Multiple bacterial species were isolated from lower respiratory tract infections in our hospital,including different species of gram positive cocci and gram negative bacilli,and these isolates exhibited high resistance to antibiotics tested.The clinical use of antibiotics and hospital infection and transmission of these pathogens should be controlled.
Pediatric inpatients;Pathogens;Antimicrobial resistance
10.3969/j.issn.1000-8535.2016.01.004
2015-10-22)
国家自然科学基金资助项目(81201341)

