转录因子Pho4参与白念珠菌药物敏感性的调控
秦玉璘 许洪涛 张璐璐 张金宇 姜远英 曹永兵
(中国人民解放军第二军医大学药学院新药研究中心,上海 200433)
·论著·
转录因子Pho4参与白念珠菌药物敏感性的调控
秦玉璘 许洪涛 张璐璐 张金宇 姜远英 曹永兵
(中国人民解放军第二军医大学药学院新药研究中心,上海 200433)
目的 通过对缺失相应转录因子基因的白念珠菌进行抗真菌药物敏感性的筛选,考察转录因子对白念珠菌耐药性的影响及调控机制。方法 通过微量液基稀释法、点板实验 (Spot Assay)检测实验菌株对抗真菌药物的敏感性。采用实时定量PCR (RT-PCR)的方法检测白念珠菌耐药性相关MDR1,CDR1以及ERG11的表达,并通过检测菌株对罗丹明6G的外排能力进一步检测菌株对抗真菌药物的外排能力。结果 最低抑菌浓度 (minimal inhibitory concentration,MIC)测定和Spot Assay实验结果表明,与亲本菌相比,PHO4基因缺失菌对氟康唑、咪康唑的敏感性显著升高。虽然耐药相关基因的表达增加,但对罗丹明6G的外排能力降低,抗氧化应激能力下降。结论 转录因子Pho4的缺失可能通过降低白念珠菌的抗氧化应激能力,减弱对药物的外排作用而导致对唑类药物敏感,但其具体的调控机制有待进一步研究。
白念珠菌;转录因子;药物敏感性;药物外排
[Chin J Mycol,2016,11(2):65-69]
白念珠菌作为一种条件致病真菌,在正常人体内可以长期、无害地共生,并与其他菌群保持平衡,机体自身的免疫力足以抵御白念珠菌的侵袭。当机体免疫力下降时,对白念珠菌的抵抗能力随之下降,引发从皮肤黏膜表层到危及生命的系统性真菌感染。近年来,随着癌症放化疗增加,获得性免疫缺陷综合征患者不断增多,器官移植及外植性器械的广泛应用使得免疫缺陷患者剧增,白念珠菌的感染率和死亡率不断升高。临床上用于治疗念珠菌病的抗真菌药物种类有限,其中氟康唑由于具有较高的生物利用度和较低的毒性,在临床应用最为广泛。然而,在长期的临床治疗中,白念珠菌逐渐对氟康唑产生耐药性,大大降低了临床治疗的效果[1]。目前,在抗真菌药物的研究中,探索真菌耐药的机制对解决真菌耐药问题、发现抗真菌药物的新靶点具有重要意义。
白念珠菌在长期的演变中,逐步形成了多种唑类药物耐药机制,包括:①药物作用靶酶突变,降低了对药物的亲和力,例如,编码羊毛甾醇14α-去甲基化酶的基因ERG11的表达量增加使真菌细胞生长不受抑制。②药物外排泵的过表达,包括易化扩散载体超家族 (major facilitator superfamily,MFS)及ABC转运蛋白 (ATP-binding cassette transporters)两大类[2]。③白念珠菌生物被膜的形成。④应激反应诱导耐药基因表达。⑤转录因子参与调控耐药基因的表达。随着基因水平研究的深入发展,临床上在对氟康唑耐受的菌株中发现普遍锌簇转录因子突变的现象,这些转录因子包括:Mrr1[3],Tac1[3-4],Upc2[5]。除锌簇转录因子外,有研究显示白念珠菌碱性亮氨酸拉链转录因子Cap1通过激活耐药基因MDR1使白念珠菌出现耐药表型[6]。转录因子Ndt80通过控制药物外排泵CDR1的表达来调控白念珠菌对唑类药物的耐受性[7]。转录因子参与调控白念珠菌耐药性的相关研究对于从基因调控方面探索白念珠菌耐药机制具有重要意义,为解决真菌耐药问题提供了新思路。
本文通过筛选16株白念珠菌不同转录因子缺失菌,研究可能影响白念珠菌耐药性的转录因子及未知的调控通路。
1 材料和方法
1.1 材料
菌株 白念珠菌 (Candidaalbicans)国际通用菌株ATCCMYA-2876 (SC5314)由美国华盛顿乔治敦大学 (Department of Microbiology and Immunology,Georgetown University,Washington,U.S.A.)William A.Fonzi教授惠赠。SN250及16株白念珠菌转录因子敲除菌由中国科学院上海生命科学院巴斯德所陈昌斌教授惠赠,菌株列表及敲除的转录因子见表1。
主要试剂 氟康唑注射液 (Fluconazole,FLC)购自Pfizer,咪康唑 (Miconazole,MCZ)购自Sigma;真菌RNAout试剂盒购自北京天恩泽基因科技有限公司,PrimeScriptTMRT Master Mix,2×SYBR Premix ExTaq均购自Takara;罗丹明6G (Rhodamine 6G)购自生工生物;药物母液配置:氟康唑为注射剂,浓度为2 mg/mL,直接取用;咪康唑使用二甲亚砜 (dimethyl sulphoxide,DMSO)溶解,配置成6.4 mg/mL储备液,分装后于-20℃长期贮存备用。

表1 RT-PCR实验中使用的引物序列
注:F.forward,R.reverse
培养基 RPMI 1640培养液:RPMI 1640 (Gibco BRL公司)10 g,NaHCO32 g,吗啡啉丙磺酸 (morpholine propanesulfonic acid,MOPS,Sigma)34.5 g,加三蒸水900 mL溶解,用1 mol/L NaOH凋pH至7.0,定容至1 000 mL,过滤除菌,4℃保存。YPD培养液 (固体和液体):蛋白胨20 g,酵母浸膏10 g,葡萄糖200 g,加三蒸水定容至1 000 mL,固体加2%琼脂,高压灭菌后于4℃保存备用。
仪器 7500型荧光定量PCR仪 (ABI),Multiskan MK3型酶标仪 (Thermo Scientific),HZ-2111K-B型恒温振荡器 (太仓市华利达实验设备有限公司),Heraeus Fresco 21微量离心机 (Thermo Scientific)。
1.2 方法
抗白念珠菌药物体外抑菌活性测定 参照美国临床实验室标准化协会 (CLSI)制定的M27-A方案。采用微量液基稀释法测定实验菌株的MIC80,取96孔板,将FLC注射液用RPMI 1640液体培养基倍比稀释,药物作用的最高浓度为64 μg/mL,最低浓度为0.125 μg/mL,每孔体积为100 μL,100 μL RPMI 1640液体培养基作为空白对照,100 μL菌液作为阳性对照,药物作用的菌液浓度为1×103~5×103cells/mL。35℃孵育24 h,48 h测定实验结果,MIC80为与阳性对照孔相比,菌株生长80%被抑制时对应的最低药物浓度。实验平行操作2~3次。
Spot Assay实验测定药物体外抑菌活性 配制含药的YPD平板,氟康唑浓度为16 μg/mL、8 μg/mL和4 μg/mL,咪康唑浓度为8 μg/mL、4 μg/mL和2 μg/mL。挑取单克隆菌落于1 mL YPD液体培养基,在30℃培养箱,200 r/min振荡培养,活化16 h。YPD调整菌液浓度为2×106cells/mL、2×105cells/mL、2×104cells/mL、2×103cells/mL和2×102cells/mL 5个浓度梯度,每种菌株,每个浓度梯度取5 μL点板。
罗丹明6G检测药物外排 于1 mL YPD液体培养基,30℃,200 r/min振荡活化菌株使其处于对数生长期。3 000 g离心5 min,用PBS洗3次后重悬,30℃,200 r/min振荡培养2 h,使细胞内的能量被耗尽。10 μmol/L罗丹明6G 30℃,200 r/min孵育细胞,1 h。用PBS洗去胞外的罗丹明6G,并调整菌浓度为5×107cells/mL,加入葡萄糖使终浓度达到2 mmol/L,分别在15 min,30 min,45 min,60 min,90 min取1 mL菌液,离心,取上清100 μL,测定荧光强度。
RT-PCR考察耐药相关基因的转录水平 使用真菌RNAout试剂盒抽提菌株RNA并测定浓度和纯度后按照Takara PrimeScriptTMRT Master Mix试剂盒说明将RNA反转录为cDNA,反应条件为:37℃ 15 min;85℃ 5 s;4℃冷却。实时定量Real Time RT-PCR按SYBR Premix Ex Taq RR420A说明书中的体系 (20 μL)进行PCR反应,反应条件为:预变性98℃ 30 s;PCR反应95℃ 5 s,60℃ 34 s,40个循环;熔解曲线分析95℃ 30 s;60℃ 1 min;95℃ 15 s。实验中使用的引物见表1。
使用ABI 7500 SDS软件系统对实验结果进行分析,RT-PCR实验结果得到相应基因的Ct (threshold cycle)值。以actin作为内参,并以其Ct值校正目的基因的Ct值,得到ΔCt值。用Ratio值 (实验组与对照组相比)表示基因表达差异,Ratio值=2(-ΔΔCt)。
生长曲线 于1 mL YPD液体培养基,30℃,200 r/min振荡活化菌株使其处于对数生长期。适当稀释菌液,以YPD培养液调整菌液浓度,使OD630值为0.1。于5 mL上述菌液中加入H2O2,使其终浓度为16 μg/mL。30℃,200 r/min振荡培养,分别于0、2、4、6、8、10、12和24 h取样100 μL,测定OD630值,以OD630值记录菌株生长变化情况。
统计分析 使用GraphPad Prism 5软件对全部数据进行分析,P<0.05差异有统计学意义。
2 结 果
2.1 药物敏感性实验
通过微量液基稀释法初步检测16株转录因子缺失菌对临床常用抗真菌药物氟康唑的敏感性。PHO4缺失菌在表2中用编号CC007表示,初步的药敏实验结果显示,PHO4缺失菌与亲本菌SN250相比,对氟康唑的敏感性显著升高,24 h测得MIC80为0.25 μg/mL,48 h时测得MIC80为0.5 μg/mL。其余15株转录因子基因敲除菌的氟康唑药敏筛选结果列在表3中。
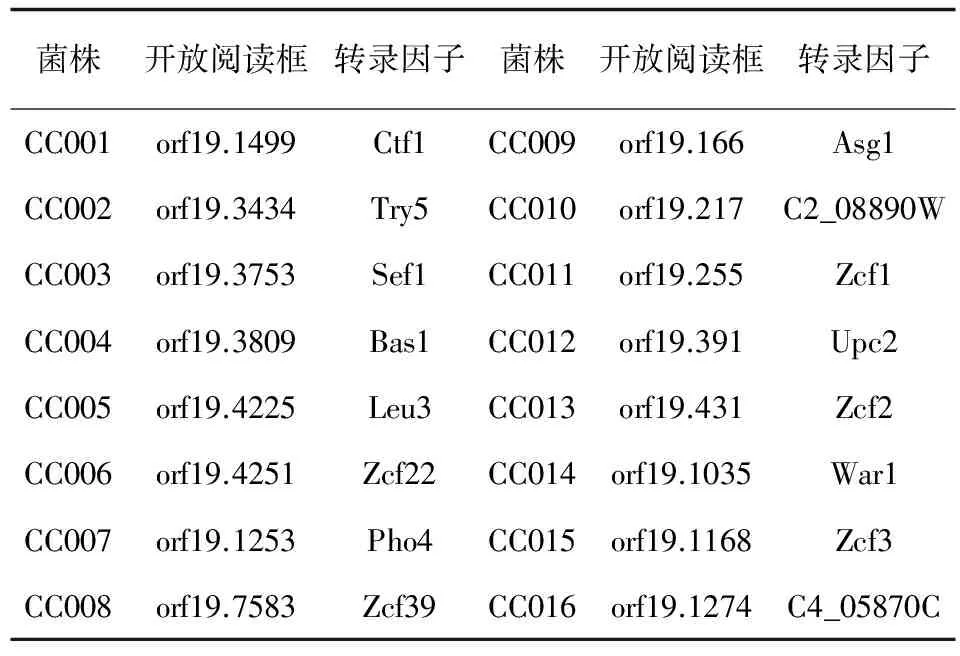
表2 16株基因缺失菌缺失的转录因子名称
表3 16株白念珠菌转录因子基因缺失菌对氟康唑的敏感性
Tab.3 The susceptibility of 16 TF deletionCandidaalbicansstrains to fluconazole
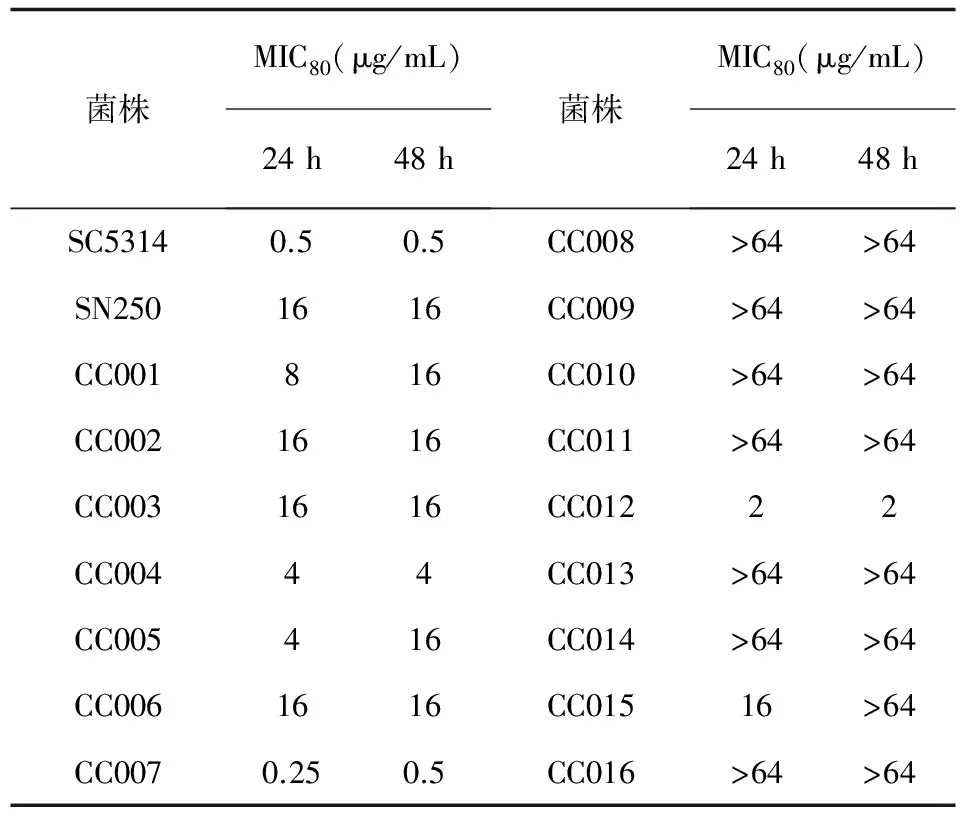
菌株MIC80(μg/mL)24h48h菌株MIC80(μg/mL)24h48hSC53140.50.5CC008>64>64SN2501616CC009>64>64CC001816CC010>64>64CC0021616CC011>64>64CC0031616CC01222CC00444CC013>64>64CC005416CC014>64>64CC0061616CC01516>64CC0070.250.5CC016>64>64
2.2 Spot Assay实验
点板实验考察PHO4基因缺失菌对氟康唑和咪康唑的敏感性,发现在YPD固体培养基上,pho4-/-对氟康唑和咪康唑均敏感,随着氟康唑的浓度增加,敏感性增加,对16 μg/mL的氟康唑最敏感。然而,pho4-/-对咪康唑的敏感性明显高于氟康唑,4 μg/mL和8 μg/mL咪康唑对pho4-/-均有明显的抑制作用 (见图1)。
2.3 罗丹明6G外排实验
加入葡萄糖供能后60 min,随着时间的延长,亲本菌和突变株对罗丹明6G的外转运增加。从加入葡萄糖15 min开始到90 min,PHO4敲除菌对罗丹明6G的外转运能力低于亲本菌SN250,PHO4敲除菌中药物外排泵活性低于SN250 (见图2)。
2.4 亲本菌SN250和PHO4敲除菌中耐药相关基因的表达水平
RT-PCR实验结果显示:PHO4缺失菌中多药耐药基因MDR1,CDR1的转录水平均高于亲本菌SN250。唑类药物的作用靶酶羊毛甾醇14α-去甲基化酶的编码基因ERG11在亲本菌SN250及突变株中的转录水平无明显差异 (见图3)。
2.5 H2O2对菌株生长的影响
生长曲线实验表明,16 μg/mL H2O2对PHO4基因缺失菌的生长有明显的抑制作用,PHO4基因的缺失降低了白念珠菌对H2O2的耐受能力 (见图4)。
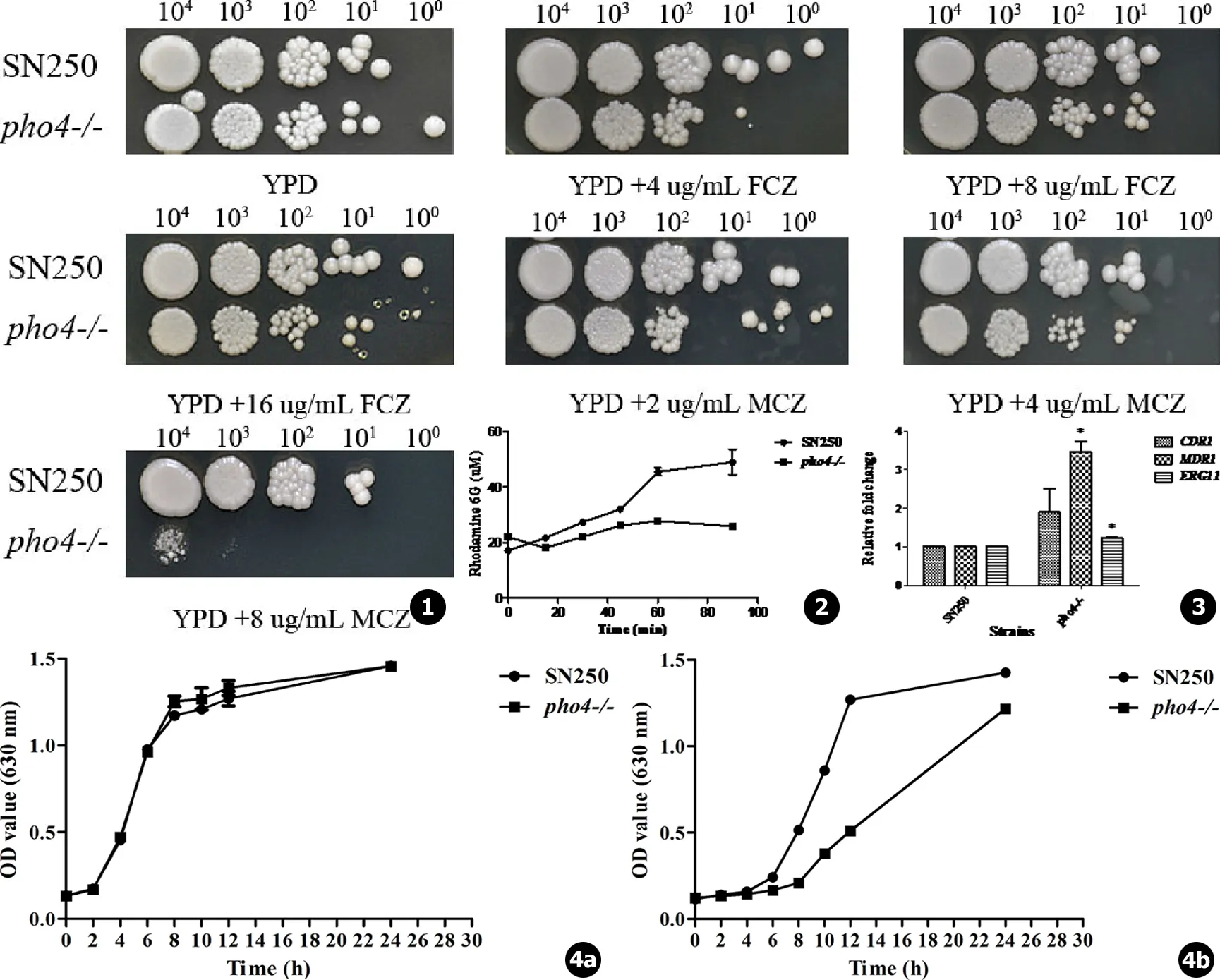
图1 点板实验考察菌株在不同浓度氟康唑和咪康唑作用下的生长差异 图2 考察SN250和pho4-/-对罗丹明6G的外排能力 图3 SN250和pho4-/-中CDR1,MDR1和ERG11的表达 图4 生长曲线结果:a.不加药对照组,b.16 μg/mL过氧化氢实验组
3 讨 论
目前,临床上广泛应用的抗真菌药物的耐药现象日渐严重。白念珠菌产生耐药现象的原因复杂,耐药机制与多种因素有关。近年来,关于转录因子参与耐药相关基因表达的调控逐渐深入,从分子水平给出了解决真菌耐药问题的新途径。
转录因子Pho4对白念珠菌在缺乏磷酸盐的环境中生长是必须的,PHO4突变株在磷酸盐缺乏的条件下发生广泛的菌丝生长和显著的毒力增加[8]。另有研究结果显示,转录因子Pho4介导菌株对亚砷酸盐的反应,但并未有该转录因子参与耐药相关调节的报道。本研究应用经典的微量液基稀释法对16株转录因子基因缺失菌的药物敏感性进行了初步筛选,发现PHO4基因缺失菌对氟康唑的敏感性有明显升高,揭示其可能参与了白念珠菌耐药性的调控。Spot assay实验在固体YPD培养基中检测突变株对氟康唑,咪康唑的敏感性,发现缺失PHO4的白念珠菌对咪康唑的敏感性高于氟康唑。氟康唑和咪康唑作为临床常用的抗白念珠菌感染药物,均通过影响真菌细胞膜重要成分麦角甾醇的生物合成,即抑制ERG11编码的羊毛甾醇14α-去甲基化酶发挥药理作用。为进一步探究PHO4参与调控耐药的分子机制,通过RT-PCR实验考察了ERG11的转录水平,并未发现PHO4缺失后显著影响ERG11的表达。而罗丹明外排实验显示,与亲本菌SN250相比,PHO4缺失菌对罗丹明6G的外排能力减弱,与其对唑类药物的敏感性增加结果一致,但PHO4缺失菌中MDR1和CDR1的转录水平反而有增加。
为什么多药耐药基因表达增加,但药物外排能力却下降?为进一步探索其机制,本研究进一步考察了缺失菌的抗应激能力。
通过考察菌株在含H2O2培养基中的生长曲线,比较PHO4缺失菌与亲本菌的敏感性,结果显示PHO4缺失菌对H2O2的敏感性显著增加,表明其抵抗氧化应激的能力下降。过氧化氢、金属和非金属盐、温度变化、渗透压、营养物质缺乏、药物作用等都是刺激白念珠菌产生应激反应的因素,而应激反应能力的改变也是药物敏感性改变的原因之一[9-10]。已有的研究结果揭示缺失转录因子Pho4的白念珠菌对亚砷酸盐和砷酸盐敏感,与白念珠菌中HOG通路的激活状态有关,该通路的激活参与调控砷酸盐脱毒相关基因的转录水平。HOG通路是白念珠菌应对外界压力,产生应激反应的主要通路[11-12]。缺失转录因子Pho4导致白念珠菌对砷酸盐敏感,HOG通路受到抑制,Pho4的表达量增多则会促进Hog1的磷酸化,激活HOG通路[13]。因此推测,PHO4缺失菌对唑类药物的敏感性增加也可能与其HOG通路被抑制,使其抗应激能力下降,导致药物外排能力减弱有关。白念珠菌对药物敏感性的调节涉及多种机制,对于Pho4参与耐药调控的机制还有待于进一步研究。
[1] Kontoyiannis DP,Lewis RE.Antifungal drug resistance of pathogenic fungi[J].Lancet,2002,359(9312):1135-1144.
[2] Morschhauser J.The genetic basis of fluconazole resistance development inCandidaalbicans[J].Biochim Biophys Acta,2002,1587(2-3):240-248.
[3] Morschhauser J.Regulation of multidrug resistance in pathogenic fungi[J].Fungal Genet Biol,2010:47(2):94-106.
[4] Coste AT,Karababa M,Ischer F,et al.TAC1,transcriptional activator ofCDRgenes,is a new transcription factor involved in the regulation ofCandidaalbicansABC transportersCDR1 andCDR2[J].Eukaryot Cell,2004,3(6):1639-1652.
[5] Znaidi S,Weber S,Al-Abdin OZ,et al.Genomewide location analysis ofCandidaalbicansUpc2p,a regulator of sterol metabolism and azole drug resistance[J].Eukaryot Cell,2008,7(5):836-847.
[6] Sasse C,Schillig R,Reimund A,et al.Inducible and constitutive activation of two polymorphic promoter alleles of theCandidaalbicansmultidrug efflux pumpMDR1[J].Antimicrob Agents Chemother,2012,56(8):4490-4494.
[7] Sellam A,Tebbji F,Nantel A.Role of Ndt80p in sterol metabolism regulation and azole resistance inCandidaalbicans[J].Eukaryot cell,2009,8(8):1174-1183.
[8] Romanowski K,Zaborin A,Valuckaite V,et al.Candidaalbicansisolates from the gut of critically ill patients respond to phosphate limitation by expressing filaments and a lethal phenotype[J].PloS One,2012,7(1):e30119.
[9] Smith DA,Nicholls S,Morgan BA,et al.A conserved stress-activated protein kinase regulates a core stress response in the human pathogenCandidaalbicans[J].Mol Biol Cell,2004,15(9):4179-4190.
[10] Alonso-Monge R,Navarro-Garcia F,Roman E,et al.The Hog1 mitogen-activated protein kinase is essential in the oxidative stress response and chlamydospore formation inCandidaalbicans[J].Eukaryot Cell,2003,2(2):351-361.
[11] Herrero-de-Dios C,Alonso-Monge R,Pla J.The lack of upstream elements of the Cek1 and Hog1 mediated pathways leads to a synthetic lethal phenotype upon osmotic stress inCandidaalbicans[J].Fungal Genet Biol,2014,69:31-42.
[12] Monge RA,Roman E,Nombela C,et al.The MAP kinase signal transduction network inCandidaalbicans[J].Microbiology,2006,152(Pt 4):905-912.
[13] Urrialde V,Prieto D,Pla J,et al.The Pho4 transcription factor mediates the response to arsenate and arsenite inCandidaalbicans[J].Front Microbiol,2015,6:118.
[本文编辑] 卫凤莲
Transcription factor Pho4 is involved in the regulation of drug susceptibility ofCandidaalbicans
QIN Yu-lin,XU Hong-tao,ZHANG Lu-lu,ZHANG Jin-yu,JIANG Yuan-ying,CAO Yong-bing
(CenterforNewDrugResearch,CollegeofPharmacy,TheSecondMilitaryMedicalUniversity,Shanghai200433,China)
Objective To study the influence ofCandidaalbicanstranscription factors (TFs) on drug susceptibility and the relevant regulating mechanisms,a screening of a TF deletion mutant library had been conducted.Methods The broth microdilution method and spot assay were used to determine the susceptibility of TF deletion strains.The expression of multidrug resistance genesMDR1,CDR1 andERG11 were examined by real-time PCR,and the analysis of rhodamine 6G efflux was performed to evaluate the efflux pump activity.Results The measurement of drug minimal inhibitory concentration and spot assay indicated an increase of susceptibility to fluconazole and miconazole inPHO4 deleted mutant compared to the parental strain.Although the mutant had a higher expression of the drug resistance genes,the amount of rhodamine 6G efflux and the oxidative stress resistance of it were lower than the parental strain.Conclusion Deletion ofPHO4 inC.albicansmight cause a decrease in oxidative stress resistance and drug efflux ability,finally result in hypersusceptibility to antifungal drugs.
Candidaalbicans;transcription factor;drug susceptibility;drug efflux
国家自然科学基金 (812735560),国家重点基础研究973计划 (2013CB531600)
秦玉璘,女 (汉族),硕士研究生在读.E-mail:1257305289@qq.com
曹永兵,E-mail:ybcao@vip.sina.com;姜远英,E-mail:13761571578@163.com
R 379.4
A
1673-3827(2016)11-0065-05
2016-02-27

