转录激活因子3对绿脓杆菌致急性肺损伤小鼠肺泡灌洗液炎症因子的影响
吴秀琳 李明霞 蔡俊 钱斓兰 郭亮 吴学玲 陈复辉
·论著·
转录激活因子3对绿脓杆菌致急性肺损伤小鼠肺泡灌洗液炎症因子的影响
吴秀琳1,6李明霞2蔡俊3钱斓兰4郭亮4吴学玲5陈复辉6
目的探讨转录激活因子3(ATF3)对绿脓杆菌致急性肺损伤(ALI)小鼠肺泡灌洗液炎症因子的影响。方法以荧光标记的绿脓杆菌(PA)(1.5×108CFU/ml,50 μl)经鼻滴入C57BL/6野生型和ATF3敲基因小鼠气管构建急性肺损伤模型;ELISA检测WT小鼠和ATF3-KO小鼠肺泡灌洗液中前炎症因子白介素-1β(IL-1β)、白介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)浓度。结果经鼻滴入绿脓杆菌6 h后小鼠肺组织病理检测表现为:中性粒细胞大量浸润、肺泡结构破坏、肺泡出血以及肺间质水肿,证实成功构建了经鼻滴入绿脓杆菌(PA)诱导的急性肺损伤模型。野生型小鼠在绿脓杆菌滴入后肺泡灌洗液中IL-1β的浓度于3、6、12和24 h时分别为(198.36±20.85)pg/ml,(131.93±8.23) pg/ml,(130.10±15.65) pg/ml,(67.04±2.77) pg/ml;肺泡灌洗液中IL-6的浓度于3、6、12和24 h时分别为(1 657.59±77.13) pg/ml,(1 232.78±31.85) pg/ml,(103.33±1.75) pg/ml,(24.44±5.79) pg/ml;肺泡灌洗液中TNF-α的浓度于3 h,6 h,12 h和24 h时分别为(542.12±49.12) pg/ml,(347.89±34.38) pg/ml,(42.23±9.63) pg/ml,(19.45±3.23 )pg/ml。野生型小鼠急性肺损伤小鼠肺泡灌洗液中IL-1β、IL-6、TNF-α浓度均于3 h表达最高,故选择3 h时相点对敲基因小鼠进行检测,ATF3敲基因小鼠在绿脓杆菌滴入后3 h时肺泡灌洗液中炎症因子IL-1β、IL-6、TNF-α的浓度分别为(321.25±7.81) pg/ml、(2 479.69±127.4) pg/ml、(840.75±22.97) pg/ml,表达明显高于野生型小鼠急性肺损伤组及对照组,均存在显著差异(P<0.05)。结论ATF3对绿脓杆菌致急性肺损伤小鼠的炎症反应有抑制作用。
转录激活因子3; 绿脓杆菌; 急性肺损伤; 促炎因子
急性肺损伤/急性呼吸窘迫综合征(acute lung injury/acute respiratory distress syndrome, ALI /ARDS)是脓毒血症、爆发性流感、严重急性呼吸综合征(severe acute respiratory syndrome, SARS)、重症肺炎等疾病的主要死亡原因[1]。其中绿脓杆菌致急性肺损伤的发病率较高。近年来虽然在气道管理和保护性机械通气策略等方面有了长足的进步,其病死率仍在40%左右。因此对ALI/ARDS发病机制及其防治的研究具有重要的临床意义。
ARDS是由炎症失控所致的临床危重症疾病,表现为急性呼吸困难,低氧血症和非心源性肺水肿。但其发病机制尚不完全明确。研究表明巨噬细胞产生的转录激活因子3(ATF3)可抑制中心粒细胞在肺内的迁移,其作用的发挥可能是通过Tiam2途径[2]。在非感染性疾病,如呼吸机相关肺损伤(ventilator induced lung injury, VILI)中,ATF3通过降低炎症反应对肺损伤有保护作用[3],证实ATF3对炎症反应有“刹车”作用,是TLR4炎症反应中的重要的负性调控基因。本课题组前期实验发现LPS腹腔注射后2 h,野生型小鼠ATF3 mRNA表达明显增加,因此推测ATF3在细菌致急性肺损伤中亦可能起一定的保护作用。因此本研究采用绿脓杆菌致急性肺损伤模型,探讨ATF3在绿脓杆菌致急性肺损伤小鼠中的保护作用及可能机制,旨在为ARDS/ALI的发病机制提供理论依据,并提供新的可能的治疗靶点。
材料与方法
一、 实验材料
荧光标记的绿脓杆菌由复旦大学中山医院呼吸科宋元林教授赠予。C57BL/6(17.8~26.25 g)小鼠,SPF级,购于第三军医大实验动物中心。ATF3敲基因小鼠(18.9~24.91 g)经美国俄亥俄州立大学Tsonwin Hai教授同意由武汉大学模式动物协同创新中心李红良教授赠送,饲养于第三军医大学新桥医院动物中心。适应3~4 d,按照随机数字表法随机分组。将小鼠随机分为4组,每组20只野生型小鼠对照组(WC组,即给予野生型小鼠生理盐水)、野生型小鼠急性肺损伤组(WA组,即给予野生型小鼠经鼻滴入绿脓杆菌)、ATF3敲基因小鼠对照组(KC组,即给予敲基因小鼠生理盐水)及ATF3敲基因小鼠急性肺损伤组(KA组,即给予敲基因小鼠经鼻滴入绿脓杆菌)。PA给予后0 h、3 h、6 h、12 h及24 h(每个时相点5只小鼠)处理小鼠。
二、研究方法
1. 急性肺损伤小鼠模型的建立及实验设计
①配制绿脓杆菌菌液:将原始菌种从-80 ℃冰箱取出解冻后接种于哥伦比亚血平板,普通三区划线后放置于37 ℃孵箱中24 h后长出大量菌落。用接种环取适量1~2个菌落置于无菌生理盐水中,用DL-ZD1浊度计调至0.5个麦氏单位,相当于1.5×108cfu/ml;②将小鼠置于秤盘中称重;③麻醉小鼠:小心打开乙醚瓶口,取出一朵医用棉球并用乙醚沾湿,置于密闭的烧瓶内,将小鼠放入烧瓶内约1 min,小鼠被麻醉后取出小鼠,进行后续滴鼻操作。在用乙醚麻醉的过程中,注意掌握麻醉时间,若麻醉时间过短则在后续操作过程中小鼠易醒,若时间过长则小鼠易死;④绿脓杆菌/生理盐水滴鼻:小鼠用乙醚麻醉后,左手提起小鼠,头部垂直向上,右手用10 μl移液器将绿脓杆菌菌液(以1.5×108cfu/ml的浓度)或生理盐水共50 μl经鼻滴注至肺内,滴注过程中可见小鼠鼻孔处有气泡产生,但嘴内无液体流出,表明绿脓杆菌经过呼吸道到达小鼠肺内;⑤麻醉小鼠:绿脓杆菌作用实验设置时间后,左手拇指和食指抓住颈部皮肤,固定并提起小鼠头部,小指夹住尾巴,以45 ℃方向进针进行戊巴比妥250 mg/kg腹腔注射麻醉小鼠,小鼠皮肤较薄,在注射时注意观察液体是否外漏;⑥肺泡盥洗:待麻醉成功后,将小鼠固定于板上,解剖颈部暴露气管,在气管上端剪一小口,置入气管导管,用1 ml生理盐水反复盥洗3次,留取灌洗液约0.7~0.8 ml左右于EP管中,做好标记,置于-80 ℃冰箱备用。收集的肺泡灌洗液用于检测炎症因子IL-1β、IL-6和TNF-α的表达;⑦收集标本:固定小鼠于板上,打开胸腔,暴露肺脏组织,小心取下肺脏组织,右上肺用于提取蛋白,左肺用于提取RNA。其余肺组织石蜡包埋及切片,HE染色。
2. 小鼠肺组织病理学检查:步骤同前。肺损伤评分按照以下三项标准进行: ①肺泡和间质水肿;②肺泡出血;③中性粒细胞浸润或聚集。 每项标准又分四个等级:0=正常,1=轻度变化,2=中度变化,3=重度变化。最终的肺损伤得分为:三项标准评分的总和(总分为9)。ELISA检测肺泡灌洗液中TNF-α和IL-1β、IL-6表达(按照试剂盒说明进行)
三、统计学方法
运用SPSS13.0统计软件进行数据分析。所有数据均以均数±标准误表示。用单因素方差分析进行多组间的比较,组间的两两比较采用q检验。P<0.05为差异,有统计学意义。
结 果
一、肺组织病理变化
肺组织切片HE染色病理镜检结果显示,在WT小鼠及ATF3-KO小鼠吸入生理盐水组的肺泡间隔无明显增厚,无明显中性粒细胞浸润。在吸入绿脓杆菌后6 h后,WT小鼠吸入绿脓杆菌组及ATF3-KO小鼠肺组织出现典型急性肺损伤病理变化,表现为中性粒细胞大量浸润、肺泡结构破坏、肺泡出血以及肺间质水肿。按照肺组织损伤病理评分,显示WA组的得分要低于KA组,提示ATF3-KO肺组织病变程度较WT小鼠组明显加重,见图1。
二、绿脓杆菌致WT小鼠急性肺损伤小鼠肺泡灌洗液中前炎症因子IL-1β、IL-6及TNF-α的表达
结果显示,野生型小鼠在绿脓杆菌滴入后肺泡灌洗液中IL-1β的浓度于3 h,6 h,12 h和24 h时分别为198.36±20.85 pg/ml,131.93±8.23 pg/ml,130.10±15.65 pg/ml,67.04±2.77 pg/ml;肺泡灌洗液中IL-6的浓度于3 h,6 h,12 h和24 h时分别为1 657.59±77.13 pg/ml,1 232.78±31.85 pg/ml,103.33±1.75 pg/ml,24.44±5.79 pg/ml;肺泡灌洗液中TNF-α的浓度于3 h,6 h,12 h和24 h时分别为542.12±49.12 pg/ml,347.89±34.38 pg/ml,42.23±9.63 pg/ml,19.45±3.23 pg/ml,见图2。
三、ATF3对绿脓致急性肺损伤小鼠肺泡盥洗液前炎症因子的影响
野生型小鼠在绿脓杆菌滴入后肺泡灌洗液中IL-1β、IL-6、TNF-α的浓度分别均于3 h表达最高,故选择3 h时相点对敲基因小鼠进行检测。ATF3敲基因小鼠在绿脓杆菌滴入后3 h时肺泡灌洗液中炎症因子IL-1β、IL-6、TNF-α的浓度分别为321.25 pg/ml±7.81、2 479.69 pg/ml±127.4、840.75 pg/ml±22.97,表达明显高于野生型小鼠急性肺损伤组(WA)及对照组(WC、KC组),即ATF3敲基因急性肺损伤组(KA组)炎症因子表达明显高于野生型小鼠急性肺损伤组及对照组,存在显著差异(P<0.05),见图3。
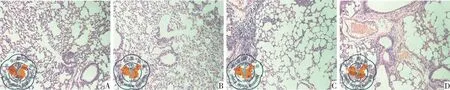
图1 小鼠肺病理学检查(HE×100);注:A为WT小鼠滴入生理盐水(WC组);B为WT小鼠滴入绿脓杆菌(WA组);C为KO小鼠滴入生理盐水(KC组);D为KO小鼠滴入绿脓杆菌(KA组)
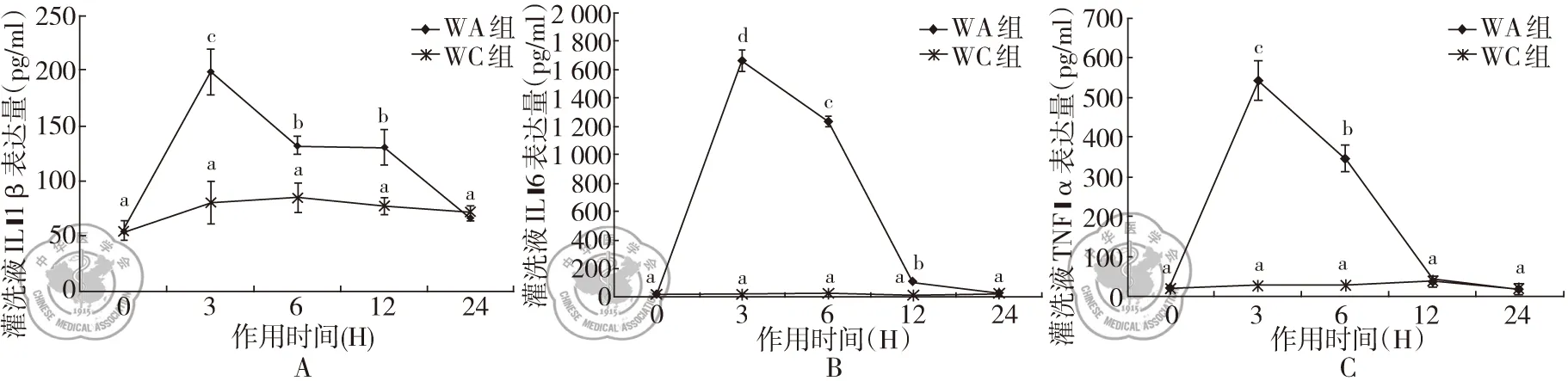
图2 野生型小鼠吸入生理盐水和绿脓杆菌肺泡灌洗液炎症因子IL-1β、IL-6及TNF-α表达时间梯度;注:a、b、c、d:P<0.05
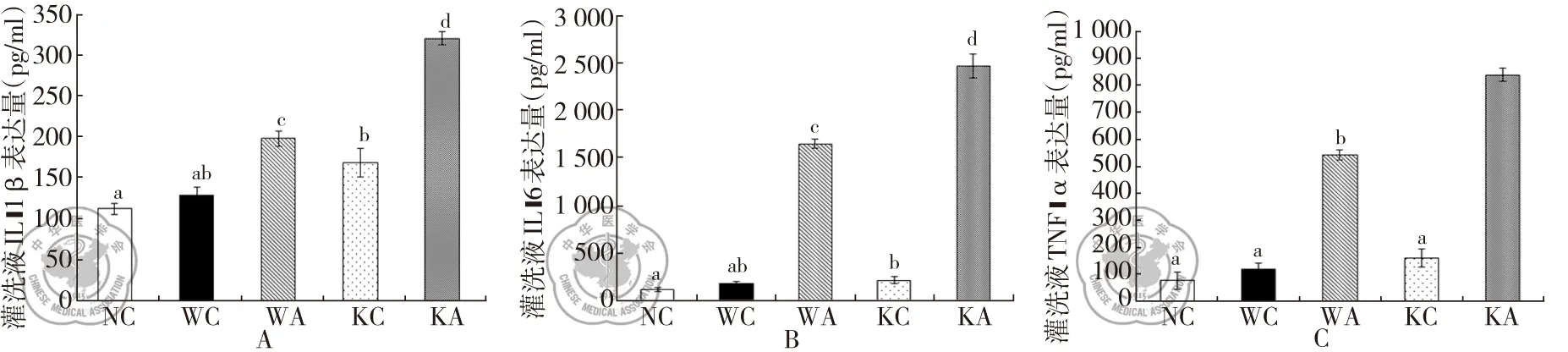
图3 ATF3对绿脓杆菌诱导的肺泡灌洗液炎症因子IL-1β、IL-6及TNF-α表达的影响;注:a、b、c、d:P<0.05
讨 论
ALI/ARDS的发病机制十分复杂,涉及环节多,受损的靶细胞多,其中炎症反应失控是其本质。参与炎症反应的细胞主要有巨噬细胞、中性粒细胞(polymorphonuclear, PMN)[4-5]。巨噬细胞是肺部防御病原微生物和肺损伤的第一道防线,是ALI早期肺部炎症反应的“导火索”[6]。PMN在炎症组织的过度募集和伴随过度激活、持续存在是导致肺内失控性炎症反应的关键环节[7]。尽管ALI/ARDS可发生在白细胞减少的患者,诸多试验证实PMN在肺内的募集是启动绝大多数ARDS的早期和重要事件及造成过度炎症反应的“元凶”[8]。而氧化应激和Toll样受体4(toll like receptor 4, TLR4)信号通路是急性肺损伤发生发展的关键途径[9]。
ATF3属于ATF/CREB家族成员,是一个应激反应诱导的快反应基因,广泛参与多种细胞活动的调控,如炎症应答、氧化应激、细胞凋亡和免疫调节等,与炎症、肿瘤、创伤、缺血缺氧、缺血灌注损伤发生等关系密切[8-12]。LPS刺激下ATF3敲基因小鼠巨噬细胞释放多种炎症因子量明显增加,表明ATF3对TLR4介导的信号通路有负调控作用[13-14]。在巨噬细胞中,HDL诱导ATF3的生成,从而下调Toll样受体(TLR)诱导的各种炎症因子的表达,对“持续的过激的炎症反应”起到灭火的作用[15]。ATF3对VILI亦有保护作用,ATF3通过降低机械通气产生的环切力诱导的炎症反应对肺损伤有保护作用,能抗衡环切力和高通气带来的炎症[3]。再次证实了ATF3对炎症反应有“刹车”作用,是TLR4炎症反应中的重要的负性调控基因。
前期预实验发现LPS腹腔注射后,ATF3 mRNA及蛋白表达 在2 h其mRNA水平明显升高,其6 h、12 h、24 h虽下降,但仍高于正常水平。这一表达模式与文献报道的LPS所致肺部炎症反应时相点相一致[16]。基于文献报道和前期实验结果,推测上调ATF3的表达可能对急性肺损伤有保护作用。
为进一步评价ATF3对绿脓杆菌诱导的ALI小鼠的作用,比较了WT小鼠和ATF3-KO小鼠组的肺组织病理变化及肺泡灌洗液中炎症因子IL-1β、IL-6、TNF-α水平。本研究发现WT小鼠及ATF3-KO小鼠吸入绿脓杆菌6h后均出现典型的ALI典型病变,表现为PMN大量浸润、肺泡结构破坏、肺泡出血以及肺间质水肿,ATF3-KO小鼠肺组织病变程度重于WT小鼠。ATF3-KO小鼠肺泡灌洗液中IL-1β、IL-6、TNF-α等炎症因子明显增高,于3h达高峰,且明显高于WT小鼠及对照组的表达。上述研究结果与文献报道相一致[17-18]。说明本研究中采用滴入绿脓杆菌(0.5个麦氏单位,相当于1.5×108CFU/ml)菌悬液诱导建立的ALI模型是成功的。这一研究结果表明,ATF3能够抑制炎症因子在绿脓杆菌诱导的ALI小鼠肺泡灌洗液中的表达,证实ATF3对绿脓杆菌致ALI的肺泡炎症反应可能有负性调控作用。
以上实验结果表明,ATF3对绿脓杆菌诱导的ALI具有保护作用。但目前对于ATF3调控ALI的机制尚不清楚。Gilchrist等[19]使用基因芯片技术分析LPS诱导巨噬细胞TLR4/NF-κB通路活化的转录谱,发现ATF3的mRNA转录活性明显升高。Nguyen等[20]证实了ATF3是通过TLR4下游的JNK/c-jun信号通路被诱导表达上调的。鉴于以上结果和文献报道,推测TLR4/NF-κB信号通路可能是ATF3负性调控ALI炎症损伤的机制之一,但尚有待进一步研究证实。
综上所述,本研究证实了ATF3对绿脓杆菌诱导的ALI有保护作用,对其过激炎症有负性调控作用。这些结果提示上调ATF3的表达有望成为治疗ALI的潜在靶点。
1 Ware LB, Matthay MA. Alveolar fluid clearance is impaired in the majority of patients with acute lung injury and the acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2001, 163(6): 1376-1383.
2 Boespflug ND, Kumar S, McAlees JW, et al. ATF3 is a novel regulator of mouse neutrophil migration[J]. Blood, 2014, 123(13): 2084-2093.
3 Akram A, Han B, Masoom H, et al. Activating transcription factor 3 confers protection against ventilator induced lung injury[J]. Am J Respir Crit Care Med, 2010, 182(4): 489-500.
4 Tauber AI. Metchnikoff and rhe phagocytosis theory[J]. Nat Rev Mol Cell Biol, 2003, 4(11): 897-901.
5 Villalta PC, Rocic P, Townsley MI. Role of MMP2 and MMP9 in TRPV4-induced lung Injury[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 307(8): L652-L659.
6 Narasaraju T, Yang E, Samy RP, et al. Excessive neutrophils and neutrophil extracellular traps contribute to acute lung injury of influenza pneumonitis[J]. Am J Pathol, 2011, 179(1): 199-210.
7 Imai Y, Kuba K, Neely GG, et al. Identification of oxidative stress and Toll-like receptor signaling as a key pathway of acute lung injury[J]. Cell, 2008, 133(2): 235-249.
8 Hellmann J, Tang Y, Zhang MJ, et al. Atf3 negatively regulates Ptgs2/Cox2 expression during acute inflammation[J]. Prostaglandins Other Lipid Mediat, 2015, 116-117:49-56.
9 Wang Z, Xu D, Ding HF, et al. Loss of ATF3 promotes Akt activation and prostate cancer development in a pten knockout mouse model[J]. Oncogene, 2015, 34 (38): 4975-4984.
10 Pu H, Wang X, Su L, et al. Heroin activates ATF3 and CytC via c-Jun N-terminal kinase pathways to mediate neuronal apoptosis[J]. Med Sci Monit Basic Res, 2015, 21:53-62.
11 Ma S, Pang C, Song L, et al. Activating transcription factor 3 is overexpressed in human glioma and its knockdown in glioblastoma cells causes growth inhibition both in vitro and in vivo[J]. Int J Mol Med, 2015, 35(6): 1561-1573.
12 Park GH, Park JH, Song HM, et al. Anti-cancer activity of Ginger (Zingiber officinale)leaf through the expression of activating transcription factor 3 in human colorectal cancer cells[J]. BMC Complement Altern Med, 2014, 14: 408.
13 Whitmore MM, Iparraguirre A, Kubelka L, et al. Negarive regulation of TLR-signaling pathways by activating transcription factor-3[J]. J Immunol, 2007, 179(6): 3622-3630.
14 Suganaqmi T, Yuan X, Shimoda Y, et al. Activating transcription factor 3 constitutes a negative feedback mechanism that attenuates saturated Fattyacid/toll-like receptor 4 signaling and macrophage activation in obese adipose tissue[J]. Cire Res, 2009, 105(1): 25-32.
15 Moore KJ, Fisher EA. High-density lipoproteins put out the fire[J]. Cell Metab, 2014, 19(2): 175-176.
16 Hai T, Wolfgang CD, Marsee DK, et al. ATF3 and stress responses[J]. Gene Expr, 1999, 321-335.
17 邱海波, 杨毅, 周韶霞, 等. 核因子-κB在小鼠急性肺损伤中的作用及治疗干预研究[J]. 中国急救医学, 2003, 23(2): 63-66.
18 王晓龙, 周向东. 核转录因子-κB在慢性气道粘液高分泌大鼠肺组织中的表达及意义[J]. 中国呼吸与危重监护杂志, 2004, 3(2): 101-102.
19 Gilchrist M, Thorsson V, Li B, et al. Systems biology approaches identify ATF3 as a negative regulator of Toll-like receptor 4[J]. Nature, 2006, 441(7090): 173-178.
20 Nguyen CT, Kim EH, Luong TT, et al. TLR4 mediates pneumolysin- induced ATF3 expression through the JNK/p38Pathway in-infected RAW 264.7 cells[J]. Mol Cells, 2015, 38(1): 58-64.
(本文编辑:黄红稷)
ChenFuhui,Email:chenfuhui2006@126.com
Objective To study the effect of activating transcription factor 3(ATF3) on inflammation of pseudomonas aeruginosa -induced acute lung injury(ALI). Methods C57BL/6 wild and ATF3 knockout mice were lightly anesthetized by ether inhalation, and inoculated intranasally with PA (1.5×108CFU/ml,50 μl) (group ALI) or normal saline (group control) to establish ALI mouse model. The mice were sacrificed at 3, 6, 12, 24 h after PA challenge. The levels of tumor necrosis factor-α(TNF-α) , interleukin-6(IL-6) and Interleukin-1β(IL-1β) in Bronchoalveolar lavage fluid(BALF) were examined by ELISA. Results After 6 h of PA stimulation, the neutrophil infiltrate in lung tissue, destruction of alveolar structure, alveolar hemorrhage and pulmonary interstitial edema had established ALI mouse model successfully. IL-1β expression in WT mice BALF which inoculated intranasally with PA were 198.36±20.85 pg/ml, 131.93±8.23 pg/ml, 130.10±15.65 pg/ml, 67.04±2.77 pg/ml at 3 h, 6 h, 12 h, 24 h separately. The same with IL-6 were 1 657.59±77.13 pg/ml, 1 232.78±31.85 pg/ml, 103.33±1.75 pg/ml, 24.44±5.79 pg/ml at 3 h, 6 h, 12 h, 24 h separately, and TNF-α were 542.12±49.12 pg/ml, 347.89±34.38 pg/ml, 42.23±9.63 pg/ml, 19.45±3.23 pg/ml at 3 h, 6 h, 12 h, 24 h separately. The top expression of IL-1β, IL-6, TNF-α in BALF were 3 h after the WT stimulate with PA, then it was choosen that the 3 h point to check the KO mice. It was found that the IL-1β, IL-6, TNF-α expression in KO mice which were stimulate with PA were 321.25±7.81 pg/ml, 2 479.69±127.4 pg/ml, 840.75±22.97 pg/ml separately. The concentration of TNF-α, IL-6 and IL-1β in BALF from ATF3 knock out acute lung injury mice were increased compared with that of ATF3 wild type acute lung injury mice (P<0.05). Conclusion ATF3 inhibites the inflammation of pulmonary of PA-induced acute lung injury.
ATF3; Pseudomonas aeruginosa; Acute lung injury; Pro-inflammatory factor
10.3877/cma.j.issn.1674-6902.2016.05.003
国家自然科学基金资助项目(81270130)
400016 重庆,武警重庆总队医院老年科1、中心实验室2、检验科3400037 重庆,第三军医大学新桥医院呼吸科4200127 上海,上海交通大学医学院仁济医院呼吸科5150001 哈尔滨,哈尔滨医科大学附属第二医院呼吸科6
陈复辉,Email:chenfuhui2006@126.com
R563
A
2016-09-02)
Effects of activating transcription factor 3 on lung inflammation of pseudomonas aeruginosa-induced acute lung injuryWuXiuling1,6,LiMingxia2,CaiJun3,QianLanlan4,GuoLiang4,WuXueling5,ChenFuhui6.1DepartmentofGeriatric,2CentralLaboratory,3Clinicallaboratory,ChongqingArmedCropsPloiceHospital,Chongqing400016,China;4DepartmentofRespiration,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China;5DepartmentofRespiration,RenjiHospital,ShanghaiJiaotongUniversitySchoolofMedicne,Shanghai200127,China;6DepartmentofRespiration,The2ndAffiliatedHospitalofHarbinMedicalUniversity,Harbin150001,China

