葡萄糖在聚对苯二胺/铜修饰电极上的电化学行为及测定
张文丽,李 容,常晓璇,苟兴龙
(西华师范大学 化学化工学院,四川 南充 637002)
葡萄糖在聚对苯二胺/铜修饰电极上的电化学行为及测定
张文丽,李 容*,常晓璇,苟兴龙*
(西华师范大学 化学化工学院,四川 南充 637002)
在静态法合成聚对苯二胺纳米片的基础上,经一步水热将铜微球均匀锚定于其上,成功合成了具有良好导电性、大比表面积、大孔径和孔容的铜/聚对苯二胺(Cu/PpPD)复合物,其独特的结构有利于电子的转移、活性位点的充分利用以及反应物、电解质等的输运。复合物对葡萄糖氧化表现出很高的电催化活性,在最优测试条件下,所构建的葡萄糖无酶传感器响应时间短(达到稳定电流的95%所需时间小于3 s)、线性范围宽(0.003~6.44 mmol/L)、灵敏度高(929 μA·mmol-1·L·cm-2)、检出限低(4.48×10-7mol/L)、重现性和选择性好,对血清样品进行检测,回收率为99.5%~101.1%。所制备Cu/PpPD复合物能实现对葡萄糖的简单、快速、灵敏、准确无酶检测,在临床医学上糖尿病人的早期诊断和治疗监测领域具有很好的应用前景。
聚对苯二胺;铜微球;葡萄糖;无酶传感器
葡萄糖是生物体内不可或缺的营养物质,是生命过程中重要的特征化合物。医学上,血糖水平是衡量新陈代谢能力和诊断糖尿病的重要指标;食品工业上,葡萄糖的测定是发酵控制的重要依据。因此,建立其快速、简便、准确的分析检测方法在临床和实际应用中具有重要意义。目前常用的分析方法为葡萄糖氧化酶(GOx)法,这种酶具有专一性高、反应速率快等优点,但易受温度、湿度、pH值、有毒物质等周围环境的影响,并且成本较高、不易储存、固定程序复杂[1-2],从而限制了该类酶传感器的应用和推广。因此,新型无酶葡萄糖传感器的研究成为该领域的热点。
无酶葡萄糖传感器的电极材料主要包括纳米金属(金[3]、银[4]、铜[5]、镍[6]、铂[7])及其氧化物(氧化铜[8]、氧化镍[9]等)。其中,纳米Cu因价格低、不易毒化而备受关注。然而,Cu纳米粒子表面能大,易团聚,致使该类电极材料的比表面积小、电催化活性低,对葡萄糖响应的线性范围窄,灵敏度与实际应用尚有差距。近年来,研究者将Cu纳米粒子负载于电活性位点多、稳定性高、成膜均匀的导电聚合物[10-11]上,以克服上述局限。聚苯胺及其衍生物所含氨基和独特的共轭系统与过渡金属间存在很强的配位作用,可使金属纳米粒子均匀稳定地负载于其上。刘有芹等[12]合成了聚邻苯二胺/氧化铜复合物,并成功用于H2O2检测。迄今为止,将纳米铜负载于聚对苯二胺纳米片用于葡萄糖无酶传感器的研究尚未见报道。本文用水热法将纳米铜粒子原位沉积于静态法合成的聚对苯二胺纳米片上,成功制备了聚对苯二胺/铜复合物,并研究了葡萄糖在该复合物修饰电极上的电化学行为,实现了对葡萄糖的高效、快速、定量检测。
1 实验部分
1.1 仪器与试剂
粉末X-射线衍射仪(XRD,Rigaku Ultima IV,Cu Kα radiation);扫描电镜(SEM,JEOL JSM-6510LV,日本电子株式会所);傅立叶变换红外光谱仪(FTIR,Nicolet 6700,美国赛默飞科技公司);全自动比表面和孔径分布分析仪(Autosorb-iQ,美国康塔仪器公司);电化学工作站(CHI618B,上海辰华仪器有限公司);高功率数控超声波清洗器(KQ-400DB,昆山超声仪器有限公司);台式高速离心机(TG16-WS,长沙湘仪离心机有限公司)。
对苯二胺(pPD)、过硫酸铵、醋酸铜、氯化钠、氢氧化钠、葡萄糖、多巴胺(DA)、尿酸(UA)、抗坏血酸(AA)、蔗糖、麦芽糖、乳糖(上海阿拉丁试剂有限公司);所有试剂均为分析纯,实验用水为二次蒸馏水。
1.2 材料制备
1.2.1 聚对苯二胺(PpPD)纳米片的合成 将3.0 g pPD超声溶于20 mL水后,在搅拌状态下向其中缓慢滴加12 mL 1.5 mol/L (NH4)2S2O4溶液,立即放入冰水浴中静置12 h,离心分离,所得深紫红色沉淀经水洗至中性后干燥,即得PpPD。
1.2.2 聚对苯二胺负载铜(Cu/PpPD)复合物的合成 将上述PpPD超声分散于10 mL水中,并向分散液(5 mg/mL)中加入2 mmol/L Cu(Ac)2,充分搅拌后再加入0.2 g AA,搅拌均匀后转入聚四氟乙烯内衬的水热反应釜中,120 ℃下反应10 h,自然冷却,离心分离,将黑色沉淀用水洗涤后干燥,得到Cu/PpPD复合材料。为了比较,在相同实验条件下合成单质铜。
1.3 玻碳电极的预处理及修饰电极的制备
将玻碳电极(GCE,Ф=4 mm)在3000#的金相砂纸(0.05 μm Al2O3抛光粉撒于其上)上打磨抛光成镜面,再依次用HNO3(1∶1)、无水乙醇、NaOH(10%)和水超声清洗5 min,最后用水洗净,室温下自然晾干备用。
将5 mg Cu/PpPD粉末超声分散于500 μL 0.02% Nafion的醇水溶液中(乙醇和水的体积比为4∶1),得到黑色均匀分散液,将9 μL分散液滴涂于预处理后的玻碳电极表面,自然晾干即制得Cu/PpPD/GCE修饰电极。
1.4 电化学测试
所有的电化学测试均在三电极系统中室温下进行,Cu/PpPD/GCE(或Cu /GCE,PpPD/GCE)为工作电极,饱和甘汞电极(SCE)为参比电极,铂电极(Pt)为辅助电极。在0.1~0.75 V电位范围内,用循环伏安法(CV)研究葡萄糖在不同电极上的电化学行为,线性扫描伏安法(LSV)考察葡萄糖在Cu/PpPD/GCE电极上的速控步,交流阻抗法(EIS)表征材料传输电荷的能力。在最佳实验条件下,采用计时电流法测定葡萄糖的线性范围、响应时间、稳定性和抗干扰性等。
俗话说:“兴趣是最好的老师。”因此,教师在小学阶段的数学课堂的教学活动中,应合理利用数字化的学习资源,将图片与文字进行结合,从而极大程度地激发学生对数学学科的兴趣,有利于学生对数学知识的接受。如教师在讲解“数字的乘除法”这一课时,由于学生的人生阅历有限,很难理解数学中抽象的数学知识,这时,教师可以利用数字化的信息资源进行一些知识的讲解, 利用数字化的资源将抽象的数学知识具体化,从而在一定程度上激发学生对数学知识的兴趣,从而高质量地完成教学活动[1]。
2 结果与讨论
2.1 材料的组成与结构表征


Fig.1 XRD patterns of PpPD,Cu and Cu/PpPD(A),and FTIR spectra of PpPD and Cu/PpPD(B)

图2 Cu(A),PpPD(B)和Cu/PpPD复合材料(C,D)的SEM图Fig.2 SEM images of the as-prepared Cu(A),PpPD(B),and Cu/PpPD(C,D)
借助SEM观察了PpPD、Cu以及Cu/PpPD复合材料的微观形貌。如图2A所示,单质Cu呈直径约1 μm的微球,但颗粒间存在较严重的团聚现象。PpPD呈厚度约为200 nm的纳米片,且随机堆积的纳米片构成了一个三维网络结构,有利于传质(如图2B)。图2C~D中可明显观察到铜微球均匀地负载于PpPD纳米片上,团聚程度较负载前有了很大改善,说明在PpPD与Cu间较强的配位作用下,Cu被成功锚定于PpPD纳米片上。
Cu的成功锚定对其团聚的抑制以及PpPD三维网络结构的引入势必影响材料的比表面积和孔结构,从而影响其电催化活性。为此,进一步测试了Cu单体与Cu/PpPD复合材料的吸/脱附等温曲线,数据显示,Cu/PpPD的平均孔径、总孔体积和比表面积分别为12.31 nm,0.072 cm3·g-1及16.12 m2·g-1;Cu的平均孔径、总孔体积和比表面积分别为7.78 nm,0.02 cm3·g-1,2.125 m2·g-1。表明Cu与PpPD复合后,其平均孔径、总孔体积和比表面积显著提高,有利于电催化过程中活性位点的充分暴露以及反应物和产物的快速输运。

图3 葡萄糖溶液在不同电极上的循环伏安图Fig.3 Cyclic voltammograms of different electrodes in 0.1 mol/L NaOH with the absence(1,2,3 and 4) and presence(1′,2′,3′ and 4′) of 2 mmol/L glucose1,1′:GCE ,2,2′:PpPD/GCE,3,3′:Cu/GCE,4,4′:Cu/PpPD/GCE;scan rate:50 mV·s-1
2.2 葡萄糖在Cu/PpPD/GCE修饰电极上的电化学行为

图4 Cu/PpPD/GCE(a)和Cu/GCE(b)的交流阻抗图Fig.4 Nyquist plots of Cu/PpPD/GCE(a)and Cu/GCE(b)
采用CV法研究了0.1 mol/L NaOH溶液中葡萄糖在Cu/PpPD/GCE修饰电极上的电化学行为,在相同条件下测试了葡萄糖在GCE,PpPD/GCE和Cu/GCE电极上的CV曲线。对比图3中曲线1、1′和2、2′可知,加入葡萄糖前后,GCE和PpPD/GCE电极上均无明显的氧化/还原峰,说明GCE和PpPD/GCE电极无催化氧化葡萄糖的性能。空白液中,Cu/GCE和Cu/PpPD/GCE电极上,分别在0.61 V和0.64 V 出现1个小而宽的还原峰,对应于Cu(Ⅱ)/Cu(Ⅲ)的氧化还原电对,与文献报道一致[18]。加入葡萄糖后,Cu/PpPD/GCE和Cu/GCE电极在0.6 V附近均出现一氧化峰,对应于Cu(Ⅲ)参与下葡萄糖被催化氧化为葡萄糖酸内酯[19],即:Cu(Ⅲ)+ Glucose+e→ Cu(Ⅱ)+ Gluconolactone,说明Cu/PpPD和Cu均可催化氧化葡萄糖。然而,Cu/PpPD/GCE电极上葡萄糖的氧化峰电流是Cu/GCE的2.5倍,表明Cu与PpPD复合后电催化氧化葡萄糖的能力有了大幅提高。这可能缘于复合后孔径和孔体积的增大有利于传质,比表面积的增大有利于活性位点与反应物的充分接触。另外,PpPD纳米片具有良好的导电性,Cu微球锚定于其上后构成一导电网络,更有利于电子的输运,从而使其电催化活性得到进一步提高。
为进一步定量考察Cu/GCE和Cu/PpPD/GCE电极上的电荷传递阻抗特性,用EIS分别测定了两电极在10 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]溶液中的交流阻抗行为。如图4所示,Cu/PpPD/GCE电极(曲线a)上的容抗弧半径比Cu/GCE电极(曲线b)小,说明Cu负载于PpPD纳米片后,复合物减小了对带负电的[Fe(CN)6]3-/[Fe(CN)6]4-电对的电子转移阻力,更有利于电化学反应的进行[20]。
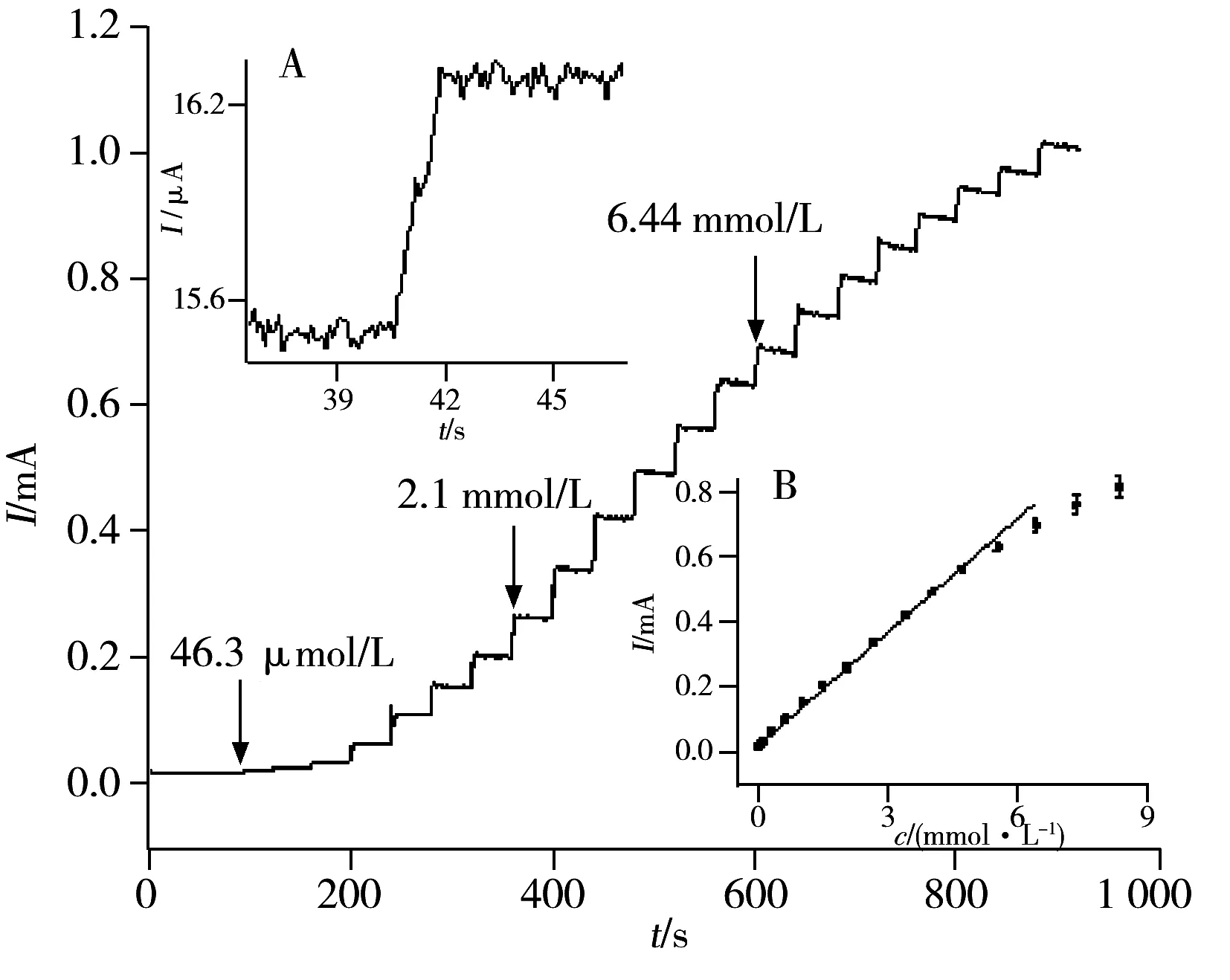
图5 Cu/PpPD/GCE电极上不同浓度葡萄糖的电流-时间响应曲线Fig.5 Amperometric response of Cu/PpPD/GCE electrode upon successive addition of glucose insert:A.response time of the Cu/PpPD/GCE electrode towards 3 μmol·L-1 glucose;B.relationship between current response and glucose concentration at Cu/PpPD/GCE;error bars indicate standard deviations of three measurements;0.1 mol/L NaOH solution,applied potential:0.6 V
在0.1 mol/L NaOH溶液中,用LSV考察了不同扫速对葡萄糖在Cu/PpPD/GCE电极上电化学行为的影响。实验表明,当扫速在10~190 mV/s范围时,随着扫速的不断增大,峰电位逐渐正移,峰电流逐渐增大,且峰电流与扫速呈良好的线性关系,线性方程为Ipa(A)=8.742×10-5+8.988×10-4v,r=0.998,说明葡萄糖在Cu/PpPD/GCE上的电化学反应受吸附控制[21]。
2.3 葡萄糖在Cu/PpPD/GCE修饰电极上的定量检测
2.3.1 工作电位的选择 恒电位条件下检测葡萄糖的电流响应时,工作电位是重要的影响因素。实验研究了不同工作电位(0.2,0.3,0.4,0.5,0.55,0.6,0.65 V)下,葡萄糖在Cu/PpPD/GCE电极上的电流响应信号。结果显示,当工作电位由0.2 V增至0.6 V时,电流响应逐渐增强,继续增大至0.65 V时,响应信号的增幅相对减小且背景电流明显增大。由于在较高工作电位下,一些在低电位下稳定的物质可能被氧化,进而影响葡萄糖的检测[22]。故选择最佳工作电位为0.6 V。
2.3.2 线性范围与检出限 在最佳工作电位(0.6 V)下,向0.1 mol/L NaOH 溶液中依次加入已知浓度的葡萄糖,其响应电流随时间的变化曲线如图5所示。结果表明,随着溶液中葡萄糖浓度的增加,响应电流不断增大,在3 s内均可达到稳定电流的95%(图5插图A)。图5插图B显示,在0.003~6.44 mmol/L浓度范围内,响应电流与浓度呈良好的线性关系,线性方程为:Ipa(A)=1.85×10-5+0.116c(mol/L),r=0.999。灵敏度为929 μA·mmol-1·L·cm-2,检出限(S/N=3)为4.48×10-7mol/L。文献中报道的部分无酶葡萄糖传感器与本文传感器的主要参数列于表1。从表1可见,本文所合成Cu/PpPD复合材料对葡萄糖测定的线性范围、灵敏度、检出限和响应时间优于文献报道的铜及铜基复合材料,有望替代葡萄糖酶传感器,用于制备新一代无酶葡萄糖传感器。如前所述,Cu/PpPD无酶传感器优越的性能源于其大的比表面、孔径和孔体积以及良好的导电性。
2.3.3 重现性、稳定性与干扰实验 用同一支Cu/PpPD/GCE电极对葡萄糖溶液平行测定7次,相对标准偏差(RSD)为2.4%,用平行修饰的3支电极对同一葡萄糖溶液平行测定3次,RSD为2.6%,说明该修饰电极具有良好的重现性。将新制备的修饰电极在葡萄糖浓度为3 mmol/L的0.1 mol/L NaOH 溶液中用计时电流法连续测试5 400 s,电流损失不足3%,说明电极具有良好的稳定性。
表1 Cu/PpPD和其他铜/铜基无酶葡萄糖传感器的分析参数对比
Table 1 Performance comparison of the as-prepared Cu/PpPD and other Cu or Cu-based hybrids as nonenzymatic glucose sensor

ElectrodematerialLinearrange(mmol/L)Sensitivity(μA·mmol-1·L·cm-2)Detectionlimit(μmol/L)Responsetime(s)ReferenceCuNanoparticles0001~324605<10[5]Cu/Graphene~4515705<2[18]CuMembrane0001~6055506620011<5[19]Cu/MWCNTs05~7592220<1[23]Cu/RGO001~124476534<15[24]Cu/Graphene0005~1111310<3[25]Cu/ITO0001~05699405<3[26]Cu/N/Graphene0004~456855713<5[27]CuNanowires0005~60110016<2[28]Cu/PpPD0003~644929045<3Thiswork
为了研究该传感器的选择性,在最优实验条件下,考察了通常与葡萄糖共存于人类血清中的易氧化物质(如DA,UA,AA等)和常见的碳水化合物(如蔗糖、麦芽糖、乳糖等)对葡萄糖定量测定的影响。在0.1 mol/L NaOH溶液中,先加入2 mmol/L葡萄糖,再依次加入0.2 mmol/L DA、UA、AA、蔗糖、麦芽糖、乳糖和20 mmol/L NaCl,电流响应结果表明,上述物质的存在对葡萄糖的响应电流几乎无影响,说明Cu/PpPD/GCE构建的无酶传感器对葡萄糖的电催化具有专一性。值得一提的是,高浓度的NaCl也未对葡萄糖的响应电流造成影响,表明该无酶葡萄糖传感器具有很强的抗Cl-毒化能力。继多种干扰物加入后,再次加入2 mmol/L葡萄糖,响应电流和加入干扰物前相等,表明Cu/PpPD/GCE的抗干扰能力强,对葡萄糖检测具有良好的选择性。
2.4 实际样品分析
采用计时电流法对3份血清样品(家美体检医院提供)进行测定。在20 mL 0.1 mol/L NaOH 溶液中先加入100 μL血清,再加入已知浓度的葡萄糖标准液进行加标回收实验,测定结果如表2所示。Cu/PpPD/GCE传感器测得的每份血清样品中血糖浓度均与医用血糖仪检测结果一致,相对误差均低于±1%,且加标回收率为99.5%~101.1%,表明该无酶葡萄糖传感器具有较高的可靠性和准确性,该方法可用于生物样品中血糖浓度的定量检测。
表2 血清样品的检测及回收率测定结果
Table 2 Determination of the serum sample and its recovery test

SamplecGlu-metera(mmol/L)cCu/PpPD-sensor(mmol/L)Relativeerror(%)Added(mmol/L)Recovery(%)RSD(%,n=3)14343390901995132454537082011009183484757-08901101127
cGlu-meterandcCu/PpPD-sensorare the glucose concentration measured by a clinical glucometer and as-fabricated Cu/PpPD biosensor,respectively
3 结 论
本文借助铜与聚对苯二胺间的强配位作用,成功将铜微球锚定于聚对苯二胺纳米片上。所制备Cu/PpPD复合材料比铜单体具有更强的导电性,更大的比表面积、孔径和孔体积,导电性的增强有助于电子在被测物和电极间的快速转移,比表面积的增大有利于催化剂活性位点的充分暴露和利用,孔体积和孔径的增大有益于传质,电子结构和孔结构的改善使Cu/PpPD对葡萄糖氧化表现出很高的电催化活性。所构建的无酶葡萄糖传感器具有响应快、灵敏度高、线性范围宽、检出限低、抗干扰能力强、稳定性和重现性好、回收率高等特点,为葡萄糖的快速、简单、准确检测提供了一种有效的电化学方法,对临床医学上糖尿病的早期诊断和监测具有重要意义。
[1] Wang H W,Lang Q L,Li L,Liang B,Tang X J,Kong L R,Mascini M,Liu A H.Anal.Chem.,2013,85(12):6107-6112.
[2] Yang J,Jiang L C,Zhang W D,Gunasekaran S.Talanta,2010,82(1):25-33.
[3] Xia Y,Huang W,Zheng J F,Niu Z J,Li Z L.Biosens.Bioelectron.,2011,26(8):3555-3561.
[4] Ahmad M,Sun H Y,Hussain M,Karim S,Nisar A,Khan M.Electroanalysis,2015,27(6):1498-1506.
[5] Wu W P,Periasamy A P,Lin G L,Shih Z Y,Chang H T.J.Mater.Chem.A,2011,3(18):9675-9681.
[6] Niu X H,Lan M B,Zhao H L,Chen C.Anal.Chem.,2013,85(7):3561-3569.
[7] Sun Y L,Yang H Y,Yu X H,Sun Z H,Meng H W,Xu X H.RSCAdv.,2015,5(86):70387-70397.
[8] Huang J F,Zhu Y H,Yang X L,Chen W,Zhou Y,Li C Z.Nanoscale,2015,7(2):559-569.
[9] Li G H,Wang X W,Liu L,Liu R,Shen F P,Cui Z,Chen W,Zhang T.Small,2015,11(6):731-739.
[10] Wang C,Chen D J,Cheng L L,Chen Y Q,Chen W,Pan M.J.Biomed.Eng.(王沧,陈大竞,程丽玲,陈裕泉,陈玮,潘敏.生物医学工程学杂志),2013,30(5):1112-1116.
[11] Wang J J,Jiang J,Hu B,Yu S H.Adv.Funct.Mater.,2008,18(7):1105-1111.
[12] Liu Y Q,Le W Z,Xue F F,Yan Y,Xu L.Mater.Rev.(刘有芹,乐文志,薛峰峰,颜芸,徐莉.材料导报),2010,24(4):103-108.
[13] Yang S W,Ye C C,Song X,He L,Liao F.RSCAdv.,2014,4(97):54810-54818.
[14] Zhang Q Q,Li R,Zhang M M,Gou X L.ActaPhys.-Chim.Sin.(张晴晴,李容,张萌萌,苟兴龙.物理化学学报),2014,30(3):476-484.
[15] Yang L,Zhen S J,Liu Z D,Huang C Z.Anal.Methods,2014,6(14):5054-5058.
[16] Bulent Z,Nuran O P,Esma K.J.Appl.Polym.Sci.,2014,131(3):39864-36874.
[17] Peng Y G,Ji J L,Zhang Y L,Wan H X,Chen D J.Environ.Prog.Sustain.Energy,2013,33(1):123-130.
[18] Luo J,Jiang S S,Zhang H Y,Jiang J Q,Liu X Y.Anal.Chim.Acta,2012,709(1):47-53.
[19] Kumar T R,Babu K J,Dong J Y,Kimc A R,Kumar G G.RSCAdv.,2015,5(52):41457-41467.
[20] Xiong J,Li R,Zhu W Q,Han Y Y,He X Y.J.Instrum.Anal.(熊健,李容,朱伟琼,韩园园,何晓英.分析测试学报),2011,30(6):607-611.
[21] Wang X L,Liu E L,Zhang X L.Electrochim.Acta,2014,130:253-260.
[22] Lu P,Liu Q B,Xiong Y Z,Wang Q,Lei Y T,Lu S J,Lu L W,Yao L.Electrochim.Acta,2015,168:148-156.
[23] Zhao J,Wei L M,Peng C H,Su Y J,Yang Z,Zhang L Y,Wei H,Zhang Y F.Biosens.Bioelectron.,2013,47:86-91.[24] Wang Q,Wang Q,Li M,Szunerits S,Boukherrou R.RSCAdv.,2015,5(21):15861-15869.
[25] He Y P,Zheng J B.Anal.Methods,2013,5(3):767-772.
[26] Sun F,Li L,Liu P,Lian Y F.Electroanalysis,2011,23(2):395-401.
[27] Jiang D,Liu Q,Wang K,Qian J,Dong X Y,Yang Z T,Du X J,Qiu B J.Biosens.Bioelectron.,2014,54:273-278.[28] Fan Z J,Liu B,Liu X H,Li Z P,Wang H G,Yang S R,Wang J Q.Electrochim.Acta,2013,109:602-608.
Electrochemical Behavior and Determination of Glucose at Poly(p-phenylenediamine)/Cu Modified Electrode
ZHANG Wen-li,LI Rong*,CHANG Xiao-xuan,GOU Xing-long*
(College of Chemistry and Chemical Engineering,China West Normal University,Nanchong 637002,China)
Poly(p-phenylenediamine) nanosheets were first synthesized through oxidative polymerization ofp-phenylenediamine,and then used as the substrate for anchoring copper microspheres via a facile solvothermal route.The resultant copper/poly(p-phenylenediamine)(Cu/PpPD)composites possess good electrical conductivity,big specific surface area,large pore size and pore volume,which are beneficial for transfer of electrons,utilization of active sites and transportation of reactant and electrolyte.The as-prepared Cu/PpPD composites showed excellent electrocatalytic activity toward the direct oxidation of glucose in the absence of any enzymes.Under the optimal conditions,the Cu/PpPD-based enzymeless glucose sensor showed the advantages of short response time(i.e.,the current achieved 95% of the steady state value within 3 s),wide linear range(0.003-6.44 mmol/L),high sensitivity(929 μA·mmol-1·L·cm-2),low detection limit(4.48×10-7mol·L-1),good reproducibility and selectivity.In addition,the as-prepared Cu/PpPD-based enzymeless glucose sensor was successfully applied in the quantitative determination of glucose in real serum samples with recoveries of 99.5%-101.1%,which indicated it has a great prospect in clinical application.
poly(p-phenylenediamine);copper microsphere;glucose;non-enzyme sensor
2015-11-17;
2015-12-28
国家自然科学基金资助项目(21571148);四川省教育厅重点资助项目(13ZA0014)
10.3969/j.issn.1004-4957.2016.05.002
O657.1;TS245.4
A
1004-4957(2016)05-0508-06
*通讯作者:李 容,博士,副教授,研究方向:电化学,Tel:0817-2568081,E-mail:lirong406b@126.com 苟兴龙,博士,教授,研究方向:无机功能材料,Tel:0817-2568016,E-mail:gouxlr@126.com

