染铅大鼠脑组织JWA mRNA表达变化与氧化应激损伤的关系
任晓慧 张中伟 徐群英 李 伟 冯建高 任清风 李炜娟 肖元梅
(南昌大学公共卫生学院,江西 南昌 330006)
染铅大鼠脑组织JWA mRNA表达变化与氧化应激损伤的关系
任晓慧 张中伟 徐群英 李 伟 冯建高 任清风 李炜娟 肖元梅
(南昌大学公共卫生学院,江西 南昌 330006)
目的 探讨铅暴露对大鼠大脑皮质、小脑、海马组织JWA mRNA表达的影响及其与脑组织氧化应激损伤的关系。方法 40只刚断乳雄性SD大鼠,按体重随机区组法分为5组(对照组和4个乙酸铅剂量组),各组自由饮用不同浓度的乙酸铅溶液(0、100、200、400、800 mg/L)。连续染毒60 d后取大鼠脑组织,RT-PCR技术检测脑组织JWA mRNA的表达量,并测定脑组织铅含量、过氧化氢(H2O2)水平、丙二醛(MDA)及8-羟基脱氧鸟苷(8-OHdG)含量。结果 与对照组相比,各染铅组大鼠大脑皮质、小脑和海马组织JWA mRNA表达水平明显降低,而脑组织铅含量及H2O2、MDA及8-OHdG水平均增加(P<0.05);脑组织JWA mRNA的表达量与其铅含量、H2O2、MDA、8-OHdG水平呈负相关(P<0.05)。结论 饮水铅暴露可导致大鼠脑组织JWA mRNA的表达变化,并与脑组织氧化应激损伤密切相关。
JWA;脑组织;氧化应激
铅是一种广泛存在于环境中对人体没有任何生理功能、反而具有毒性的重金属元素,可造成多系统多器官损伤〔1〕。神经系统是铅毒性作用的重要靶器官,越来越多的研究表明铅毒性没有安全阈值〔2〕,低水平铅暴露对机体脑功能的影响已成为目前铅神经毒性研究关注的焦点,但铅毒性的确切机制至今尚不十分清楚。随着研究的进展,从自由基及其诱导的氧化应激损伤方面探讨铅毒性机制受到广泛关注。作为一种新的活跃的环境应答基因,JWA被证实参与多种环境因素(如热应激和氧化应激)的应答反应,在保护细胞免受氧化应激诱导的DNA损伤和细胞凋亡方面发挥关键作用〔3,4〕,但目前尚未见JWA在铅毒性中作用的相关报道。本文给予大鼠饮用不同剂量乙酸铅溶液后,通过RT-PCR技术检测其大脑皮质、小脑、海马组织中JWA mRNA的表达及其与脑组织氧化应激损伤的关系,为进一步探讨铅神经毒性机制提供依据。
1 材料与方法
1.1 主要试剂与仪器 三水合乙酸铅(分析纯,西陇化工厂);RNA提取试剂盒(Omega公司);引物(Invitrogen公司合成);逆转录及PCR试剂盒(美国Thermo公司);过氧化氢(H2O2)及丙二醛(MDA)测定试剂盒(南京建成生物工程研究所);8-羟基脱氧鸟苷(8-OHdG)测定试剂盒(上海研鑫生物科技有限公司);铅溶液标准物质(国家标准物质信息平台,标准号GBW08619);PCR扩增仪(美国 BIO-RAD);凝胶成像分析系统(美国Synoptics 公司);AA-6300C型石墨炉原子吸收分光光度计(日本岛津公司);722可见分光光度计(上海兴茂仪器公司)。
1.2 实验动物及处理 刚断乳雄性、健康SPF级SD大鼠40只,体重90~100 g〔购自北京维通利华实验动物有限公司,动物合格证号:SCXK(京)2012-0001〕,适应性喂养1 w后按体重随机区组法分为空白对照组和4个乙酸铅剂量组。采用自由饮水的方式进行染毒:空白对照组饮用去离子水,4个乙酸铅剂量组分别饮用不同浓度的乙酸铅溶液(100、200、400、800 mg/L),连续染毒60 d。最后一次染毒后第2天,称重并以60 mg/kg体重戊巴比妥钠腹腔注射麻醉动物,冰上迅速取出全脑,并用冰冷的生理盐水冲净血液后分离大脑皮质、小脑和海马,称重后置于液氮中保存备用。
1.3 检测指标及其方法
1.3.1 RT-PCR检测JWA mRNA表达 RNA提取试剂盒提取大鼠脑组织RNA,检测RNA纯度浓度后使用逆转录试剂盒进行逆转录反应(RT),PCR试剂盒进行聚合酶链式扩增反应(PCR)。程序:95℃预变性1~3 min,(95℃变性30 s,57℃退火30 s,72℃延伸1 min)×40个循环,72℃终延伸7 min。JWA上游引物5'TCCGTGCCTGGGATGATTTC3',下游引物5'GGCTCAGAAACCCAACGACT3',产物为165 bp;内参基因β-actin上游引物5'CTGTGTGGATTGGTGGCTCT3',下游引物5'GCTCAGTAACAGTCCGCCTA3',产物为133 bp。扩增产物经琼脂糖凝胶电泳后,用Bio-rad公司的Quantity One4.6.2凝胶分析软件分析JWA基因和内参β-actin基因条带光密度值(OD值),计算OD(JWA)/OD(内参)的比值作为JWA mRNA的相对表达量。
1.3.2 脑组织铅含量 脑组织经消化后用石墨炉原子吸收分光光度法测定其铅的含量,按国家标准规定的方法进行〔5〕。
1.3.3 脑组织H2O2、MDA及8-OHdG测定 在冰浴中用冰生理盐水将脑组织制成10%的组织匀浆,4℃ 4 500 r/min离心10 min后吸取上清液置于冰浴中待用。H2O2测定采用钼酸铵法、MDA的测定采用TBA法、8-OHdG采用ELISA法测定,各指标的测定均按照试剂盒所示方法进行。
1.4 统计分析 采用SPSS13.0软件行单因素方差分析,指标间的关联用Pearson直线相关分析。
2 结 果
2.1 铅暴露对大鼠脑组织JWA mRNA表达的影响 大鼠染铅后,其大脑皮质、小脑、海马的JWA mRNA表达水平较对照组明显降低(均P<0.01);并随着饮水铅含量的升高,各脑组织JWA mRNA表达水平呈逐渐下降的趋势。见表1、图1。
2.2 染铅后各组大鼠脑组织铅含量的变化 染铅后,大鼠大脑皮质、小脑、海马铅的含量较对照组明显增加(P<0.01);随着饮水铅含量的升高,各脑组织铅含量逐渐升高,各剂量组间比较均具有统计学差异(P<0.05)。见表2。


组别大脑皮质小脑海马对照组1.626±0.3461.543±0.2641.203±0.079100mg/L组1.283±0.2051)1.307±0.1921)1.037±0.0881)200mg/L组1.232±0.1651)1.223±0.2301)0.931±0.1421)400mg/L组1.169±0.2811)1.161±0.1391)0.892±0.0961)2)800mg/L组0.952±0.0941)2)3)1.105±0.1031)0.834±0.1121)2)F值8.6165.89915.225P值<0.01<0.01<0.01
1)与对照组相比,2)与100 mg/L组比,3)与200 mg/L组比,4)与400 mg/L组比,均P<0.05;下表同

M:DNA marker;1~5泳道依次为对照组、100 mg/L组、200 mg/L组、400 mg/L组、800 mg/L组图1 JWA mRNA在铅暴露大鼠大脑皮质、小脑和海马中的表达


组别大脑皮质小脑海马对照组0.927±0.1952.508±0.0512.849±1.380100mg/L组1.560±0.0701)3.226±0.5081)4.254±0.5841)200mg/L组1.917±0.1331)2)3.294±0.5041)5.515±1.2791)2)400mg/L组2.681±0.4211)2)3)3.814±0.7641)2)6.785±0.8281)2)3)800mg/L组3.478±0.4831)2)3)4)4.211±0.6991)2)3)8.457±0.9401)2)3)4)F值83.63010.50234.769P值<0.01<0.01<0.01
2.3 铅暴露对各组大鼠脑组织H2O2水平、MDA及8-OHdG含量的影响 大脑皮质、小脑和海马H2O2水平、MDA及8-OHdG含量与对照组比较均增加(P<0.05);随着饮水铅含量的升高,各脑组织H2O2水平、MDA及8-OHdG含量均基本呈逐渐升高趋势,表明脑组织发生了明显的氧化应激反应及氧化损伤。见表3~表5。
2.4 大鼠脑组织JWA mRNA表达量与铅含量和氧化应激损伤的相关性分析 相关分析结果显示,大鼠染铅后,其大脑皮质、小脑、海马组织JWA mRNA的表达量与其组织的铅含量呈负相关关系,并与组织的H2O2水平和MDA、8-OHdG含量呈负相关(P<0.05)。见表6。
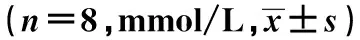

组别大脑皮质小脑海马对照组16.370±3.3329.203±0.57911.931±1.311100mg/L组20.025±2.2911)14.969±1.7121)13.108±2.072200mg/L组23.171±5.3211)15.514±1.9641)14.691±2.0641)400mg/L组25.490±8.9971)2)16.438±2.1081)15.351±2.9641)2)800mg/L组26.851±1.2921)2)17.380±2.5331)2)16.021±1.3411)2)F值5.65322.8845.381P值<0.01<0.01<0.01
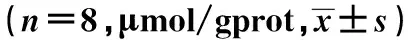

组别大脑皮质小脑海马对照组0.869±0.1690.612±0.1110.657±0.120100mg/L组1.086±0.3640.645±0.0961.059±0.2851)200mg/L组1.149±0.1400.815±0.1921)2)1.162±0.1641)400mg/L组1.315±0.4481)0.839±0.0931)2)1.189±0.3841)800mg/L组1.492±0.4611)2)0.984±0.0571)2)3)4)1.214±0.2061)F值3.73513.1326.838P值<0.05<0.01<0.01


组别大脑皮质小脑海马对照组21.126±3.65119.747±3.83523.564±4.093100mg/L组26.752±3.5151)24.751±5.3031)28.160±4.3811)200mg/L组27.107±6.6201)27.267±5.3611)30.117±3.4321)400mg/L组30.712±6.5141)30.263±4.9781)2)32.202±4.2891)2)800mg/L组33.055±7.5061)2)3)32.075±6.0041)2)3)34.060±4.0481)2)3)F值6.8469.07710.905P值<0.01<0.01<0.01
表6 各脑组织JWA mRNA表达量与铅含量和氧化应激损伤的相关系数(r值)

脑组织铅含量H2O2MDA8-OHdG大脑皮质-0.6322)-0.4752)-0.3261)-0.5562)小脑-0.4702)-0.5042)-0.5892)-0.5572)海马-0.6252)-0.5452)-0.6752)-0.7822)
1)P<0.05,2)P<0.01
3 讨 论
氧化应激是指机体在遭受各种有害刺激时,体内活性氧自由基(ROS)产生过多,超过机体的清除能力,氧化系统和抗氧化系统失衡,导致机体组织脂质过氧化水平升高,引起DNA氧化损伤,对机体造成损害〔6〕。H2O2是重要的活性氧之一,和体内其他活性氧自由基一样,攻击细胞膜上的多不饱和脂肪酸致脂质过氧化〔7〕。MDA是体内主要的脂质过氧化产物之一,是细胞和组织过氧化的终产物,能通过影响细胞膜上的蛋白质、酶或者受体功能发生改变而导致细胞损伤,严重时甚至导致细胞死亡〔8〕。8-OHdG是DNA氧化损伤的关键标志物,广泛应用于评价内源性DNA氧化损伤,并作为包括癌症在内的许多疾病的危险因子〔9〕。
越来越多的研究表明,氧化应激及其所致氧化损伤在铅的毒性机制中发挥重要作用。Shakoor等〔10〕用不同浓度铅溶液处理油菜幼苗后,其H2O2和MDA水平升高且植物生长受到抑制;流行病学研究结果显示,慢性铅暴露可致儿童尿8-OHdG水平升高〔11〕。本研究结果显示,大鼠饮用含铅溶液后,其脑组织H2O2、MDA和8-OHdG水平均显著升高,提示铅暴露可致大鼠脑组织处于氧化应激状态并致脑组织发生氧化损伤。
JWA是周建伟等〔12〕从原代培养的人气管和支气管上皮细胞中分离并克隆的细胞骨架样基因,该基因在生物进化上高度保守,广泛存在于各组织器官并分布于细胞质中。研究表明JWA可参与多种环境因素的应答反应,并在氧化应激诱导的DNA损伤中起关键作用〔3,4〕。目前对该基因在氧化应激损伤中的研究绝大部分是基于体外培养的细胞进行的,对整体动物的研究极少。此次研究结果显示,大鼠饮水暴露于铅2个月后,其脑组织JWA基因mRNA表达水平明显降低,并与组织的铅含量、H2O2、MDA、8-OHdG水平呈负相关关系,与上述研究结果不完全一致。众所周知,机体受神经、体液的调节及其他器官系统的影响,并处于复杂的生长和代谢内环境中,同时大多数环境因素对机体的影响是长期的、慢性的,这些都可能影响机体对外界有害物质的损伤效应。
综合以上研究结果,饮水铅暴露可致大鼠脑组织JWA 因mRNA表达降低,并与H2O2、MDA、8-OHdG水平密切相关,提示铅可通过诱导的脑组织氧化应激及损伤而影响JWA基因的表达。
1 Needleman H.Lead poisoning〔J〕.Annu Rev Med,2004;55:209-22.
2 Herbert N.Low level lead exposure:history and discovery〔J〕.Ann Epidemiol,2009;19(4):235-8.
3 Zhu T,Chen R,Li AP,etal.JWA as a novel molecule involved in oxidative stress-associated signal pathway in myelogenous leukemia cells〔J〕.J Toxicol Environ Health(Part A),2006;69(15):1399-411.
4 Zhu T,Chen R,Li AP,etal.Regulation of a novel cell differentiation-associated gene,JWA during oxidative damage in K562 and MCF-7 cells〔J〕.J Biomed Sci,2005;12(1):219-27.
5 中华人民共和国卫生部.GB5009 12-2010食品中铅的测定〔S〕.北京:中国标准出版社,2010.
6 Sies H.Oxidative stress:oxidants and antioxidants〔J〕.Exp Physiol,1997;82(2):291-5.
7 Nourazarian AR,Kangari P,Salmaninejad A.Roles of oxidative stress in the development and progression of breast cancer〔J〕.Asian Pac J Cancer Prev,2014;15(12):4745-51.
8 Ho E,Karimi GK,Liu CC,etal.Biological markers of oxidative stress:applications to cardiovascular research and practice〔J〕.Redox Biol,2013;1(1):483-91.
9 Valavanidis A,Vlachogianni T,Fiotakis C.8-hydroxy-2'-deoxyguanosine (8-OHdG):a critical biomarker of oxidative stress and carcinogenesis〔J〕.J Environ Sci Health C Environ Carcinog Ecotoxicol Rev,2009;27(1):120-39.
10 Shakoor MB,Ali S,Hameed A,etal.Citric acid improves lead (pb)phytoextraction in brassica napus L.by mitigating pb-induced morphological and biochemical damages〔J〕.Ecotoxicol Environ Saf,2014;109(1):38-47.
11 廖伟棠,霍 霞,刘 伟,等.电子垃圾拆解区学龄前儿童铅暴露对尿中8-羟基脱氧鸟苷水平的影响〔J〕.汕头大学医学院学报,2011;24(1):32-4.
12 周建伟,Di PY,Zhao YH,等.新的细胞骨架相关基因JWA的克隆、鉴定、序列分析、表达和组织分布研究.见:叶鑫生,沈倍奋,汤锡芳,等.细胞调控的探索〔M〕.北京:军事医学科学出版社,1999:110-9.
〔2016-07-19修回〕
(编辑 曲 莉)
Effects of lead exposure on expression of JWA gene mRNA and its relationship with oxidative stress and damage in brain tissues of rats
REN Xiao-Hui, ZHANG Zhong-Wei, XU Qun-Ying,et al.
School of Public Health, Nanchang University, Nanchang 330006, Jiangxi, China
Objective To explore the effects of lead exposure on the expression of JWA mRNA in cerebral cortex, cerebellum and hippocampus of rats and the relationship with oxidative stress and damage in brain tissues.Methods 40 weaned male SD rats were divided randomly into five groups according to the weight block design, and drank unlimitedly distilled water containing 0, 100, 200, 400, 800 mg/L lead acetate for 60 days respectively. Then the expression of JWA mRNA in the brain was detected by RT-PCR, and the levels of lead, Hydrogen peroxide (H2O2), malondialdehyde (MDA)and 8- hydroxyl deoxyguanosine(8-OHdG)in brain tissue were determined by the related kits respectively.Results Compared with those of control group, the expression of JWA mRNA in cerebral cortex, cerebellum and hippocampus of lead exposure groups was decreased significantly, whereas contents of lead, H2O2, MDA and 8-OHdG in brain tissue were increased (P<0.05).Correlation analysis results revealed that the expression of JWA gene mRNA was negatively correlated with contents of lead, H2O2, MDA and 8-OHdG in brain tissue(P<0.05).Conclusions Exposure to lead through drinking water could affect the expression of JWA mRNA and its expression intimately correlates with oxidative and stress damage of brain tissues.
JWA; Brain tissues; Oxidative stress
国家自然科学基金项目(81160342);江西省自然科学基金项目(20122BAB205047);江西省教育厅科技项目(GJJ11312)
肖元梅(1972-),女,博士,副教授,主要从事重金属中毒机制与防治研究。
任晓慧(1991-),女,硕士,主要从事重金属中毒机制与防治研究。
R994.4
A
1005-9202(2016)23-5794-04;
10.3969/j.issn.1005-9202.2016.23.010

