单增李斯特氏菌商品化核酸检测试剂盒评价
陈彬,林艳,柯璐,徐珊,林杰,戴晓丽,郑晶
(福建出入境检验检疫局技术中心,福建省检验检疫技术研究重点实验室,福建福州350001)
单增李斯特氏菌商品化核酸检测试剂盒评价
陈彬,林艳,柯璐,徐珊,林杰,戴晓丽,郑晶*
(福建出入境检验检疫局技术中心,福建省检验检疫技术研究重点实验室,福建福州350001)
通过实验室内确认和实验室间协同实验对商品化单增李斯特氏菌LAMP试剂盒进行适用性评价,选择具有代表性的5大类15个细类食品基质,对剂盒方法包括灵敏度、特异性、假阴性率、假阳性率、相对准确度、检出限、耐变性以及批间变异8项定性方法性能指标进行实验室内评估。并对10家实验室的协同实验结果进行评价。试剂盒检测结果与基准方法GB 4789.30-2010《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验》检测结果上无显著差异,能基本满足食品样品的检测要求,但蔬菜制品类的商品化核酸试剂盒法灵敏度仅为5%、假阴性率高达95%、相对准确率为68%,且与基准法检测阳性确证比在5%的置信区间内存在统计学差异,因此不适用于蔬菜制品的检测。10家实验室对3个接种水平样本的检测,特异性、灵敏度以及相对准确度均为100%,因此LAMP试剂盒检测法结果稳定可靠。
单核细胞增生李斯特氏菌;环介导等温扩增;商品化核酸试剂盒;评价
单核细胞增生李斯特氏菌 (Listeriamonocytogenes),广泛分布于自然界,是人类最重要的食源性病原菌之一。国家标准采用传统的微生物培养法,检测周期长,而以现代分子生物学建立的细菌核酸检测法不仅克服了费时的缺陷,在操作上也更简便和高效[1-2]。环介导等温扩增技术(Loop-mediated isothermalamplification,LAMP)技术是 2000年Notomi等[3]在PCR技术上发展起来的一种新型的恒温核酸扩增技术,具有简便、快速、灵敏度高、特异性强等优点,在致病菌的筛选检测上已经得到广泛的应用[4-8]。应用该技术形成商品化的检测试剂盒正日益为广大食品检测机构和人员所使用,单核细胞增生李斯特氏菌核酸检测试剂盒的质量对检测结果具有重要影响,因此对其进行科学有效地评价是十分必要的。本实验根据SN/T 2775-2011《商品化食品检测试剂盒评价方法》[5]和SN/T 3266-2012《食品微生物检验方法确认技术规范》[9]要求,参考GB 4789.30-2010《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌核酸检验》[10],研究建立了单核细胞增生李斯特氏菌LAMP检测试剂盒评价方案,并对该试剂盒进行了评价试验,以评估其在食品微生物检测中的适用性。
1 材料和方法
1.1 材料与试剂
单核细胞增生李斯特氏菌(ATCC7644)、金黄色葡萄球菌(ATCC6538):均购自购自上海汉尼生物技术有限公司。
单核细胞增生李斯特氏菌核酸检测试剂盒(Listeria monocytogenes Nucleic acid Detection Kit)(批号Lmo11080101、Lmo11082902、Lmo11090501):广州华峰生物科技有限公司。GB 4789.30-2010《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌核酸检验》中所需主要培养基以及试剂:北京陆桥技术有限责任公司。
1.2 仪器与设备
Stomacher3500拍击式均质器:英国SEWARD;KD-2100TBC电子天平:福建科迪技术有限公司;MODULYO-4K冷冻干燥机(配有真空泵):美国Edword公司;BD115型恒温培养箱:德国Binder公司。
1.3 方法
1.3.1 添加菌样制备
各菌株分别接种于营养肉汤和营养琼脂斜面中37℃培养18 h~24 h。冻干菌株存储于4℃。
1.3.2 试验食品种类的选择
根据SN/T 3266-2012《食品微生物检验方法确认技术规范》[10]规定选择本次试验的食品基质,见表1。

表1 供试食品种类Table1 The selected food types

式中:a为LAMP试剂盒检测确定为阳性而基准法确定为阴性的样本数;b为LAMP试剂盒检测确定为阴性而基准法确定为阳性的样本数。
评价:当χ2<3.84,表示两种方法的阳性确证比率在5%的置信区间内没有统计学差异,每一类食品的每一个接种水平必须达到该标准。当χ2≥3.84,表示两者在5%置信区间存在统计学差异,从而必须将该类食品从适用范围中剔除。
1.3.5 定性评价指标与计算方式
灵敏度(P+)指LAMP方法和基准方法均确证为阳性的数量除以基准方法确证为阳性的总数;特异性(P-)指LAMP方法和基准方法均确证为阴性的总数除以基准方法确证为阴性的总数;假阴性率(pf-)指LAMP方法确证为阴性而基准方法确证为阳性的数量除以基准方法确证为阳性的总数,(pf-)=1-(P+);假阳性率(pf+)指LAMP方法确证为阳性而基准方法确证为阴性的数量除以基准方法确证为阴性的总数,(pf+)= 1-(P-)。根据SN/T 3266-2012《食品微生物检验方法确认技术规范》中规定待确认方法满足检测要求的条件是:灵敏度≥98%、特异性≥90.4%、假阴性率<2%、假阳性率<9.6%。
相对准确度(Relative Accuracy):相同的样品用LAMP检测法和基准法测试结果的一致程度,两种方法均确证为阳性的样本数与均确证为阴性的样本数之和除以样品总数。
检测限:某个接种水平的一组样本,当检测阳性
1.3.3 检测方法
人工污染基质:根据不同的基质物理状态和是否经加工程序处理,添加相适应状态的微生物。因加工食品中的微生物状态为受损菌,未受损的微生物接种到未加工食品中,针对干粉样或粒状样品可添加冻干菌种,对潮湿的食品添加菌液。
按未接种(L0)、低(L1)、高(L2)3个菌浓度水平添加到基质中,拍击均质后制备成测试样品,存于4℃,分析前保持微生物稳定。其中L1接种条件应保证POD(检出概率)值在25%~75%;L2接种条件应保证POD(检出概率)=100%。对供试基质分别用LAMP试剂盒和基准方法进行测试,均进行20个平行,对检测数据进行分析统计。
1.3.4 方法的显著性差异检验
用于判断LAMP法与基准方法阳性比例的差异显著性。采用卡方检验(χ2)分析。结果比例大约占样品总数的50%时,该接种水平即为方法检测限,定性检测方法的检测限应小等于3CFU/ 25 g(mL)~5CFU/25 g(mL)。
1.3.6 耐变性检验
取单核细胞增生李斯特氏菌(ATCC7644)高浓度、低浓度菌悬液作为目标菌,金黄色葡萄球菌(ATCC6538)作为阴性对照。两个变量分别取两个水平:时间:65min和55min;温度:65℃和60℃。交叉组合后每个组合进行10个平行,以检出率(POD值)作为统计分析数据[9-14]。
1.3.7 批间变异测试
取单核细胞增生李斯特氏菌(ATCC7644)作为目标菌,以金黄色葡萄球菌(ATCC6538)作为阴性对照,目标菌的浓度须满足检测POD值在25%~75%的水平。分别用3个不同批号的单增李斯特氏菌LAMP检测试剂盒进行检测,每个批次设计10个平行,以POD值作为结果数据分析试剂盒的批间变异和稳定性。
1.3.8 协同实验
以脱脂牛奶和蔗糖作为保护剂,取单核细胞增生李斯特氏菌(ATCC7644)作为目标菌,分别制备未接种(L0)、低(L1)、高(L2)3个水平的冻干基质。发送至10家实验室,均以全脂奶粉作为供试基质,同时开展LAMP法和基准方法检测,每个水平设计8个平行,统计分析结果[15-20]。
2 实验结果及统计分析
2.1 方法的显著性差异检验结果、定性指标结果与评价
5种食品种类的检测结果见表2;5类食品类型2个接种水平的卡方检验结果见表3。

表2 5种食品种类的检测结果Table2 The testing resultsof fivekindsof food types
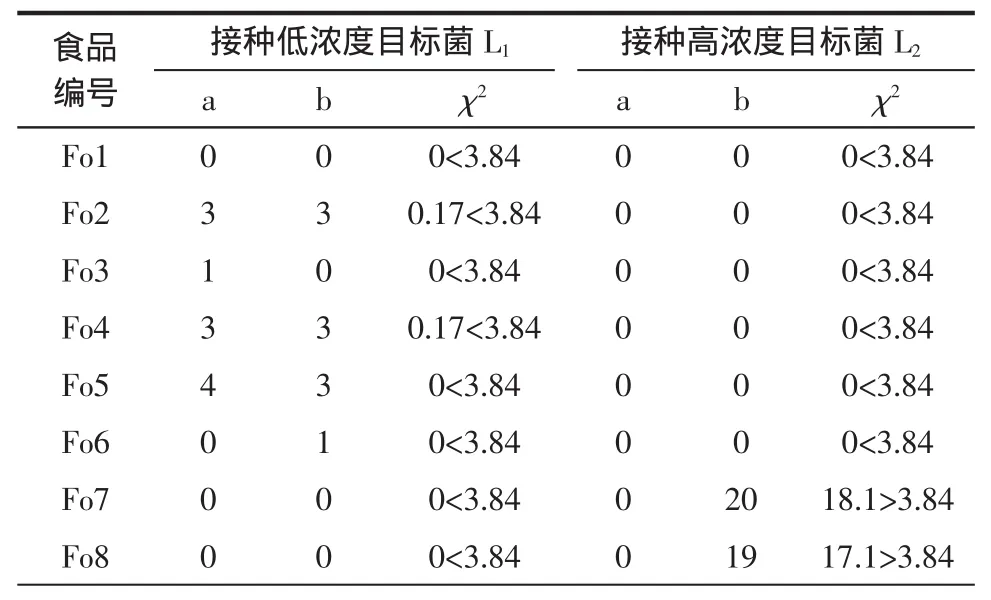
表3 5类食品类型2个接种水平的卡方检验结果Table3 The chi-square test resultsof two levelof vaccination for five kind of food type
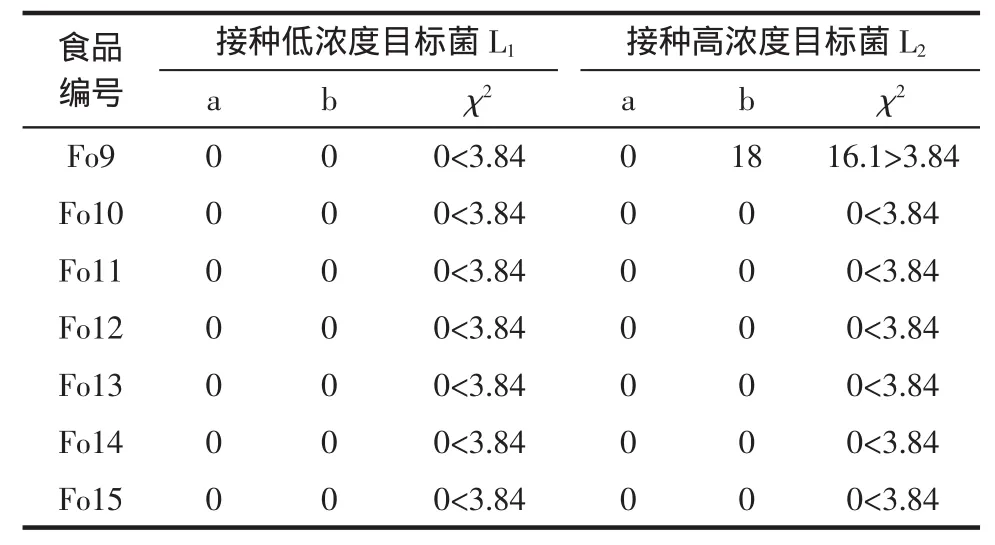
续表3 5类食品类型2个接种水平的卡方检验结果Continue table3 The chi-square test resultsof two levelof vaccination for fivekind of food type
由表3卡方检验结果可知:蔬菜制品大类的3个细类即食品编号为Fo7、Fo8、Fo9在目标菌接种水平为L1时χ2=0<3.84,LAMP法检测与基准法检测阳性确证比在5%的置信区间内无统计学差异,而接种水平为L2时χ2=0≥3.84,存在统计学差异。
根据1.3.4指标项目以及计算方式统计表3数据,统计结果见表4。
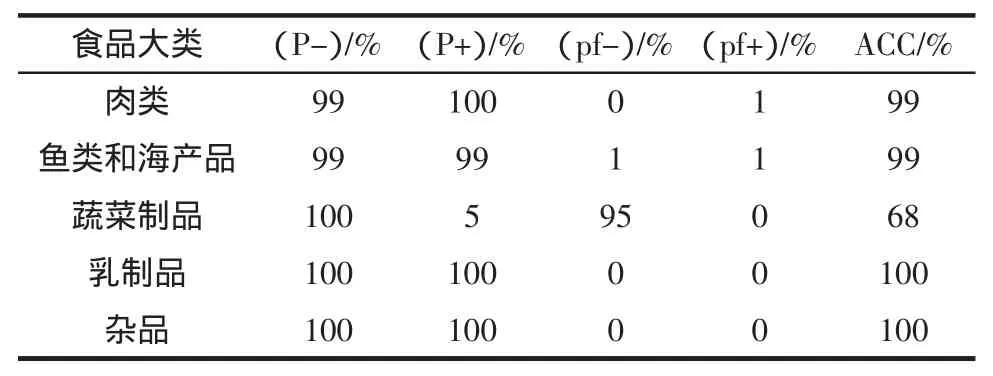
表4 5类食品基质检测结果统计Table4 Result statisticsof five typesof foodm atrix testing
根据SN/T 3266-2012《食品微生物检验方法确认技术规范》[10]及表4统计数据可知:5个食品种类的LAMP法检测特异性(P-)均为100%≥98%、假阳性率(pf+)均<9.6%;肉类、鱼类和海产品、乳制品、杂品4个食品种类的灵敏度(P+)均≥90.4%、假阴性率(pf-)均<2%,且相对准确率高;而蔬菜制品的LAMP法检测灵敏度仅有5%、假阴性高达95%,相对准确率低,为68%。综上:蔬菜制品的LAMP方法与基准法具有显著性差异,此外灵敏度低、假阴性率高,相对准确率低,因此蔬菜制品在LAMP法检测时应从适用范围中删除。在本文以下各项检测中对蔬菜制品不作统计分析。
2.2 检出限
目标菌接种水平计数结果见表5,各类食品POD计算见表6。当检测阳性结果比例大等于样品总数的50%时(即POD≥50%)的接种水平即为方法检出限。

表5 目标菌接种水平计算结果Table5 The inoculation level results for targetbacteria
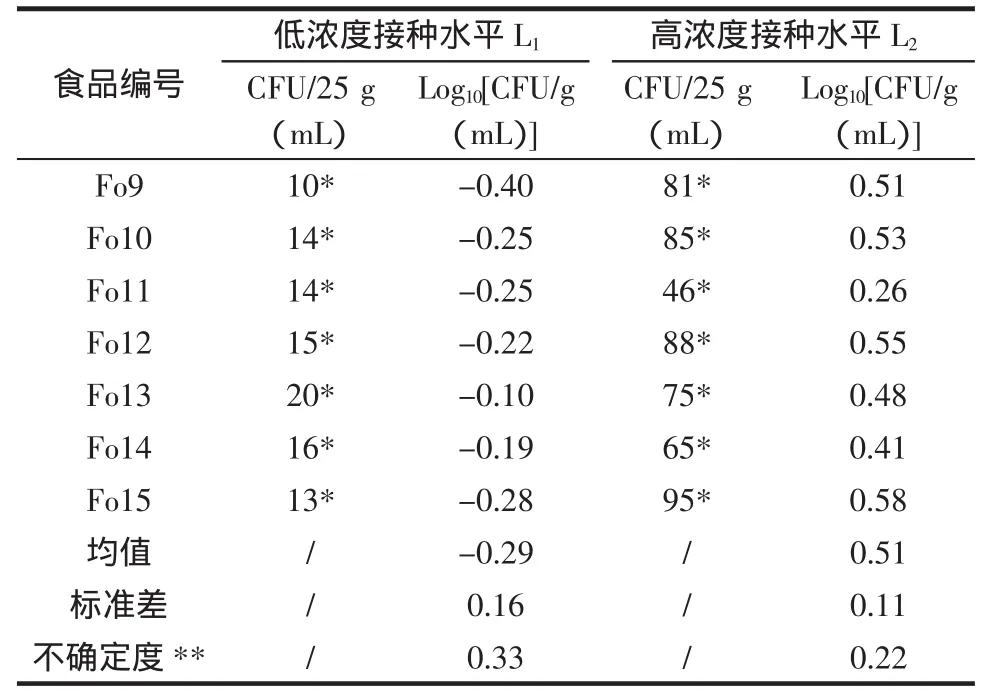
续表5 目标菌接种水平计算结果Continue table5 The inoculation level results for targetbacteria
根据接种菌悬液稀释计数结果,计算得出:接种目标菌水平L1约为0.51CFU/g(mL),其不确定度范围为0.24CFU/g(mL)至1.10CFU/g(mL),接种水平L2为3.24CFU/g(mL),其不确定度范围为1.96CFU/g(mL)至5.33CFU/g(mL)。
LAMP法各类食品检出率(POD)结果见表6。

表6 LAMP法各类食品检出率(POD)Table6 A llkindsof food detection(POD)of LAMP %
从表5、6数据可以得出:当检测阳性结果比例大约占样品总数的50%时,肉类食品和乳制品食品的试剂盒方法检出限均为3.24CFU/g;鱼类和海产品和杂品食品试剂盒方法检出限均为0.51 CFU/g。4种食品类型的检出限均小等于3CFU/25 g或mL~5CFU/25 g或mL。
2.3 耐变性
耐变性实验结果见表7。

表7 耐变性实验结果Table7 Reasultsof stability test %
由表7结果表明,当检测样品菌浓度较高时,该试剂盒检测结果稳定;当菌浓度较低时,四种条件下的POD值均大于50%,则满足确认标准。在65℃,55min的条件下,反应时间低于试剂盒说明书规定的时间,出现假阳性结果。综合结果表明,在60℃,55min的反应条件下检测结果相对于其它温度和时间最为满意。
2.4 批间变异
批间差异实验结果家表8。

表8 批间差异实验结果Table8 Reasultsof inter-batch varlations
由表8结果表明,该试剂盒的批间差异较小,但个别可能会出现假阴性的结果,无假阳性结果。
2.5 协同实验
共计收到10家实验室的检测结果,均是有效数据。结果见表9,数据形式以“阳性结果样本数/阴性结果样本数”,统计分析见表10。
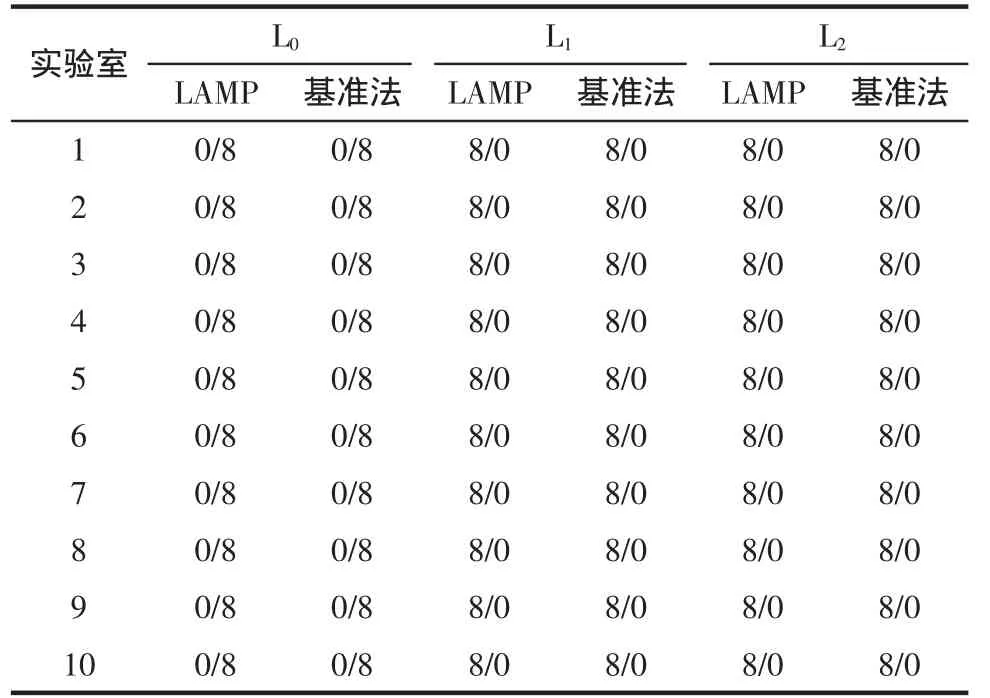
表9 协同实验结果Table9 Resultsof collaboration test
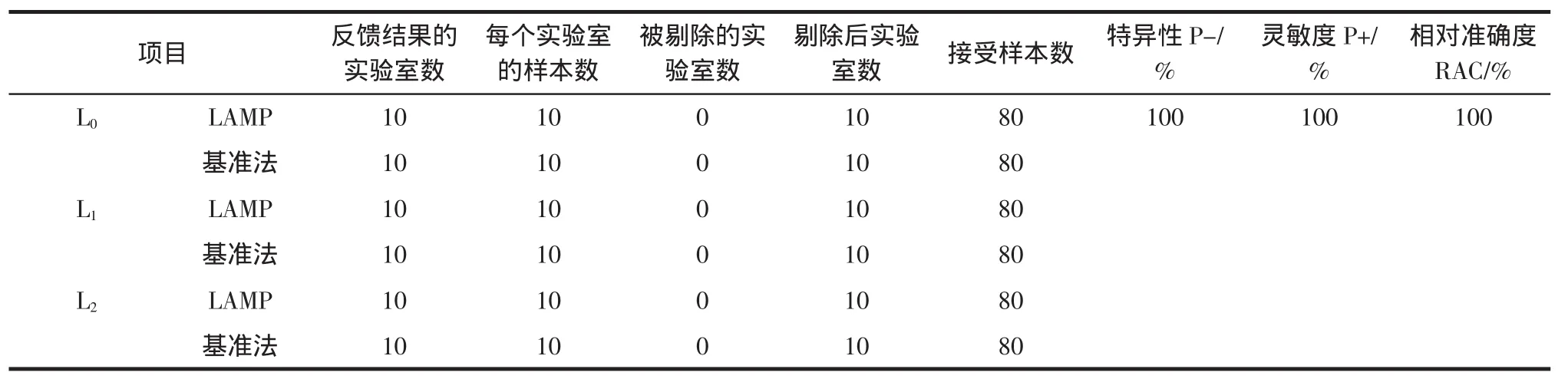
表10 协同实验统计结果Table10 Statisticalanalysisof collaboration test
由表10统计结果表明,10家实验室对3个接种水平样本的检测,特异性、灵敏度以及相对准确度均为100%,因此LAMP试剂盒检测法结果稳定可靠。
3 结论
评价结果单核细胞增生性李斯特氏菌核酸试剂盒方法检测结果与国家标准方法检测结果总体上比较无显著差异,能满足食品样品的检测要求,但不适用于蔬菜制品检测。单核细胞增生性李斯特氏菌LAMP检测方法具有快速、灵敏、操作简便的特点,且无需使用大型或高价仪器,适用于实验室快速筛查检测,并可在基层实验室推广应用。
[1] 刘秀峰,江建真,林萍.单核细胞增生李斯特菌研究进展[J].海峡预防医学杂志,2010,16(5):23-25
[2]江迎鸿,刘垚,谭贵良,等.LAMP技术及其在食品安全检测中的应用[J].广东农业科学,2010(7):220-222
[3] Notomi T,Okayama H,Masubuchi H,et a1.Loop-mediated Isothermalamplification ofDNA[J].Nucleic AcidsRes,2000,28(12):63
[4]李玉锋,李帅,黄丽娟,等.LAMP技术在食品致病菌检测中的研究进展[J].西华大学学报(自然科学版),2011,30(1):16-18
[5]李秀敏,王羽,张先舟,等.环介导等温扩增技术快速检测单核细胞增生性李斯特氏菌的研究 [J].安徽农业科学,2010,38(24): 13122-13123,13134
[6] 吴雁军,曹亢,郭慧媛,等.单增李斯特菌检测方法的最新研究进展[J].中国乳业,2011(4):38-42
[7]郭桂萍,葛红梅,王匀,等.单增李斯特菌检测技术研究进展[J].中国食物与营养,2011,17(3):12-15
[8]张体银,郑晶,黄晓蓉,等.环介导等温扩增技术快速检测食品中的单增李斯特氏菌[J].中国食品学报,2010,10(3):206-210
[9]黄晓蓉,杨方,黄志强,等.SN/T 2775-2011商品化食品检测试剂盒评价方法[S].北京:中国标准出版社,2011
[10]黄晓蓉,郑晶,郑麟毅,等.SN/T 3266-2012食品微生物检验方法确认技术规范[S].北京:中国标准出版社,2012
[11]中华人民共和国卫生部.GB 4789.2-2010食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验[S].北京:中国标准出版社,2010
[12]郑晶,黄晓蓉,陈彬,等.食品微生物学检测方法确认技术指南的标准化研究[J].现代测量与实验室管理,2010(6):54-57
[13]张敏,杨柳,尹大伟,等.国内外非标准方法确认技术探讨[J].实验室科学,2015,18(4):231-234
[14]付溥博,张西萌,韩笑,等.食品微生物检测试剂盒评价方法建立与应用[J].中国公共卫生,2015,31(6):837-841
[15]邵碧英,董建,陈彬,等.沙门氏菌核酸检测试剂盒的评价[J].食品科学,2015,36(24):242-245
[16]Mori Y,Hirano T,Notomi T.Sequence specific visual detection of LAMP reactions by addition of cationic polymers[J].BMC Biotechnology,2006(6):3
[17]LUO J,VOGEL R F,NIESSEN L.Development and application of a loop-mediated isothermal amplification assay for rapid identification ofaflatoxigenicmoldsand their detection in food samples[J].International Journalof Food Microbiology,2012,159(3):214-224
[18]董健,郑晶,林杰,等.3M PetrifilmTM金黄色葡萄球菌检验测试片的评价[J].食品与发酵科技,2014,50(4):56-60
[19]俞漪.食品微生物测试片标准法和国标法比较研究[J].农产品加工·学刊,2012(10):138-140
[20]刘秀梅,卢行安,顾其芳,等.AOAC 991.14 PetrifilmTM大肠菌群测试片法与GB4789.3大肠菌群计数法的比较研究[J].中国食品学报,2010,10(6):167-170
[21]WANG Deguo,WANG Yongzhen,XIAO Fugang,et al.A comparison of in-house real-time LAMPAssayswith a commercialassay for the detection of pathogenic bacteria[J].Molecules,2015,20(6):9487-9495
[22]董健,郑晶,林杰,等.Easy TestTM菌落总数测试片的评价[J].食品与发酵科技,2013,49(5):68-77
[23]XIEGuosi,HUANG Jie,ZHANGQingli,etal.Specific and rapid diagnosis of Edwardsiella tarda by a novel loop-mediated isothermal amplification targeting the upstream region of hlyb gene[J].Journal ofAquatic AnimalHealth,2013,25(2):110-118
Evaluation of Listeria monocytogenes Comm ercial Nucleic Acid Detection K it
CHENBin,LINYan,KE Lu,XUShan,LIN Jie,DAIXiao-li,ZHENG Jing*
(Centerof Technology,Fujian Entry-Exit Inspection and Quarantine Bureau,Fujian ProvincialKey Laboratory of Inspection and Quarantine Technology Research,Fuzhou 350001,Fujian,China)
Based on indoor technicalparametersby validation and collaboration test.Choose five categoriesand 15 sub-types for Typical foodmatrix,indoor technical parameters include sensitivity,specificity,false negative rate and false positive rate relative accuracy,limit of detection(LOD),resistance to denaturation and batch variation.Synergy of10 laboratory to evaluate the results of the experiment.Results showed that the kitwas not significantly different from the national standard method in general,and could meet the requirements of food sample testing.However,the sensitivity just5%,false negative rate isashigh as95%,the relative accuracy is 68%,and there is statisticaldifferenceswithin the 5%confidence interval for positive confirm ratio compared with referencemethods.Thus the commercialkitwasnotsuitable for detection in vegetable products.Specificity,sensitivity and the relative accuracy is all 100%for Three level of sample detection of 10 laboratory.So the LAMPkitmethod isstable and reliable.
Listeriamonocytogenes;loop-mediated isothermalamplification;Commercialization nucleic acid detection kit;evaluation
10.3969/j.issn.1005-6521.2016.24.025
2016-03-21
福建省科技计划项目(2011Y0002);国家认监委出入境检验检疫行业标准制(修)订计划项目(2013B264K)
陈彬(1969—),女(汉),高级工程师,学士,研究方向:食品微生物检验。
*通信作者:郑晶(1973—),女(汉),研究员,硕士,研究方向:食品微生物检验。

