不同方法提取甜玉米芯多酚对比研究
林枞雨,马永强,王鑫,李煜,戴传荣,黄赫雁
(哈尔滨商业大学食品工程学院,黑龙江省普通高等学校食品科学与工程重点实验室,黑龙江哈尔滨150076)
不同方法提取甜玉米芯多酚对比研究
林枞雨,马永强*,王鑫,李煜,戴传荣,黄赫雁
(哈尔滨商业大学食品工程学院,黑龙江省普通高等学校食品科学与工程重点实验室,黑龙江哈尔滨150076)
以美国脆王甜玉米芯为原料,分别采用乙醇浸提、超声波辅助和微波辅助提取甜玉米芯多酚并选择最优方法,通过单因素试验及L9(34)正交试验设计,确定甜玉米芯多酚最佳提取条件。结果表明:超声波辅助提取法效果明显优于乙醇浸提法和微波辅助提取法,甜玉米芯多酚提取率为95.10%。单因素试验及正交设计表明当甜玉米芯多酚提取3次,提取温度40℃,超声时间为60min,超声功率300W,乙醇浓度70%,料液比1∶25(g/mL)时,多酚提取率达到最高,为96.04%,多酚得率为16.24mg/g。本试验为甜玉米芯多酚分离纯化的进一步研究提供试验依据。
甜玉米芯;多酚;乙醇浸提法;微波辅助法;超声波辅助法
我国作为世界传统农业大国,植物资源丰富,主要经济作物——玉米年产量在1.5亿t以上,作为副产物的玉米芯也达到了4 000多万t[1],已然变成一种数量可观的生物资源,但一直以来国内对玉米芯的研究较少,回收利用率不高使绝大部分玉米芯只能作为动物饲料或直接焚烧,造成了极大资源浪费和环境污染。本试验所研究的甜玉米又称为蔬菜玉米。甜玉米起源于美国,有100多年的栽培历史,在20多年前传入了中国。甜玉米含有丰富和均衡的营养成分,且具有较好的口感,很受消费者喜欢,被称为“黄金食品”[2]。陈家明[3]等研究表明甜玉米芯一般占甜玉米重量的20.0%~30.0%,其中含有主要成分为:纤维素、木质素、半纤维素和木聚糖,还有其他成分,如粗脂肪、糖类、粗蛋白、矿物质等[4],也包括芦丁、金丝桃苷、龙胆酸等多种植物多酚[5],其含量多于1.34%。植物多酚又被叫做植物单宁,大量存在于植物体的组织中,如黄酮、咖啡酸、儿茶素、绿原酸、榭皮素、金丝桃苷等。K. Frendenberg根据多酚结构特点又将其分成缩合单宁(condensed tannin)与水解单宁(hydrolysable tannin)两类[6],方便了进一步的研究。
众所周知,多酚具有多种生理功能和药理功能,清除自由基、抗肿瘤、抑菌、抗辐射、降血脂、抗氧化、防晒美白和提高免疫力等对人类健康有益的作用[7-9],可以改善并提高膳食的结构,是一种既营养又保健的食用佳品。为了增加甜玉米的综合利用价值和有效资源开发,改善农业废料对环境带来的危害,实验以甜玉米芯多酚物质的几种提取方法为对比,选取最优方法进行工艺优化研究。
1 材料与方法
1.1 材料与试剂
原材料取自黑龙江绥化产美国脆王甜玉米。
没食子酸标准品、无水乙醇(分析纯)、福林酚试剂(分析纯)、碳酸钠(分析纯)和蒸馏水等。
1.2 仪器与设备
FW177型中草药粉碎机、DK-98-1型电热恒温水浴锅:天津市泰斯特仪器有限公司;R209型旋转蒸发器:上海申胜生物技术有限公司;SHB-IV型双A循环水式多用真空泵:郑州长城科工贸有限公司;FA1104B型电子天平:上海越平科学仪器有限公司;722型紫外分光光度计:上海元析仪器有限公司;TDL80-2B型高速离心机:上海安亭科学仪器厂制造;JY-98-111DN型超声波细胞粉碎机:宁波新芝生物科技有限公司;XH-MC-1型祥鹄实验室微波催化合成/反应仪:北京祥鹄科技发展有限公司。
1.3 材料的预处理
将甜玉米去粒后用烘盘装甜玉米芯,放于阳台晾干后斩块,用粉碎机粉碎甜玉米芯,再过80目筛,备用[10]。
1.4 标准曲线的绘制
采用福林酚法,以没食子酸为标准品,测定甜玉米芯中多酚的含量[11-12]。
准确称取50mg没食子酸标准品,先加入少量蒸馏水待没食子酸溶解后,加蒸馏水定容至500mL,混匀后得到浓度为100μg/mL的没食子酸标准溶液。量取标准液0.05、0.10、0.15、0.20、0.25、0.30mL于10mL比色管中,加蒸馏水定容至2mL,摇匀后加1mL福林酚试剂,4min后加入1mL 10%碳酸钠溶液,25℃水浴2 h,测定溶液在765 nm波长处的吸光值(A765),进行3组平行试验,以吸光度为纵坐标,没食子酸含量(μg)为横坐标,得线性回归方程y=0.022x+0.009,R2= 0.998 0,具有良好的线性关系。
1.5 总多酚的测定
以福林酚显色法测定。取甜玉米芯提取液1mL于10mL容量瓶内,再加入1mL福林酚试剂,4min后加入1mL 10%碳酸钠溶液,25℃水浴下反应2 h,测定溶液在765nm波长处的吸光值(A765),根据标准曲线计算甜玉米芯提取液中总多酚的没食子酸当量,总多酚含量以每100 g甜玉米芯的没食子酸当量(mg)表示。
1.6 总多酚提取率的测定
利用如下公式计算总多酚提取率(P)
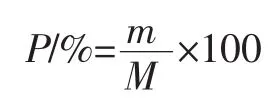
式中:m为提取的多酚总质量,mg;M为样品含有的多酚总质量,mg。
1.7 不同方法提取甜玉米芯多酚[13]
1.7.1 乙醇浸提法提取甜玉米芯多酚工艺
精确称量10 g预处理后的样品粉末于500mL烧杯中,以料液比1∶25(g/mL)加入70%的乙醇-水溶液作为浸提液,在70℃水浴条件下反应2h,水浴完毕后,将高速离心机转速调节为4 000 r/min,离心10min。离心后的样液经过抽滤获得澄清液体,样渣放置于500mL烧杯中,按照上述的步骤再重复提取2次,3次所得澄清液体旋蒸后即得到粗多酚提取液,定容至250mL,以1.5中的方法测定提取的多酚总质量,再利用1.6的方法计算总多酚提取率。
1.7.2 微波辅助法提取甜玉米芯多酚工艺[14]
精确称量10 g预处理后的样品粉末于500mL烧杯中,以料液比1∶25(g/mL)加入70%的乙醇-水溶液做为浸提液,调节微波功率至600W,温度至60℃的条件下提取3min,将高速离心机转速调节为4 000 r/min,离心10min。离心后的样液经过抽滤获得澄清液体,样渣放置于500mL烧杯中,按照上述的步骤再重复提取2次,3次所得澄清液体旋蒸后即得到粗多酚提取液,定容至250mL,以1.5中的方法测定提取的多酚总质量,再利用1.6的方法计算总多酚提取率。
1.7.3 超声波辅助法提取甜玉米芯多酚工艺[15]
精确称量10 g预处理后的样品粉末于500mL烧杯中,以料液比1∶25(g/mL)加入70%的乙醇-水溶液做为浸提液,在温度50℃,超声波功率300W的条件下提取60min,将高速离心机转速调节为4 000 r/min,离心10min。离心后的样液经过抽滤获得澄清液体,将样渣放置于500mL烧杯中,按照上述的步骤再重复提取2次,3次所得澄清液体旋蒸后即得到粗多酚提取液,定容至250mL,以1.5中的方法测定提取的多酚总质量,再利用1.6的方法计算总多酚提取率。
1.8 不同提取条件对甜玉米芯多酚提取率的单因素试验
根据1.7.1、1.7.2和1.7.3的提取工艺,比较它们的总多酚提取率,选取提取率最高的方法研究提取次数、提取温度、超声时间、超声功率、乙醇浓度和料液比对甜玉米芯多酚提取率的影响。
以1.7.3的提取工艺为基础,分别调节提取次数为1、2、3、4和5次,提取温度为30、40、50、60、70℃,超声时间为20、40、60、80、100min,超声功率为200、250、300、350、400W,乙醇浓度50%、60%、70%、80%和90%,料液比为1∶15、1∶20、1∶25、1∶30和1∶35(g/mL)。
1.9 正交试验
在1.8的基础上,进行正交试验对甜玉米芯多酚提取工艺进行优化,以总多酚提取率为指标,确定甜玉米芯多酚提取的最佳工艺条件。
根据单因素试验确定基准试验因素为:提取次数3次,料液比为1∶25(g/mL)。选择试验因素为提取温度(A)、超声时间(B)、超声功率(C)和乙醇浓度(D),设立3个水平,利用正交试验设计L9(34)对甜玉米芯中多酚的超声波辅助提取工艺进行优化,正交试验因素及水平见表1。

表1 正交试验因素及水平Table1 Factorsand levels in orthogonalarray design
2 结果与分析
2.1 提取甜玉米芯多酚的优化方法选择
提取甜玉米芯多酚的优化方法选择见表2。
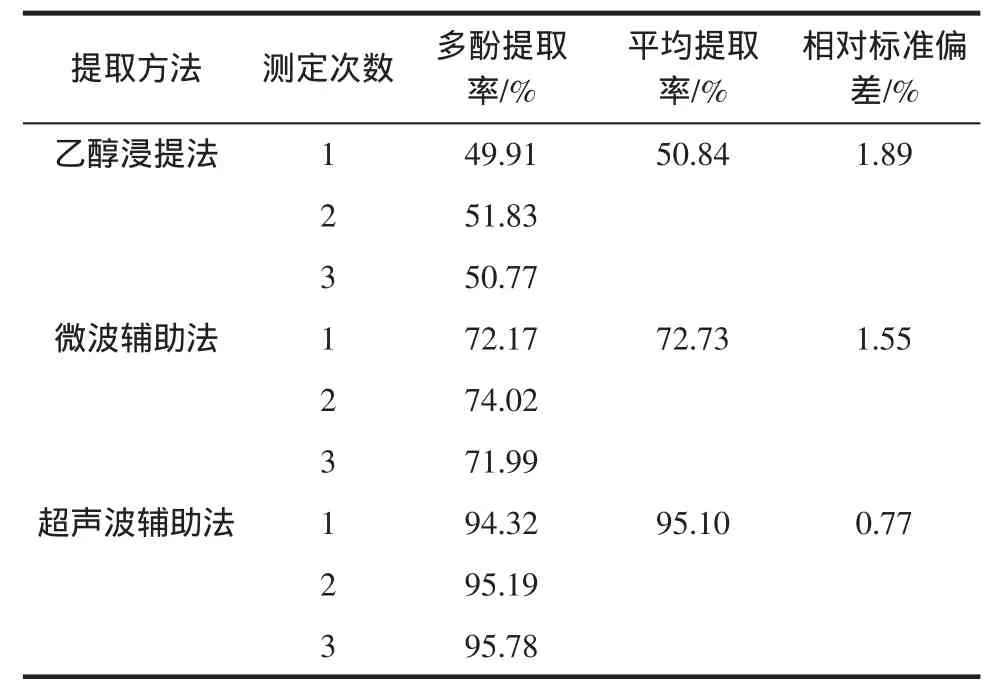
表2 不同方法提取甜玉米芯多酚的测定结果Table2 Themeasurement resultswith differentmethods for extracting of sweet corn cob polyphenols
乙醇浸提法即有机溶剂提取法,是选用对目标成分具有良好溶解性并可以断裂氢键的有机溶剂将其从原料中提取浸出的方法。微波辅助法是利用微波能来提高萃取效率的技术[16]。微波在传递过程中穿透植物体并被植物体吸收,产生热能,在热效应作用下,植物细胞内的温度迅速上升,使细胞中的水分气化,产生的压力使细胞膜破裂,增大了提取物与溶剂之间的接触面积,增加了系统内的热动力,使提取成分更容易溶解于提取液中,从而提高了提取效率。而超声辅助提取是多酚提取方法的一种,超声波辅助提取的强化动力来源于其空化作用,空化作用引起了湍动效应、微扰效应、界面效应和聚能效应等[17]。超声波被多个研究证明能够显著地减少提取时问并增加提取率从而促进许多植物原材料活性成分的提取[18]。
由表2可知,3种提取甜玉米芯多酚的效果为:超声波辅助法>微波辅助法>乙醇浸提法,且超声波辅助法效果明显优于其余两种,故选择超声波辅助法进行正交优化试验。
2.2 超声波辅助法单因素试验
2.2.1 提取次数对甜玉米芯多酚提取率的影响
提取次数对甜玉米芯多酚提取率的影响见图1。
由图1所示,当提取次数在3次之前,甜玉米芯多酚提取率呈显著上升趋势,是因为在一定的提取次数内,多酚经乙醇作用而大量溶解。在3次之后增长趋势逐渐变得平缓,主要由于原料里所剩多酚已经不多,呈现附着状态,很难被溶解出来。考虑到试验成本和试剂用量,故可选取3次为最佳提取次数。
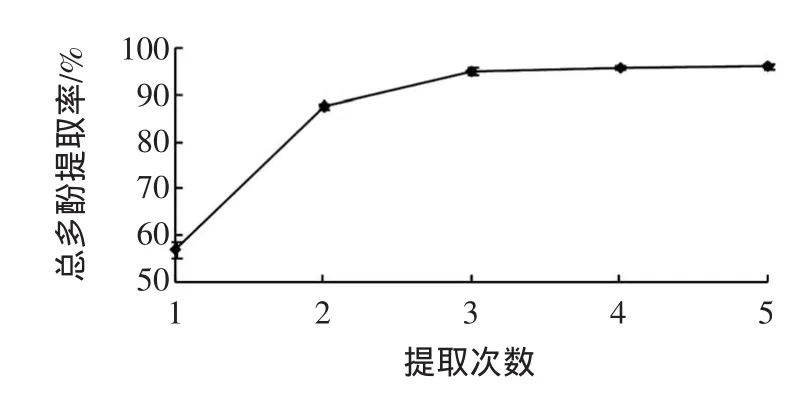
图1 提取次数对甜玉米芯多酚提取率的影响Fig.1 Effectsofextraction timeson extraction efficiency of polyphenols from sweet corncobs
2.2.2 提取温度对甜玉米芯多酚提取率的影响
提取温度对甜玉米芯多酚提取率的影响见图2。
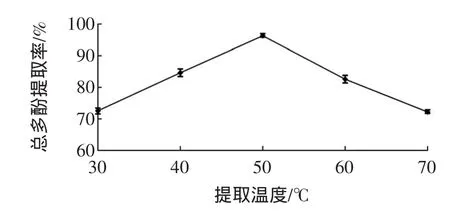
图2 提取温度对甜玉米芯多酚提取率的影响Fig.2 Effectsof extraction tem peratureson extraction efficiency of polyphenols from sweet corncobs
由图2所示,50℃为最佳提取温度。当温度低于50℃时,多酚提取率随温度的增高呈显著上升趋势,这是因为更高的温度可以加快机体内分子的运动水平,使多酚从甜玉米芯粉末中快速溶出。在高于50℃后,多酚得率呈现明显的下降趋势,是因为过高的温度会使乙醇大量挥发,导致溶剂浓度降低,从而影响了多酚的提取率。
2.2.3 超声时间对甜玉米芯多酚提取率的影响
超声时间对甜玉米芯多酚提取率的影响见图3。
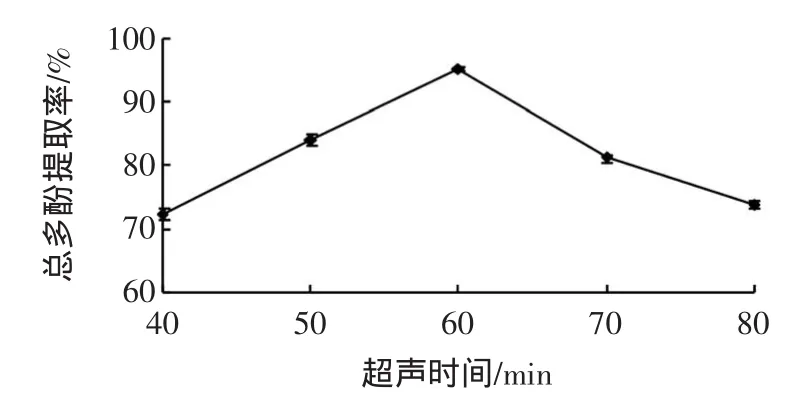
图3 超声时间对甜玉米芯多酚提取率的影响Fig.3 Effectsof ultrasonic tim eon extraction efficiency of polyphenols from sweet corncobs
由图3所示,60min为最佳超声时间。当超声时间少于60min时,多酚提取率随着时间呈明显的上升趋势,但在高于60min之后,多酚提取率呈下降趋势,这是由于在一定的空化作用下机体发生破碎,多酚分子得以释放,加快了目标物质的溶出,但过长的超声时间会使空化效应作用力有所减少,影响多酚的析出,而且会破坏多酚的分子结构的化学键,溶出更多的杂质。
2.2.4 超声功率对甜玉米芯多酚提取率的影响
超声功率对甜玉米芯多酚提取率的影响见图4。
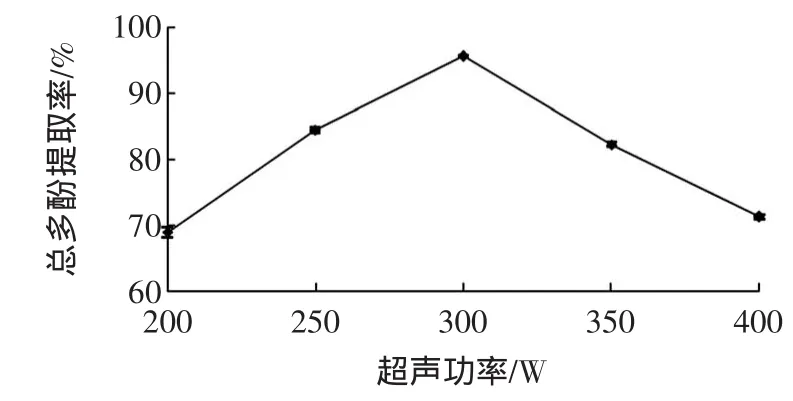
图4 超声功率对甜玉米芯多酚提取率的影响Fig.4 Effectsof ultrasonic power on extraction efficiency of polyphenols from sweet corncobs
由图4所示,300W为最佳超声功率。当功率低为300W时,多酚提取率随功率的加大呈显著上升趋势。随着功率的继续加大,多酚的提取率又急剧下降,主要是由于超声功率的增强,使空化作用和机械剪切的搅拌作用也随之增强,甜玉米芯细胞加速裂解后使多酚物质快速溶出,当功率过大时,超声可能会引起溶液瞬时升温,使局部过热,从而造成了分子裂解,提取率呈现下降的趋势[19]。
2.2.5 乙醇浓度对甜玉米芯多酚提取率的影响
乙醇浓度对甜玉米芯多酚提取率的影响见图5。
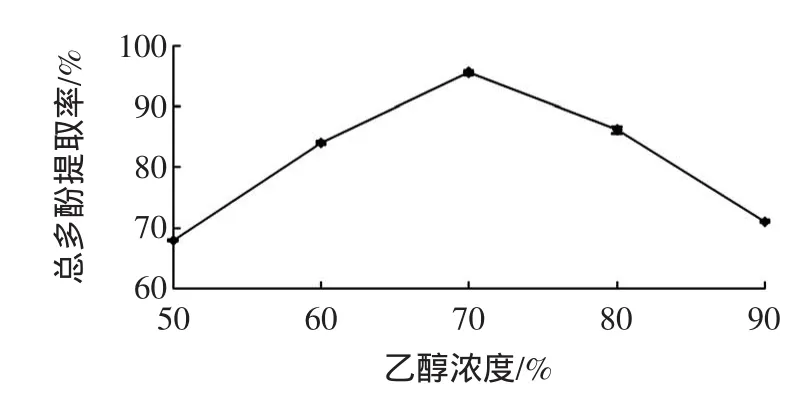
图5 乙醇浓度对甜玉米芯多酚提取率的影响Fig.5 Effectsof ethanolconcentrationson extraction efficiency of polyphenols from sweet corncobs
由图5所示,乙醇浓度70%为最佳浓度。当试剂浓度低于70%时,多酚提取率随浓度的增加显现上升趋势,这是因为一定浓度的乙醇溶液可以破坏内部硫水键与氢键,打开甜玉米芯细胞结构,使得多酚物质充分析出,当乙醇浓度大于70%之后,多酚得率呈明显下降趋势,原因是高浓度的乙醇导致玉米芯中的组织细胞通透性变弱,同时乙醇也会大量地挥发,作用于物料的减少。
2.2.6 料液比对甜玉米芯多酚提取率的影响
料液比对甜玉米芯多酚提取率的影响见图6。
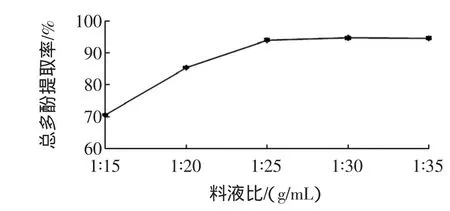
图6 料液比对甜玉米芯多酚提取率的影响Fig.6 Effectsof solid-liquid ratioson extraction efficiency of polyphenols from sweet corncobs
由图6可看出,料液比在1∶15(g/mL)~1∶25(g/mL)之间,多酚提取率呈上升趋势,因为溶剂较多,可增加与物料的表面积接触,加快了目标物质的溶出。在1∶25(g/mL)之后,多酚提取率增长平缓,由于料液比的增加会溶解出更多的非酚类物质,这不仅浪费有机试剂还引入了杂质。综合经济成本及后续进行的浓缩处理等因素的考虑,故可确定料液比单因素的最佳条件为1∶25(g/mL)。
2.3 正交试验优化提取条件
正交试验设计及结果见表3。
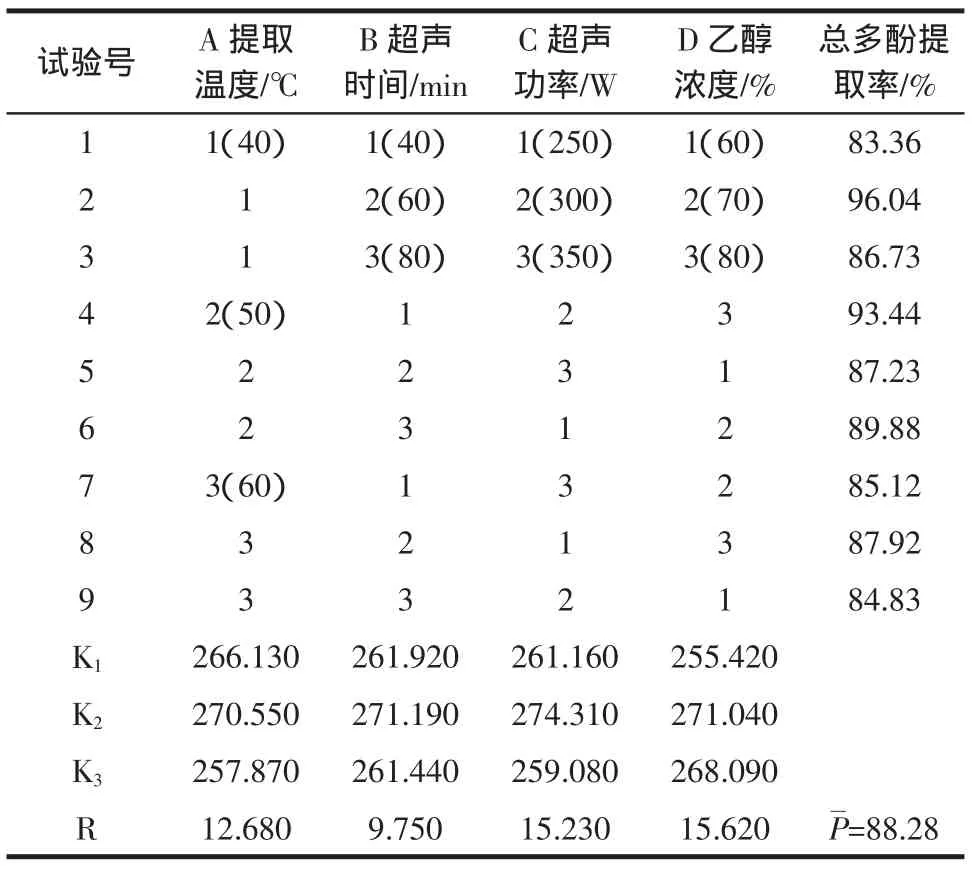
表3 正交试验设计及结果Table3 Orthogonalarray designmatrix and experimental results
通过正交试验数据和计算结果可知,影响甜玉米芯多酚提取率因素的主次为D>C>A>B,即乙醇浓度>超声功率>提取温度>超声时间,理论最佳提取组合为A2B2C2D2,因为这个组合不在正交已做的9组试验中,所以对其验证并进行3组平行试验,结果表明该组合对甜玉米芯多酚的提取率为95.88%,比正交试验最佳组合A1B2C2D2的结果低,由于超声作用会使混合液温度快速上升,温度过高,会造成乙醇挥发,溶液浓度降低,因此试验得出甜玉米芯多酚提取率最佳条件为提取3次,提取温度40℃,超声时间为60min,超声功率300W,乙醇浓度70%,料液比1∶25(g/mL)。赖富饶等[15]的研究结果表明:提取温度40℃,超声时间45min,超声功率200W,乙醇浓度80%,料液比1∶15(g/mL)时,多酚提取率最高。与本文的工艺参数不同,可能是由于原材料产地不同而造成的总多酚含量不同,还可能是由于采用的超声辅助提取仪器不同,但最终提取率与本文结果基本一致。
3 结论
1)应用乙醇浸提法、微波辅助法和超声波辅助法提取甜玉米芯多酚,以总多酚提取率为指标,可知超声波辅助法(95.10%)的甜玉米芯多酚提取率明显高于乙醇浸提法(50.84%)和微波辅助法(72.73%),因此选取超声波辅助法进行正交优化试验。
2)由正交试验结果可以看出,超声波辅助法提取甜玉米芯多酚试验的影响因素主次是乙醇浓度>超声功率>提取温度>超声时间,通过验证和计算得出最佳参数为提取3次,提取温度40℃,超声时间为60min,超声功率300W,乙醇浓度70%,料液比1∶25(g/mL),多酚提取率达到最高,为96.04%,多酚得率为16.24mg/g。
[1]徐淑芬.浅谈玉米芯的综合利用[J].科技情报开发与经济,2011, 21(17):174-175
[2]黄建初,李崇高,韩明,等.我国甜玉米保鲜加工的现状及研究进展[J].安徽农业科学,2012,40(20):10609-10611
[3]陈家明,余稳稳,吴晖,等.玉米芯的营养成分分析[J].现代食品科技,2012,28(9):1073-1075
[4]李昌文,张丽华,纵伟,等.玉米芯的综合利用研究技术进展[J].食品研究与开发,2015,36(15):139-143
[5] 陈智毅,徐玉娟,尹艳,等.甜玉米多酚类成分的测定[J].食品科学,2010,31(10):235-238
[6] EHaslam.Plant polyphenolsand chemical defense a reappraisal[J]. Chem,1988,14(10):1789-1805
[7]CHOIDY,LEEY J,HONG JT,etal.Antioxidantpropertiesofnaturalpolyphenolsand their therapeutic potentials for Alzheimer’sdisease[J].Brain Research Bulletin,2012,87(2/3):144-153
[8] WILLIAMSR J,SPENCER JP E.Flavonoids,cognition,and dementia:actions,mechanisms,and potential therapeutic utility for Alzheimer’s disease[J].Free Radical Biology and Medicine,2012, 52(1):35-45
[9] 冯丽,宋曙辉,赵霖,等.植物多酚种类及其生理功能的研究进展[J].江西农业学报,2007,19(10):105-107
[10]马永强,袁诺,葛林,等.甜玉米芯多酚提取工艺研究[J].农产品加工,2015(12):36-38
[11]Sun J,Yao J,Huang Setal.Antioxidant Activity of Polyphenoland Anthocyanin Extracts from Fruits of Kadsura coccinea(Lem.)A.C. Smith[J].Food Chemistry,2009,117(2):276-281
[12]LinaresE,Giorgio S,Augusto O.Inhibition of in Vivo LeishmanicidalMechanismsby Tempol:Nitric Oxide down-regulation and OxidantScavenging[J].Free Radical Biology and Medicine,2008,44(8): 1668-1676
[13]陶明,罗茜,陈超,等.会理石榴皮中多酚提取方法的研究[J].辽宁化工,2012,41(10):991-993
[14]周惠燕,陈珏.正交试验法优化葡萄皮中多酚的提取工艺[J].上海中医药杂志,2011,45(6):84-86
[15]赖富饶,李臻,吴晖,等.甜玉米芯多酚的超声提取工艺优化[J].现代食品科技,2012,28(1):17,52-55
[16]贝玉祥,郭英,和万芬,等.诃子中总多酚含量的测定及其超声提取工艺的研究[J].生物技术,2008(2):82-84
[17]姚瑞祺.植物多酚提取分离方法研究进展[J].农产品加工(学刊), 2011(5):84-85
[18]温玲蓉,林恋竹,赵谋明.溪黄草常压回流提取物与减压回流提取物抗氧化性的比较[J].现代食品科技,2010,26(1):71-75
[19]刘强,吴艳,吴金鸿,等.超声波辅助提取胖大海多糖工艺优化[J].食品科学,2012,33(20):99-103
Com parison of Polyphenols of Sweet Corn Cob Extracted by Different M ethods
LINCong-yu,MA Yong-qiang*,WANGXin,LIYu,DAIChuan-rong,HUANGHe-yan
(Collegeof Food Engineering,Harbin University ofCommerce,Key Laboratory for Food Science and Engineering in Heilongjiang Collegeand University,Harbin 150076,Heilongjiang,China)
In thisstudy,the American Krispy King sweetcorn cob,as theexperimentalmaterials,wasextracted by the ethanol,ultrasonic-assisted and microwave-assisted to decide the bestmethod.Through the single factorexperimentand L9(34)orthogonaldesign to determine the optimum extraction conditionsofpolyphenolsof sweetcorn cob.The resultsshowed thatultrasonic-extractionmethodwasbetter than ethanolextraction andmicrowave-assisted extraction,and the extraction rate of polyphenolswas 95.10%.Single factor experimentand orthogonal design experiments showed thatwhen ultrasonic-assisted extracted three times,extraction temperature 40℃,ultrasonic time 60min,ultrasonic power 300W,ethanol concentration 70%and solid-liquid ratio 1∶25(g/mL),thehighestextraction rateofpolyphenolswas96.04%and theyieldofpolyphenolswas16.24mg/g.This studycanprovideexperimentalreferencesforfurtherdevelopmentandutilizationofpolyphenolsofsweetcorncob.
sweetcorncob;polyphenol;ethanolextraction;microwave-assistedmethod;ultrasonic-assisted method
10.3969/j.issn.1005-6521.2016.24.014
2016-08-14
哈尔滨商业大学研究生创新科研项目(YJSCX2015-392HSD)
林枞雨(1991—),男(汉),硕士研究生,主要研究方向:农产品加工与贮藏。
*通信作者:马永强(1963—),男,教授,博导,主要研究方向:食品化学。

