罗汉果醇抗肿瘤活性及其作用机制研究
符毓夏, 王 磊, 李典鹏*
( 1. 广西师范大学 生命科学学院, 广西 桂林 541004; 2. 广西植物功能物质研究与利用重点实验室, 广西壮族自治区中国科学院 广西植物研究所, 广西 桂林 541006 )
罗汉果醇抗肿瘤活性及其作用机制研究
符毓夏1,2, 王 磊2, 李典鹏2*
( 1. 广西师范大学 生命科学学院, 广西 桂林 541004; 2. 广西植物功能物质研究与利用重点实验室, 广西壮族自治区中国科学院 广西植物研究所, 广西 桂林 541006 )
罗汉果醇是罗汉果皂苷的苷元,有研究报道罗汉果皂苷V具有防癌抑癌作用。该研究采用噻唑蓝实验(MTT法)检测罗汉果醇对不同肿瘤细胞增殖的抑制情况,以及不同浓度的罗汉果醇对CNE1细胞的增殖抑制率;应用细胞克隆形成实验进一步验证罗汉果醇对CNE1细胞增殖的抑制作用;采用Annexin V/PI 双染法检测罗汉果醇对CNE1细胞凋亡的影响;以实时定量PCR技术检测罗汉果醇对CNE1细胞中Caspase-3、Survivin、 Bax和Bcl-2基因的mRNA 表达水平的影响。结果表明:罗汉果醇能显著抑制DU145、HepG2、A549、CNE1、CNE2细胞的增殖,其中对CNE1细胞增殖的抑制作用最为显著,并呈剂量依赖性,其半数抑制浓度IC50为(81.48 ± 4.73) μmol·L-1;通过对CNE1细胞进一步的克隆形成实验,也验证了这一点;Annexin V/PI 双染法可见随着浓度的增加,凋亡比例增加;实时定量PCR技术检测显示罗汉果醇处理后,促凋亡基因Caspase-3、Bax的表达增加,抗凋亡基因Survivin、Bcl-2的表达减少。因此,罗汉果醇可能是通过促进Caspase-3、Bax等促凋亡基因和抑制Survivin、Bcl-2等抗凋亡基因的表达,来诱导肿瘤细胞凋亡,进而发挥抗肿瘤活性。
罗汉果醇, 抗肿瘤, 细胞增殖, 细胞凋亡, 凋亡基因
罗汉果为葫芦科(Cucurbitaceae)罗汉果属多年生草质藤本植物罗汉果(Momordicagrosvenorii)的干燥果实。从1977年以来,罗汉果一直被《中华人民共和国药典》收录,也是卫生部、中医药管理局批准的首批药食两用中药。罗汉果的民间药用历史已有三百多年,临床用于治疗高血压、肺结核、哮喘、胃炎、百日咳、急、慢性气管炎等疾病,药理研究表明罗汉果有止咳祛痰、泻下、保肝、增强免疫等作用(王勤和李爱媛,1999)。 罗汉果的主要有效成分为罗汉果皂苷(Mogrosides),其苷元为葫芦烷型的四环三萜罗汉果醇(Mogrol) (Kasai et al,1989)。根据苷元连接糖基的数目及连接位置的不同现已分离鉴定出20多种皂苷(Matsumoto et al,1990;斯建勇等,1996;李典鹏等,2000; Dianpeng et al, 2006,2007)。
成熟罗汉果主要富含罗汉果皂苷V,其甜度在蔗糖300倍以上,而热值几乎为零。因此,罗汉果总皂苷已广泛应用于保健食品及饮料添加行业。同时,罗汉果皂苷V具有防癌抑癌作用(Takao & Midori,2002;Takasakia et al,2003)。但罗汉果皂苷进入体内后多在消化道中被肠内细菌分泌的糖苷键水解酶水解为次生苷或者苷元,随后进入血液循环,发挥生物学活性(杨秀伟等,2007;Murata et al,2010)。也就是说罗汉果皂苷V的药理作用主要来源于其苷元,要研究罗汉果皂苷的抗肿瘤活性及作用机制,需从苷元下手。但目前尚未见关于罗汉果醇抗肿瘤活性的相关报道。本研究采用噻唑蓝实验(MTT法)、细胞克隆形成实验、Annexin V/PI 双染法检测罗汉果醇对肿瘤细胞增殖和凋亡的影响,并应用实时定量PCR技术研究其可能的作用机制。
1 材料与方法
1.1 细胞株
人前列腺癌细胞株DU145,人肝癌细胞株HepG2,人肺癌细胞株A549,人鼻咽癌细胞株CNE1和CNE2,购自中国典型培养物保藏中心。
1.2 试剂及耗材
噻唑蓝 [3-(4,5-dimethyl-2-thiazolyl)-2, 5- diphenyl-2-H-tetrazolium bromide,MTT]、二甲基亚砜(DMSO)购自Sigma公司,MTT粉末用PBS配制成浓度为5 mg·mL-1的母液后过滤除菌避光-20 ℃保存备用;DMEM培养基购自GIBCO公司;胎牛血清购自hyclone公司;胰蛋白酶(Trypsin)、细胞总RNA提取试剂盒、M-MLV逆转录试剂盒购自美国Invitrogen 公司;75 cm2培养瓶、96 孔培养板购自购于美国Corning costar 公司;双抗(Penicillin- Streptomycin,青链霉素溶液)购自美国Merck 公司;荧光定量预混试剂盒购自天根生化科技有限公司。
PBS溶液由本实验室自行配置,配方:NaCl 8.00 g,KCl 0.24 g,NaHPO3·12H2O 3.63 g,KH2PO40.20 g,溶于900 mL蒸馏水中,调pH为7.0~7.4,加水定溶至1 000 mL,120 ℃、0.5 MPa高温高压蒸汽灭菌0.5 h后,置于4 ℃冰箱中保存备用。
1.3 方法
1.3.1 细胞培养 细胞株用含10%胎牛血清(FBS)、1%链霉素和青霉素的DMEM培养液,置于37 ℃、95%湿度、含5%CO2的培养箱中培养。每1~2 d更换1次培养液,待细胞贴壁长至80%~90%融合时0.25%胰蛋白酶消化传代,继续培养。
1.3.2 罗汉果醇的制备 采用酸水解法从粗罗汉果皂苷Ⅴ(含量50%)制备获得,纯度为98.98%(陈冰等,2014),将其用DMSO溶解,配成终浓度为50 mmol·L-1,用PBS稀释成适当浓度使用。
1.3.3 MTT实验 取长至80%~90%融合的对数生长期细胞,用0.25%胰蛋白酶消化,制成2 × 104~3 × 104个·mL-1的单细胞悬液,接种于96孔板中,每孔100 μL,置于37 ℃、5% CO2的细胞培养箱中培养。培养24 h后,分别加入不同浓度的罗汉果醇,使终浓度为6.25、12.5、25.0、50.0、100.0、200 μmol·L-1,另设阴性对照组,每组设4个平行孔。继续培养72 h后,弃去50 μL培养液,每孔加入50 μL MTT(1 mg·mL-1),于培养箱中作用4 h后,吸出上清液并每孔加入100 μL的DMSO,充分震荡至结晶溶解后,使用酶标仪检测各孔在570 nm处的吸收值(OD值),实验重复3次。按以下公式计算肿瘤细胞抑制率。抑制率(Inhibitory rate,IR%)=(1-实验组平均OD值/对照组平均OD值) × 100%。用SPSS 18.0软件计算半数抑制浓度(IC50)。
1.3.4 细胞克隆形成实验 取长至80%~90%融合的对数生长期人鼻咽癌CNE1细胞,用0.25%胰蛋白酶消化,制成3 000 个·mL-1的细胞悬液,接种于六孔板中,每孔1 mL,置于37 ℃、5% CO2的细胞培养箱中培养。培养24 h后,分别加入不同浓度的罗汉果醇,使终浓度为12.5、25.0、50.0、100.0、200 μmol·L-1,另设阴性对照组,每组设2个平行复孔。培养10~15 d。当培养板中出现肉眼可见的克隆时,终止培养。用5%结晶紫染液染色20~30 min,显微镜下计算克隆形成数(克隆形成率 = 克隆数/接种细胞数 × 100%), 实验重复3次。
1.3.5 Annexin V/PI 双染法检测细胞凋亡实验 取长至80%~90%融合的对数生长期人鼻咽癌CNE1细胞,用0.25%胰蛋白酶消化,制成3×105个·mL-1的细胞悬液,接种于直径100 mm的培养皿中,每皿5 mL,置于37 ℃、5% CO2的细胞培养箱中培养。培养24 h后,分别加入不同浓度的罗汉果醇,使终浓度为12.5、25.0、50.0、100.0、200 μmol·L-1,另设阴性对照组。培养24 h后收集细胞,Annexin V-FITC/PI染色,用流式细胞仪检测细胞凋亡率。
1.3.6 实时定量PCR技术检测Caspase-3、Survivin、 Bax、Bcl-2基因mRNA 表达 取长至80%~90%融合的对数生长期人鼻咽癌CNE1细胞,用0.25%胰蛋白酶消化,制成3×105个·mL-1的细胞悬液,接种于直径100 mm的培养皿中,每皿5 mL,置于37 ℃、5%CO2的细胞培养箱中培养。培养24 h后,分别加入不同浓度的罗汉果醇,使终浓度为12.5、25.0、50.0、100.0、200 μmol·L-1,另设阴性对照组。培养24 h后收集细胞,用Trizol裂解提取RNA,逆转录为cDNA。以cDNA为模板进行PCR反应。Caspase-3上游引物序列为5′-GACATACTCCTTCCATCAA-3′,下游引物序列为5′-ATTCATAGCACAGCATCA-3′;Survivin上游引物序列为5′-ATGGGTGCCCCGACGTTGCCCCCT-3′,下游引物序列为5′-TCAATCCATGGCAGCCAGCTGCTCG-3′; Bax上游引物序列为5′-GGCCCACCAGCTCTGAGCAGA-3′,下游引物序列为5′-GCCACGTGGGCGTCCCAAAGT-3′; Bcl-2上游引物序列为5′-GTGGAGGAGCTCTTCAGGGA-3′,下游引物序列为5′-AGGCACCCAGGGTGATGCAA-3′;GAPDH为内参基因,上游引物序列为5′-AGAAGGCTGGGGCTCATTTG-3′,下游引物序列为5′-AGGGGCCATCCACAGTCTTC-3′。荧光定量 PCR反应体系为7 μL ddH2O、1 μL cDNA、10 μL Super Red PreMix Plus、1 μL Primer(-F)、1 μL Primer(-R)。反应条件为95 ℃预变性1 min,95 ℃变性15 s,57~62 ℃退火20 s(其中Bcl-2 57.5 ℃,Caspase-3、Survivin 59.5 ℃,Bax 61.5℃),72 ℃延伸45 s,共35个循环。用相对定量方法(2-△△Ct)进行数据分析,扩增效率应为90%~110%。其中△△Ct=(Ct目的基因-Ct内参基因)待测组-(Ct目的基因-Ct内参基因)对照组。
2 结果与分析
2.1 罗汉果醇对不同肿瘤细胞增殖的抑制作用
罗汉果醇对DU145、HepG2、A549、CNE1、CNE2细胞的增殖均有明显的抑制作用(表1)。从表1的IC50值可以看出,罗汉果醇对鼻咽癌CNE1细胞增殖的抑制作用强于其它几种细胞株,因此我们选择CNE1细胞进行后续研究。
表 1 罗汉果醇对不同肿瘤细胞的半数抑制浓度
Table 1 Half inhibitory concentration of mogrol on different tumor cells
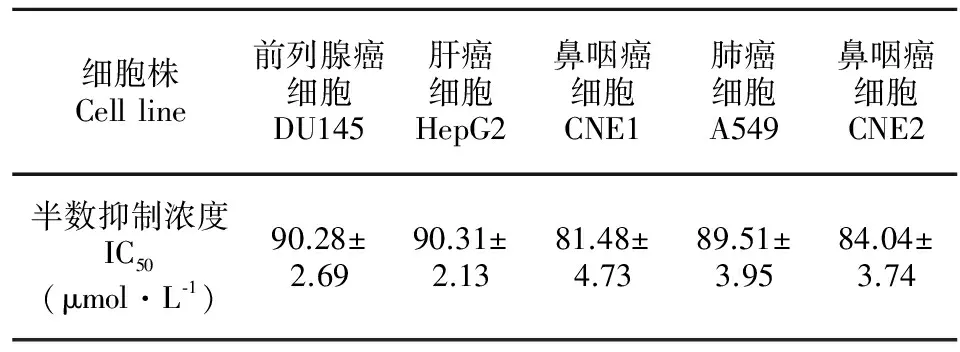
细胞株Cellline前列腺癌细胞DU145肝癌细胞HepG2鼻咽癌细胞CNE1肺癌细胞A549鼻咽癌细胞CNE2半数抑制浓度IC50(μmol·L⁃1)90.28±2.6990.31±2.1381.48±4.7389.51±3.9584.04±3.74
2.2 不同浓度罗汉果醇对CNE1细胞增殖的抑制作用
图1显示,不同浓度的罗汉果醇对CNE1细胞具有不同的抑制作用,随着浓度的上升,抑制率不断增加,在浓度为200 μmol·L-1时,抑制率达到了100%。在罗汉果醇处理鼻咽癌CNE1细胞48 h后,在显微镜下观察发现,在高浓度下,细胞极度皱缩,细胞核凝缩,板底已可见碎渣样物质;在中浓度下,细胞体积缩小、贴壁率降低,且部分呈碎块状;在低浓度下的细胞与对照组细胞相比,细胞形态没有明显的区别,如图2所示。这从形态学上表明,不同浓度的罗汉果醇对CNE1细胞的抑制程度不同。
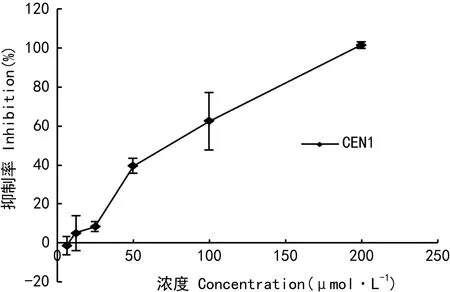
图 1 不同浓度罗汉果醇对CNE1细胞增殖的抑制作用Fig. 1 Inhibition of different concentrations of mogrol on the proliferation of CNE1 cells
2.3 发罗汉果醇对鼻咽癌CNE1细胞克隆形成的抑制作用
克隆形成率反映了细胞群体依赖性和增殖能力两个重要性状。为了进一步检测罗汉果醇对CNE1细胞增殖能力的影响,我们进行了克隆形成实验。通过对形成的克隆进行计数并计算克隆形成率,结果发现不同浓度的罗汉果醇(50、100、200 μmol·L-1)处理CNE1细胞后,形成的克隆数各不相同(图3),50、100、200 μmol·L-1罗汉果醇处理组的克隆形成率分别为(72.45 ± 13.67)%、 (18.45% ± 7.51)%和(12.64% ± 8.66)%。其中,100、200 μmol·L-1罗汉果醇处理组与对照组 [(71.33 ± 15.92)%]相比,差异具有显著性(P<0.05)。这进一步验证罗汉果醇对CNE1细胞增殖的抑制作用。
2.4 罗汉果醇对鼻咽癌CNE1细胞凋亡的影响
细胞凋亡是指在一定的生理或病理条件下,为维持内环境稳定,由基因控制的细胞自主的有序的死亡。研究表明,大量的小分子化合物通过诱导细胞凋亡,进而发挥抗肿瘤活性。为了检测罗汉果醇是否通过诱导肿瘤细胞凋亡而抑制其增殖,我们采用Annexin V/PI 双染流式细胞术对不同浓度的罗汉果醇诱导CNE1细胞凋亡的水平进行了评估。如图4所示,罗汉果醇作用24 h后,阴性对照组细胞凋亡率为3.2%,不同浓度罗汉果醇 (25、50、100 μmol·L-1)的细胞凋亡率依次为5.4%、14.9%、24.9%,说明罗汉果醇能诱导CNE1细胞凋亡,且诱导CNE1细胞凋亡的效果具有浓度依赖性。因此,罗汉果醇对肿瘤细胞增殖的抑制作用,在一定程度上是通过诱导细胞凋亡实现的。
2.5 罗汉果醇对CNE1细胞Caspase-3、Survivin、 Bax、Bcl-2基因mRNA 表达的影响
细胞凋亡是一个受到严格调控的过程,它受到促凋亡基因(如Caspase-3、Bax等)和抗凋亡基因(如Survivin、Bcl-2等)的平衡调控。为了研究罗汉果醇诱导CNE1细胞凋亡的机理,我们用实时定量PCR技术检测了罗汉果醇处理24 h后,CNE1细胞中Caspase-3、Survivin、 Bax、Bcl-2等基因mRNA的表达水平。如图5所示,Survivin基因mRNA的表达明显受到抑制,在25 μmol·L-1时,表达量减少至对照的67.13%,随着浓度的升高,抑制程度随之增强,在100 μmol·L-1时,降至对照的37.5%;Caspase-3基因mRNA的表达明显增强,在100 μmol·L-1罗汉果醇处理时,表达量升至对照组的4.6倍,且成一定的浓度依赖性;Bcl-2基因mRNA的表达受到轻微的抑制,在100 μmol·L-1时,表达量也只是对照组的70.3%; Bax基因mRNA的表达量在用12.5 μmol·L-1和25 μmol·L-1罗汉果醇处理时,表达量与对照组相比,表达量基本无明显变化,到50 μmol·L-1时,表达量才有明显上升,在100 μmol·L-1时,是对照组的3.8 倍。这些结果表明,罗汉果醇通过上调Caspase-3、Bax等促凋亡基因和下调Survivin、Bcl-2等抗凋亡基因的表达,进而诱导CNE1细胞凋亡。
3 讨论与结论
在用药物治疗肿瘤的过程中,细胞凋亡起着非常重要的作用,因为大多数的抗肿瘤药物是通过诱导肿瘤细胞凋亡来发挥它们的抗肿瘤效应的。本研究通过MTT实验发现罗汉果醇对CNE1细胞的增殖有明显的抑制作用,且具有浓度依赖性,细胞克隆形成实验进一步验证了这一点。Annexin V/PI 双染流式细胞术发现罗汉果醇可诱导CNE1细胞发生凋亡,且随着浓度的上升,凋亡率随之增加。因此罗汉果醇可能通过诱导肿瘤细胞发生凋亡,从而抑制肿瘤细胞的增殖,发挥抗肿瘤作用。在肿瘤细胞中凋亡相关基因的调控起着重要的作用,它们的突变、缺失和过表达, 都将会使细胞增殖失去控制或凋亡受到阻碍。Caspase 家族在介导细胞凋亡的过程中起着非常重要的作用,其中Caspase-3是细胞凋亡过程中发挥重要功能的凋亡执行蛋白之一,它在凋亡信号传导的许多途径中发挥功能,Caspase-3基因的过表达会诱导细胞发生凋亡。Survivin是至今发现的凋亡抑制蛋白家族(Inhibitor of apoptosis protein,IAP)中作用最强的凋亡抑制蛋白之一,具有肿瘤特异性,只表达于肿瘤和胚胎组织中。闵玲等(2003)研究表明,Survivin在CNE1细胞中表达。其表达的程度与肿瘤的发展及预后密切相关(Rosenblatt et al,2008;Weiss et al, 2009;Nouraee et al,2009)。Survivin直接作用于Caspase,主要通过抑制Caspasc-3和Caspasc-7的活性来阻断各种刺激诱导的细胞凋亡过程。本研究结果表明,罗汉果醇作用于CNE1细胞后Survivin基因mRNA 表达降低,Caspase-3基因mRNA的表达增强。表明罗汉果醇可能是通过降低survivin的表达,使肿瘤细胞的凋亡抑制作用减弱,从而上调Caspase-3的表达,促使肿瘤细胞发生凋亡。Bcl-2是抑制凋亡作用的基因,能够通过阻碍损伤的DNA转录出有激活细胞凋亡相关基因信号或阻止相关基因产物产生的作用以抑制细胞的凋亡。Bax是促细胞凋亡的基因,其中21%的氨基酸与Bcl-2同源,能够与抗凋亡基因Bcl-2形成异源二聚体抑制Bcl-2,从而促进细胞凋亡的作用。Bcl-2与Bax的比率决定了细胞的凋亡与否,当Bax居多时,Bcl-2被抑制,凋亡也随之被诱导;反之,则Bax会受到抑制,即细胞凋亡被抑制,细胞得以继续生存(Yin et al,1994)。本文中Bax基因mRNA表达增多,Bcl-2基因mRNA表达被抑制,表明罗汉果醇可能通过促进Bax的表达,抑制Bcl-2的表达来诱导细胞凋亡。罗汉果醇可以通过诱导细胞凋亡,从而抑制肿瘤细胞的增殖,发挥抗肿瘤作用,但其确切抗肿瘤活性有待于在动物水平上进一步研究。

图 2 罗汉果醇对CNE1细胞形态的影响 A. 对照; B. 低浓度(25 μmol·L-1); C. 中浓度(100 μmol·L-1); D. 高浓度(200 μmol·L-1)。Fig. 2 Effects of mogrol on the morphology of CNE1 cells A. Control; B. Low concentration (25 μmol·L-1); C. Medium concentration(100 μmol·L-1); D. High concentration (200 μmol·L-1).
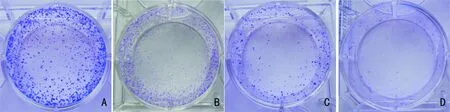
图 3 罗汉果醇CNE1细胞克隆形成的影响 A. 对照; B. 50 μmol·L-1; C. 100 μmol·L-1; D. 200 μmol·L-1。Fig. 3 Effects of mogrol on the colony formation of CNE1 cells A. Control; B. 50 μmol·L-1; C. 100 μmol·L-1; D. 200 μmol·L-1.

图 4 罗汉果醇对鼻咽癌CNE1细胞凋亡的影响 A. 对照; B. 25 μmol·L-1; C. 50 μmol·L-1; D. 100 μmol·L-1。Fig. 4 Effects of mogrol on the apoptosis of CNE1 cells A. Control; B. 50 μmol·L-1; C. 100 μmol·L-1; D. 200 μmol·L-1.

图 5 罗汉果醇对CNE1细胞mRNA 表达的影响 A. Survivin; B. Caspase-3; C. Bcl-2; D. Bax; 与对照组相比,*表示差异显著(P<0.05)。Fig. 5 Effects of mogrol on the expression of mRNA in CNE1 cells A. Survivin; B. Caspase-3; C. Bcl-2; D. Bax; Compared with the control group, *means significant differences (P<0.05).
CHEN B, YANG XR, XU F,et al, 2014. Study on the preparation and metabolism of mogrol in rats [J]. Guihaia, 34(2):198-202. [陈冰, 羊学荣, 徐风, 等, 2014. 罗汉果醇的制备及大鼠体内代谢研究 [J]. 广西植物, 34(2): 198-202.]DIANPENG LI, TSUYOSHI IKEDA, NANAE MATSUOKA, et al, 2006. Cucurbitane glycosides from unripe fruits of Lo Han Kuo (Siraitiagrosvenori) [J]. Chem Pharm Bull, 54(10):1425-1428.
DIANPENG LI, TSUYOSHI IKEDA, TOSHIHIRO NOHARA, et al, 2007. Cucurbitane glycosides from unripe fruits ofSiraitiagrosvenori[J]. Chem Pharm Bull, 55(7):1082-1086.KASAI R, NIE RUILIU, NASHI K, et al, 1989. Sweet cucurbitane glycosides from fruits of siraitia siamensic (chi-zi Luo-han-guo) a Chinese folk medicine [J]. Agric Biol Chem, 53(12):3374.
KONOSHIMA T, TAKASAKI M, 2002. Cancer-chemopreventive effective of natural sweeteners and related cpmpounds [J]. Pure Appl Chem, 74(7):1309-1316.
LI DP, ZHANG HR, 2000. Studies and uses of Chinese medicion Luohanguo-a special local product of Guangxi [J]. Guihaia, 20(3):270-276. [李典鹏, 张厚瑞, 2000. 广西特产植物罗汉果的研究与应用 [J]. 广西植物, 20(3):270-276. ]
MATSUMOTO K, KASAI R, OHTANI K,et al, 1990. Minor cucurbitane glycosides from fruits ofSiraitiagrosvenorii(cucurbitancaae) [J]. Chem Pharm Bull, 38(7):2030.
MIN L,ZHOU KY, ZHANG YF, et al, 2003. Transcription and expression of survivin gene in two cell lines of nasopharyngeal carcinoma [J]. Chin J Canc Prev Treat, 10(7):691-693. [闵玲, 周克元, 张月飞, 等, 2003. 鼻咽癌细胞中Survivin基因的转录和表达 [J]. 肿瘤防治杂志, 10(7):691-693.]
MURATA Y, OGAWA T, SUZUKI YA, et al, 2010. Digestion and absorption ofSiraitiagrosvenoriitriterpenoids in the rat [J]. Biosci Biotechnol Biochem, 74(3):673-676.
NOURAEE N, MOWLA SJ, OZHAND A, et al, 2009. Expression of survivin and its spliced variants in bladder tumors as a potential prognostic marker [J]. Urol J, 6(2):101-108.
ROSENBLATT R, JONMARKER S, LEWENSOHN R, et al, 2008. Current status of prognostic immunohistochemical markers for urothelial bladder cancer [J]. Tum Biol, 29(5):311-322.
SI JY, CHEN DH, CHANG Q, et al, 1996. Isolation and determination of cucurbitane-glycosides from fresh fruits ofSiraitiagrosvenorii[J]. Integr Plant Biol, 38(6):489-494. [斯建勇, 陈迪华, 常琪, 等, 1996. 罗汉果中三萜苷的分离和结构测定 [J]. 植物学报, 38(6):489-494. ]
TAKASAKIA M, KONOSHIMA T, MURATA Y, et al, 2003. Anticarcinogenic activity of natural sweeteners, cucurbitane glycosides, fromMomordicagrosvenori[J]. Canc Lett, 198:37-42.
WANG Q, LI AY, 1999. Pharmacologicl research ofMomordicagrosvenori[J]. Chin Mat Med, 24(7):425-428. [王勤, 李爱媛, 1999. 罗汉果醇的药理作用研究 [J]. 中国中药杂志, 24(7):425-428.]
WEISS C, VAN RSMER F, CAPALBO G, et al, 2009. Survivin expression as a predictive marker for local control in patients with high-risk T1 bladder cancer treated with transurethral resection and radiochemotherapy [J]. Radiat Oncol Biol Phys, 74(5):1455-1460.YANG XW, ZHANG JY, XU W, 2007. Biotransformation of Mogroside Ⅲ by human intestinal bacteria [J]. J Peking Univ, 39(6): 657-662. [杨秀伟, 张建业, 徐嵬, 2007. 罗汉果皂苷Ⅲ的人肠内细菌生物转化 [J]. 北京大学学报, 39(6): 657-662.]
YIN XM, OLTVAI ZN, KORSMEGER SJ, 1994. BH1 and BH2 domains Bcl-2 are required for inhibition of apoptosis and heterodimerization with Bax [J]. Nature, 369(6478): 321-323.
Activity and mechanism of anticancer properties of mogrol
FU Yu-Xia1,2, WANG Lei2, LI Dian-Peng2*
( 1.GuangxiNormalUniversity, Guilin 541004, Guangxi, China; 2.GuangxiKeyLaboratoryofFunionalPhytochemicalsResearchandUtilization,GuangxiInstituteofBotany,GuangxiZhuangAutonomousRegionandChineseAcademyofSciences, Guilin 541006, Guangxi, China )
Mogrol is the aglycone of mogrosides, and it is reported that Mogroside V has good cancer prevention and anti-cancer efficacy. This study was to explore the inhibitroy effects of mogrol against proliferation of human nasopharyngeal cancer CNE1 cells, and the molecular mechanism of apoptosis induced by mogrol. The inhibitory activities of different tumor cells were assessed by MTT assay. The concentration-dependent inhibition by mogrol on the most sensitive CNE1 cells were further studied. Cell clonogenicity was detected by colonyforming assay to further verification the inhibition of mogrol on the proliferation of CNE1 cells. And the apoptosis was examined by Annexin V/PI double staining. To further analyze the apoptosis mechanism of cell apoptosis, we detected the Caspase-3, Survivin, Bax and Bcl-2 mRNA expression levels in CNE1 cells after treating with mogrol by real time-PCR. The results showed that mogrol could significantly inhibit the proliferation of DU145, HepG2, A549, CNE1, CNE2 cells, the inhibitory effect of CNE1 cells was the most significant and in a dose-dependent manner, the IC50was (81.48 ± 4.73) μmol·L-1. The colonyforming assay also verified that mogrol could inhibit the proliferation of CNE1 cells. Apoptosis of CNE1 cells was examined by Annexin V/PI double staining, the apoptosis rate was increased with concentration. Real time-PCR showed that mogrol could promote the expression of Caspase-3, Bax genes and inhibit the expression of survivin, Bcl-2 genes. Therefore, mogrol can probably induce the apoptosis of tumor cells, and result in anti-tumor activity, by promoting the expression of Caspase-3, Bax and other pro-apoptotic genes and inhibiting the expression of survivin Bcl-2 and other anti-apoptotic genes.
mogrol, antineoplastic, cell proliferation, apoptosis, apoptotic genes
10.11931/guihaia.gxzw201502025
2015-11-23
2016-02-25
国家自然科学基金(81160392,81160518,21562009) [Supported by the National Natural Science Foundation of China(81160392,81160518, 21562009)]。
符毓夏(1988-),女,广西钦州人,硕士,细胞生物学专业,(E-mail)fuyusha88@163.com。
*通讯作者: 李典鹏,博士,研究员,硕士研究生导师,从事天然药物化学成分研究,(E-mail)ldp@gxib.cn。
Q946, R285
A
1000-3142(2016)11-1369-07
符毓夏, 王磊, 李典鹏. 罗汉果醇抗肿瘤活性及其作用机制研究 [J]. 广西植物, 2016, 36(11):1369-1375
FU YX, WANG L, LI DP. Activity and mechanism of anticancer properties of mogrol [J]. Guihaia, 2016, 36(11):1369-1375

