当归饮片蛋白质的提取与活性分析
潘剑茹, 张小梅, 李玲玲, 王香玲, 吴伦巧, 陈莉娟, 李 娴
( 福州大学 生物科学与工程学院, 福州 350108 )
当归饮片蛋白质的提取与活性分析
潘剑茹*, 张小梅, 李玲玲, 王香玲, 吴伦巧, 陈莉娟, 李 娴
( 福州大学 生物科学与工程学院, 福州 350108 )
当归是传统的补血中药,其所含的多糖与小分子已有大量的研究,然而当归中的蛋白质组成与功效仍无人知晓。该研究通过0.05 mol·L-1Tris-HCl(pH=8.0)缓冲液浸提和组织匀浆得到当归饮片粗提液,结合硫酸铵沉淀和透析法去除粗提液中的多糖及还原糖等小分子成分,得到当归饮片总蛋白质,并首次对其组成和生物活性进行了研究。结果表明:当归饮片蛋白含量较高,分子量为17.5~90.7 kDa,其中 17.5 kDa的蛋白含量最高,达47%。饮片蛋白在pH 5~11范围内较为稳定,pH为3时,仅余少量17.5 kDa的蛋白。当归饮片蛋白质中至少有3种蛋白在80 ℃内稳定存在,其中热稳定性最好的是17.5 kDa的蛋白,在热处理温度达到100 ℃时,仍然稳定存在,但随着处理时间的延长,该蛋白有部分单体发生了交联反应。当归饮片蛋白质具有清除DPPH自由基的能力,且该能力随着热处理温度及热处理时间的增加而增加,pH处理会影响该能力,pH为5.0时,清除能力最高,5.0两侧清除能力均下降。此外,当归饮片蛋白质对细胞有很强的选择性,表现为对正常肝细胞L-02有显著的增殖作用(1.0~4.0 mg·mL-1,P<0.01),对白血病细胞K562则表现出显著的抑制作用(0.5~1.5 mg·mL-1,P<0.01),当归饮片蛋白浓度为1.0 mg·mL-1时,可使L-02细胞增值率达550% (P<0.01),而K562细胞的抑制率达18.3% (P<0.01)。综上所述,当归饮片饮片蛋白具有重要的生物活性,可望从中开发出具有保肝作用的药物蛋白。
当归饮片, 蛋白质, 稳定性, DPPH自由基, 细胞增殖
当归(Angelicasinensis)为伞形科多年生草本植物当归的干燥根,其在中国、韩国和日本,作为香料、补药或药物,已有一千多年的使用历史,至今仍作为一种传统中药在中国中医界广泛使用(Williamson et al,2013)。它通常用于治疗贫血,促进血液循环,缓解疼痛和治疗便秘,但主要用于女性生殖问题的治疗,如痛经,闭经,并用于分娩或手术后失血过多的辅助“补血”(Wu et al,2005)。此外,当归常与其他草药配伍使用,如著名的四物汤(何瑶等,2012)等,或作为药食两用的药用食物用于煮肉炖汤。中国的当归主产于甘肃、云南和四川,但是长期以来,无论产量还是质量,都是甘肃岷县一带量多且上乘,所以甘肃岷县的当归被誉为“道地药材”(严辉等,2009)。
到目前为止,人们对当归进行了大量的研究,研究主要集中于当归的化学成分分析(吴燕燕等,2008;宋秋月等,2011)、炮制工艺(宋金春等,2007;吴志成等,2014)、抽提液的生物学效应(刘凯等,2012;刘芳等,2015)、配伍效果(李伟霞等,2012;李淑娇等,2014)等。早期研究认为当归中的主要化学成分为藁苯内酯类的挥发油和阿魏酸,以之作为当归的有效成分并用以鉴定当归品种的质量(中华人民共和国药典,2010)。近年来,人们发现当归中还含有香豆素、黄酮、有机酸、多糖、微量元素及维生素等多种具有生物学效应的成分(倪竹南等,2007)。特别是当归多糖,其含量丰富,在补血方面具有双向调节作用,在抗肿瘤、抗辐射、抗氧化、抗病毒等方面也具有良好的效果(李成军等,2007)。以上研究丰富了当归的药理作用,但当归的有效成分就是这些小分子和多糖吗?这个问题的答案仍不明朗,因为迄今为止,人们对当归中重要的高分子物质——“当归蛋白质”的组成和作用仍一无所知。为此,本研究制备了当归饮片蛋白,并对当归饮片蛋白的组成、稳定性及其生物活性等方面进行了研究,以评估其开发和应用的潜力。
1 材料与方法
1.1 材料与仪器
当归饮片购自北京同仁堂(毫州)饮片有限责任公司。BCA试剂盒购自美国 Thermo science,DPPH购自美国sigma公司,其余试剂均属国产分析纯试剂。人正常肝细胞株L-02和人白血病细胞株K562购自中国科学院上海生科院细胞资源中心。
电热恒温水浴HWSH12(上海一恒科技有限公司);高速离心机CF15RX型(日本HITACHI公司);电子分析天平BS 124 S(德国SARTORIUS公司);磁力搅拌器Color Squid(德国IKA公司); pH计(德国METTLER-TOLEDO);日立U-1900比例光束分光光度计(日本日立公司);Synergy多功能酶标仪(美国Biotek公司)。
1.2 方法1.2.1 当归饮片蛋白质的抽提与制备 称取20.00 g当归饮片,按1∶10的料液比(w/v)加入0.05 mol·L-1Tris-HCl 缓冲液(pH 8.0),4 ℃浸泡过夜后反复匀浆4次,每次匀浆1 min,然后用四层纱布过滤,滤液离心(12 000 r·min-1)15 min,取上清液,得到当归饮片粗提液。往粗提液中加入硫酸铵至80%终饱和度,待当归蛋白完全沉淀,离心(12 000 r·min-1)15 min,取沉淀按1∶2比例添加0.05 mol·L-1Tris-HCl 缓冲液(pH8.0),充分震荡溶解,离心(12 000 r·min-1)15 min,取上清液,透析脱盐,制得当归总蛋白。
以牛血清白蛋白作为标准蛋白,采用BCA试剂盒法分别测定当归饮片粗提液和当归饮片总蛋白的蛋白含量;以葡萄糖为标准制作标准曲线,用蒽酮硫酸法(Babu et al,1987) 分别测定当归饮片粗提液和当归饮片总蛋白的总糖含量。以SDS-PAGE法(Laemmli,1970)分析当归饮片全蛋白。电泳采用12.5%分离胶,考马斯亮蓝法染色,使用Image J 软件分析相关电泳条带的分子量和含量。1.2.2 当归饮片蛋白质清除DPPH自由基活性 按照Blois的方案测定清除DPPH自由基的活性(Blois,1958)。准确称取20 mg DPPH用无水乙醇定容于250 mL容量瓶中,得到浓度为2×10-4mol·L-1的DPPH溶液。取 2 mL 不同浓度的样品液,加入 2 mL 2 × 10-4mol·L-1的 DPPH 溶液,混匀,反应 30 min 后测定 517 nm 处的吸光值Ai,同时测定 2 mL DPPH + 2 mL 乙醇的吸光值A0和 2 mL 样品液 + 2 mL 乙醇混合后的吸光值Aj。以溶剂无水乙醇调零。
DPPH自由基的清除率: 清除率(%)=[1-(Ai-Aj)/A0]×100%
1.2.3 当归饮片蛋白质的稳定性分析 取1.2.1所得当归饮片蛋白质,分别用下述方法处理后,分别进行SDS-PAGE和DPPH自由基清除活性分析,以研究当归饮片全蛋白经不同处理后的稳定性。
(1)热处理温度稳定性:将当归饮片蛋白质分别于室温(28 ℃)、40、60、80和100 ℃静置30 min,离心(12 000 r·min-1)15 min,取上清。
(2)热处理时间稳定性:将当归饮片蛋白质分别沸水浴0.5、1、1.5和2 h,离心(12 000 r·min-1)15 min,取上清。
(3)pH处理稳定性:将当归饮片蛋白质分别调至pH 3、5、7、9和11,静置30 min,离心(12 000 r·min-1)15 min,取上清。
1.2.4 当归饮片蛋白对细胞增殖能力的影响(MTT法) 取对数生长期的人正常肝细胞株L-02和人白血病细胞株K562,用含10% 小牛血清的RPMI 1640培养液配成5 × 105·mL-1的悬液,接种于96孔板内,培养至贴壁。对照组只加入基础培养液,实验组加入不同浓度的当归饮片总蛋白,每组设三个复孔。加好样的96孔板置于37 ℃,含5% CO2的培养箱中培养24 h后,离心(1 200 r·min-1)5 min,甩去上清。向板内加入MTT[3-(4,5-二甲基吡啶-2-基)-2,5- diphenyltetrazoliumbromide]溶液50 μL,37 ℃继续培养4 h,再加入DMSO溶解液,混匀, 30 min后通过酶联检测仪测定OD570,空白试剂调零。
式中,A1为实验组OD570值,A2为对照组OD570值。1.2.5 统计学处理 采用Excel软件进行统计处理,作标准差计算、t检验等。以P>0.05为相差无显著性。
2 结果与分析
2.1 当归饮片蛋白质的制备
每克当归饮片中含有(606.5 ± 6.41) mg多糖,(42.9 ± 0.6) mg还原糖,(51.8 ± 0.1) mg蛋白。为排除其他活性组分的影响,本研究通过硫酸铵沉淀除去了99.92%的多糖,并通过透析除去了还原糖等小分子活性组分和盐,得到当归饮片总蛋白。
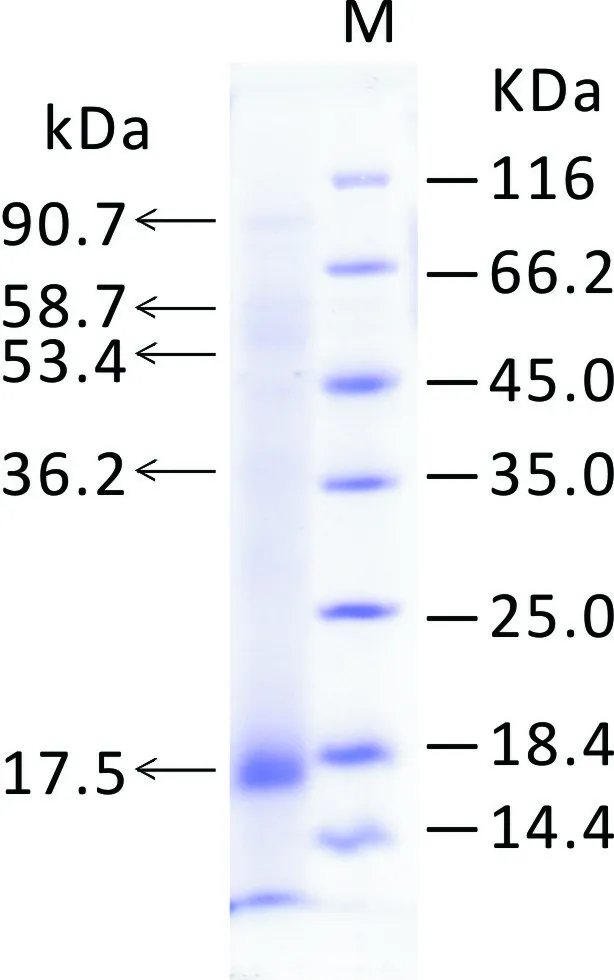
图 1 当归饮片中的蛋白组分Fig. 1 Protein constituent of the decoction pieces of Chinese Angelica
当归饮片中的蛋白质组成如图1所示。由图1可知, 当归饮片蛋白的分子量分布范围为 17~90 kDa,
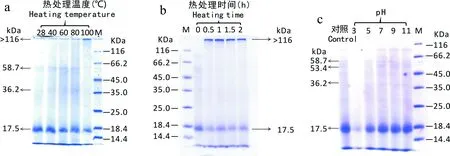
图 2 当归饮片蛋白的热处理温度(a)、热处理(100 ℃)时间(b)及pH稳定性(c)Fig. 2 Heating temperature (a), heating(100 ℃ ) time (b) and pH-dependent stability (c) of the protein of the decoction pieces of Chinese Angelica
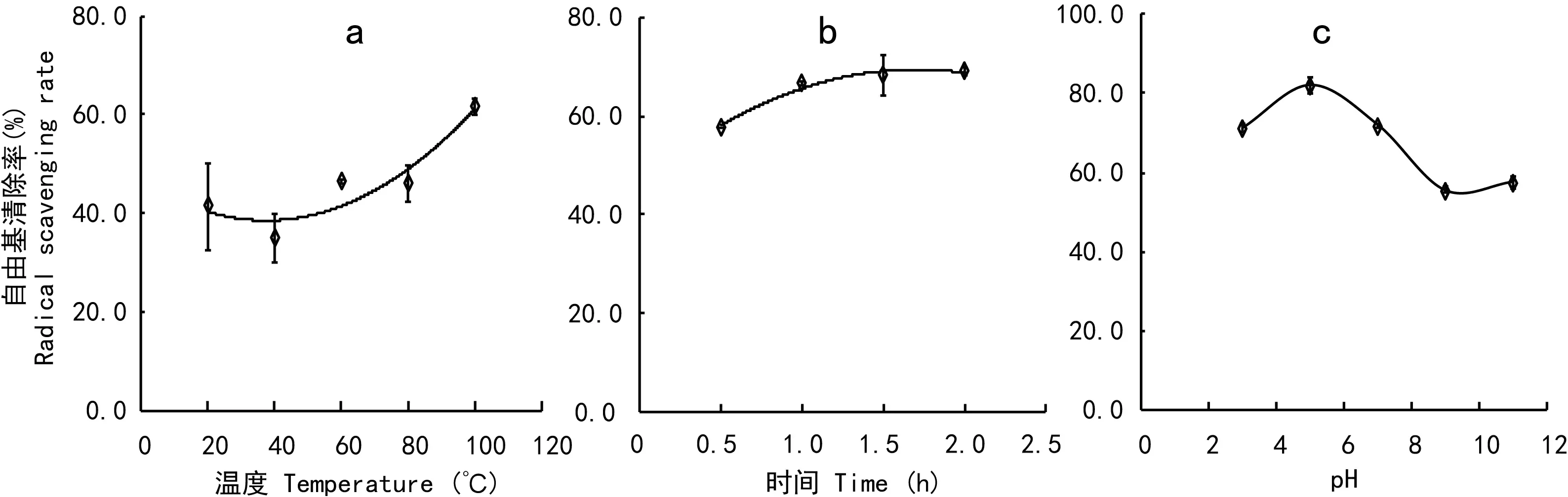
图 3 热处理温度(a)、沸水浴热处理时间(b)及pH(c)对当归饮片蛋白清除DPPH自由基的能力的影响Fig. 3 Effects of heating temperature (a), heating(100 ℃) time (b) and pH (c) on DPPH radical scavenging ability of the protein of the decoction pieces of Chinese Angelica
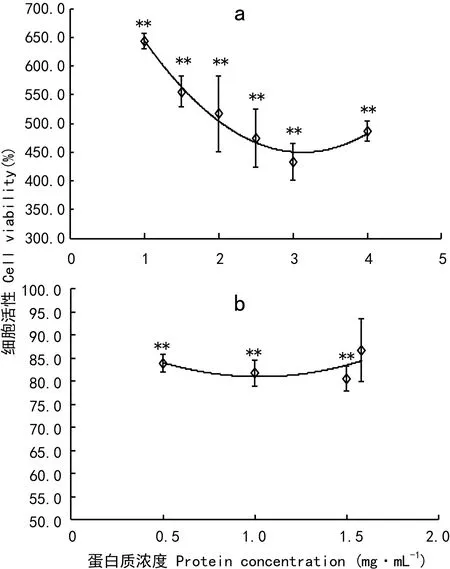
图 4 当归饮片蛋白质对(a)正常人肝细胞株L-02和 (b)人白血病细胞株K562增殖能力的影响 每组3个平行,与对照组相比,**P<0.01。Fig. 4 Effects of the protein of the decoction pieces of Chinese Angelica on cell viability in (a)L-02 and (b) K562 cells n=3, compared with control group, **P<0.01.
其主要蛋白质的分子量分别为17.5、36.2、53.4、58.7和90.7 kDa,其中含量最高的蛋白分子量为17.5 kDa,约占当归饮片总蛋白的 47%。
2.2 当归饮片蛋白质的稳定性
如图2:a所示,当处理温度小于80 ℃时,当归饮片蛋白中分子量为58.7、36.2和17.5 kDa的蛋白基本稳定存在,100 ℃热处理后,前两条蛋白条带消失不见,仅余分子量17.5 kDa的蛋白,与此同时,电泳分离胶顶部出现分子量超过116 kDa的新蛋白条带。
在此基础上,本研究逐渐延长了当归饮片蛋白沸水浴的时间,以进一步检验当归饮片蛋白的热稳定性,结果如图2:b所示。由图可知,分子量为17.5 kDa的蛋白热稳定性好,100 ℃处理2 h仍保持溶解性,在图2:a中新出现的高分子量蛋白在沸水浴过程中一直稳定存在。
当归饮片蛋白的pH稳定性如图2:c所示。由图可知,当归饮片蛋白在pH 7~11的范围内稳定性好,在酸性pH范围内,随pH的下降,溶解性逐渐降低,当pH=3时,大部分蛋白条带消失,实验过程可看到絮状物存在,经离心有沉淀,但17.5 kDa的蛋白仍保持少量的可溶性。
2.3 当归饮片蛋白质清除DPPH自由基活性
本研究发现来自当归饮片的蛋白质具有清除DPPH自由基的能力,如图3所示。该能力随蛋白质热处理温度的增加而增加(图3:a, b),在100 ℃处理2 h,该能力不仅没有下降,反而继续上升(图3:b)。如图3:c所示,在pH 3~11的范围内,当归饮片蛋白质都具有清除DPPH自由基的能力,在pH 3~5的范围内,蛋白质清除自由基的能力随pH升高而加强,在pH=5时,蛋白质清除自由基的能力最强,pH 超过5后,蛋白质清除自由基的能力随pH升高而缓慢下降,在pH 9~11的范围内下降的趋势趋于平稳。
2.4 当归饮片蛋白对细胞增殖能力的影响
由图4:a可知,当归饮片蛋白质对正常人肝细胞株L-02有极显著的增殖作用,蛋白质浓度为1.0 mg·mL-1时,细胞活力高达650%(P<0.01),在1.0~3.0 mg·mL-1的剂量范围内,增殖作用逐渐减低,但最低也有近450%的细胞活力(P<0.01),在3.0~4.0 mg·mL-1的剂量范围内,增殖作用逐渐回升(P<0.01)。
对于人白血病细胞株K562(图4:b),当归饮片蛋白质则表现出显著的抑制作用,在0.5~1.5 mg·mL-1的剂量范围内,抑制作用先逐渐减低,再逐渐增加,但整体变化不大,细胞活力基本为80%左右(P<0.01)。
3 讨论与结论
本研究利用硫酸铵沉淀法得到当归饮片中的蛋白质,并首次对其进行了研究。本研究中,当归饮片蛋白含量较高,分子量分布广,其中以分子量17.5 kDa的蛋白含量最高,达47%,稳定性也最好。当归饮片蛋白质具有清除DPPH自由基的能力,对正常人肝细胞株L-02有极显著的增殖作用,对人白血病细胞株K562则表现出显著的抑制作用。
蛋白质作为具有重要功能的生物大分子,通常对温度很敏感,高温下会变性沉淀。因此,对于需要煎煮服用的中草药,人们的研究对象通常不是其中的蛋白质,而是多糖和各种小分子。本研究结果表明,中草药中存在耐高温的蛋白质,且其在高温下依然有生物活性。当归饮片中的蛋白质就属于这样的类型。本研究中,当归饮片蛋白质中至少有3种蛋白在80 ℃内稳定存在,尤其是含量最高的17.5 kDa的蛋白,在热处理温度达到100 ℃时,仍然稳定存在,其他蛋白条带则均已消失。在100 ℃的热处理温度下,随着处理时间的延长,该蛋白含量逐渐下降,但有高分子量蛋白条带随之出现,这表明在100 ℃的热处理过程中,该蛋白有部分单体发生了交联反应。当归饮片蛋白稳定性好可能与其制作过程有关。当归饮片为当归生药除去杂质,洗净,润透,切薄片,低温干燥而成。当归生药中含有还原糖,在饮片制作过程中,生药中的蛋白质和糖可能发生了美拉德反应,而使蛋白质带上糖基,从而增强了蛋白质的稳定性。更有趣的是,当归饮片蛋白质清除DPPH自由基的能力非但不会因高温处理而丧失,反而随着处理温度的上升和处理时间的延长而增加。由于100 ℃的热处理过程中,当归饮片蛋白仅为17.5 kDa的蛋白及其交联产物,因此清除DPPH自由基的能力的增加可能与17.5 kDa的蛋白在高温处理过程中构象的变化和分子间的交联有关,其具体的原因有待进一步的探讨。
此外,本研究还通过了MTT实验来初步探索了当归饮片蛋白对细胞的生物学效应。该方法是非常成熟的药物筛选技术,已广泛应用于生物活性因子的活性检测、大规模的抗肿瘤药物筛选、细胞毒性试验等。通过该实验,本研究发现当归饮片蛋白质(1 mg·mL-1)能极显著地促进正常人肝细胞增殖,使其细胞活力高达650%(P<0.01),同时对白血病细胞却具有显著的抑制作用,使其细胞活力降至80%左右(P<0.01),这与中医中的“扶正祛邪”的说法相仿。迄今为止,已发现的具有细胞增殖能力的物质很多,但能选择性促进正常细胞增殖同时又能抑制肿瘤细胞增殖的物质少之又少,当归饮片蛋白质非凡的促肝细胞增殖能力和选择性使其具有巨大的开发和应用潜力。下一步将深入寻找具有促肝细胞增殖能力的蛋白质并探究其保肝机理。
BABU LS, JAISINGH K, RAMESH S, 1987. A modified anthrone-sulfuric acid method for the determination of fructose in the presence of certain proteins [J]. Anal Biochem, 167(2):327-330.
BLOIS MS, 1958. Antioxidant determinations by the use of a stable free radical [J]. Nature, 181 (4617):1199-1200.
COMMITTEE OF PHARMACOPOEIA, 2010. Pharmacopoeia of the People’s Republic of China : Ⅰ [S]. Beijing: China Medico Pharmaceutical Science & Technology Publishing House: 124-125. [国家药典委员会, 2010.中华人民共和国药典(一部) [S]. 北京:中国医药科技出版社:124-125. ]
HE Y, FU CM, MAO Q, et al, 2012. Effects of Siwu decoction with different extracting techniques on hmatopoietic function in mice with blood deficiency [J]. Chin J Exp Trad Med For, 18(12):198-201. [何瑶,傅超美,毛茜,等,2012. 四物汤不同提取工艺对血虚模型小鼠造血功能的影响 [J]. 中国实验方剂学杂志, 18(12):198-201.]
LAEMMLI UK, 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 [J]. Nature, 227(5259):680-685.
LI CJ, JIN XL, SHEN YH, 2007. Composition and biological function of the polysaccharide ofAngelicasinensis[J]. J Q Univ Med,28(9):1096-1098. [李成军,金香兰,沈云虹, 2007. 当归多糖的成分及其生物学作用 [J]. 齐齐哈尔医学院学报, 28(9):1096-1098.]
LI SJ,TANG YP, LI WX, et al, 2014. Comparing tonifying blood effects of Danggui-Honghua with different proportions on blood deficiency mice [J].Chin Pharmacol Bull, 30(6):874-879. [李淑娇,唐于平,李伟霞, 等, 2014. 当归-红花不同配比对血虚小鼠补血作用的比较研究 [J]. 中国药理学通报, 30(6):874-879.]
LI WX, TANG YP, GUO JM, et al, 2012. Comparative assessing the effects of angelica root and Chuanxiong on the hemorheology and the blood coagulation function in acute blood stasis rats [J].Chin J Integr Trad West Med, 32(6):806-811. [李伟霞, 唐于平, 郭建明, 等, 2012.比较评价当归川芎配伍对急性血瘀大鼠血液流变学及凝血功能的影响 [J].中国中西医结合杂志, 32(6):806-811.]
LIU F, CAO XZ,YANG WL, et al,2015. Study on bacteriostasic activity of total flavonol fromAngelicasinensis[J]. Chin Food Add, (1):60-63. [刘芳,曹新志,杨王霖, 等, 2015.当归总黄酮醇提液的体外抑菌作用研究 [J]. 中国食品添加剂, (1):60-63.]
LIU K, ZHANG XF,ZHANG J,et al, 2012. Effect of angelic decoction on proliferation, apoptosis, collagen synthesis of human umbilical vein endothelial cells [J]. Chin J Aesth Med , 21(5):782-784. [刘凯,张选奋,张瑾, 等, 2012.当归水煎液对人脐静脉内皮细胞增殖、凋亡及胶原合成的影响 [J]. 中国美容医学, 21(5):782-784.]
NI ZN, LÜ GY, LOU ZH, et al, 2007. Research progress of the chemical composition and pharmacological activity of volatile oil in Angelica root [J]. Chin J Inf Trad Chin Med,14(7):93-95. [倪竹南,吕圭源,楼招欢, 等, 2007. 当归挥发油化学成分和药理作用研究进展 [J]. 中国中医药信息杂志, 14(7):93-95.]SONG JC, HU CQ, LIU H, et al, 2007. Influence of processing on active components inAngelicasinensis[J]. Chin Pharm J,42(14):1052-1054. [宋金春,胡传芹,刘红, 等, 2007.炮制对当归药材有效成分的影响 [J].中国药学杂志, 42(14):1052-1054.]
SONG QY, FU YB, LIU J, et al, 2011. Chemical constituents fromAngelicasinensis[J]. Chin Trad Herb Drugs, 42(10):1900-1904. [宋秋月,付迎波,刘江, 等, 2011.当归的化学成分研究 [J]. 中草药, 42(10):1900-1904.]WILLIAMSON EM, LORENC A, BOOKER A, et al, 2013.The rise of traditional Chinese medicine and its material medica: a comparison of the frequency and safety of materials and species used in Europe and China [J]. J Ethnopharmacol, 149(2):453-462.
WU JN, 2005. Danggui [M]// An Illustrated Chinese Materia Medica. Oxford: Oxford University Press: 87.
WU YY, SHANG MY, CAI SQ, et al, 2008. HPLC fingerprint of the components of radixAngelicaesinensis[J]. Acta Pharm Sin, 43(7): 728-732. [吴燕燕,尚明英,蔡少青, 等, 2008.当归的化学成分指纹图谱 [J]. 药学学报, 43(7):728-732.]
WU ZC,YANG XC,WANG MW, et al, 2014. Research on the optimal processing technology of Danggui prepared with liquor [J]. W J Trad Chin Med, 27(1):40-42. [吴志成,杨锡仓,王明伟, 等,2014. 酒当归最佳炮制工艺研究 [J]. 西部中医药, 27(1):40-42.]
YAN H, DUAN JA, QIAN DW, et al, 2009. Quality analysis and evaluation of Angelica herbs in different regions in Chinese [J]. Chin Trad Herb Drugs, 40(12):1988-1992. [严辉,段金廒,钱大玮, 等, 2009. 我国不同产地当归药材质量的分析与评价 [J]. 中草药, 40(12):1988-1992.]
Extraction and activity analysis of the protein in the decoction pieces of Chinese Angelica
PAN Jian-Ru*, ZHANG Xiao-Mei, LI Ling-Ling, WANG Xiang-Ling,WU Lun-Qiao, CHEN Li-Juan, LI Xian
(CollegeofBiologicalScienceandEngineering,FuzhouUniversity, Fuzhou 350108, China )
Chinese Angelica is one of the herbs most commonly used by Traditional Chinese Medicine (TCM) practitioners with the ability of “enrich the blood”. A large number of studies have been done on the polysaccharides and small molecules of Chinese Angelica while the protein composition and of Chinese Angelica are still barely known. In this research, crude extract in the decoction pieces of Chinese Angelica was obtained by 0.05 M Tris-HCl (pH = 8.0) buffer extraction and tissue homogenates. Protein of the decoction pieces of Chinese Angelica was obtained by combination with ammonium sulfate precipitation and dialysis which could remove the polysaccharides and other small molecules such as reducing sugars in crude extract. The composition and the biological activity of the protein of Chinese Angelica were studied for the first time to evaluate their potential for development and application. The results showed that Angelica Pieces is high in protein. These protein’s molecular weight range from 17.5 kDa to 90.7 kDa and the 17.5 kDa one was the highest at content, amounting to 47%. Almost all proteins were stable under the condition of pH 5-11 while only a few proteins with the molecular weight of 17.5 kDa survived under acidicconditions(pH 3). At least three proteins were stable at 80 ℃. Among those protein, the 17.5 kDa protein showed the best thermostability, which was stable on heat treatment (100 ℃). But some of the monomers of 17.5 kDa protein seemed to be cross linked to from an emerging one with the Mw bigger than 116 kDa during the process of boiling water bath. Protein of the decoction pieces of Chinese Angelica was proved to have the ability to scavenge DPPH radicals which was increased with the temperature and time of heat treatments. The highest ability was presented under pHconditionsof 5.0 and declined under other pHconditions. In addition, protein of the decoction pieces of Chinese Angelica was proved to have effects on normal cells and tumor cells. Resultsinvitroexperiments showed that the proliferation of human normal hepatic cell line L02 cells was promoted significantly (1.0 - 4.0 mg·mL-1,P<0.01) while that of human erythromyeloblastoid leukaemic cell line K562 was inhibited observably by these proteins (0.5-1.5 mg·mL-1,P<0.01). With 1.0 mg·mL-1pretreatment of the protein, the proliferation of L-02 cells was enhanced to 550% (P<0.01), while the inhibitory rate of K562 cells reached 18.3% (P<0.01). In conclusion, the important biological activity of proteins of decoction pieces of Chinese Angelica was confirmed and a pharmaceutical protein with hepatic protective effect would be developed from these proteins.
decoction pieces of Chinese Angelica, protein, stablity, DPPH free radicals, cell proliferation
10.11931/guihaia.gxzw201512028
2015-12-28
2016-04-11
国家自然科学基金(81472907)[Supported by the National Natural Science Foundation of China(81472907)]。
潘剑茹(1977-),女,福建福州人,博士,副研究员,主要从事生物医学研究,(E-mail)panjr@fzu.edu.cn。
Q946, R284.2
A
1000-3142(2016)11-1363-06
潘剑茹, 张小梅, 李玲玲, 等. 当归饮片蛋白质的提取与活性分析 [J]. 广西植物, 2016, 36(11):1363-1368
PAN JR, ZHANG XM, LI LL, et al. Extraction and activity analysis of the protein in the decoction pieces of Chinese Angelica [J]. Guihaia, 2016,36(11):1363-1368
*通讯作者

